脉络膜新生血管(choroidal neovascularization,CNV)常见于年龄相关性黄斑变性(age-related macular degeneration,AMD)、病理性近视等多种致盲性眼病过程中,并导致一系列并发症,包括出血、渗漏以及光感受器丢失的瘢痕化等,是不可逆视觉障碍的主要原因[1]。抑制新生血管生成和血管通透性,已被证明是稳定脉络膜新生血管和提高视力的有效策略[2]。尽管目前临床上采取抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗此类疾病,已经取得重大进展,但仍存在许多未尽人意之处,如某些患者无应答、出现抗药性以及需要进行反复玻璃体腔注药等[3-5],甚至加剧了部分患者脉络膜毛细血管的退化及缺氧[6]。一个重要的原因是多种生长因子共同作用的影响[7],因此探索多靶点治疗显得尤为重要,以期患者能够获得更好的治疗效果。目前抗新生血管药物在治疗肿瘤方面的研究以及应用较多,这也为研究眼科新生血管类疾病提供了新思路。
5α-羟基木香酸(5α-hydroxycostic acid,5α-HA)是从菊科植物提取出来的一种化合物。有研究表明其可以通过干扰VEGF和血管生成素2介导的信号通路抑制新生血管生成和抑制乳腺癌细胞迁移。在无毒剂量下,5α-HA能抑制VEGF诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖和斑马鱼胚胎血管形成[8]。VEGF的受体VEGFR2广泛表达于血管内皮细胞表明及胚面[9],由此我们推测,在VEGF164诱导的大鼠脉络膜血管内皮细胞模型中可能存在相似的作用,该药物可能会抑制脉络膜新生血管的发展以及由新生血管导致的血管渗漏。本研究首先通过探索5α-HA对VEGF164诱导的大鼠脉络膜血管内皮细胞模型的作用,然后进一步检测紧密连接蛋白以及钙黏蛋白的表达情况,旨在为脉络膜新生血管的治疗寻找新的治疗靶点。
1 材料与方法 1.1 材料与试剂大鼠脉络膜血管内皮细胞(choroidal vascular endothelial cells,CECs)购自中国北纳创联生物科技有限公司(BNCC)。5α-HA、Semaxanib(VEGFR2特异性阻断剂)购自上海陶术科技生物有限公司Topscience。VEGF164(北京近岸蛋白质科技有限公司),Tie2 kinase inhibitor(美国selleck),DMEM/F12培养基(美国Gibco),胎牛血清(美国Gibco),基质胶(康宁),CCK-8试剂盒(日本同仁)。BCA蛋白浓度测定试剂盒和ECL发光试剂盒购自碧云天,大鼠VEGFR2、P-VEGFR2、Tie2、P-Tie2、FAK、P-FAK、VE-Cadherin、ZO-1、occludin、Ang 2和内参β-actin购自美国affinity,对应的二抗购自碧云天,DAPI(广州硕普生物科技有限公司),Simply P总RNA提取试剂盒购自杭州博日科技有限公司(BIOER),反转录、RT-qPCR检测试剂盒购自广州易锦生物技术有限公司。
1.2 方法 1.2.1 CCK-8法检测各组CECs的增殖情况将对数生长期CECs接种于96孔板中培养24 h后分组:①空白对照组,细胞用含0.2% DMSO常规培养基进行培养;②模型组,在培养基中加入30 ng/mL VEGF164进行培养;③干预组,在培养基中加入30 ng/mL VEGF164+100 μmol/L 5α-HA共同培养;④抑制剂组,在培养基中加入30 ng/mL VEGF164+5 μmol/L Semaxanib (VEGFR2特异性阻断剂),24 h后加入CCK-8为10 ∶1的培养基110 μL,培养4 h后检测各孔在450 nm的光密度值[D(450)]。
1.2.2 细胞划痕实验检测各组条件培养液CECs水平迁移的影响待CECs细胞生长铺满至90%左右时,消化重悬细胞,调整细胞悬液浓度至5×105/mL并接种于6孔板中,待细胞贴壁生长后,用200 μL加样枪头垂直于6孔板板底行“一”字形划线,用PBS冲洗悬浮细胞3次,显微镜下拍摄不同条件培养液干预0、24 h后的照片(×40),重复3次。测量并按照公式“(S0-S24)/S0×100%”计算各组细胞相对迁移率(S0:原始空白区面积,S24:24 h后空白区面积)。
1.2.3 Transwell小室检测各组不同条件培养液对CECs垂直迁移的影响调整CECs至3×105/mL,根据不同分组在Transwell下室分别加入不同条件培养基600 μL;然后在上室中分别加入CECs细胞悬液100 μL,置入孵箱中培养24 h,弃去小室内培养液,棉签擦拭小室内表面未迁移细胞,多聚甲醛固定30 min后用结晶紫染色25 min,PBS清洗3次后自然风干,倒置显微镜下随机选取不同视野拍照(×100),相对垂直迁移率=干预组/对照组×100%。
1.2.4 Matrigel基质胶法检测各组不同条件培养液下对CECs管腔形成的影响用预冷的200 μL枪头在96孔板中分别每孔加入Matrigel基质胶50 μL,并置于37 ℃孵箱中培养30 min,使基质胶充分凝固。同时消化已在不同分组培养基下预培养48 h的CECs细胞,用完全培养基重悬并调整浓度约为4×105/mL,将不同分组的细胞接种于96孔板并置于细胞孵箱中培养5 h,倒置显微镜下随机选取3个不同视野进行拍照(×40),采用Image J软件分析相对总成管长度,相对管腔形成率=干预组/对照组×100%。
1.2.5 RT-qPCR检测各组细胞Ang 2、VE-Cadherin、ZO-1的mNRA的表达制备不同分组CECs细胞样本,按照Simply总RNA提取试剂盒提取总RNA,通过反转录合成cDNA。按照RT-qPCR设置反应条件:95 ℃ ×30 s→95 ℃ ×10 s→60 ℃ ×30 s,40个循环,进行目的基因扩增,以β-actin为标准内参,得到目的基因Ct值,目的基因相对表达量用2-△△Ct法进行统计学分析。其中引物(表 1)由北京擎科生物科技有限公司设计与合成。
| 引物名称 | 引物序列(5'-3') |
| Ang 2-F | AGCACAAAGGATTCGGACAATGA |
| Ang 2-R | CCCTTCCAGTAGTACCACTTGAT |
| VE-Cadherin-F | ACAGAGGCCAATACTTCCGAATAA |
| VE-Cadherin-R | CTGGGCAGCATTCTCACATACTT |
| ZO-1-F | GAGAGGAAGAGCGCATGCTAAA |
| ZO-1-R | GCTGTCCGACTTGAGCATATACA |
| β-actin-F | AGATCAAGATCATTGCTCCTCCT |
| β-actin-R | ACGCAGCTCAGTAACAGTCC |
1.2.6 Western blot检测各组细胞VEGFR2、P-VEGFR2、Tie2、P-Tie2、VE-Cadherin、ZO-1及Occludin蛋白的表达
采用Western blot法检测5α-HA对CECs细胞VEGFR2、P-VEGFR2、Tie2、P-Tie2、VE-Cadherin、ZO-1及Occludin蛋白表达的影响。收集不同分组细胞样本,按照说明书提取总蛋白,BCA法分别计算各组蛋白浓度,按照说明书使用预制胶、电泳、转膜(快转),抗体孵育后进行曝光显影,用Image J测定各条带灰度值,以β-actin条带为标准内参,得到目的蛋白的相对表达量,各蛋白相对表达量=目标蛋白灰度值/β-actin灰度值。
1.2.7 细胞免疫荧光实验检测各组细胞Ang 2蛋白表达将CECs以3×104/孔接种于24孔板,根据不同分组进行加药,培养48 h后对爬片上的细胞用PBS洗涤3次,用4%多聚甲醛固定15 min,用山羊血清溶液封闭30 min,Ang 2鼠抗(1 ∶150) 4 ℃过夜,用山羊抗鼠Alexa Fluor R594染料(1 ∶200)37 ℃下孵育1 h,用DAPI(1 μg/mL)染色核5 min,PBS清洗4次,滴入适量封片液封片,在荧光显微镜下观察并拍照(×200)。
1.3 统计学方法采用Image J图像处理软件和GraphPad Prism 8.0软件对数据结果进行分析处理和作图,多组间比较采用单因素方差分析,P < 0.05表示差异有统计学意义。
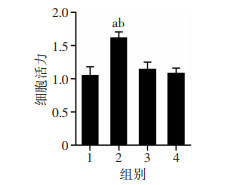
2 结果 2.1 5α-HA对VEGF164诱导的CECs细胞活性的影响当VEGF164为30 ng/mL的浓度刺激CECs细胞48 h后,与空白对照组比较,模型组细胞活性显著增高,差异有统计学意义(P < 0.01),而干预组VEGF164+5α-HA刺激48 h后,与空白对照组及抑制剂组细胞活性差异无统计学意义,但与模型组比较显著降低,差异有统计学意义(P < 0.05, 图 1)。
|
|
a: P < 0.01,与空白对照组比较;b: P < 0.01,与干预组比较 1:空白对照组;2:模型组;3:干预组;4:抑制剂组 图 1 5α-HA对VEGF164诱导的CECs细胞活性的影响(n=3, x±s) |
2.2 不同干预条件下培养基对CECs细胞水平迁移的影响
与空白对照组比较,模型组CECs细胞水平迁移面积明显增加,差异有统计学意义(P < 0.01);而与模型组比较,干预组水平迁移面积显著降低,差异有统计学意义(P < 0.01);对照组、干预组与抑制剂组无明显差异,见图 2。

|
| A:划痕实验结果;B:各组细胞相对水平迁移率(n=3, x±s) 1:空白对照组;2:模型组;3:干预组;4:抑制剂组 a: P < 0.01,与空白对照组比较;b: P < 0.01,与干预组比较 图 2 5α-HA对各组CECs细胞水平迁移的影响 |
2.3 不同条件培养基对CECs细胞垂直迁移的影响
与空白对照组比较,模型组垂直迁移的细胞数量明显增多,显著提高CECs的垂直迁移能力,差异具有统计学意义(P < 0.01);干预组可明显降低VEGF164对CECs垂直迁移的影响(P < 0.05);其中对照组、干预组及抑制剂组无明显差异(图 3)。

|
| A:垂直迁移实验结果;B:各组细胞相对迁移率(n=3, x±s) 1:空白对照组;2:模型组;3:干预组;4:抑制剂组 a: P < 0.01,与空白对照组比较;b: P < 0.05,与干预组比较;c: P < 0.05,与模型组比较 图 3 5α-HA对各组CECs细胞垂直迁移的影响 |
2.4 不同条件培养基对CECs细胞管腔成型的影响
与空白对照组比较,模型组可显著提高CECs的总成管长度,差异具有统计学意义(P < 0.01);干预组可明显减少VEGF164对CECs细胞总成管长度的影响(P < 0.01);其中对照组、干预组及抑制剂组无明显差异(图 4)。

|
|
A:细胞管腔形成实验结果;B:各组细胞相对总成管长度(n=3, x±s) 1:空白对照组;2:模型组;3:干预组;4:抑制剂组 a: P < 0.01,与空白对照组比较;b: P < 0.01,与干预组比较;c: P < 0.01,与模型组比较 图 4 5α-HA对各组CECs细胞成血管的影响 |
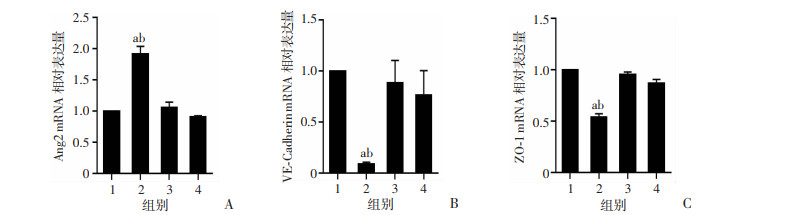
2.5 各组间Ang 2、VE-Cadherin及ZO-1 mRNA相对表达量
模型组Ang 2 mRNA相对表达量明显高于空白对照组(P < 0.01),VE-Cadherin及ZO-1 mRNA相对表达量模型组均低于空白对照组(P < 0.05),干预组Ang 2 mRNA相对表达量低于模型组,VE-Cadherin及ZO-1 mRNA相对表达量干预组均高于模型组,差异均有统计学意义(P < 0.05);空白对照组、干预组及抑制剂组间无明显差异(图 5)。
|
| a: P < 0.01,与空白对照组比较;b: P < 0.01,与干预组比较 1:空白对照组;2:模型组;3:干预组;4:抑制剂组 图 5 各组Ang 2(A)、VE-Cadherin(B)及ZO-1(C)mRNA相对表达量(n=3, x±s) |
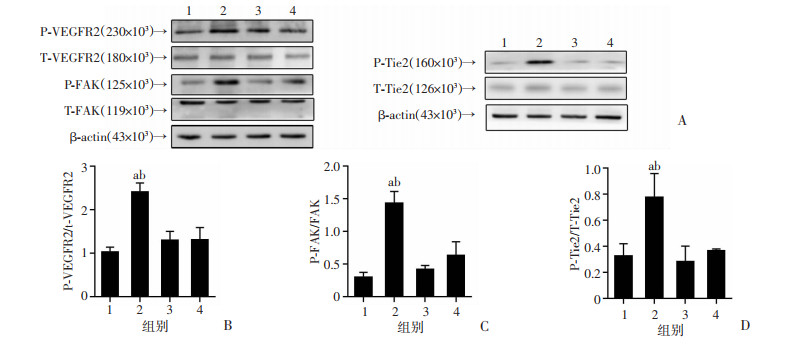
2.6 各组间相关信号通路蛋白及渗漏蛋白相对表达量
各组间总VEGFR2、Tie2及FAK蛋白相对表达量比较差异无统计学意义。模型组蛋白P-VEGFR2、P-Tie2及P-FAK相对表达量均高于空白对照组(P < 0.05),而干预组P-VEGFR2、P-Tie2及P-FAK蛋白相对表达量均低于模型组(P < 0.05)。空白对照组、干预组及抑制剂组间无明显差异,见图 6。
|
| 1:空白对照组;2:模型组;3:干预组;4:抑制剂组 A:Western blot结果;B~D分别为3种蛋白相对表达量 a: P < 0.01,与空白对照组比较;b: P < 0.01,与干预组比较 图 6 5α-HA对各组CECs细胞P-VEGFR2、P-FAK及P-Tie2蛋白的影响(n=3, x±s) |
模型组VE-Cadherin、Occludin及ZO-1蛋白相对表达量均低于空白对照组(P < 0.05),干预组VE-Cadherin、Occludin及ZO-1蛋白相对表达量均高于模型组(P < 0.05)。空白对照组、干预组及抑制剂组间无明显差异,见图 7。

|
|
1:空白对照组;2:模型组;3:干预组;4:抑制剂组 A:Western blot结果;B~D:各相关渗漏蛋白相对表达量 a: P < 0.05,b: P < 0.01,与空白对照组比较;c: P < 0.05,d: P < 0.01,与干预组比较 图 7 5α-HA对各组CECs细胞相关渗漏蛋白的影响(n=3, x±s) |
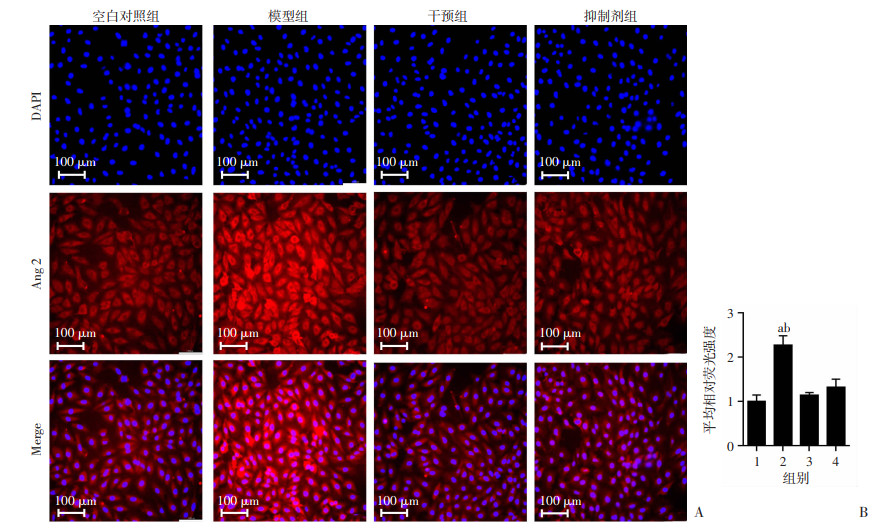
2.7 各组间Ang 2相对平均荧光强度
模型组Ang 2相对平均荧光强度高于空白对照组(P < 0.01),干预组Ang 2相对平均荧光强度低于模型组(P < 0.05),空白对照组、干预组及抑制剂组间无明显差异,见图 8。
|
|
1:空白对照组;2:模型组;3:干预组;4:抑制剂组 A:Ang 2细胞免疫荧光观察;B:Ang 2相对平均荧光强度(n=3, x±s) a: P < 0.01,与空白对照组比较;b: P < 0.01,与干预组比较 图 8 5α-HA对各组CECs Ang 2蛋白的影响 |
3 讨论
CNV作为多种眼底疾病发展的病理过程,由多因素、多因子影响其发生和发展,发病机制尚未明确[10]。近年来发现Ang 2和VEGF-A协同驱动视网膜血管渗漏、新生血管形成和炎症[11-12]。有研究表明,VEGF单独阻断内皮细胞之间紧密连接的效力是Ang 2的2倍。然而,2种生长因子共同作用使通透性增加是单独使用VEGF的3倍[13]。LIANG等[8]发现5α-HA通过干扰VEGF和Ang 2相关途径,具有抗血管生成能力,从而抑制乳腺癌细胞的迁移。本研究发现,在体外CNV模型中,5α-HA能分别抑制VEGF164或Ang 2与它们受体(VEGFR2/Tie2)结合所引起的受体磷酸化,在通过检测各组细胞FAK磷酸化的水平来看,模型组FAK磷酸化水平明显升高,但干预组FAK磷酸化水平对于模型组有明显下调。由此可见,5α-HA可能是通过抑制VEGFR/FAK信号通路磷酸化实现的,从而抑制其一系列下游促进新生血管的生物学作用。另外本研究通过PCR及细胞免疫荧光发现,5α-HA具有抑制由VEGF164诱导引起CECs细胞中Ang 2的表达,由此可见,研究5α-HA对眼部脉络膜新生血管的作用和其可能涉及的机制具有重要意义。
血管的生成靠内皮细胞的增殖、迁移等来完成,受到多种不同细胞因子的调控[14-15],VEGF扮演关键角色[16],Ang 2通过激活血管内皮细胞诱导新生血管生成[17]。有学者研究发现Ang 2升高与新生血管疾病严重程度相关[18]。脉络膜新生血管生成的体外模拟实验通常借助于各种血管内皮细胞来完成,其中大鼠脉络膜血管内皮细胞是体外实验模型中最常用的血管内皮细胞之一,它可以由原代培养获得,更加接近体内生长的情况,而且它很容易获得[19]。本研究在体外培养大鼠脉络膜血管内皮细胞,采用VEGF164成功构建CNV模型,模拟CNV发展过程中VEGF过表达的状态,在本研究中加入适宜浓度的5α-HA对CNV模型进行干预,发现其可以有效抑制CNV模型中CECs细胞的增殖、迁移以及管腔形成,可见5α-HA体外对CNV的抑制作用比较显著,在抑制CNV的发生发展过程中显示出巨大潜力。
紧密连接和黏附连接在血管内皮细胞之间的连接中起重要作用,而Occludin以及ZO-1在形成紧密连接复合体蛋白中扮演重要角色[20],经典的钙黏蛋白是黏附连接的主要跨膜蛋白[21]。它们共同调节细胞通透性和局部微环境的稳定。研究表明,VEGFA能够刺激FAK活化,进而激活Src,使桩蛋白、VE-Cadherin和紧密连接蛋白形成的复合物降解,增大内皮间隙,最终导致血管通透性升高[22-23]。VEGFA亦能促进内皮细胞Ang 2的表达并产生一系列生物学作用,包括新生血管生成及血管渗漏[24-25],目前眼科临床使用的各种主流抗VEGF类药物主要是通过抑制VEGF与其受体结合从而抑制脉络膜新生血管的生长及血管渗漏,改善或维持患者的视力[26]。然而,并非所有患者对此类疗法都有足够的疗效,而这些患者几乎没有其他的治疗选择[27]。本研究显示100 μmol/L的5α-HA可明显逆转CNV模型CECs细胞中VE-Cadherin、ZO-1及Occludin的低表达,可见5α-HA不仅具有抑制新生血管的作用,而且在改善血管渗漏方面也有巨大潜力。
综上所述,本研究发现5α-HA可在细胞水平上抑制新生血管的发生与发展,并改善血管渗漏,其机制可能与阻断VEGF或Ang 2与VEGFR2或Tie2受体结合,并通过抑制FAK磷酸化,阻断VEGF诱导的Ang 2表达,进而逆转VE-Cadherin、ZO-1及Occludin的低表达等通路有关。但由于5α-HA药理作用复杂,体外培养的细胞与体内环境的表现可能存在一定的差别,因此,体内实验有待进一步验证,但这在抑制脉络膜新生血管以及改善血管渗漏的作用将为临床应用提供新思路,为单独使用抗VEGF药物治疗不佳的患者带来希望。
| [1] |
PATEL P, SHETH V. New and innovative treatments for neovascular age-related macular degeneration (nAMD)[J]. J Clin Med, 2021, 10(11): 2436. |
| [2] |
WOLF A T, HARRIS A, ODDONE F, et al. Disease progression pathways of wet AMD: opportunities for new target discovery[J]. Expert Opin Ther Targets, 2022, 26(1): 5-12. |
| [3] |
SARKAR A, JUNNUTHULA V, DYAWANAPELLY S. Ocular therapeutics and molecular delivery strategies for neovascular age-related macular degeneration (nAMD)[J]. Int J Mol Sci, 2021, 22(19): 10594. |
| [4] |
陈有信, 汤加. 抗血管内皮生长因子治疗眼部新生血管性疾病问题与挑战[J]. 中华实验眼科杂志, 2019, 37(1): 1-4. CHEN Y X, TANG J. Problems and challenges of anti-vascular endothelial growth factor therapy for ocular neovescularization diseases[J]. Chin J Exp Ophthalmol, 2019, 37(1): 1-4. |
| [5] |
CAMPBELL M, DOYLE S L. Current perspectives on established and novel therapies for pathological neovascularization in retinal disease[J]. Biochem Pharmacol, 2019, 164: 321-325. |
| [6] |
KIM J, PARK J R, CHOI J, et al. Tie2 activation promotes choriocapillary regeneration for alleviating neovascular age-related macular degeneration[J]. Sci Adv, 2019, 5(2): eaau6732. |
| [7] |
MAMMADZADA P, CORREDOIRA P M, ANDRÉ H. The role of hypoxia-inducible factors in neovascular age-related macular degeneration: a gene therapy perspective[J]. Cell Mol Life Sci, 2020, 77(5): 819-833. |
| [8] |
LIANG N, LI Y L, CHUNG H Y. Two natural eudesmane-type sesquiterpenes from Laggera alata inhibit angiogenesis and suppress breast cancer cell migration through VEGF-and angiopoietin 2-mediated signaling pathways[J]. Int J Oncol, 2017, 51(1): 213-222. |
| [9] |
LAMALICE L, HOULE F, JOURDAN G, et al. Phosphorylation of tyrosine 1214 on VEGFR2 is required for VEGF-induced activation of Cdc42 upstream of SAPK2/p38[J]. Oncogene, 2004, 23(2): 434-445. |
| [10] |
ZHOU R M, SHI L J, SHAN K, et al. Circular RNA-ZBTB44 regulates the development of choroidal neovascularization[J]. Theranostics, 2020, 10(7): 3293-3307. |
| [11] |
JOUSSEN A M, RICCI F, PARIS L P, et al. Angiopoietin/Tie2 signalling and its role in retinal and choroidal vascular diseases: a review of preclinical data[J]. Eye (Lond), 2021, 35(5): 1305-1316. |
| [12] |
KHAN M, AZIZ A A, SHAFI N A, et al. Targeting angiopoietin in retinal vascular diseases: a literature review and summary of clinical trials involving faricimab[J]. Cells, 2020, 9(8): 1869. |
| [13] |
PETERS S, CREE I A, ALEXANDER R, et al. Angiopoietin modulation of vascular endothelial growth factor: effects on retinal endothelial cell permeability[J]. Cytokine, 2007, 40(2): 144-150. |
| [14] |
王蕊, 黄美娟, 许燕艳, 等. Ang-Tie轴在血管和淋巴系统相关疾病中作用的研究进展[J]. 生物工程学报, 2021, 37(8): 2633-2644. WANG R, HUANG M J, XU Y Y, et al. Advances of angiopoietin-tie axis in vascular and lymphatic system-related diseases[J]. Chin J Biotechnol, 2021, 37(8): 2633-2644. |
| [15] |
韩梦雨. 新生血管性眼病发病相关细胞因子研究进展[J]. 中华实验眼科杂志, 2018, 36(8): 636-642. HAN M Y. Research progress of pathological relevant cytokines of neovascular eye diseases[J]. Chin J Exp Ophthalmol, 2018, 36(8): 636-642. |
| [16] |
WOOLARD J, BEVAN H S, HARPER S J, et al. Molecular diversity of VEGF-A as a regulator of its biological activity[J]. Microcirculation, 2009, 16(7): 572-592. |
| [17] |
GAO X W, XU Z P. Mechanisms of action of angiogenin[J]. Acta Biochim Biophys Sin, 2008, 40(7): 619-624. |
| [18] |
NG D S, YIP Y W, BAKTHAVATSALAM M, et al. Elevated angiopoietin 2 in aqueous of patients with neovascular age related macular degeneration correlates with disease severity at presentation[J]. Sci Rep, 2017, 7: 45081. |
| [19] |
冉一君, 王梦蕾, 黎梦, 等. 载IR780靶向纳米粒体外荧光成像及光动力诱导大鼠脉络膜血管内皮细胞凋亡的研究[J]. 第三军医大学学报, 2020, 42(1): 67-74. RAN Y J, WANG M L, LI M, et al. In vitro imaging of targeting fluorescent IR780 nanoparticles and their mediated photodynamics in rat choroidal endothelial cells[J]. J Third Mil Med Univ, 2020, 42(1): 67-74. |
| [20] |
FRANKE W W. Discovering the molecular components of intercellular junctions: a historical view[J]. Cold Spring Harb Perspect Biol, 2009, 1(3): a003061. |
| [21] |
HARTSOCK A, NELSON W J. Adherens and tight junctions: structure, function and connections to the actin cytoskeleton[J]. Biochim Biophys Acta BBA Biomembr, 2008, 1778(3): 660-669. |
| [22] |
CHEN X L, NAM J O, JEAN C, et al. VEGF-induced vascular permeability is mediated by FAK[J]. Dev Cell, 2012, 22(1): 146-157. |
| [23] |
ZHANG W J, XU Q L, WU J, et al. Role of src in vascular hyperpermeability induced by advanced glycation end products[J]. Sci Rep, 2015, 5: 14090. |
| [24] |
FAGIANI E, CHRISTOFORI G. Angiopoietins in angiogenesis[J]. Cancer Lett, 2013, 328(1): 18-26. |
| [25] |
MATSUMOTO K, EMA M. Roles of VEGF-A signalling in development, regeneration, and tumours[J]. J Biochem, 2014, 156(1): 1-10. |
| [26] |
XI L. Pigment epithelium-derived factor as a possible treatment agent for choroidal neovascularization[J]. Oxid Med Cell Longev, 2020, 2020: 8941057. |
| [27] |
FERNÁNDEZ-ROBREDO P, SANCHO A, JOHNEN S, et al. Current treatment limitations in age-related macular degeneration and future approaches based on cell therapy and tissue engineering[J]. J Ophthalmol, 2014, 2014: 510285. |




