在病理条件下,血小板迅速活化,并通过形成血小板聚集体在受伤的血管壁周围形成稳定的止血栓[1]。尽管血小板的活化和聚集对正常止血很重要,但在血栓形成性疾病如冠状动脉性疾病和缺血性中风的发病机制中也起着至关重要的作用[2]。临床上常用阿司匹林、氯吡格雷等抗血小板药物预防和治疗这些血栓性疾病[3-4]。然而,目前的抗血小板治疗存在一些局限性,如出血并发症的风险增加,以及与阿司匹林和氯吡格雷相关的耐药性。因此,亟需寻找选择性抑制血栓形成而不影响正常止血过程的新型抗血小板药物。
剪切力诱导的血小板聚集(shear stress-induced platelet aggregation,SIPA)是一种独特的血小板反应,在病理性血栓形成中起主要作用。大量研究表明,剪切力通过血管性血友病因子(vWF)与血小板糖蛋白(GP) Ibα受体的结合,对血小板的活化和聚集产生直接影响[5-6]。瞬时血流加速和减速产生的剪切梯度诱导循环中的血小板机械感应导致其聚集在狭窄区域[7-8]。GPIbα与vWF的结合介导了剪切作用下血小板在vWF上的束缚和滚动,这被认为是剪切介导的血小板活化的第一步。随后机械流体剪切力在与vWF结合的血小板中触发一系列信号事件,导致整合素GPⅡb/Ⅲa的配体结合功能激活,其传递“外-内”信号,介导稳定的血小板黏附、聚集和血栓形成[9-10]。这些事件可以在没有外源性化学激动剂的情况下发生,因此,SIPA被认为在病理性动脉血栓形成中起关键作用,而对正常止血过程作用很小[11]。
三七三醇皂苷(Panax notoginseng saponins,PTS)是三七的主要成分之一,由人参皂苷Rg1(Rg1)、三七皂苷R1(R1)和人参皂苷Re(Re)组成。PTS作为IST的抗血小板聚集剂和神经保护剂在中国临床应用已超过17年。在PTS中,Rg1具有最强的抗血小板活性,可通过抑制血小板聚集、降低血液粘度、增强纤维蛋白溶解系统活性,促进血管内皮NO的释放来实现抗血栓形成;R1可以抑制过氧化物的产生和白细胞的黏附;Re可以增强腺苷酸环化酶活性、血小板细胞Ca2+水平,抑制血小板活化[12-13]。PTS的抗血小板作用研究多是对激动剂诱导的血小板聚集影响[13-15],作用机制尚未完全清楚,特别是在系统和深入解释与抗血小板聚集相关的靶点和途径方面,这影响了PTS药物目前的临床价值。本文研究PTS主要成分Rg1、Re和R1对剪切力诱导的血小板活化和聚集的影响,为其临床应用提供新的科学依据。
1 材料与方法 1.1 仪器与试剂IX71倒置荧光显微镜(Olympus公司,美国);单色制冷CCD相机(Photometrics公司,美国);PSP01-CS双向推拉型精密注射泵(苏州讯飞科学仪器有限公司);PDG-32G-2等离子清洗机(Harrick公司,德国);Streampix 7.0视频录制软件(Norpix公司,加拿大);CytoFLEX流式细胞仪(Beckman Coulter公司,美国),Aggrestar(PL-12)多参数血小板功能分析仪(江苏英诺华医疗技术有限公司,南京)。
人参皂苷Rg1、Re和三七皂苷R1(上海源叶生物科技有限公司);Calcein AM荧光染料、Anti-Hu CD61-PerCP-eFluorTM710、Anti-Hu CD62P-PE和Anti-Hu PAC-1-FITC(Invitrogen公司,美国);二磷酸腺苷(adenosine diphosphate, ADP,Topscience公司,美国);花生四烯酸(arachidonic acid,AA,MCE公司,美国)4%多聚甲醛溶液(上海碧云天生物技术有限公司);牛血清白蛋白(bovine serum albumin, BSA,ORTHO公司,美国)。
1.2 血液采集与处理12名健康志愿者,男性7名,女性5名,年龄(28.3± 5.7)岁,由重庆市血液中心永川分中心招募。纳入标准:2周内无服药史、手术史和酗酒史,其血常规和凝血功能检测指标[活化部分凝血酶时间(activated partial thromboplatin time, APTT)、凝血酶原时间(prothrombin time, PT)] 均在正常参考范围内。排除标准:有出血和血栓栓塞史;正在服用抗血小板药物或抗凝血治疗;血细胞计数异常,包括血小板减少(< 150 ×109/L)和凝血障碍,纤维蛋白原 < 2.0 g/L或 > 4.0 g/L,PT > 15.5 s, APTT>39 s。本研究经重庆医科大学附属永川医院伦理委员会批准(2023年审020),志愿者均被告知和签署知情同意书。利用3.2%柠檬酸钠真空采血管采集志愿者肘前静脉全血样品,室温放置,2 h内使用。
1.3 微流控芯片设计与制作微通道设计参考课题组前期研究[16]。每块芯片由6个平行排列的流动室组成,设计用于安装在标准25 mm×75 mm显微镜载玻片上。每个流动室包含狭窄微通道、样品池和出口。流动室的尺寸为0.7 mm宽、0.07 mm高、10 mm长(图 1A、B)。狭窄区域宽度为0.14 mm,以形成80%的狭窄。芯片的制作如前所述[17]。聚二甲基硅氧烷(polydimethylsiloxane, PDMS)微通道加工采用感光干膜软光刻工艺,通过氧等离子处理(30 W,1 min)将PDMS微通道和载玻片进行不可逆键合,制备成玻璃-PDMS微通道芯片。
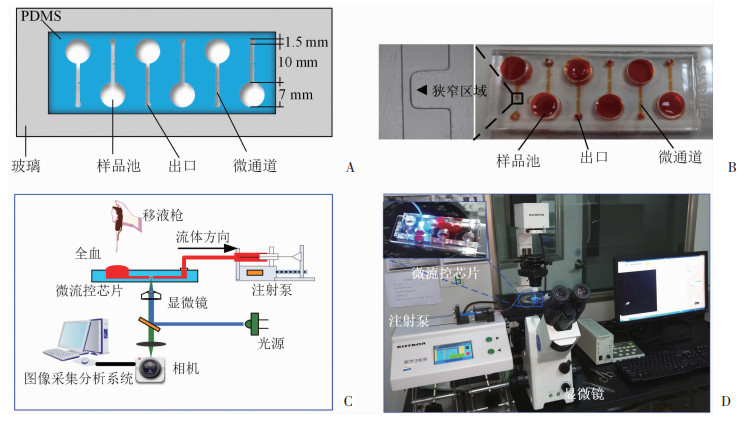
|
| A: 微流控芯片示意图;B:微流控实物图(橙色为染料);C: 微流控芯片分析系统的流程图;D:微流控芯片分析系统实物图 图 1 微流控芯片分析系统 |
1.4 微通道内流场仿真分析
设置出口体积流量为9、27、52 μL/min,进口为静压,采用Solidworks软件进行微通道结构设计,并通过其流体仿真分析模块进行流体动力学(computational fluid dynamic, CFD)模拟,分析微通道内壁剪切率和速度分布。假设流体性质为稳定的、不可压缩的层流,在模型内创建92 215个网格,通过求解器运算CFD解。
1.5 微流控芯片检测血小板聚集行为 1.5.1 不同药物浓度实验全血样本与不同浓度的Rg1、Re和/或R1(终浓度为0、0.05、0.1、0.25、0.5 mg/mL)混合,最后加入Calcein AM荧光染料(终浓度为4 μmol/L)在37 ℃静止孵育30 min。使用注射泵以52 μL/min的速度将全血样本灌注到狭窄微通道,持续150 s。或3种化合物在相同浓度下联合使用,以探究是否具有协同作用。
1.5.2 不同的剪切率实验全血样品与生理盐水(对照组)或0.5 mg/mL Rg1、Re、R1混合,加入Calcein AM荧光染料后在37 ℃静止孵育30 min。将全血样本加载到样品池中,设置注射泵为回拉模式,分别以9、27、52 μL/min的速度抽出样本(图 1C、D)。使用Streampix 7.0软件控制单色制冷CCD相机以每秒1帧的速度捕捉图像,使用ImageJ软件分析图像,以表面覆盖率为量化指标。
1.6 流式细胞术测定血小板活化情况采用流式细胞术评估Rg1、Re和R1对剪切诱导的血小板活化的影响。用3% BSA封闭狭窄微通道1 h,使用磷酸盐缓冲液(PBS)冲洗微通道。将全血样本与生理盐水或0.5 mg/mL Rg1、Re、R1在37 ℃孵育30 min,将处理后的全血样本以52 μL/min速度灌注通过BSA封闭的狭窄微通道,收集剪切后的血液样本。取5 μL样本与抗人CD61- PerCP-eFluorTM710、PAC-1-FITC和CD62P-PE抗体黑暗中孵育20 min。抗CD62P和PAC-1抗体分别作为P-选择素表达和GPⅡb/Ⅲa激活的标志物,而血小板则由抗CD61抗体识别。取5 μL未处理的血液灌注前标记作为阴性对照,Rg1、Re、R1处理组以剪切后的全血作为实验组,生理盐水处理组剪切后的全血作为阳性对照。标记后将血小板固定在1%多聚甲醛中。使用CytoFLEX流式细胞仪进行分析,使用蓝色(488 nm)和红色(633 nm) 激光器作为激发光源。荧光检测器的滤光片配置为:APC-A700 715/25、FITC 525/40和PE 585/42。通过前向散射光(FSC)和CD61单克隆抗体识别血小板群体,测定血小板表面CD62P和PAC-1的表达水平。
1.7 PL-12血小板功能分析仪测定血小板功能PL-12分析仪具有基于阻抗的自动血细胞分析仪和激动剂试剂盒;可以在固定的时间间隔内自动和连续地计算在添加激动剂前后柠檬酸钠全血中血小板计数的变化。全血与生理盐水(对照组)或0.5 mg/mL Rg1、Re、R1在37 ℃孵育30 min,将300 μL全血样本加入到聚碳酸酯试管中混匀并插入测量位置,按下开始键进行自动检测。血小板计数在检测开始时测定2次,以获得平均基线值。在第3个检测点前,在血样中加入激动剂AA(5 mmol/L)和ADP(100 μmol/L)以激活血小板,激动剂用量为全血样品的1/10。由于聚集产生的结构太大而不能被算作单个血小板,因此随着血小板聚集的增加,单个血小板计数下降。PL-12分析仪对血小板进行数次计数,直到获得最低水平的单个血小板计数。每个样本的最大血小板聚集率(maximum aggregation rate,MAR)使用以下公式计算:MAR=[(基线血小板数量-最低水平血小板数量)/基线血小板数量]×100%。
1.8 统计学分析所有计量资料用x ± s表示,统计分析采用GraphPad Prism 9.0软件,多组间比较采用单因素方差分析,采用Dunnett’s多重检验进行两两比较,P < 0.05表示差异有统计学意义。
2 结果 2.1 流体仿真分析管壁剪切率在狭窄伪影上呈对称分布,在输入剪切率为300、800、1 500 s-1(9、27、52 μL/min)时,血小板通过狭窄处时剪切率增加到1 500、4 500、9 000 s-1。当靠近狭窄处时,剪切率高,流体速度快。狭窄后区域,剪切率和速度恢复到与狭窄前区域相同(图 2A、B)。血液样本灌注到狭窄微通道中,由黏附的血小板形成聚集体,主要在狭窄出口区域形成聚集体(图 2C)。
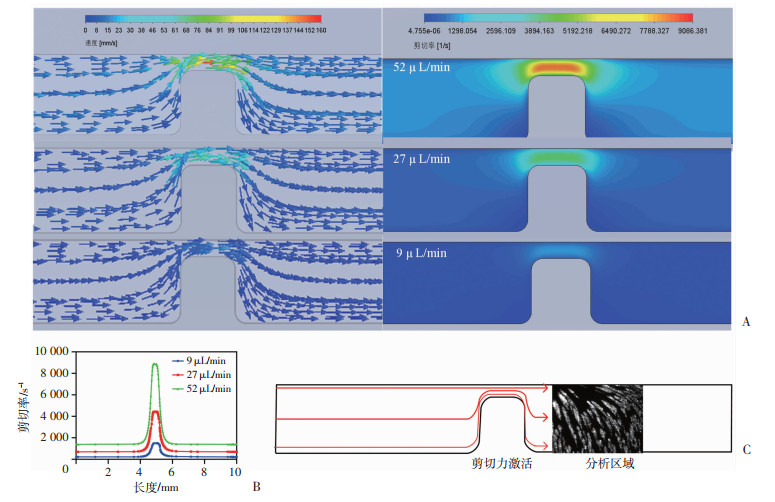
|
| A: 速度和壁面剪切率分布;B: 微通道底部中心线壁剪切率的变化;C: 狭窄微通道图形 图 2 狭窄微通道的CFD仿真分析 |
2.2 三七三醇皂苷主要成分具有抗SIPA活性
不同浓度Rg1、Re、R1处理后的样本在9 000 s-1剪切率条件下黏附聚集的典型荧光图像如图 3A所示,随着药物浓度增加,血小板聚集体的大小和数量随之减少。Rg1、Re和R1均呈浓度依赖性显著抑制剪切诱导的血小板聚集(P < 0.01,图 3B)。通过血小板聚集体表面覆盖率计算每个药物浓度对应的抑制率,结果表明Re对SIPA抑制作用最强,Rg1次之,R1作用最弱。此外,当3种化合物在相同浓度下联合使用时,对剪切力诱导的血小板聚集有明显的抑制作用,没有表现出协同作用。根据Rg1、Re和R1浓度与抑制率量效曲线进一步分析,依次计算出Rg1、Re和R1对血小板聚集的半抑制率(IC50)分别为0.1、0.07、0.2 mg/mL。
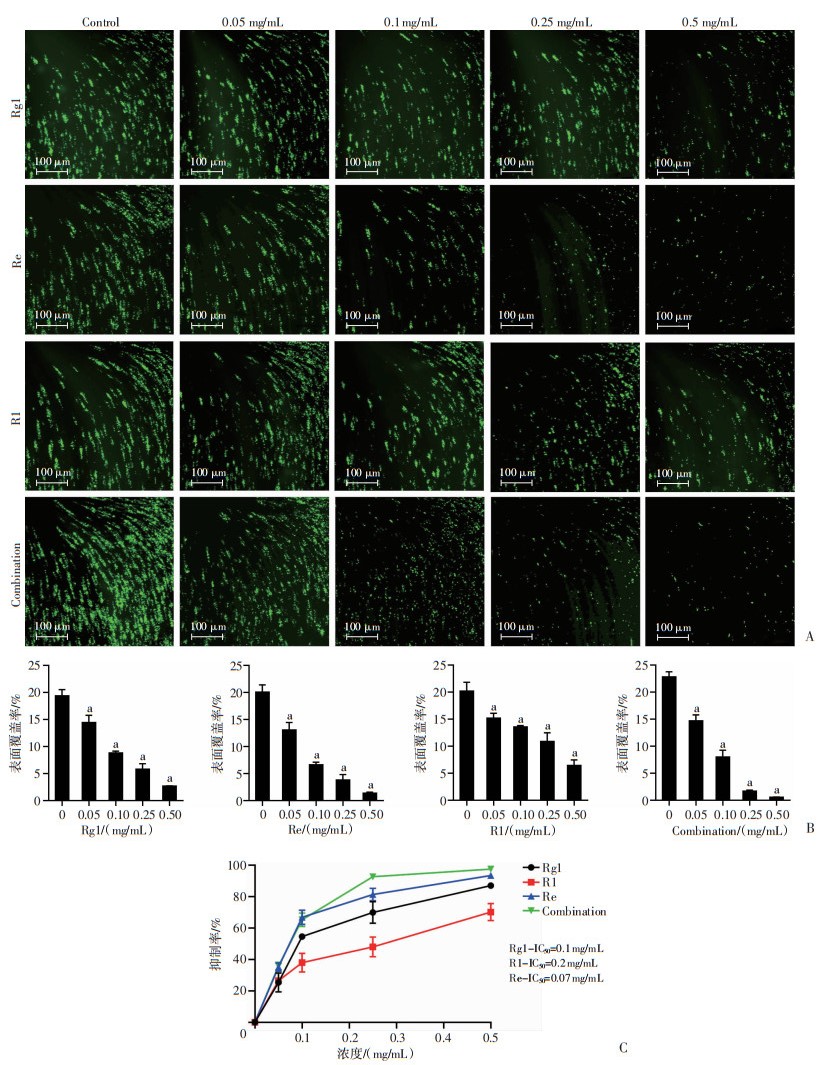
|
| A: 使用微流控技术观察血小板的聚集;B: 血小板聚集体表面覆盖率 a: P < 0.01, 与对照组比较;C: Rg1、Re和R1抑制血小板聚集的量效关系 图 3 不同浓度条件下Rg1、Re和R1抗SIPA活性 |
在1 500、4 500、9 000 s-1剪切率条件下,随着剪切率的增加血小板聚集体大小随之增大,在1 500 s-1剪切率下,血小板聚集体呈不规则分布,而在4 500 s-1和9 000 s-1剪切率条件下,血小板聚集体沿流动方向分布且呈条索状。Rg1、Re和R1处理后血小板聚集体大小和数量均减少。Rg1、Re和R1在4 500、9 000 s-1剪切率条件下显著抑制血小板的聚集(P < 0.05,图 4)。
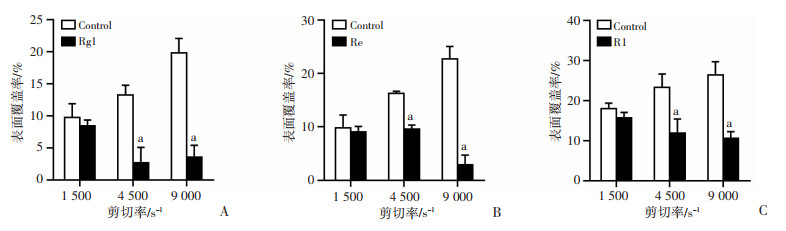
|
| a: P < 0.05, 与对照组比较 图 4 不同剪切率条件下Rg1(A)、Re(B)和R1(C)抗SIPA活性 |
2.3 三七三醇皂苷主要成分抑制剪切诱导的血小板活化
采用流式细胞术分析血小板表面活化标志物(P-选择素和GPⅡb/Ⅲa)表达情况。结果显示,当血小板处于静息状态时,几乎不会发生活化(CD62P和PAC-1表达 < 2%)。经过高剪切力诱导后,血小板活化程度显著升高(P < 0.01)。Rg1、Re和R1处理后,P-选择素的表达和GPⅡb/Ⅲa的活化显著降低(P < 0.01),且与R1相比,Rg1和Re抑制程度较强,与聚集实验结果一致(图 5)。
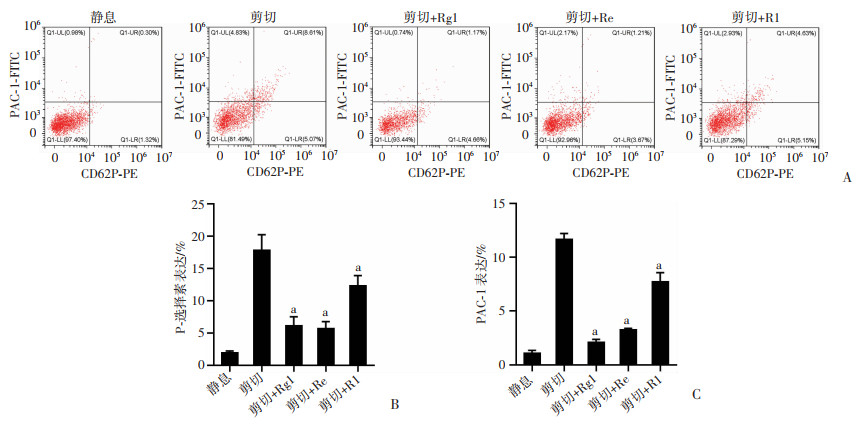
|
|
a:P < 0.01, 与剪切组比较 A: 流式细胞术分析血小板的活化指标CD62P和PAC-1;B: P-选择素表达百分比;C: PAC-1表达百分比 图 5 剪切诱导的血小板活化分析 |
2.4 三七三醇皂苷主要成分抑制激动诱导的血小板聚集
采用PL-12分析仪检测Rg1、Re和R1对AA和ADP诱导的血小板聚集的影响。结果显示,Rg1、Re处理后,经AA诱导的MAR显著降低(P < 0.05),而R1无显著变化(图 6A)。对于ADP诱导的血小板聚集,Rg1和R1显著影响MAR值(P < 0.05),R1降低MAR值,但差异无统计学意义(图 6B)。
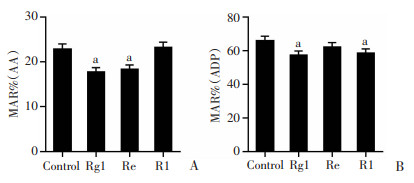
|
|
a:P < 0.05, 与对照组比较 A: AA诱导的血小板聚集;B: ADP诱导的血小板聚集 图 6 Rg1、Re和R1对激动剂诱导的血小板聚集影响 |
3 讨论
尽管剪切力在血栓形成中起主要作用,但目前靶向剪切力诱导的抗血小板药物少有研究,而中草药抗SIPA活性的研究更少。本研究探讨了三七三醇皂苷主要成分对SIPA的影响。PTS包含3种主要成分人参皂苷Rg1、Re和三七皂苷R1。先前的研究表明,PTS对胶原、凝血酶和ADP等不同激动剂的刺激具有抗血小活性[14]。本研究探讨PTS 3种主要成分对SIPA的作用,以及3种成分的联合是否具有协同作用。结果表明,Rg1、Re和R1呈浓度依赖性抑制高剪切力诱导的血小板聚集,而对于相对较低的剪切力,抑制作用无统计学意义。通过计算IC50发现,Re抑制作用最强,并且Rg1、Re和R1三者联合没有协同作用。许多研究表明vWF与GPIb的结合启动了高剪切诱导的血小板聚集。XU等[18]通过分子对接实验表明Rg1、Re和R1均能够与GPIb稳定结合,并且表面等离子共振技术结果表明Re与GPⅠb结合活性最高,Rg1次之,最低是R1。Re表现出更强的抑制效果可能与其容易结合GPIb有关,Re与GPIb结合干扰血小板聚集。Rg1、Re和R1抑制高剪切诱导的血小板聚集,而对低剪切诱导的血小板聚集无显著影响,这可能是由于低剪切诱导的血小板聚集主要由纤维蛋白原和GPⅡ/Ⅲa介导,很少或没有涉及GPIb与vWF的结合, 这支持了Rg1、Re和R1是通过抑制vWF与GPIb的结合抑制高剪切诱导的血小板聚集。
本研究进一步探索了Rg1、Re和R1对剪切力诱导的血小板活化的影响,通过流式细胞术定量分析血小板活化指标P-选择素和GPⅡb/Ⅲa来表征流过狭窄微通道的血小板活化情况。P-选择素主要定位于血小板的α颗粒或内皮细胞的WeibeL-Palade小体,静息状态时无表达或持续低表达。血小板活化后,P-选择素通过α颗粒与血小板膜的融合在血小板膜表面迅速表达。GPⅡb/Ⅲa是由钙依赖性a亚单位(GPⅡb)和b亚单位(GPⅢa)组成的异二聚体。在静息血小板中,GPⅡb/Ⅲa对其配体(纤维蛋白原和VWF)的亲和力较低。血小板活化触发细胞内信号传递导致GPⅡb/Ⅲa构象改变,从而增加其与纤维蛋白原和vWF的亲和力[19]。升高的剪切力可促进血浆vWF与GPⅠb/Ⅸ/Ⅴ复合体结合,进而启动细胞间信号级联,导致钙离子动员增加,肌动蛋白收缩和细胞骨架重排等进程[20],最终导致P-选择素释放、GPⅡb/Ⅲa激活等,本研究结果与理论相符。Rg1、Re和R1抑制P-选择素表达和GPⅡb/Ⅲa活化,提示通过抑制vWF-GPIb相互作用抑制血小板的活化。
ADP是G蛋白偶联受体P2Y1和P2Y12的有效配体[23],AA是血小板内血栓素A2的前体,通过环氧合酶和血栓素合成酶转化为TXA2[24]。本研究结果表明,PTS主要成分的抗血小板活性与激动剂类型无关,提示PTS可能不是作为一种拮抗剂来抵消2种激动剂与质膜上的血小板受体结合。Rg1、Re和R1对激动剂诱导的血小板聚集的抑制作用可以增强其自身抗血小板活性。
与以往由外源性激动剂作为诱导剂的研究相比,本研究纳入了流体动力学作为血小板的诱导剂。微流控芯片技术可模拟体内狭窄动脉,在体外实现病理流动环境,研究三七三醇皂苷主要成分对血小板功能的影响。然而,本研究也存在不足之处,虽然证明了Rg1、Re和R1能够抑制高剪切力诱导的血小板聚集而对低剪切力诱导的血小板聚集无影响,但实验所涉及的剪切率值为1 500、4 500、9 000 s-1,对于其在剪切率值高于9 000 s-1时发挥怎样的作用,以及其在什么剪切率范围内能够最大程度发挥作用还有待探明。
综上所述,本研究探讨了三七三醇皂苷主要成分对SIPA的影响,结果表明:Rg1、Re和R1抑制高剪切力诱导的血小板聚集,三者单独使用时Re的作用最强,三者联合使用时不具有协同作用。此外,Rg1、Re和R1显著抑制剪切力诱导的血小板活化。Rg1、Re和R1通过选择性抑制SIPA发挥新的抗血小板活性,具有成为新一代抗血小板药物的潜力。后续将研究其对下游信号通路的调节,以期明确PTS成分单体如何发挥抗SIPA活性。
| [1] |
YE T, SHI H X, PHAN-THIEN N, et al. The key events of thrombus formation: platelet adhesion and aggregation[J]. Biomech Model Mechanobiol, 2020, 19(3): 943-955. DOI:10.1007/s10237-019-01262-x |
| [2] |
KOENEN R R, BINDER C J. Platelets and coagulation factors: established and novel roles in atherosclerosis and atherothrombosis[J]. Atherosclerosis, 2020, 307: 78-79. DOI:10.1016/j.atherosclerosis.2020.07.008 |
| [3] |
XIONG Y Y, BATH P M. Antiplatelet therapy for transient ischemic attack and minor stroke[J]. Stroke, 2020, 51(11): 3472-3474. DOI:10.1161/STROKEAHA.120.031763 |
| [4] |
KAMRAN H, JNEID H, KAYANI W T, et al. Oral antiplatelet therapy after acute coronary syndrome: a review[J]. JAMA, 2021, 325(15): 1545-1555. DOI:10.1001/jama.2021.0716 |
| [5] |
SHIOZAKI S, TAKAGI S, GOTO S. Prediction of molecular interaction between platelet glycoprotein ibα and von Willebrand factor using molecular dynamics simulations[J]. J Atheroscler Thromb, 2016, 23(4): 455-464. DOI:10.5551/jat.32458 |
| [6] |
PUSHIN D M, SALIKHOVA T Y, ZLOBINA K E, et al. Platelet activation via dynamic conformational changes of von Willebrand factor under shear[J]. PLoS One, 2020, 15(6): e0234501. DOI:10.1371/journal.pone.0234501 |
| [7] |
NESBITT W S, WESTEIN E, TOVAR-LOPEZ F J, et al. A shear gradient-dependent platelet aggregation mechanism drives thrombus formation[J]. Nat Med, 2009, 15(6): 665-673. DOI:10.1038/nm.1955 |
| [8] |
JAIN A, GRAVELINE A, WATERHOUSE A, et al. A shear gradient-activated microfluidic device for automated monitoring of whole blood haemostasis and platelet function[J]. Nat Commun, 2016, 7: 10176. DOI:10.1038/ncomms10176 |
| [9] |
SHATTIL S J, NEWMAN P J. Integrins: dynamic scaffolds for adhesion and signaling in platelets[J]. Blood, 2004, 104(6): 1606-1615. DOI:10.1182/blood-2004-04-1257 |
| [10] |
GONG H X, SHEN B, FLEVARIS P, et al. G protein subunit Galpha13 binds to integrin alphaIIbbeta3 and mediates integrin "outside-in" signaling[J]. Science, 2010, 327(5963): 340-343. DOI:10.1126/science.1174779 |
| [11] |
RANA A, WESTEIN E, NIEGO B, et al. Shear-dependent platelet aggregation: mechanisms and therapeutic opportunities[J]. Front Cardiovasc Med, 2019, 6: 141. DOI:10.3389/fcvm.2019.00141 |
| [12] |
GAO Y, GAO C Y, ZHU P, et al. Ginsenoside Re inhibits vascular neointimal hyperplasia in balloon-injured carotid arteries through activating the eNOS/NO/cGMP pathway in rats[J]. Biomedecine Pharmacother, 2018, 106: 1091-1097. DOI:10.1016/j.biopha.2018.07.044 |
| [13] |
ZHOU Q, JIANG L, XU C H, et al. Ginsenoside Rg1 inhibits platelet activation and arterial thrombosis[J]. Thromb Res, 2014, 133(1): 57-65. DOI:10.1016/j.thromres.2013.10.032 |
| [14] |
QI H Y, HUANG Y L, YANG Y, et al. Anti-platelet activity of panaxatriol saponins is mediated by suppression of intracellular calcium mobilization and ERK2/p38 activation[J]. BMC Complement Altern Med, 2016, 16: 174. DOI:10.1186/s12906-016-1160-7 |
| [15] |
闫海峰, 代向东, 樊克涛, 等. 人参皂苷Re对ADP、PAF、AA诱导家兔血小板聚集功能的影响[J]. 天津中医药大学学报, 2016, 35(5): 310-313. YAN H F, DAI X D, FAN K T, et al. Effection of ginsenoside Re on ADP, PAF, AA-induced platelet aggregation[J]. J Tianjin Univ Tradit Chin Med, 2016, 35(5): 310-313. |
| [16] |
ZHANG T C, LIU L, HUANG X J, et al. Application of microfluidic chip technology to study the inhibitory effect of tetramethylpyrazine on platelet aggregation, activation, and phosphatidylserine exposure mediated by pathological high shear rate[J]. Blood Coagul Fibrinolysis, 2023, 34(1): 47-60. DOI:10.1097/MBC.0000000000001179 |
| [17] |
张天聪, 陈丹, 廖娟, 等. 生理性流动条件下血小板在玻璃表面的聚集行为[J]. 医用生物力学, 2022, 37(3): 425-432. ZHANG T C, CHEN D, LIAO J, et al. Platelet aggregation on glass surface under physiological flow condition[J]. J Med Biomech, 2022, 37(3): 425-432. |
| [18] |
XU Z Y, XU Y, XIE X F, et al. Anti-platelet aggregation of Panax notoginseng triol saponins by regulating GP1BA for ischemic stroke therapy[J]. Chin Med, 2021, 16(1): 12. DOI:10.1186/s13020-021-00424-3 |
| [19] |
VARGA-SZABO D, PLEINES I, NIESWANDT B. Cell adhesion mechanisms in platelets[J]. Arterioscler Thromb Vasc Biol, 2008, 28(3): 403-412. DOI:10.1161/ATVBAHA.107.150474 |
| [20] |
FEGHHI S, MUNDAY A D, TOOLEY W W, et al. Glycoprotein ib-Ⅸ-Ⅴ complex transmits cytoskeletal forces that enhance platelet adhesion[J]. Biophys J, 2016, 111(3): 601-608. DOI:10.1016/j.bpj.2016.06.023 |
| [21] |
YIN H, STOJANOVIC A, HAY N, et al. The role of Akt in the signaling pathway of the glycoprotein Ib-Ⅸ induced platelet activation[J]. Blood, 2008, 111(2): 658-665. DOI:10.1182/blood-2007-04-085514 |
| [22] |
CHEN Z S, LI T L, KAREEM K, et al. The role of PI3K/Akt signaling pathway in non-physiological shear stress-induced platelet activation[J]. Artif Organs, 2019, 43(9): 897-908. DOI:10.1111/aor.13465 |
| [23] |
LEON C, ALEX M, KLOCKE A, et al. Platelet ADP receptors contribute to the initiation of intravascular coagulation[J]. Blood, 2004, 103(2): 594-600. DOI:10.1182/blood-2003-05-1385 |
| [24] |
RIVERA J, LOZANO M L, NAVARRO-NÚÑEZ L, et al. Platelet receptors and signaling in the dynamics of thrombus formation[J]. Haematologica, 2009, 94(5): 700-711. DOI:10.3324/haematol.2008.003178 |




