泰国伯克霍尔德菌(Burkholderia thailandensis,B.thailandensis)是一种非发酵革兰阴性杆菌,隶属于伯克霍尔德菌属(Burkholderia)[1]。现有报道的泰国伯克霍尔德菌主要分离自热带、亚热带地区的土壤、水和植物标本中,我国海南地区的土壤和水源中也分离到泰国伯克霍尔德菌。该菌与类鼻疽伯克霍尔德菌在菌落形态、免疫原性和抗菌药物敏感谱等表型特征方面非常相似,曾被划为类鼻疽伯克霍尔德菌的两个生物型[2]。二者主要表现在致病力方面存在差异:泰国伯克霍尔德菌毒力弱,极少对人感染致病;类鼻疽伯克霍尔德菌毒力强,容易引起人畜共患的类鼻疽病[3]。然而近年来在美国、泰国和马来西亚等国家都相继报道了泰国伯克霍尔德菌引起人感染致病的病例,包括创伤感染、蜂窝组织炎、组织脓肿、肺部脓肿等化脓性感染[4-6]。同时相关研究表明现有的生物学和免疫学鉴定方法都易出现泰国伯克霍尔德菌菌种鉴定结果的错误[7]。这些问题必然造成临床上泰国伯克霍尔德菌的错、漏检,从而导致该菌的致病性被低估。
因此,我们认为泰国伯克霍尔德菌是一种临床上被低估了的条件致病菌。前期的临床工作中,我们从1例肺脓肿合并全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)患者的痰液和血液标本中分离到一株泰国伯克霍尔德菌,命名为BPM[7]。随后通过动物实验证实泰国伯克霍尔德菌BPM具有较强的致病性且在小鼠模型中可观察到炎症反应。为了明确BPM引起宿主感染致病的分子机制,本研究选取小鼠巨噬细胞RAW264.7为BPM的宿主细胞模型,以临床分离的泰国伯克霍尔德菌高致病株BPM(GenBank: CP050020, CP050021)为病原菌代表菌株[8-9],评价细菌与细胞孵育时间对细菌侵入细胞数量的影响,通过观察感染细胞的形态学改变、多核巨细胞(multinucleate giant cells,MNGC)的形成规律以及细胞凋亡情况来评价感染模型的稳定性,为进一步研究其致病机制奠定基础。
1 材料与方法 1.1 菌株、细胞株、试剂及仪器泰国伯克霍尔德菌BPM(GenBank:CP050020,CP050021,本实验室分离、鉴定、测序及保存)[7],小鼠巨噬细胞RAW264.7(上海翼和应用生物技术有限公司),DMEM培养基(美国Gibco公司),胎牛血清(美国Gibco公司),胰酶(美国Hyclone公司),哥伦比亚血琼脂平皿(美国Thermo公司),LB固体培养基(北京索莱宝科技有限公司),LB液体培养基(北京索莱宝科技有限公司),LEGENDplexTM Mouse Proinflammatory Chemokine Panel(美国Biolegend公司),4%多聚甲醛(国药控股重庆化学试剂有限公司),氯化钠(国药控股重庆化学试剂有限公司),24孔板(美国Thermo公司)。恒温孵箱(上海精宏实验室设备有限公司),台式高速冷冻离心机(美国Beckman公司),纯水仪(美国Millipore公司),恒温摇床(上海世平实验设备有限公司),高压灭菌器(日本Hirayama公司),生物安全柜(苏州安泰有限公司),赛默飞多功能酶标仪(美国Thermo公司),透射电子显微镜(美国FEI公司),恒温恒湿细胞培养箱(美国Forma公司),倒置显微镜(日本Olympus公司),活细胞工作站(日本Olympus公司)等。
1.2 细菌入胞率的分析将过夜培养的RAW264.7细胞加入至15 mL离心管,100×g离心5 min后弃上清,再用DMEM培养基重悬,稀释细胞浓度至4×105/孔,并以1 mL/孔的量接种于24孔板中。配制4×108/mL的菌液,以100 μL/孔的量感染细胞,并在恒温恒湿细胞培养箱中相互作用2 h后用无菌PBS洗涤3次,随后加入1 mL含氯霉素(终浓度34 μg/mL)DMEM继续培养1 h,然后用无菌PBS轻柔洗涤细胞3次,加入1 mL DMEM继续培养1、2、4、6、8 h,后用无菌PBS轻柔洗涤3次,无菌水1 mL/孔使细胞完全裂解,稀释一定浓度后将菌液均匀涂布于LB固体平板上,对细胞内存活的细菌数进行计数。收集感染1、2、4、6、8 h的细胞,摄取率计算方法公式:细胞裂解出的细菌数/感染初始细菌数×100%[10]。每个实验组重复3次,整体步骤重复3次。
1.3 透射电镜(TEM)观察受感染细胞形态为进一步观察泰国伯克霍尔德菌感染宿主细胞后引起的形态学改变,将BPM与RAW264.7细胞共培养,利用透射电镜观察不同时相点受感染细胞的形态特征、病理变化以及崩解死亡情况。
1.4 Giemsa染色观察MNGC的形成将RAW264.7细胞在盖玻片上过夜培养,第2天开始感染BPM,取不同时相点的感染细胞,洗涤2次,4%多聚甲醛固定15 min,无水乙醇再清洗5 min。待盖玻片干燥后进行Giemsa染色,观察MNGC的形成。MNGC形成比例=多核巨细胞中的核数/总的核数×100% [11]。
1.5 流式细胞术检测不同时相点诱导细胞凋亡情况24孔板培养RAW264.7细胞过夜。第2天吸弃培养液, 每孔加1×107 CFU新鲜培养的待测细菌,37 ℃孵育60 min;再次吸弃培养液, 刮取细胞制备PBS细胞悬液,采用FITC-Annexin V/PI双染法,用流式细胞仪检测不同时相点诱导细胞凋亡情况。
1.6 细胞上清炎症因子的检测用BPM感染RAW264.7细胞,收集不同感染时相下细胞培养上清,采用LEGENDplexTM试剂对各个时间点BPM感染RAW264.7细胞产生的各种炎症因子进行了检测,并绘制时间点-炎症因子值的曲线图。
2 结果 2.1 宿主细胞对细菌的摄取率分析以RAW264.7细胞作为模型进行吞噬后存活实验,实验中菌株BPM的MOI=100。细菌在LB培养基中生长的倍增时间约为1 h,但在感染细胞中从感染1~8 h细菌数量没有明显增加。
2.2 不同感染时相细菌的胞内生存状态和RAW264.7细胞病理损伤将BPM与RAW264.7细胞共培养,利用透射电镜观察结果显示:BPM感染细胞12 h后,细胞质均匀、未见水肿,细胞质内存在较多细胞器空泡,细胞膜完整,大量细胞崩解(图 2A)。感染18 h后,细胞质均出现轻度水肿、相对稀疏。细胞膜完整、周围伪足较少。细胞周围可见较多细胞崩解(图 2B);感染24 h后,膜破损、消失,基质逸散,细胞器和细菌游离(图 2C)。

|
| 图 1 不同时相点RAW264.7细胞对BPM的摄取率(n=5,x±s) |

|
| 图 2 透射电镜观察不同感染时相细胞内细菌生存状态和RAW264.7细胞病理改变 |
2.3 MNGC形成率的分析结果
BPM引起的MNGC在感染后16 h增加较明显,且形态改变也比较明显(图 3),这与活细胞动态观察的结果相一致。另外,值得注意的是,在MNGC内存在大量的BPM,而该菌在非融合细胞或较小的MNGC内数量较少。

|
| 图 3 Giemsa染色观察不同感染时相MNGC的形成(LM×1 000) |
2.4 不同感染时相细胞的凋亡情况
由于凋亡早期和晚期的炎症细胞均无法有效清除细菌,故本实验在分析结果时将凋亡早期和晚期细胞均包含在内。流式FITC-Annexin V/PI双染法分析结果显示:感染3 h后,BPM就可引起RAW264.7细胞凋亡。感染6 h后,RAW264.7细胞的凋亡更加明显,且随着时间的延长,凋亡的水平有逐渐增高的趋势(图 4)。

|
| A: 3 h; B: 6 h; C: 12 h; D: 20 h 图 4 流式细胞仪检测BPM感染RAW264.7细胞后凋亡情况 |
2.5 感染细胞炎症因子的检测结果
BPM感染RAW264.7细胞前8 h,细胞分泌炎症因子较低。感染8 h后炎症因子(TNF-α、IFN-β、MCP-1和IL-1α)开始急速升高,到感染后18 h达到峰值,然后迅速降低;而感染细胞18 h后炎症因子(IL-6、IL-1β)开始急速升高,到感染后24 h达到峰值(图 5)。
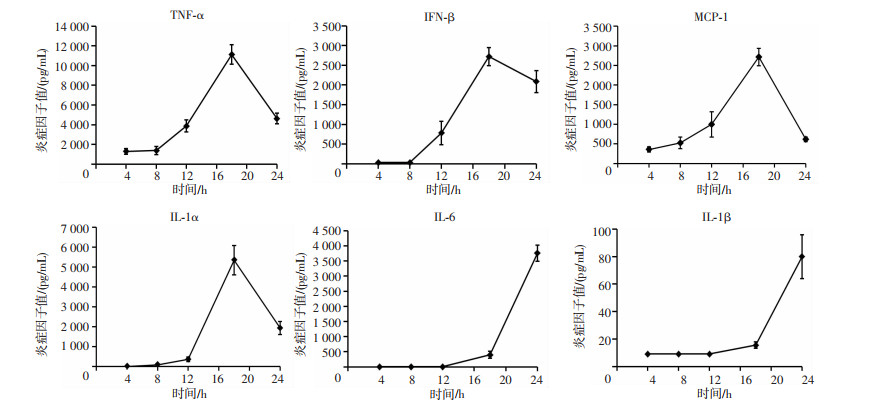
|
| 图 5 BPM感染RAW264.7细胞分泌炎症因子值的时间曲线(n=3, x±s) |
3 讨论
泰国伯克霍尔德菌引起人感染致病的过程极其复杂,受很多因素的影响,研究细菌胞内寄生过程,早期一般都通过建立细菌和细胞吞噬后存活率模型来观察[12]。本文以稳定、易培养的小鼠巨噬细胞RAW264.7为细胞模型,通过建立泰国伯克霍尔德菌感染RAW264.7细胞模型,不仅为今后建立泰国伯克霍尔德菌感染小鼠动物模型提供实践基础,也为后续泰国伯克霍尔德菌感染致病机制研究工作提供借鉴,节约宝贵的科研时间[13-14]。
本研究中,我们通过细胞对细菌的摄取率、MNGC形成能力来表征宿主的表型反应。已有文献报道泰国伯克霍尔德菌能在数分钟内进入细胞内[15],因此,本研究分别选用1、2、4、6、8 h作为BPM与RAW264.7细胞共同作用的时间,通过细胞吞噬后细菌存活实验来表征宿主对泰国伯克霍尔德菌感染的反应。同时,我们还利用透射电镜观察宿主细胞内泰国伯克霍尔德菌生存状态和细胞病理损伤情况,成功建立了泰国伯克霍尔德菌胞内感染模型。但在建立该感染模型的过程中发现泰国伯克霍尔德菌高致病株与以往报道的泰国伯克霍尔德菌存在一些不同之处[16-17]。比如,我们在细胞模型中发现细胞对细菌的摄取率并没有像所阐述得那样高(60%),这可能与孵育时间有关,孵育时间越长,细菌通过运动黏附上细胞的数量越多,巨噬细胞的蠕动越活跃[18]。此外,我们在细胞模型中还发现细胞细菌在LB培养基中生长的倍增时间约为1 h,但在感染细胞中从感染1~8 h细菌数量没有明显增加,这可能是因为细菌开始侵入细胞时,由于免疫杀伤作用使其数量减少,之后细菌逃避宿主细胞免疫清除并开始增殖,在一段时间后达到拷贝峰值,而后处于生长增殖的平台期[19-20]。这一规律在炎症因子的检测中也有体现,BPM感染细胞上清的炎症因子值从1~8 h也是没有明显增加。随着病原菌复制的不断增加,病原菌的免疫原性和分泌性抗原的增加使宿主的免疫反应性不断增强,进而分泌的细胞因子也增加,而感染后期随着细胞的不断崩解,细胞因子分泌再次出现降低[21]。
本研究构建的泰国伯克霍尔德菌强毒株感染RAW264.7细胞模型能较好地反映出泰国伯克霍尔德菌感染后宿主细胞的病理损伤变化规律,为进一步研究该菌与宿主细胞的相互作用,阐明其致病机制具有重要的指导意义。
| [1] |
GARCIA E C. Burkholderia thailandensis: genetic manipulat-ion[J]. Curr Protoc Microbiol, 2017, 45(1): 4C.2.1-4C.2.15. |
| [2] |
BRETT P J, DESHAZER D, WOODS D E. Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species[J]. Int J Syst Bacteriol, 1998, 48 Pt 1: 317-320. |
| [3] |
NGAMDEE W, TANDHAVANANT S, WIKRAIPHAT C, et al. Competition between Burkholderia pseudomallei and B. thailandensis[J]. BMC Microbiol, 2015, 15: 56. |
| [4] |
LERTPATANASUWAN N, SERMSRI K, PETKASEAM A, et al. Arabinose-positive Burkholderia pseudomallei infection in humans: case report[J]. Clin Infect Dis, 1999, 28(4): 927-928. |
| [5] |
GLASS M B, GEE J E, STEIGERWALT A G, et al. Pneumonia and septicemia caused by Burkholderia thailandensis in the United States[J]. J Clin Microbiol, 2006, 44(12): 4601-4604. |
| [6] |
GINTHER J L, MAYO M, WARRINGTON S D, et al. Identification of Burkholderia pseudomallei near-neighbor species in the northern territory of Australia[J]. PLoS Negl Trop Dis, 2015, 9(6): e0003892. |
| [7] |
段梦, 唱凯, 王艺, 等. 泰国伯克霍尔德菌错误鉴定1例[J]. 临床检验杂志, 2016, 34(3): 237-239. DUAN M, CHANG K, WANG Y, et al. Misidentification of Burkholderia in Thailand: a case report[J]. Chin J Clin Lab Sci, 2016, 34(3): 237-239. |
| [8] |
LI J, HU W W, QU G X, et al. Characterization of a type VI secretion system vgrG2 gene in the pathogenicity of Burkholderia thailandensis BPM[J]. Front Microbiol, 2021, 12: 811343. |
| [9] |
CHANG K, LUO J, XU H, et al. Human infection with Burkholderia thailandensis, China, 2013[J]. Emerg Infect Dis, 2017, 23(8): 1416-1418. |
| [10] |
黎元莉, 方瑶, 陈海, 等. 类鼻疽伯克霍尔德氏菌感染THP-1细胞模型的评价及其感染机制的初步探讨[J]. 第三军医大学学报, 2015, 37(23): 2348-2352. LI Y L, FANG Y, CHEN H, et al. Evaluation of a Burkholderia pseudomallei invaded THP-1 cell model and primary investigation on mechanism of its infection to host cells[J]. J Third Mil Med Univ, 2015, 37(23): 2348-2352. |
| [11] |
方瑶, 潘静, 李倩, 等. 类鼻疽伯克霍尔德氏菌感染RAW264.7细胞模型的建立[J]. 中国人兽共患病学报, 2013, 29(3): 282-285. FANG Y, PAN J, LI Q, et al. Establishment of a Burkholderia pseudomallei invaded RAW264.7 cell model[J]. Chin J Zoonoses, 2013, 29(3): 282-285. |
| [12] |
LI Q, FANG Y, ZHU P, et al. Burkholderia pseudomallei survival in lung epithelial cells benefits from miRNA-mediated suppression of ATG10[J]. Autophagy, 2015, 11(8): 1293-1307. |
| [13] |
中国微生物学会医学微生物学与免疫学专业委员会, 重庆市微生物学会临床微生物专业委员会. 类鼻疽诊断与治疗专家共识[J]. 中华传染病杂志, 2022, 40(10): 577-583. Medical Microbiology and Immunology Committee of Chinese Society of Microbiology, Clinical Microbiology Committee of Chongqing Society of Microbiology. Expert consensus on diagnosis and treatment of melioidosis[J]. Chin J Infect Dis, 2022, 40(10): 577-583. |
| [14] |
夏飞, 屈磊, 胡海涛, 等. 类鼻疽伯克霍尔德菌经鼻感染BALB/c小鼠模型的构建与评价[J]. 中国热带医学, 2022, 22(10): 923-929. XIA F, QU L, HU H T, et al. Establishment and evaluation of a BALB/c mouse model of Burkholderia pseudomallei via nasal infection[J]. China Trop Med, 2022, 22(10): 923-929. |
| [15] |
KOSTOW N, WELCH M D. Plasma membrane protrusions mediate host cell-cell fusion induced by Burkholderia thailandensis[J]. Mol Biol Cell, 2022, 33(8): ar70. |
| [16] |
PLACE D E, CHRISTGEN S, TULADHAR S, et al. Hierarchical cell death program disrupts the intracellular niche required for Burkholderia thailandensis pathogenesis[J]. mBio, 2021, 12(3): e0105921. |
| [17] |
PLACE D E, BRIARD B, SAMIR P, et al. Interferon inducible GBPs restrict Burkholderia thailandensis motility induced cell-cell fusion[J]. PLoS Pathog, 2020, 16(3): e1008364. |
| [18] |
毛婵, 李倩, 方瑶, 等. 类鼻疽伯克霍尔德氏菌感染A549细胞模型的建立[J]. 第三军医大学学报, 2013, 35(19): 2010-2013. MAO C, LI Q, FANG Y, et al. Establishment of a Burkholderia pseudomallei invaded A549 cell model[J]. J Third Mil Med Univ, 2013, 35(19): 2010-2013. |
| [19] |
李倩, 毛旭虎. 类鼻疽伯克霍尔德菌感染与免疫逃逸机制的研究进展[J]. 微生物与感染, 2020, 15(4): 259-264. LI Q, MAO X H. Progress in the mechanisms of Burkholderia pseudomallei infection and immune evasion[J]. J Microbes Infect, 2020, 15(4): 259-264. |
| [20] |
FANG Y, CHEN H, HU Y, et al. Burkholderia pseudomallei-derived miR-3473 enhances NF-κB via targeting TRAF3 and is associated with different inflammatory responses compared to Burkholderia thailandensis in murine macrophages[J]. BMC Microbiol, 2016, 16(1): 283. |
| [21] |
RAO C L, MAO C, XIA Y P, et al. Transcriptome analysis reveals unfolded protein response was induced during the early stage of Burkholderia pseudomallei infection in A549 cells[J]. Front Genet, 2020, 11: 585203. |




