2. 400030 重庆,重庆国际免疫研究院
2. Chongqing International Institute for Immunology, Chongqing, 400030, China
严重急性呼吸系统综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的暴发对人类健康构成了巨大威胁[1]。截至2022年12月,COVID-19已在全球大范围流行,全球已有至少6亿人口确诊,其中报告的死亡病例约为600万例。感染SARS-CoV-2出现的一般症状有发热、咳嗽、乏力等,严重时可发生急性肺损伤、呼吸衰竭甚至死亡[2-4]。
大多数老年和重症COVID-19患者体内出现细胞因子风暴,表现为促炎细胞因子IL-6、IL1RA和趋化因子CCL2、CCL8、CXCL2、CXCL8、CXCL9、CXCL16水平显著升高[5]。另外研究报道,Ⅰ型IFN在COVID-19患者和非COVID-19呼吸疾病患者中的表达都为阴性[5-6],提示SARS-CoV-2感染患者后,可能通过抑制Ⅰ型IFN反应进而逃逸先天免疫反应。先天性免疫反应无法及时启动,但快速的适应性免疫反应能够有效控制病毒,绝大部分人为无症状感染者[7]。年龄和基础疾病很大程度影响COVID-19进展,当体内病毒复制到一定程度而适应性免疫功能缺陷,特别是T细胞功能和抗体应答下降将会导致疾病的快速进展。然而,关于感染SARS-CoV-2恢复期患者、重症患者和死亡患者的免疫学特征研究并不充分。
本研究通过横断面研究分析了69例恢复期病例、45例重症病例、9例死亡病例的细胞因子水平、外周血免疫T细胞特征以及PD-1在T细胞上的表达,以此评估不同疾病程度COVID-19患者免疫学特征,有助于帮助我们理解疾病进展相关风险因素,对COVID-19的治疗提供建议。
1 资料与方法 1.1 研究对象与分组标准纳入2020年2月5日至4月10日在武汉火神山医院收治的123例COVID-19确诊患者为研究对象。纳入标准:①根据中国国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》以及咽拭子样本的定量RT-PCR检测,经实验室确诊为SARS-CoV-2阳性,诊断为COVID-19;②进行完整的流式分析,包括T细胞分群、PD-1表达和细胞因子检测;③进行与流式分析对应的实验室检查。
分组标准:为了更好地对应实验室结果所体现的免疫特征,本研究根据患者的治疗效果和临床转归进行分组,以流式细胞术等实验室检查标本采集当天的日期为分组判定时间点,通过分析病例中患者此时间点的各项临床指征综合进行分组。判定标准如下:①恢复组(处于恢复期的患者,须符合以下所有条件):体温≤37.3 ℃;无呼吸困难、气喘、气促等呼吸道症状;呼吸频率(RR)恢复至12~20次/min;血氧饱和度(SpO2)≥93%;胸部CT影像显示肺部无毛玻璃状或阴影等肺炎指征;患者采集标本后7 d内康复出院。②重症组(仍有以下任意一条或以上的重症症状的患者):体温>37.3 ℃;有呼吸困难、气喘或气促等呼吸道症状;RR>20次/min;静息状态下,SpO2<93%;动脉血氧分压PaO2/吸氧浓度FiO2≤300 mmHg;影像学检查仍有肺炎指征;及未达到恢复组标准的患者。③死亡组:具有重症组指标且采集标本后14 d内死亡。本研究通过武汉火神山医院伦理委员会的许可(批准文件号:HSSLL011),并且患者均签署知情同意书。
1.2 临床实验室数据收集电子病历数据由2人分别统计并校正以保证数据的准确性。临床实验室数据的入组标准为:结果报告时间与流式细胞术报告为同一天或前后一天,主要包括外周血全血细胞计数,血清生化检测(肝功、肾功、电解质、凝血功能、肌酸激酶等)等。有部分患者未进行全部实验室检查。
1.3 细胞因子检测细胞因子检测数据的入组标准同1.2。外周血分离血浆后,在武汉火神山医院检验科防护实验室使用瑞思凯尔多重微球流式免疫荧光发光仪,并按照配套的12项细胞因子检测试剂盒说明书检测IL-5、IFN-α、IL-2、IL-6、IL-1β、IL-10、IFN-γ、IL-8、IL-17、IL-4、IL-12p70、TNF-α表达。
1.4 外周血免疫细胞流式细胞术检测本实验采用几组预混抗体试剂标记外周全血T细胞不同亚群,使用试剂如下:DURAClone IM Phenotyping Basic免疫检测试剂盒(B53309, Beckman Coulter),DURAClone IM T细胞亚群试剂组(B53328, Beckman Coulter),DURAClone IM Treg试剂组(B53346, Beckman Coulter)。加入100 μL外周全血到预混抗体试剂管,充分涡旋混合,避光室温反应15 min后加入2 mL溶血剂(A09777,Beckman Coulter),充分混匀后避光室温孵育15 min,然后用PBS清洗细胞2次后重悬。在武汉火神山医院检验科防护实验室使用贝克曼DxFLEX流式细胞仪进行检测。
1.5 统计学方法使用GraphPad Prism8.0软件进行分析。不符合正态分布的连续变量用中位数(四分位数间距)[M(P25, P75)]表示,符合正态分布的连续变量用x±s表示,分类变量用n(%)表示。组间比较采用χ2检验、单因素方差分析或者Kruskai-Wallis检验。P < 0.05为差异有统计学意义。
2 结果 2.1 COVID-19患者特征本研究共收集123例COVID-19确诊患者,其中恢复组共有69例,男性40例,女性29例;重症组共有45例,男性25例,女性20例;死亡组共9例,均为男性,有统计学差异(P < 0.05)。所有患者中位年龄为69岁,最小27岁,最大88岁,恢复组60岁以上患者有36例(52.2%),重症组60岁以上患者有35例(77.8%),死亡组60岁以上病例有8例(88.9%)。常见的基础代谢疾病包括高血压(n=46,37.4%)、糖尿病(n=24,19.5%)、心血管疾病(n=18,14.6%),另外有18例(14.6%)患者患有急性心肌损伤,6例(4.9%)患有急性肾损伤,6例(4.9%)患有急性肝损伤,其中继发感染、急性肾损伤、呼吸障碍和昏迷等组间具有统计学差异(P < 0.05)。病例初诊时的基本特征的具体分布见表 1。
| 基本信息和临床症状 | 所有病例(n=123) | 恢复组(n=69) | 重症组(n=45) | 死亡组(n=9) | P值 |
| 女性 | 49(39.8) | 29(42.0) | 20(44.4) | 0(0.0) | 0.039 |
| 男性 | 74(60.2) | 40(58.0) | 25(55.6) | 9(100.0) | |
| 年龄/岁 | 69.0(61.0,77.0) | 62.0(57.0,72.0) | 72.0(69.0,82.0) | 81.0(77.0,84.5) | < 0.01 |
| >60岁 | 79(64.2) | 36(52.2) | 35(77.8) | 8(88.9) | < 0.01 |
| 高血压 | 46(37.4) | 25(36.2) | 18(40.0) | 3(33.3) | 0.89 |
| 糖尿病 | 24(19.5) | 12(17.4) | 9(20.0) | 3(33.3) | 0.52 |
| 心血管疾病 | 18(14.6) | 8(11.6) | 8(17.8) | 2(22.2) | 0.53 |
| 呼吸衰竭 | 11(8.9) | 3(4.3) | 6(13.3) | 2(22.2) | 0.09 |
| 继发感染 | 5(4.1) | 1(1.4) | 2(4.4) | 2(22.2) | 0.012 |
| 急性心肌损伤 | 18(14.6) | 7(10.1) | 8(17.8) | 3(33.3) | 0.14 |
| 急性肾损伤 | 6(4.9) | 2(2.9) | 1(2.2) | 3(33.3) | < 0.01 |
| 急性肝损伤 | 6(4.9) | 2(2.9) | 3(6.7) | 1(11.1) | 0.44 |
| 发烧 | 91(74.0) | 52(75.4) | 32(71.1) | 7(77.8) | 0.85 |
| 最高体温/℃ | 38.0(37.2,38.5) | 38.0(37.2,38.5) | 38.1(37.3,38.5) | 38.5(37.7,39.2) | 0.39 |
| 咳嗽 | 110(89.4) | 63(91.3) | 40(88.9) | 7(77.8) | 0.46 |
| 呼吸障碍 | 83(67.6) | 40(58.0) | 35(77.8) | 8(88.9) | 0.03 |
| 乏力 | 78(63.4) | 39(56.5) | 32(71.1) | 6(66.7) | 0.28 |
| 肌痛 | 35(28.5) | 18(26.1) | 15(33.3) | 2(22.2) | 0.64 |
| 咳痰 | 24(19.5) | 10(14.5) | 13(28.9) | 1(11.1) | 0.13 |
| 头痛 | 4(3.3) | 3(4.3) | 2(4.4) | 1(11.1) | 0.66 |
| 昏迷 | 11(8.9) | 0(0.0) | 2(4.4) | 9(100.0) | < 0.01 |
| 收缩压/mmHg | 131.0±17.0 | 130.0±16.0 | 135.0±24.0 | 133.0±11.0 | 0.61 |
| 心率/次·min-1 | 92.0±14.0 | 91.0±14.0 | 95.0±17.0 | 92.0±17.0 | 0.71 |
2.2 不同疾病程度的COVID-19患者实验室特征
血常规结果显示死亡组白细胞较重症组和恢复组升高(P < 0.05),死亡组白细胞均值超过正常范围上限;红细胞数量随着疾病严重程度增加逐渐减少(P < 0.05),这可能是重症患者缺氧的原因之一;死亡组和重症组患者血小板数量较恢复组低(P < 0.05),但仍处于正常范围内;恢复组、重症组和死亡组患者中性粒细胞频率逐渐增加(P < 0.05),且淋巴细胞频率逐渐减少(P < 0.05)。
为了进一步评估不同疾病进展患者体内的炎症情况,分析患者炎症和生化相关指标。重症组和死亡组患者表现出炎症指标C反应蛋白升高(P < 0.05),死亡组患者肝功指标总胆红素、直接胆红素和间接胆红素升高(P < 0.05),肾功指标血尿素氮升高以及碱性磷酸酶、乳酸脱氢酶、肌酸激酶、降钙素原显著升高(P < 0.05),见表 2,提示死亡组患者可能出现肝肾等器官的损伤。
| 实验室检查指标 | 正常范围 | 恢复组 | 重症组 | 死亡组 | P值 | ||||||||
| n | 均值 | 范围 | n | 均值 | 范围 | n | 均值 | 范围 | |||||
| IL-5/pg·mL-1 | < 3.1 | 49 | 3.3 | 1.6~17.5 | 46 | 3.2 | 1.8~9.6 | 14 | 4.3 | 2.1~14.2 | 0.38 | ||
| IFN-α/pg·mL-1 | < 8.5 | 49 | 3.4 | 0.6~22.3 | 46 | 2.6 | 0.5~22.0 | 14 | 2.7 | 1.9~3.7 | 0.49 | ||
| IL-2/pg·mL-1 | < 7.5 | 49 | 5.2 | 1.3~52.9 | 46 | 4.6 | 1.7~17.7 | 14 | 14.7 | 3.0~33.8 | < 0.01bc | ||
| IL-6/pg·mL-1 | < 5.4 | 49 | 36.3 | 0.0~280.2 | 46 | 194.8 | 0.0~2 194.6 | 14 | 1 928.2 | 71.2~9 799.6 | < 0.01abc | ||
| IL-1β/pg·mL-1 | < 12.4 | 49 | 23.6 | 0.0~439.1 | 46 | 11.8 | 0.0~264.7 | 14 | 14.8 | 0.0~32.2 | 0.13 | ||
| IL-10/pg·mL-1 | < 12.9 | 49 | 4.4 | 2.2~21.6 | 46 | 5.7 | 2.4~21.5 | 14 | 22.6 | 2.7~114.5 | < 0.01abc | ||
| IFN-γ/pg·mL-1 | < 23.1 | 49 | 7.3 | 0.2~121.2 | 46 | 7.0 | 0.4~33.5 | 14 | 17.3 | 2.0~80.8 | 0.21 | ||
| IL-8/pg·mL-1 | < 20.6 | 49 | 24.8 | 1.7~247.7 | 46 | 31.5 | 1.7~149.9 | 14 | 306.3 | 18.4~1 219.7 | < 0.01abc | ||
| IL-17/pg·mL-1 | < 21.4 | 49 | 3.8 | 1.1~37.8 | 46 | 4.0 | 1.6~34.0 | 14 | 4.8 | 3.0~14.0 | < 0.01bc | ||
| IL-4/pg·mL-1 | < 8.56 | 49 | 2.9 | 1.2~9.6 | 46 | 2.8 | 0.9~17.9 | 14 | 2.9 | 1.9~4.6 | 0.90 | ||
| IL-12p70/pg·mL-1 | < 3.4 | 49 | 3.1 | 1.5~15.5 | 46 | 3.2 | 1.6~18.8 | 14 | 2.7 | 2.1~3.2 | 0.64 | ||
| TNF-α/pg·mL-1 | < 16.5 | 49 | 4.1 | 0.3~41.6 | 46 | 3.3 | 0.3~23.9 | 14 | 3.2 | 0.0~7.6 | 0.39 | ||
| WBC/109·L-1 | 3.5~9.5 | 74 | 6.2 | 2.1~13.3 | 56 | 6.7 | 1.7~32.4 | 14 | 12.4 | 3.1~35.8 | < 0.01bc | ||
| RBC/1012·L-1 | 4.0~5.8 | 74 | 3.9 | 2.9~5.7 | 56 | 3.4 | 2.0~4.8 | 14 | 3.0 | 2.5~3.6 | < 0.01abc | ||
| HGB/g·L-1 | 120.0~170.0 | 74 | 120.8 | 84.0~166.0 | 56 | 106.8 | 60.0~148.0 | 14 | 93.0 | 74.0~109.0 | < 0.01abc | ||
| PLT/109·L-1 | 125.0~350.0 | 74 | 215.5 | 82.0~410.0 | 56 | 178.2 | 39.0~320.0 | 14 | 138.0 | 14.0~393.0 | < 0.01ab | ||
| 中性粒细胞频率(%) | 40.0~75.0 | 74 | 57.6 | 40.2~89.9 | 56 | 69.6 | 47.0~96.6 | 14 | 89.1 | 72.9~96.0 | < 0.01abc | ||
| 中性粒细胞计数/109·L-1 | 1.8~6.3 | 74 | 3.6 | 1.2~10.2 | 56 | 4.9 | 1.0~30.9 | 14 | 11.2 | 2.3~34.3 | < 0.01bc | ||
| 淋巴细胞频率(%) | 20.0~50.0 | 74 | 30.0 | 5.8~48.1 | 56 | 19.1 | 0.8~40.0 | 14 | 6.2 | 2.4~24.4 | < 0.01abc | ||
| 淋巴细胞计数/109·L-1 | 1.1~3.2 | 74 | 1.8 | 0.4~3.3 | 56 | 1.1 | 0.1~3.0 | 14 | 0.6 | 0.3~0.9 | < 0.01abc | ||
| 单核细胞频率(%) | 3.0~10.0 | 74 | 8.3 | 3.5~14.3 | 56 | 7.5 | 0.6~17.9 | 14 | 3.6 | 0.0~8.3 | < 0.01bc | ||
| 单核细胞计数/109·L-1 | 0.1~0.6 | 74 | 0.5 | 0.2~1.1 | 56 | 0.5 | 0.0~1.1 | 14 | 0.4 | 0.0~1.0 | 0.08 | ||
| C反应蛋白/mg·L-1 | 0.0~4.0 | 72 | 6.7 | 0.0~196.7 | 56 | 26.3 | 0.0~254.5 | 14 | 109.1 | 15.8~242.9 | < 0.01abc | ||
| 谷丙转氨酶/IU·L-1 | 9.0~50.0 | 74 | 39.7 | 4.4~521.6 | 56 | 30.6 | 4.1~114.0 | 14 | 45.4 | 8.6~320.5 | 0.50 | ||
| 谷草转氨酶/IU·L-1 | 9.0~60.0 | 74 | 26.7 | 8.0~232.9 | 56 | 27.3 | 10.2~162.8 | 14 | 40.0 | 14.9~102.0 | 0.18 | ||
| 总胆红素/μmol·L-1 | 0.0~26.0 | 74 | 8.9 | 4.0~19.8 | 56 | 11.7 | 4.0~27.7 | 14 | 67.3 | 5.8~554.5 | < 0.01bc | ||
| 直接胆红素/μmol·L-1 | 0.0~8.0 | 74 | 3.0 | 1.1~11.5 | 56 | 5.2 | 1.9~19.2 | 14 | 43.2 | 2.3~376.0 | < 0.01bc | ||
| 间接胆红素/μmol·L-1 | 0.0~14.0 | 59 | 5.9 | 2.5~12.4 | 47 | 6.6 | 1.3~16.4 | 14 | 24.0 | 2.3~178.5 | < 0.01bc | ||
| 总胆汁酸/μmol·L-1 | 0.0~10.0 | 74 | 6.2 | 0.0~54.0 | 56 | 6.4 | 0.0~24.2 | 14 | 20.7 | 0.0~84.3 | < 0.01bc | ||
| 总蛋白/g·L-1 | 65.0~85.0 | 74 | 66.3 | 53.6~88.5 | 56 | 62.0 | 45.0~79.5 | 14 | 54.5 | 40.4~63.3 | < 0.01abc | ||
| 白蛋白/g·L-1 | 40.0~55.0 | 74 | 38.2 | 30.8~47.1 | 56 | 35.5 | 24.5~43.8 | 14 | 31.5 | 26.7~41.6 | < 0.01abc | ||
| 球蛋白/g·L-1 | 20.0~40.0 | 59 | 28.3 | 19.1~46.7 | 47 | 26.0 | 14.6~40.6 | 14 | 23.0 | 13.3~27.8 | < 0.01b | ||
| 白球比值 | 1.0~2.4 | 59 | 1.4 | 0.8~2.0 | 47 | 1.4 | 0.6~2.1 | 14 | 1.4 | 1.0~2.1 | 0.91 | ||
| 葡萄糖/μmol·L-1 | 3.9~6.1 | 74 | 5.7 | 4.1~10.2 | 56 | 7.1 | 4.5~17.3 | 14 | 7.4 | 3.9~11.2 | < 0.01ab | ||
| 血尿素氮/μmol·L-1 | 3.1~8.0 | 74 | 5.6 | 1.9~22.3 | 56 | 7.1 | 1.1~30.6 | 14 | 17.6 | 8.4~37.7 | < 0.01bc | ||
| 肌酐/μmol·L-1 | 57.0~97.0 | 74 | 65.9 | 32.0~124.5 | 56 | 75.3 | 28.5~304.2 | 14 | 78.4 | 42.1~232.9 | 0.24 | ||
| 尿酸/μmol·L-1 | 202.0~416.0 | 74 | 307.9 | 117.0~748.0 | 56 | 249.0 | 65.0~576.0 | 14 | 249.4 | 104.0~801.0 | 0.01a | ||
| 碱性磷酸酶/IU·L-1 | 45.0~125.0 | 74 | 76.5 | 41.7~148.8 | 56 | 97.7 | 37.4~347.8 | 14 | 135.0 | 51.6~272.0 | < 0.01abc | ||
| 谷氨酰转肽酶/IU·L-1 | 10.0~60.0 | 74 | 46.5 | 0.0~222.8 | 56 | 64.5 | 10.7~446.1 | 14 | 45.2 | 25.0~80.5 | 0.14 | ||
| 肌酸激酶/IU·L-1 | 24.0~190.0 | 71 | 43.3 | 17.1~192.8 | 52 | 41.1 | 7.1~223.3 | 14 | 71.4 | 13.2~275.3 | 0.02bc | ||
| 乳酸脱氢酶/IU·L-1 | 120.0~250.0 | 71 | 195.5 | 126.9~476.2 | 52 | 252.7 | 114.9~712.3 | 14 | 329.3 | 220.5~649.7 | < 0.01abc | ||
| 羟丁酸脱氢酶/IU·L-1 | 72.0~182.0 | 71 | 153.4 | 107.0~332.0 | 52 | 211.6 | 98.6~645.6 | 14 | 270.1 | 166.9~593.5 | < 0.01abc | ||
| 肌酸激酶同工酶/IU·L-1 | 0.0~24.0 | 71 | 8.9 | 0.0~17.6 | 52 | 10.4 | 0.0~31.8 | 14 | 20.1 | 6.7~72.0 | < 0.01bc | ||
| 胱抑素C/mg·L-1 | 0.6~1.3 | 74 | 1.1 | 0.7~1.7 | 56 | 1.4 | 0.8~4.6 | 14 | 1.8 | 1.1~2.7 | < 0.01abc | ||
| 二氧化碳/mmol·L-1 | 22.0~29.0 | 74 | 24.8 | 18.6~32.1 | 56 | 26.6 | 21.2~37.1 | 14 | 26.3 | 18.5~35.7 | 0.01a | ||
| 降钙素原/ng·mL-1 | 0.0~0.05 | 50 | 0.1 | 0.0~0.4 | 45 | 0.2 | 0.0~2.1 | 14 | 2.8 | 0.1~12.3 | < 0.01abc | ||
| 纤维蛋白原/g·L-1 | 2.0~4.0 | 72 | 3.0 | 1.8~5.0 | 56 | 2.8 | 1.1~5.0 | 14 | 2.8 | 1.0~4.7 | 0.56 | ||
| 活化部分凝血酶时间/s | 21.0~37.0 | 72 | 28.2 | 20.8~38.8 | 56 | 30.3 | 21.9~47.0 | 14 | 38.3 | 24.2~68.4 | < 0.01bc | ||
| 凝血酶原时间/s | 9.2~15.0 | 72 | 12.7 | 10.7~17.3 | 56 | 13.6 | 11.3~22.6 | 14 | 16.1 | 11.7~26.0 | < 0.01abc | ||
| 凝血酶时间/s | 10.0~20.0 | 72 | 15.1 | 12.8~18.8 | 56 | 16.4 | 13.2~27.9 | 14 | 17.1 | 12.6~25.3 | < 0.01ab | ||
| D二聚体/mg·L-1 | 0.0~0.55 | 72 | 1.1 | 0.1~0.7 | 56 | 4.1 | 0.3~40.0 | 14 | 2.8 | 1.0~6.8 | < 0.01ab | ||
| K/mmol·L-1 | 3.5~5.3 | 73 | 4.3 | 3.4~5.1 | 56 | 4.2 | 3.1~5.5 | 14 | 4.4 | 3.6~5.9 | 0.09 | ||
| Na/mmol·L-1 | 137.0~147.0 | 73 | 141.2 | 134.7~146.4 | 56 | 141.2 | 131.4~158.4 | 14 | 148.3 | 132.8~165.1 | < 0.01bc | ||
| Cl/mmol·L-1 | 99.0~110.0 | 73 | 106.0 | 93.9~112.3 | 56 | 104.4 | 92.7~116.0 | 14 | 109.3 | 95.3~130.1 | 0.01bc | ||
| Ca/mmol·L-1 | 2.11~2.52 | 73 | 2.3 | 2.0~2.5 | 56 | 2.2 | 1.8~2.6 | 14 | 2.2 | 2.0~2.6 | < 0.01b | ||
| P/mmol·L-1 | 0.85~1.51 | 59 | 1.2 | 0.7~1.6 | 47 | 1.0 | 0.3~1.7 | 14 | 0.8 | 0.0~1.7 | < 0.01ab | ||
| Mg/mmol·L-1 | 0.75~1.02 | 59 | 0.9 | 0.8~1.1 | 47 | 0.9 | 0.6~1.2 | 14 | 1.0 | 0.8~1.5 | < 0.01c | ||
| a: P < 0.05,恢复组与重症组比较;b: P < 0.05,恢复组与死亡组比较;c: P < 0.05,重症组与死亡组比较;表中P值为3组总体比较;n代表采集标本的病例数量,不代表入组病例数量(同一患者可能有多次采样检测,也有一部分患者未进行某项指标检测) | |||||||||||||
2.3 不同疾病程度的COVID-19患者细胞因子表达
为了更好地了解患者体内的炎症状态,测定3组患者血浆IL-5、IFN-α、IL-2、IL-6、IL-1β、IL-10、IFN-γ、IL-8、IL-17、IL-4、IL-12p70、TNF-α表达水平。结果显示死亡组患者血浆IL-2、IL-6、IL-8、IL-10、IL-17表达高于重症组和恢复组(P < 0.05),其他细胞因子表达在3组之间差异无统计学意义。
重症组和死亡组患者IL-6的表达水平分别是正常范围上限的36倍和357倍;重症组和死亡组患者IL-8的表达水平分别是正常范围的上限的1.5倍和15倍,见表 2和图 1。
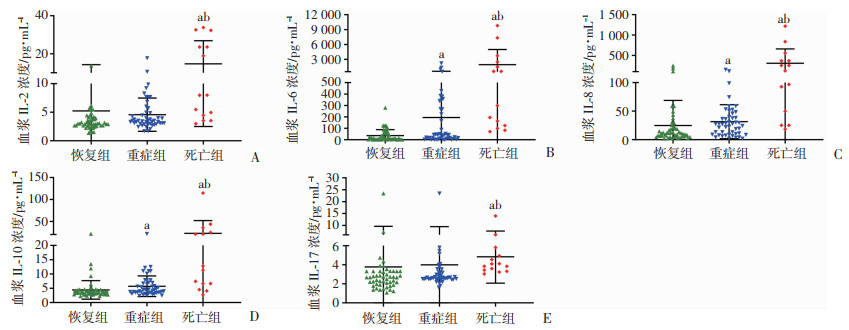
|
| A~E:分别为血浆IL-2、IL-6、IL-8、IL-10、IL-17浓度;a:P < 0.05,与恢复组比较;b:P < 0.05,与重症组比较 图 1 不同疾病程度COVID-19患者血浆细胞因子表达 |
2.4 不同疾病程度的COVID-19患者免疫细胞特征
随着COVID-19疾病的加重,患者淋巴细胞频率和绝对值下降(P < 0.05),见表 2。进一步分析证明CD4和CD8在3组患者淋巴细胞中的表达频率无统计学差异,重症组和死亡组CD4+和CD8+T细胞数量低于恢复组(P < 0.05),重症组和死亡组的CD4+Treg细胞频率高于恢复组(P < 0.05),见表 3。以上结果表明,CD4+和CD8+T细胞数量减少与COVID-19疾病严重程度相关,且重症组和死亡组具有更高比例的免疫抑制Treg细胞,这可能是疾病进展的重要原因。
| T细胞亚群 | 恢复组(n=76) | 重症组(n=57) | 死亡组(n=14) | P值 | |||||
| 均值 | 范围 | 均值 | 范围 | 均值 | 范围 | ||||
| CD4+ T细胞亚群 | |||||||||
| CD4+淋巴细胞频率(%) | 55.7 | 18.5~77.0 | 52.1 | 28.4~80.4 | 60.2 | 30.6~79.9 | 0.05 | ||
| CD4+ T细胞数量/109·L-1 | 1.0 | 0.2~2.0 | 0.6 | 0.0~2.0 | 0.3 | 0.2~0.6 | < 0.01ab | ||
| CD4+效应T/CD4+T细胞(%) | 0.6 | 0.0~8.4 | 0.9 | 0.0~12.2 | 0.7 | 0.0~2.3 | 0.49 | ||
| CD4+效应T细胞数量/106·L-1 | 5.4 | 0.0~64.3 | 5.7 | 0.0~88.1 | 1.9 | 0.1~7.0 | 0.55 | ||
| CD4+幼稚T/CD4+T细胞(%) | 24.4 | 4.9~54.6 | 17.8 | 1.2~59.5 | 27.2 | 9.2~57.2 | < 0.01ac | ||
| CD4+幼稚T细胞数量/106·L-1 | 256.6 | 19.5~969.8 | 96.9 | 2.1~428.9 | 92.1 | 31.9~229.3 | < 0.01ab | ||
| CD4+TCM/CD4+ T细胞(%) | 57.3 | 23.2~82.6 | 54.8 | 25.6~84.8 | 45.1 | 31.0~66.9 | < 0.01bc | ||
| CD4+ TCM细胞数量/106·L-1 | 570.2 | 102.8~1 147.7 | 317.6 | 22.7~1 169.4 | 158.9 | 57.7~433.3 | < 0.01abc | ||
| CD4+TEM/CD4+ T细胞(%) | 17.7 | 2.0~58.0 | 26.4 | 2.7~64.0 | 27.0 | 8.2~47.7 | < 0.01ab | ||
| CD4+ TEM细胞数量/106·L-1 | 160.9 | 18.1~479.8 | 136.8 | 13.7~711.8 | 94.3 | 25.2~209.9 | 0.08 | ||
| PD-1+ CD4+ T/CD4+ T细胞(%) | 10.1 | 1.1~32.7 | 20.5 | 7.4~55.9 | 17.0 | 6.5~29.2 | < 0.01ab | ||
| PD-1+ CD4+ T细胞数量/106·L-1 | 92.8 | 11.4~211.9 | 106.1 | 11.5~390.8 | 53.2 | 19.8~91.5 | < 0.01bc | ||
| PD-1+ CD4+ TCM/CD4+ TCM(%) | 65.2 | 39.7~89.8 | 54.9 | 21.1~82.2 | 52.9 | 35.3~83.6 | < 0.01ab | ||
| PD-1+ CD4+ TCM细胞数量/106·L-1 | 60.3 | 7.9~155.7 | 61.2 | 6.0~253.8 | 27.8 | 9.6~60.7 | 0.01bc | ||
| PD-1+ CD4+ TEM/CD4+ TEM(%) | 21.1 | 2.5~59.3 | 37.1 | 6.7~74.4 | 37.1 | 11.0~55.8 | < 0.01ab | ||
| PD-1+ CD4+ TEM细胞数量/106·L-1 | 19.7 | 0.6~102.6 | 34.6 | 3.2~139.5 | 20.0 | 2.7~35.3 | < 0.01ac | ||
| PD-1+ CD4+效应T/CD4+效应T细胞(%) | 0.2 | 0.0~2.2 | 0.5 | 0.0~4.6 | 0.9 | 0.0~3.3 | < 0.01b | ||
| PD-1+ CD4+效应T细胞数量/106·L-1 | 0.2 | 0.0~2.1 | 0.5 | 0.0~10.7 | 0.5 | 0.0~2.1 | 0.21 | ||
| CD8+ T细胞亚群 | |||||||||
| CD8+淋巴细胞频率(%) | 36.9 | 14.4~77.3 | 41.4 | 16.5~67.9 | 36.2 | 17.8~62.6 | 0.06 | ||
| CD8+ T细胞数量/109·L-1 | 0.7 | 0.2~2.3 | 0.5 | 0.1~1.8 | 0.2 | 0.0~0.5 | < 0.01abc | ||
| CD8+效应T/CD8+T细胞(%) | 20.3 | 0.0~58.2 | 26.1 | 2.4~62.7 | 24.8 | 5.3~45.9 | 0.05a | ||
| CD8+效应T细胞数量/106·L-1 | 137.6 | 0.1~1 196.9 | 116.4 | 2.7~779.7 | 50.2 | 7.4~111.2 | 0.08 | ||
| CD8+幼稚T/CD8+T细胞(%) | 16.7 | 1.1~67.3 | 8.3 | 0.5~37.6 | 9.1 | 1.3~32.9 | < 0.01ab | ||
| CD8+幼稚T细胞数量/106·L-1 | 98.0 | 15.2~309.5 | 34.1 | 2.2~147.1 | 16.1 | 4.7~45.8 | < 0.01ab | ||
| CD8+TCM/CD8+ T细胞(%) | 11.5 | 0.5~38.7 | 10.2 | 1.6~33.0 | 9.2 | 1.9~25.8 | 0.37 | ||
| CD8+ TCM细胞数量/106·L-1 | 72.6 | 6.7~328.0 | 46.9 | 2.4~167.3 | 19.1 | 4.1~66.4 | < 0.01ab | ||
| CD8+TEM/CD8+ T细胞(%) | 50.7 | 0.3~76.8 | 55.4 | 21.8~90.9 | 56.9 | 37.9~81.5 | 0.13 | ||
| CD8+ TEM细胞数量/106·L-1 | 351.7 | 2.4~1 205.2 | 258.6 | 16.2~1 265.3 | 132.2 | 24.6~362.9 | < 0.01ab | ||
| PD-1+ CD8+ T/CD8+ T细胞(%) | 13.4 | 2.1~28.9 | 28.2 | 7.4~69.3 | 29.3 | 11.4~61.9 | < 0.01ab | ||
| PD-1+ CD8+ T细胞数量/106·L-1 | 83.8 | 0.0~301.8 | 121.8 | 6.4~487.3 | 70.1 | 14.3~250.6 | < 0.01ac | ||
| PD-1+ CD8+ TCM/CD8+ TCM(%) | 42.5 | 13.8~93.3 | 31.2 | 3.4~53.7 | 22.7 | 7.3~46.2 | < 0.01ab | ||
| PD-1+ CD8+ TCM细胞数量/106·L-1 | 35.3 | 0.0~127.3 | 37.5 | 1.5~117.5 | 15.0 | 2.1~64.7 | 0.02bc | ||
| PD-1+ CD8+ TEM/CD8+ TEM(%) | 26.5 | 0.0~74.6 | 43.3 | 22.0~67.9 | 51.6 | 26.9~73.4 | < 0.01ab | ||
| PD-1+ CD8+ TEM细胞数量/106·L-1 | 24.1 | 0.0~127.0 | 52.0 | 3.5~213.9 | 39.9 | 6.0~169.9 | < 0.01a | ||
| PD-1+ CD8+效应T/CD8+效应T细胞(%) | 4.4 | 0.0~24.9 | 10.2 | 0.4~58.4 | 13.9 | 2.4~30.8 | < 0.01ab | ||
| PD-1+ CD8+效应T细胞数量/106·L-1 | 3.8 | 0.0~39.4 | 13.4 | 0.1~126.2 | 8.6 | 0.9~37.6 | < 0.01a | ||
| CD25+Foxp3+ Treg细胞亚群 | |||||||||
| Treg/CD4+ T细胞(%) | 3.2 | 0.6~8.5 | 5.0 | 0.5~16.9 | 6.2 | 1.5~14.3 | < 0.01ab | ||
| Treg细胞数量/106·L-1 | 30.5 | 6.1~120.0 | 24.1 | 10.4~76.3 | 19.3 | 7.8~59.9 | 0.06 | ||
| 幼稚型Treg/Treg(%) | 14.1 | 0.8~40.5 | 9.7 | 0.8~58.0 | 10.7 | 2.7~21.8 | 0.02a | ||
| 幼稚型Treg细胞数量/106·L-1 | 4.1 | 0.1~20.0 | 2.1 | 0.1~8.2 | 1.7 | 0.3~3.2 | < 0.01ab | ||
| 记忆型Treg/Treg(%) | 85.5 | 58.3~99.2 | 89.5 | 37.0~99.2 | 88.8 | 77.6~97.3 | 0.05 | ||
| 记忆型Treg数量/106·L-1 | 26.3 | 5.3~105.1 | 21.7 | 1.8~71.7 | 17.4 | 6.5~56.9 | 0.14 | ||
| 激活型Treg/Treg(%) | 44.5 | 8.6~80.7 | 40.2 | 10.1~81.1 | 42.3 | 10.1~83.5 | 0.47 | ||
| 激活型Treg细胞数量/106·L-1 | 13.1 | 1.8~42.5 | 9.1 | 0.5~38.5 | 8.0 | 0.8~27.4 | 0.01a | ||
| a: P < 0.05,恢复组与重症组比较;b: P < 0.05,恢复组与死亡组比较;c: P < 0.05,重症组与死亡组比较;表中P值为3组总体比较;n代表采集标本的病例数量,不代表入组病例数量(同一患者可能有多次采样检测) | |||||||||
为了评估T细胞的分化状态,分析123例患者外周血标本T细胞CCR7和CD45RA分子的表达水平。细胞分群如图 2所示:幼稚T细胞(CCR7+CD45RA+);效应记忆T细胞(TEM)(CCR7-CD45RA-);中央记忆T细胞(TCM)(CCR7+CD45RA-);效应T细胞(CCR7-CD45RA+)。由图 3和表 3可见,恢复组表现出更高比例的幼稚CD8+T细胞(P < 0.05);恢复组和重症组CD4+TCM频率高于死亡组(P < 0.05);恢复组CD4+TEM频率低于重症组和死亡组(P < 0.05);而CD4+效应T细胞、CD8+TCM、CD8+TEM的表达在3组中无明显差异。
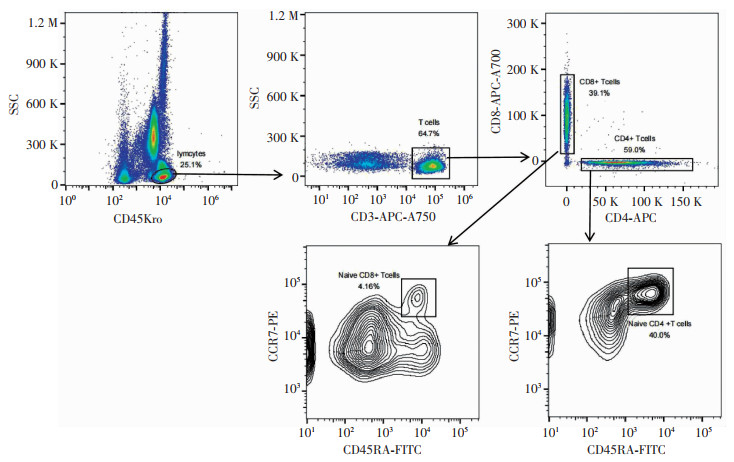
|
| 图 2 T细胞分群策略 |
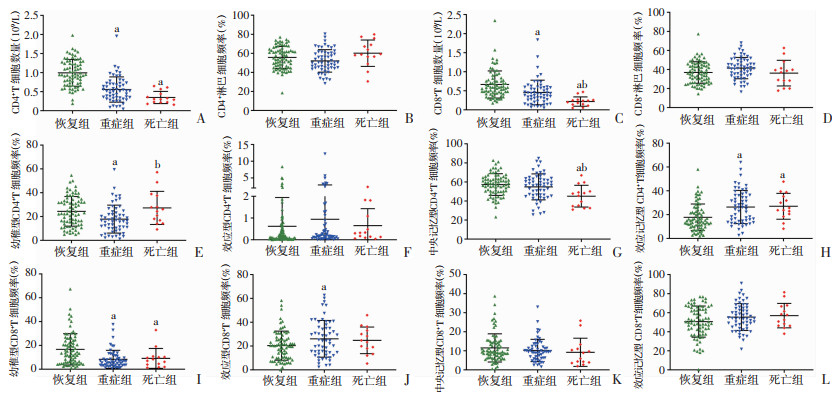
|
|
a:P < 0.05,与恢复组比较;b:P < 0.05,与重症组比较 A: CD4+T细胞计数;B:CD4+淋巴细胞比例;C:CD8+T细胞计数;D:CD8+淋巴细胞比例;E~H:分别为CD4+幼稚T细胞频率、CD4+效应T细胞频率、CD4+中央记忆T细胞频率、CD4+效应记忆T细胞频率;I~L:分别为CD8+幼稚T细胞频率、CD8+效应T细胞频率、CD8+中央记忆T细胞频率、CD8+效应记忆T细胞频率 图 3 不同疾病程度患者T细胞特征 |
2.5 PD-1在不同疾病程度COVID-19患者T细胞中的表达
通过流式细胞术检测PD-1在T细胞中的表达,评估不同疾病程度COVID-19患者T细胞的功能状态。在重症组和死亡组患者中,CD4+T和CD8+T细胞上调了PD-1的表达频率,进一步发现PD-1在重症组和死亡组CD4+效应T细胞、CD4+TEM、CD8+效应T细胞、CD8+TEM上的表达频率高于恢复组(P < 0.05),见图 3和表 3。相反的是,重症组和死亡组PD-1在CD4+TCM和CD8+TCM表达频率低于恢复组(P < 0.05),见图 4和表 3。以上结果表明重症组和死亡组效应T细胞功能衰竭,抗病毒功能下降。
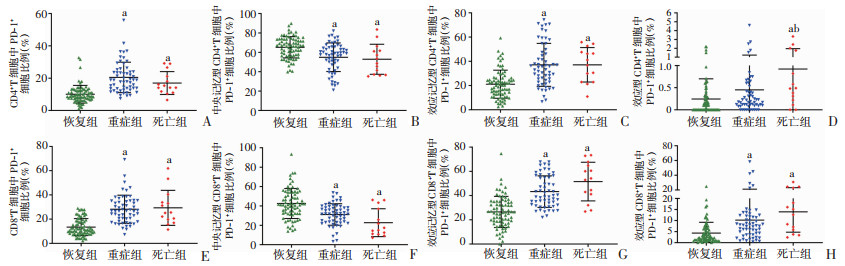
|
|
a:P < 0.05,与恢复组比较;b:P < 0.05,与重症组比较 A~D:PD-1分别在CD4+T细胞、CD4+中央记忆T细胞、CD4+效应记忆T细胞、CD4+效应T细胞上的表达频率;E~H:PD-1分别在CD8+T细胞、CD8+中央记忆T细胞、CD8+效应记忆T细胞、CD8+效应T细胞上的表达频率 图 4 PD-1在不同疾病程度患者外周血T细胞表达 |
3 讨论
当人类感染SARS-CoV-2后,大多数患者表现为无症状或轻症,一部分患者表现为重症,出现肝肾等器官损伤,严重者出现急性呼吸综合窘迫征(acute respiratory distress syndrome,ARDS)甚至死亡。免疫反应是机体应对感染的一道关键防线,主要包括先天性免疫反应和适应性免疫反应。了解COVID-19患者免疫特征有助于预防和治疗感染,然而关于不同疾病进展的患者免疫系统特征了解并不充分,本研究将123例COVID-19患者分为恢复组(n=69)、重症组(n=45)、死亡组(n=9),横断面研究COVID-19患者细胞因子水平和T细胞特征,探讨不同COVID-19疾病程度的患者免疫学特征改变。
一项研究表明老年小鼠感染SARS-CoV-2后表现出降低的IFN反应和抗体应答,初次感染时,老年小鼠较年轻小鼠获得较少的免疫记忆,其二次感染的风险增加[8]。另外老年人群中Ⅰ型IFN的RIG-I信号通路受损[9],提示老年人群先天免疫应答减弱,病毒在体内大量复制导致很多老年病例疾病较重。这与我们的结果类似,本研究观察到年龄超过60岁的患者分别为死亡组8例(88.9%),重症组35例(77.8%),恢复组36例(52.2%),提示年龄是影响疾病程度的一个因素,而年龄是否通过IFN介导宿主免疫进而影响疾病严重程度仍需进一步探索。
细胞因子风暴一词最早用来描述移植物抗宿主反应,当机体发生免疫反应过度激活、感染、药物刺激时高水平细胞因子进入外周血,导致多器官炎症和损伤[10-11]。大多数重症COVID-19患者体内出现细胞因子风暴,血浆高表达IL-2、IL-2R、IL-6、IL-7、IL-10、G-CSF、IP10、MCP1、MCP-3、IL-1RA、MIP1A、IFN-γ和TNF-α[12-14],其中IL-6升高最为显著[15],本研究表明死亡组和重症组病患血浆表现出高水平的IL-2、IL-6、IL-8、IL-10、IL-11,特别是以IL-6升高为主。IL-8的升高可能与高度激活的中性粒细胞相关,对IL-6和IL-8的靶向阻断可能会减轻机体的炎症程度,挽救危重患者。值得注意的是,大多数恢复组患者IL-6水平仍未恢复至正常范围,其原因可能是标本采集时,患者并未治愈,此时可能正处于炎症恢复期。
自COVID-19流行以来,SARS-CoV-2出现多种变异株,包括阿尔法株(α)、贝塔株(β)、伽马株(γ)、德尔塔株(δ)以及最近大流行的奥密克戎株(ο)。奥密克戎株主要感染宿主上呼吸道且症状轻于原始株[16-17],其导致的住院率和重症率低于之前的毒株。最近的一项研究分别用原始株、德尔塔株和奥密克戎株感染小鼠,发现奥密克戎株感染组检测到较低的细胞因子,以及更低的CD4+T细胞和较高的CD8+T细胞,说明在奥密克戎株引起的COVID-19中CD8+T细胞可能发挥着关键的抗病毒作用。其次PD-1+T细胞的表达也随病毒变异减少,提示T细胞功能正常对清除病毒非常重要[18]。一项研究[19]对未接种新冠疫苗且分别感染原始株、贝塔株、德尔塔株和奥密克戎株患者体内T细胞应答分析, 发现奥密克戎株感染组CD4+和CD8+T细胞对S、N、M蛋白的反应比例高于其他组,说明随着病毒的变异,T细胞的特异性免疫应答更强,这对控制感染十分关键。
研究发现CD4+T细胞对SARS-CoV-2的S蛋白应答更为显著[20],CD4+T细胞应答可在症状出现2 d检测到,且轻症患者CD4+T细胞数量明显多于重症[21]。本研究显示,重症组和死亡组患者淋巴细胞减少和中性粒细胞增多,进一步分析T淋巴细胞的亚群及其功能改变,结果提示重症组和死亡组CD4+和CD8+T细胞数量明显低于恢复组,且死亡组CD4+TCM比例明显下降,下降原因可能为CD4+TCM归巢至肺部等感染严重的器官,进而外周循环CD4+TCM减少,其具体机制仍需进一步探究。
PD-1在多种免疫细胞上表达,是细胞功能耗竭的一种分子标志。分析PD-1在T细胞上的表达,结果显示,PD-1在重症组和死亡组CD4+T细胞和CD8+T细胞中的表达高于恢复组,表明重症患者和死亡患者T细胞衰竭,这可能是介导疾病严重程度的重要因素。进一步研究细胞因子和T细胞耗竭的机制对临床靶向治疗重症和危重症患者有十分重要的价值。
本研究为样本量较大且较全面的横断面研究,结合COVID-19患者的临床特征,关注不同疾病程度患者的T细胞改变以及PD-1在T细胞上的表达,观察到重症组和死亡组的淋巴细胞减少、细胞因子水平升高、T细胞上PD-1的表达升高更为显著,本研究结果为危重症患者临终前的免疫状态以及患者的预后提供了重要参考。
本研究也存在一定的局限性,由于武汉火神山医院收治的患者很多为外院转运的患者,病例间存在病程和治疗的差异,因此,我们根据流式检测时间点的临床症状进行分组,但对患者的初始病情不清楚,不能动态监测免疫特征改变。综上,本研究对不同疾病程度的COVID-19患者免疫状态提供了重要的参考价值,有助于临床上治疗和预防重症患者。
| [1] |
ZHU N, ZHANG D, WANG W, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382(8): 727-733. |
| [2] |
HU B, GUO H, ZHOU P, et al. Characteristics of SARS-CoV-2 and COVID-19[J]. Nat Rev Microbiol, 2021, 19(3): 141-154. |
| [3] |
WOLFEL R, CORMAN V M, GUGGEMOS W, et al. Virological assessment of hospitalized patients with COVID-2019[J]. Nature, 2020, 581(7809): 465-469. |
| [4] |
XU Z, SHI L, WANG Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, 8(4): 420-422. |
| [5] |
BLANCO-MELO D, NILSSON-PAYANT B E, LIU W C, et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19[J]. Cell, 2020, 181(5): 1036-1045. e9. |
| [6] |
ARUNACHALAM P S, WIMMERS F, MOK C K P, et al. Systems biological assessment of immunity to mild versus severe COVID-19 infection in humans[J]. Science, 2020, 369(6508): 1210-1220. |
| [7] |
SETTE A, CROTTY S. Adaptive immunity to SARS-CoV-2 and COVID-19[J]. Cell, 2021, 184(4): 861-880. |
| [8] |
CHEN Y, LI C, LIU F, et al. Age-associated SARS-CoV-2 breakthrough infection and changes in immune response in a mouse model[J]. Emerg Microbes Infect, 2022, 11(1): 368-383. |
| [9] |
MOLONY R D, NGUYEN J T, KONG Y, et al. Aging impairs both primary and secondary RIG-I signaling for interferon induction in human monocytes[J]. Sci Signal, 2017, 10(509): eaan2392. |
| [10] |
WANG J, JIANG M, CHEN X, et al. Cytokine storm and leukocyte changes in mild versus severe SARS-CoV-2 infection: Review of 3939 COVID-19 patients in China and emerging pathogenesis and therapy concepts[J]. J Leukoc Biol, 2020, 108(1): 17-41. |
| [11] |
FERRARA J L, ABHYANKAR S, GILLILAND D G. Cytokine storm of graft-versus-host disease: a critical effector role for interleukin-1[J]. Transplant Proc, 1993, 25(1 Pt 2): 1216-1217. |
| [12] |
QIN C, ZHOU L, HU Z, et al. Dysregulation of immune response in patients with coronavirus 2019 (COVID-19) in Wuhan, China[J]. Clin Infect Dis, 2020, 71(15): 762-768. |
| [13] |
LIU J, LI S, LIU J, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients[J]. EBioMedicine, 2020, 55: 102763. |
| [14] |
WAN S, YI Q, FAN S, et al. Relationships among lymphocyte subsets, cytokines, and the pulmonary inflammation index in coronavirus (COVID-19) infected patients[J]. Br J Haematol, 2020, 189(3): 428-437. |
| [15] |
COPAESCU A, SMIBERT O, GIBSON A, et al. The role of IL-6 and other mediators in the cytokine storm associated with SARS-CoV-2 infection[J]. J Allergy Clin Immunol, 2020, 146(3): 518-534. e1. |
| [16] |
IACOBUCCI G. Covid-19: Runny nose, headache, and fatigue are commonest symptoms of omicron, early data show[J]. Br Med J, 2021, 375: n3103. |
| [17] |
HUI K P Y, HO J C W, CHEUNG M C, et al. SARS-CoV-2 Omicron variant replication in human bronchus and lung ex vivo[J]. Nature, 2022, 603(7902): 715-720. |
| [18] |
SURYAWANSHI R K, CHEN I P, MA T, et al. Limited cross-variant immunity from SARS-CoV-2 Omicron without vaccination[J]. Nature, 2022, 607(7918): 351-355. |
| [19] |
KEETON R, TINCHO M B, NGOMTI A, et al. T cell responses to SARS-CoV-2 spike cross-recognize Omicron[J]. Nature, 2022, 603(7901): 488-492. |
| [20] |
GRIFONI A, WEISKOPF D, RAMIREZ S I, et al. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals[J]. Cell, 2020, 181(7): 1489-1501. e15. |
| [21] |
TAN A T, LINSTER M, TAN C W, et al. Early induction of functional SARS-CoV-2-specific T cells associates with rapid viral clearance and mild disease in COVID-19 patients[J]. Cell Rep, 2021, 34(6): 108728. |




