2. 730050 兰州,中国人民解放军联勤保障部队第九四○医院药剂科;
3. 710061 西安,西安交通大学医学院第一附属医院药学部
2. No. 940 Hospital of Joint Logistics and Security Force, Lanzhou, Gansu Province, 730050;
3. Department of Pharmacy, First Affiliated Hospital of Xi'an Jiaotong University School of Medicine, Xi'an, Shaanxi Province, 710061, China
低压低氧(hypobaric hypoxia,HH)是人们暴露在高海拔地区时遇到的一种应激性环境条件[1]。心脏作为机体内耗氧量较大的器官,充足的氧气供应是维持心肌细胞活力和机能的关键[2]。当机体长时间处于低压低氧环境下,心肌细胞所得到的氧气供应量减少,加重或诱发其他心血管疾病[3]。随着国家经济的发展,前往高原地区旅游和工作的人越来越多,减轻低压低氧对心脏的损伤成为研究的重点。
矮垂头菊(Cremanthodium humile)是青藏高原的特有物种,生长在海拔2 400~5 600 m的高山草甸和碎石区。这种特殊的草药长期以来一直被传统的藏医用于抗炎、解毒和缓解疼痛。课题组前期研究发现矮垂头菊乙醇提取物表现出优异的抗氧化活性,能够缓解低压低氧对小鼠心脑组织的损伤[4],进一步研究发现矮垂头菊中含有丰富的总酚类和总黄酮类物质,对矮垂头菊正丁醇提取物(n-butanol extract of Cremanthodium humile,BECH)研究发现其具有优异的自由基清除能力,是一种天然的抗氧化剂[5],但其在体内的抗缺氧活性尚未可知。因此,本实验将研究BECH对高原缺氧小鼠心肌损伤的保护作用,并初步阐明其作用机制,为其开发研制成治疗高原缺氧心肌损伤的药物奠定基础。
1 材料与方法 1.1 实验材料矮垂头菊正丁醇提取物根据课题组前期研究方法制备[5]。肌酸激酶(creatine kinase,CK,A032-1-1)、谷草转氨酶(aspartate aminotransferase,AST,C010-2-1)、活性氧(reactive oxygen species,ROS,E004-1-1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px,A005-1-2)、乳酸脱氢酶(lactate dehydrogenase,LDH,A020-2-2)、过氧化氢酶(catalase,CAT,A007-1)、乳酸(lactic acid,LD,A019-2-1)、丙二醛(malondialdehyde,MDA,A003-1-2)、超氧化物歧化酶(superoxide dismutase,SOD,A001-3-2)和总抗氧化能力(total antioxidant capacity,T-AOC,A015-2-1)的测定试剂盒以及总蛋白定量(BCA,A045-4-2)测定试剂盒均来自南京建成生物工程研究所;心肌肌钙蛋白I(cardiac troponin I,c-TnI,JL11280-96T)ELISA试剂盒为上海江莱生物科技有限公司产品。核因子E2相关因子2(nuclear factor E2-associated factor 2,Nrf-2)、血红素加氧酶1(heme oxygenase 1,HO-1)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、B淋巴细胞瘤-2基因(B lymphocytostoma-2 gene,Bcl-2)、裂解半胱氨酸蛋白酶-3(cleaved cysteinyl aspartate specific proteinase-3) 兔单克隆抗体购自Abcam;羊抗小鼠IgG-HRP抗体和羊抗兔IgG-HRP抗体购自Proteintech;SDS-PAGE凝胶制备试剂盒、高效RIPA裂解液(组织/细胞)、苯甲磺酰氟(PMSF)、PVDF膜购自Immobilon,ECL Plus超敏发光液购自Affinity。
1.2 实验仪器Speotramax@i3全自动荧光酶标仪(美国Molecular Devices公司);R-1001VN旋转蒸发仪(上海亚荣生化仪器厂);AE200电子天平(沈阳龙腾电子有限公司);NP80紫外可见分光光度计(上海舜宇恒平科学仪器有限公司);DYC-3070大型低压低氧动物实验舱(贵州风雷航空军械有限公司产品);ChemiDoo MP全能型凝胶成像系统(上海艾研生物科技有限公司)。
1.3 实验动物清洁级雄性BALB/c小鼠(体质量18~22 g)购自北京华阜康生物科技股份有限公司[SCXK(京)2019-0008]。小鼠在恒温(22±2)℃和恒湿(40±5)%的条件下,保持12 h光照/12 h黑暗循环,并可自由获取颗粒食物和自来水。本研究经中国人民解放军联勤保障部队第九四○医院伦理委员会批准(2021KYLL169)。
1.4 常压密闭缺氧实验常压密闭缺氧实验按照前期报道的方法[6]进行。50只BALB/c小鼠按照随机数表法分为5组(n=10):缺氧模型组、乙酰唑胺(acetazolamide,AZ)组(300 mg/kg),BECH低(125 mg/kg)、中(250 mg/kg)、高剂量(500 mg/kg)组。连续5 d给小鼠灌胃BECH溶液和AZ。用同样的方法给予缺氧模型组小鼠生理盐水(0.2 mL)。第5天口服给药后等待60 min,将小鼠放入装有5 g钠石灰的250 mL密闭瓶中。密封瓶口,记录小鼠存活时间(T),按照公式计算延长率。延长率=(T给药组-T缺氧模型组)/T缺氧模型组× 100%。
1.5 急性减压耐受实验急性减压耐受实验根据前期报道的方法[7]进行。30只BALB/c小鼠按照随机数表法分为3组(n=10):急性减压组、AZ(300 mg/kg)组和BECH(500 mg/kg)组。连续灌胃给药5 d,然后将小鼠放入低压低氧动物实验舱。以100 m/min的速度减压,分别在5 000、8 000 m的模拟高度维持5 min。实验舱继续减压,直到模拟高度为10 000 m,并维持1 h。记录死亡小鼠的数量,并计算每组的动物死亡率。
1.6 低压低氧诱发小鼠心肌组织损伤模型的建立52只BALB/c小鼠按照随机数表法分为4组(n=13):正常对照组、低压低氧组、乙酰唑胺组(300 mg/kg) 和BECH组(500 mg/kg)。连续灌胃给药5 d,第5天灌胃给药后等待60 min,正常对照组置于当地海拔,其他各组小鼠置于大型低压低氧动物实验舱中。以10 m/s的速度升到模拟海拔8 000 m,舱内的湿度和温度分别保持在40%~50%和23~25 ℃,保持海拔高度24 h。随后降至海拔4 000 m,并迅速摘眼球取血,用颈椎脱位法处死小鼠。收集每只小鼠心肌组织-80 ℃保存用于后续研究。
1.6.1 HE染色观察低压低氧小鼠心肌组织的病理学变化待动物舱降至当地海拔后,每组迅速取出3只,脱颈椎处死,解剖取出心脏,用4%多聚甲醛固定液进行固定,石蜡包埋,组织切片后HE染色用光学显微镜观察病理变化。
1.6.2 心肌组织匀浆液的制备每组选取10只小鼠的心肌组织,根据组织质量∶生理盐水=1 ∶9,加入适量生理盐水制备成10%的心肌组织匀浆。匀浆在4 ℃下以2 000 r/min离心10 min,-80 ℃保存备用。
1.6.3 低压低氧小鼠血清中相关损伤因子的活性测定每组随机取10只小鼠,摘眼球取血,4 000 r/min离心10 min后取上层血清待测。CK、AST、c-TnI活性测定的具体实验操作根据相关试剂盒说明书进行,CK活性以U/mL表示,AST活性以U/L表示,c-TnI活性以pg/mL表示。
1.6.4 低压低氧小鼠心肌组织中氧化应激相关指标的含量和活性测定根据相关试剂盒说明书测定MDA、SOD、CAT、GSH-Px和T-AOC,MDA含量以nmol/mg表示。SOD、GSH-Px、CAT和T-AOC的活性均以U/mg表达。
1.6.5 低压低氧小鼠心肌组织中能量代谢相关指标的含量和活性测定按照试剂盒说明书测定LDH、LD。LDH活性以U/g表示,LD水平以mmol/g表示。
1.6.6 蛋白表达水平的测定每组随机取3只小鼠的心肌组织,精密称取,按照组织质量∶高效蛋白裂解液(RIPA ∶PMSF=100 ∶1)=1 ∶9配制匀浆液,使用组织研磨仪制备心肌组织匀浆,匀浆结束后在冰浴条件下静置30 min充分裂解,12 000 r/min低温(4 ℃)离心15 min,取10 μL上清稀释后用于BCA蛋白定量。根据BCA蛋白定量计算好的上样量上样,凝胶电泳法分离所需蛋白,湿法转膜将蛋白转至PVDF膜上,5% 脱脂牛奶封闭2 h后,加入一抗[包括Nrf-2 (1 ∶1 000)、HO-1(1 ∶1 000)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)、cleaved Caspase-3(1 ∶800)和β-actin(1 ∶3 000)],放入4 ℃冰箱摇床,缓慢摇晃过夜,放入1×TBST中进行洗膜,10 min洗3次。加入二抗,室温下摇床上孵育2 h,化学发光法显色,放入全能型凝胶成像系统进行曝光,灰度值用Image-Pro Plus8.0软件扫描测定。
1.7 统计学分析采用SPSS 26.0软件进行统计学分析,正态分布的计量数据以x±s表示,组间差异采用独立样本t检验,多组间比较采用单因素方差分析。P < 0.05被认为差异有统计学意义。
2 结果 2.1 BECH不同给药剂量延长常压密闭缺氧小鼠的存活时间采用常压密闭缺氧实验来评估BECH对小鼠存活时间的影响,结果如表 1所示:BECH能显著延长小鼠在常压密闭缺氧环境下的存活时间(P < 0.01),且高剂量(500 mg/kg)延长效果最好。根据这一结果,后期我们选择了BECH 500 mg/kg用于以下实验。
| 组别 | 剂量/(mg/kg) | 存活时间/min,x±s | 延长率/% |
| 缺氧模型组 | 32.65±0.46 | ||
| 乙酰唑胺组 | 300 | 39.42±4.03b | 20.74 |
| BECH组 | 125 | 35.66±3.78a | 9.22 |
| 250 | 39.56±3.48b | 21.16 | |
| 500 | 43.34±3.16b | 32.74 | |
| a: P < 0.05,b: P < 0.01,与缺氧模型组比较 | |||
2.2 BECH降低对急性减压缺氧小鼠的死亡率
通过急性减压耐受实验评价药物抗缺氧活性,急性减压组和AZ组在模拟的10 000 m高海拔地区1 h内的死亡率分别为100%和60%(P < 0.01),给予BECH后小鼠死亡率降低为50%(P < 0.01)。
2.3 HE染色观察小鼠心肌组织病理学变化正常对照组小鼠心肌组织无明显的肿胀现象,细胞间界限清晰且排列整齐,细胞形态结构完整,细胞核染色较为均匀,心肌纤维排列有序且组织层次清晰。低压低氧组小鼠心肌组织可见明显的水肿、肿胀,细胞坏死、细胞形态变形,细胞核出现固缩现象,心肌纤维结构混乱,没有明显的层次。乙酰唑胺组小鼠心肌组织水肿、肿胀现象减轻,细胞形态较为完整,细胞核有固缩现象,心肌纤维纹理较为清晰。BECH组小鼠心肌组织肿胀现象与模型对照组比较有改善,心肌组织水肿有所减轻,细胞染色较为均匀,核固缩现象减轻,心肌纤维纹理较为整齐。结果显示,BECH能减轻高原缺氧对小鼠心肌组织细胞的损伤(图 1)。

|
| 绿箭头:示肿胀心肌组织;红箭头:示细胞核固缩 图 1 HE染色观察BECH对低压低氧小鼠心肌组织病理学变化的影响 |
2.4 BECH降低小鼠血清中相关损伤因子的水平
如图 2所示,低压低氧组小鼠血清中CK、AST、c-TnI水平显著升高(P < 0.01)。BECH预处理可以降低小鼠血清中CK、AST、c-TnI的活性(P < 0.01)。

|
| 1:正常对照组;2:低压低氧组;3:乙酰唑胺组;4:BECH组 a:P < 0.01,与正常对照组比较;b:P < 0.05,c:P < 0.01,与低压低氧组比较 图 2 BECH对低压低氧小鼠血清中CK(A)、AST(B)、c-TnI(C)活性的影响(n=10,x±s) |
2.5 BECH降低小鼠心肌组织中氧化应激损伤
如图 3所示,低压低氧组小鼠心肌组织中ROS、MDA含量与CAT活性增加(P < 0.05,P < 0.01),SOD、GSH-Px和T-AOC水平显著下降(P < 0.01)。BECH预处理后小鼠心肌组织中ROS、MDA含量与CAT活性显著降低(P < 0.05,P < 0.01),SOD、GSH-Px和T-AOC的活性显著提高(P < 0.01)。

|
| 1:正常对照组;2:低压低氧组;3:乙酰唑胺组;4:BECH组 a:P < 0.05,b:P < 0.01,与正常对照组比较;c:P < 0.05,d:P < 0.01,与低压低氧组比较 图 3 BECH对低压低氧条件下小鼠心肌组织中ROS(A)、MDA(B)含量及SOD(C)、CAT(D)、GSH-Px(E)和T-AOC(F)活性的影响(n=10,x±s) |
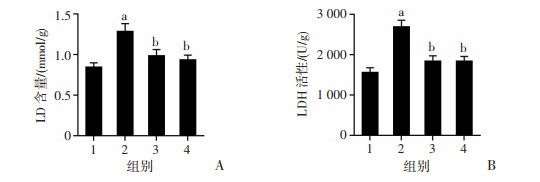
2.6 BECH降低小鼠心肌组织中能量代谢障碍
如图 4所示,低压低氧小鼠心肌组织中的LD含量和LDH活性在高海拔地区24 h内有明显的增加(P < 0.01)。用BECH预处理后,LD含量和LDH活性下降(P < 0.01)。
|
| 1:正常对照组;2:低压低氧组;3:乙酰唑胺组;4:BECH组 a:P < 0.01,与正常对照组比较;b:P < 0.01,与低压低氧组比较 图 4 BECH对低压低氧条件下小鼠心肌组织中LD(A)含量和LDH(B)活性的影响(n=10,x±s) |
2.7 BECH提高小鼠心肌组织中Nrf-2与HO-1的蛋白表达
如图 5所示,低压低氧组小鼠心肌组织中Nrf-2、HO-1蛋白表达升高(P < 0.05,P < 0.01);经BECH预处理后,低压低氧小鼠心肌组织中Nrf-2、HO-1蛋白表达进一步升高(P < 0.05,P < 0.01)。

|
|
1:正常对照组;2:低压低氧组;3:乙酰唑胺组;4:BECH组 A:Western blot检测小鼠心肌组织中蛋白表达;B:蛋白表达量化结果 a:P < 0.05,b:P < 0.01,与正常对照组比较;c:P < 0.05,d:P < 0.01,与低压低氧组比较 图 5 BECH对低压低氧条件下小鼠心肌组织中Nrf-2、HO-1蛋白表达的影响(n=3,x±s) |
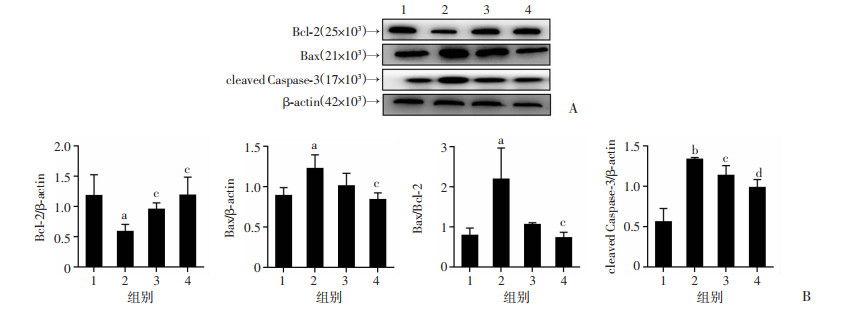
2.8 BECH降低小鼠心肌组织中凋亡相关蛋白的表达
如图 6所示,低压低氧组小鼠心肌组织中Bax、cleaved Caspase-3蛋白表达升高(P < 0.05,P < 0.01),Bcl-2蛋白表达降低(P < 0.05),Bax/Bcl-2的比值升高(P < 0.05);经BECH预处理后,低压低氧小鼠心肌组织中Bax、cleaved Caspase-3蛋白表达降低(P < 0.05,P < 0.01),Bcl-2蛋白表达升高(P < 0.05),Bax/Bcl-2的比值降低(P < 0.05)。
|
|
1:正常对照组;2:低压低氧组;3:乙酰唑胺组;4:BECH组 A:Western blot检测小鼠蛋白表达;B:量化分析结果 a:P < 0.05,b:P < 0.01,与正常对照组比较;c:P < 0.05,d:P < 0.01,与低压低氧组比较 图 6 BECH对低压低氧条件下小鼠心肌组织中Bcl-2、Bax、Bax/Bcl-2、cleaved Caspase-3蛋白表达的影响(n=3,x±s) |
3 讨论 3.1 BECH降低小鼠心肌组织损伤
心脏作为机体重要的供血器官,对氧气的需求量较高,在高原低压低氧环境下极易受到损伤[8]。本研究通过对小鼠心肌组织病理学的观察发现,低压低氧组小鼠心肌组织细胞排列紊乱,组织出现肿胀现象,细胞间隙中浸出物较多;与低压低氧组相比,给予BECH后小鼠心肌组织中肿胀现象明显改善,组织病理学损伤减轻。心肌组织受到损伤后会导致细胞膜结合酶发生泄漏,导致血清中的CK、AST、c-TnI的含量升高[9]。本研究结果表明,低压低氧小鼠血清中CK、AST、c-TnI的水平升高,BECH预处理后可以降低CK、AST、c-TnI的水平,说明BECH可以维持相关功能因子的水平,缓解低压低氧造成的心肌细胞损伤。
3.2 BECH缓解小鼠心肌组织中氧化应激损伤低压低氧所诱导的氧化应激是引起心肌组织损伤的诱因之一[10]。暴露在低压低氧环境下能够破坏体内的抗氧化系统,活性氧自由基ROS的产生将引发脂质过氧化,导致机体内MDA的含量升高[11],同时抑制内源性抗氧化酶(SOD、CAT、GSH-Px)的活性[12]。本研究发现,低压低氧组小鼠心肌组织中ROS、MDA含量升高,抗氧化酶和总抗氧化能力显著降低,这与前期研究结果一致[13]。经BECH处理后能提高抗氧化酶和总抗氧化能力,降低ROS、MDA含量。结果表明,BECH可以提高机体内抗氧化系统防御能力,免受低压低氧诱导的氧化应激损伤。
3.3 BECH改善小鼠心肌组织中能量代谢障碍能量代谢是机体维持生命和日常活动的基础[14]。有研究发现,高原缺氧往往伴随着能量代谢障碍[15]。在无氧或氧气稀缺的条件下,机体的能量供应大多来自糖酵解。心脏在机体内的耗氧量较多,所以当缺氧时间较长时会导致心肌组织中乳酸堆积,造成代谢性酸中毒[16]。LDH能够催化丙酮酸和乳酸的相互转化,是肌肉损伤的一个准确指标。实验结果显示缺氧后,小鼠心肌组织中LD的含量升高,LDH的活性降低,这与已报告的结果一致[17]。说明BECH能够有效改善小鼠缺氧后的能量代谢障碍,有助于避免急性低压低氧引起的代谢性酸中毒。
3.4 BECH可以提高小鼠心肌组织的抗氧化能力Nrf-2/HO-1信号通路已被证明在细胞保护中发挥抗氧化、抗凋亡和抗炎作用[18]。Nrf-2位于细胞质中,是该通路的主要调节氧化应激的转录因子之一,其核转位被Keap1所抑制,在氧化应激刺激下,Nrf-2与Keap1分离并转运到细胞核中以调节HO-1等抗氧化蛋白的表达,因此,Nrf-2和下游基因HO-1的激活对氧化应激损伤具有保护作用[19]。有研究发现,Nrf-2/HO-1信号通路的激活可以减少心脏受到的氧化应激损伤[20]。本实验通过对低压低氧小鼠心肌组织中Nrf-2、HO-1的蛋白表达检测发现,给予BECH后,低压低氧小鼠心肌组织中Nrf-2、HO-1的蛋白表达继续升高,说明BECH通过激活Nrf-2/HO-1通路,提高Nrf-2、HO-1蛋白表达,进而改善高原缺氧诱导的氧化应激损伤。
3.5 BECH降低小鼠心肌组织的细胞凋亡细胞凋亡在低压低氧诱导的心肌损伤中同样发挥重要的作用[21]。Bax和Bcl-2作为Bcl-2家族中重要的促凋亡蛋白和抗凋亡蛋白,Bcl-2和Bax的蛋白比例决定了细胞凋亡的严重程度。有研究表明,高原缺氧会增加心肌细胞的凋亡,使Bax、cleaved Caspase-3的蛋白表达升高[22]。Bax作为重要的促凋亡蛋白,其蛋白表达量的升高进一步反映了Caspase-3从线粒体中释放到细胞质中而被激活,从而加重心肌细胞凋亡。在本研究中,低压低氧组小鼠心肌组织中Bax、cleaved Caspase-3的蛋白表达量升高,Bax/Bcl-2的比值升高;给予BECH后,Bax/Bcl-2的比值降低,抑制心肌细胞凋亡。
综上所述,矮垂头菊正丁醇提取物对低压低氧诱导的心肌组织损伤具有良好的保护作用,其作用机制可能与清除过量ROS,提高体内抗氧化酶活性,激活Nrf-2/HO-1抗氧化通路缓解氧化应激损伤,同时调节凋亡相关蛋白,抑制细胞凋亡有关。
| [1] |
张侃, 陈景元, 李维国, 等. 高原高寒地区卫勤保障实践与思考[J]. 西北国防医学杂志, 2014, 35(5): 497-499. ZHANG K, CHEN J Y, LI W G, et al. Practice and thinking of medical support in plateau and cold area[J]. Med J Natl Defending Forces Northwest China, 2014, 35(5): 497-499. |
| [2] |
CHEN K, WANG S, SUN Z J. In vivo cardiac-specific expression of Adenylyl cyclase 4 gene protects against klotho deficiency-induced heart failure[J]. Transl Res, 2022, 244: 101-113. |
| [3] |
范宗静, 李星星, 崔杰, 等. 黄芪多糖对缺氧/复氧人心脏微血管内皮细胞凋亡、细胞周期的影响[J]. 中国医学前沿杂志(电子版), 2021, 13(11): 56-60. FAN Z J, LI X X, CUI J, et al. Effects of astragalus polysaccharide on apoptosis and cell cycle of human cardiac microvascular endothelial cell injured by hypoxia/reoxygenation[J]. Chin J Front Med Sci (Electron Version), 2021, 13(11): 56-60. |
| [4] |
景临林, 马慧萍, 樊鹏程, 等. 矮垂头菊乙醇提取物的体外自由基清除活性及其对高原缺氧小鼠的保护作用研究[J]. 天然产物研究与开发, 2015, 27(10): 1815-1820. JING L L, MA H P, FAN P C, et al. In vitro free radical scavenging activity of ethanol extract of Cremanthodium humile and its protective effect on mice under hypobaric hypoxia condition[J]. Nat Prod Res Dev, 2015, 27(10): 1815-1820. |
| [5] |
邵瑾, 马慧萍, 赵彤, 等. 矮垂头菊不同极性溶剂萃取物的抗氧化活性研究[J]. 化学研究与应用, 2019, 31(10): 1752-1759. SHAO J, MA H P, ZHAO T, et al. Study on antioxidant activity of different polar solvent extracts of Cremanthodium humile[J]. Chem Res Appl, 2019, 31(10): 1752-1759. |
| [6] |
MA H P, FAN P C, JING L L, et al. Anti-hypoxic activity at simulated high altitude was isolated in petroleum ether extract of Saussurea involucrata[J]. J Ethnopharmacol, 2011, 137(3): 1510-1515. |
| [7] |
FAN P C, MA H P, JING L L, et al. The antioxidative effect of a novel free radical scavenger 4'-hydroxyl-2-substituted phenylnitronyl nitroxide in acute high-altitude hypoxia mice[J]. Biol Pharm Bull, 2013, 36(6): 917-924. |
| [8] |
BAIK A H. Hypoxia signaling and oxygen metabolism in cardio-oncology[J]. J Mol Cell Cardiol, 2022, 165: 64-75. |
| [9] |
APPLE F S, SANDOVAL Y, JAFFE A S, et al. Cardiac troponin assays: guide to understanding analytical characteristics and their impact on clinical care[J]. Clin Chem, 2017, 63(1): 73-81. |
| [10] |
PU X Y, LI F X, LIN X, et al. Oxidative stress and expression of inflammatory factors in lung tissue of acute mountain sickness rats[J]. Mol Med Rep, 2022, 25(2): 49. |
| [11] |
GAO X, XU D R, ZHANG X Y, et al. Protective effect of lemon peel polyphenols on oxidative stress-induced damage to human keratinocyte HaCaT cells through activation of the Nrf2/HO-1 signaling pathway[J]. Front Nutr, 2020, 7: 606776. |
| [12] |
LAKSHMI SUNDARAM R, VASANTHI H R. Dalspinin isolated from Spermacoce hispida (Linn.) protects H9C2 cardiomyocytes from hypoxic injury by modulating oxidative stress and apoptosis[J]. J Ethnopharmacol, 2019, 241: 111962. |
| [13] |
刘睿, 邵瑾, 赵彤, 等. 荠苧黄酮对低压低氧小鼠心肌组织损伤的改善作用与机制研究[J]. 中国新药杂志, 2021, 30(1): 55-61. LIU R, SHAO J, ZHAO T, et al. Ameliorative effect and mechanism of mosloflavone on hypobaric hypoxia-induced heart damage in mice[J]. Chin J New Drugs, 2021, 30(1): 55-61. |
| [14] |
WANG X B, HOU Y, LI Q Y, et al. Rhodiola crenulata attenuates apoptosis and mitochondrial energy metabolism disorder in rats with hypobaric hypoxia-induced brain injury by regulating the HIF-1α/microRNA 210/ISCU1/2(COX10) signaling pathway[J]. J Ethnopharmacol, 2019, 241: 111801. |
| [15] |
MURRAY A J. Energy metabolism and the high-altitude environment[J]. Exp Physiol, 2016, 101(1): 23-27. |
| [16] |
CHITRA L, BOOPATHY R. Altered mitochondrial biogenesis and its fusion gene expression is involved in the high-altitude adaptation of rat lung[J]. Respir Physiol Neurobiol, 2014, 192: 74-84. |
| [17] |
孙杨, 魏崇莉, 赵彤, 等. 甘松乙酸乙酯部位改善低压和低氧诱导的心肌组织损伤作用及机制[J]. 中国现代中药, 2021, 23(1): 83-88. SUN Y, WEI C L, ZHAO T, et al. Ethyl acetate extract fraction of Nardostachys chinensis ameliorates hypobaric hypoxia-induced myocardial injury via inhibiting oxidative stress[J]. Mod Chin Med, 2021, 23(1): 83-88. |
| [18] |
NITTI M, IVALDO C, TRAVERSO N, et al. Clinical significance of heme oxygenase 1 in tumor progression[J]. Antioxidants (Basel), 2021, 10(5): 789. |
| [19] |
KIM S R, SEONG K J, KIM W J, et al. Epigallocatechin gallate protects against hypoxia-induced inflammation in microglia via NF-κB suppression and Nrf-2/HO-1 activation[J]. Int J Mol Sci, 2022, 23(7): 4004. |
| [20] |
CHEN G, LIU G R, CAO D W, et al. Polydatin protects against acute myocardial infarction-induced cardiac damage by activation of Nrf2/HO-1 signaling[J]. J Nat Med, 2019, 73(1): 85-92. |
| [21] |
HE P J, LI Y, ZHANG R T, et al. Role of p22phox and NOX5 in autophagy and apoptosis of osteoblasts induced by hypoxia[J]. Chin J Repar Reconstr Surg, 2021, 35(7): 855-861. |
| [22] |
ZHONG L H, JIA J, YE G H. Rian/miR-210-3p/Nfkb1 feedback loop promotes hypoxia-induced cell apoptosis in myocardial infarction through deactivating the PI3K/Akt signaling pathway[J]. J Cardiovasc Pharmacol, 2020, 76(2): 207-215. |




