溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚未明确,由遗传、环境等多种因素共同参与的慢性非特异性肠道炎症性疾病,多累及直肠及远端结肠,病变以黏膜及黏膜下层弥漫性、连续性炎症分布为特征。临床主要表现为腹泻、腹痛、血便和体质量减轻等,病情反复,迁延不愈,与结直肠癌的发生发展有密切关系,严重危害人类健康及生活质量水平[1-2]。目前UC的发病机制及病因尚未完全阐明,研究认为,肠道免疫失调、肠道菌群失衡以及环境、遗传因素是导致UC发病的主要原因[3]。遗传易感个体暴露于各种危险因素中导致肠道黏膜屏障受损,进而触发肠道免疫细胞的激活[4-6]。在这些异常激活的免疫细胞中,Th17和Treg细胞之间的分化平衡在维持肠道稳态中起着关键作用[7-8]。一般认为,Th17细胞通过分泌IL-17、IL-21和IL-22等促炎因子参与炎症反应,而表达叉头盒蛋白P3 (forkhead box protein P3, Foxp3)为特征的Treg细胞则分泌抑制性炎症因子如TGF-β抑制自身免疫反应。自21世纪初以来,以抗肿瘤坏死因子及免疫抑制剂治疗为主的新兴治疗手段逐渐成熟,但达到临床完全缓解仍有一定困难[9-10]。开发靶向肠道炎症信号通路及免疫调节的新药物,可对溃疡性结肠炎的防治提供新的思路。
姜酮(zingerone, Zin)是一种从生姜中提取的天然无毒的酚类化合物,具有抗炎、抗肿瘤、抗氧化的作用[11-13]。已有报道表明姜酮可通过抑制NF-kB活性和IL-1β信号通路改善三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)诱导的结肠炎[14],且最新研究发现姜酮可通过T细胞介导的免疫反应在乳腺癌中发挥抗癌活性[15],但是关于姜酮在肠道炎症T细胞免疫调节方面的作用尚未报道。本研究通过构建DSS诱导的急性结肠炎模型,观察姜酮对结肠炎小鼠的疗效,并分别在体内和体外分析姜酮对CD4+ T细胞亚群的影响,初步探讨姜酮治疗UC的免疫调节机制。
1 材料与方法 1.1 材料15只6~8周龄SPF级C57BL/6雄性小鼠,体质量为22~25 g,购自陆军军医大学第二附属医院实验动物中心,实验前适应性饲养1周。实验按照陆军军医大学动物伦理要求进行(AMUWEC20226158)。
主要试剂:DSS购自阿拉丁公司;RPMI 1640培养基、DMEM培养基、胎牛血清(FBS)购自美国Gibco公司;马血清购自Hyclone公司;HEK 293T细胞由本实验室保存,PrimeScriPt RT reagent Kit with gDNA Eraser(Perfect Real Time)、TB Green Premix Ex Taq Ⅱ (Tli RNaseH Plus)购自日本Takara公司;引物由上海生工合成;TRIzol RNA提取试剂、eBioscienceTM Foxp3/Transcription Factor Staining Buffer Set购自美国Invitrogen公司;姜酮购自MCE公司中国代理;豆蔻酰佛波醇乙酯(Phorbol-12-myristate-13-acetate, PMA)、离子霉素(ionomycin)购自Abcam公司;anti-mouse CD3ε Antibody、anti-mouse CD28 Antibody、anti-mouse IL-12/IL-23 P40 Antibody、anti-mouse IFN-γ Antibody、Th17多因子检测试剂盒选自美国Biolegend公司;Naive CD4+ T细胞分离试剂盒购自Miltenyi公司;Ⅳ型胶原酶选自美国Worthingdon;DNase Ⅰ购自Roche公司;Percoll淋巴细胞分离液购自Cytiva;流式抗体anti-mouse CD45-PerCp、anti-mouse CD3-BV510、anti-mouse CD4-PB、anti-mouse IL-17A-FITC、anti-mouse IFN-γ-PE-Cy7、anti-mouse Foxp3-APC、anti-mouse CD25-PE-Cy7、anti-mouse CD4-PerCp购自美国Biolegend公司;anti-mouse RORγt-PE购自BD公司;pGL4.35 (luc2P/9XGAL4 UAS/Hygro)载体、PR-TK载体、双荧光素酶(Dual-Luciferase)检测试剂盒均购自Promega公司;RORγ 79~518 pFN26A (BIND) hRluc-neo质粒、pGL4-mRORc-promoter (-2206~+138) 质粒购自长沙优宝公司。
1.2 方法 1.2.1 药物溶液的配制对于动物实验,取80 mg姜酮粉末(分子量为194.23)溶于1 mL DMSO溶液制备成80 mg/mL的储备液,该储备液用无菌PBS按照1 ∶19的体积稀释为4 mg/mL的工作液,每只小鼠每次尾静脉注射100 μL工作液(每只小鼠体积按20 g计算),使得每只小鼠的最终给药剂量为20 mg/kg;对于细胞实验,取194.23 mg药物溶于1 mL DMSO溶液制备成1 mol/L的储备液,根据细胞实验所需的药物浓度用培养基稀释成合适的工作浓度。
1.2.2 UC小鼠模型的建立与分组将6~8周龄的SPF级雄性老鼠按随机数字分为对照组(Water组)、模型组(DSS组)、姜酮干预组(DSS + Zin组,20 mg/kg)。除对照组外各组小鼠自由饮用一定浓度的DSS溶液7 d。造模第一天起即对姜酮干预组用姜酮处理,给药方法采取尾静脉注射的方式进行,具体喂养方法见图 1。
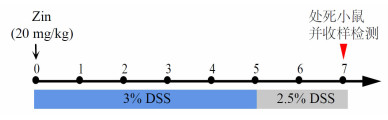
|
| 图 1 DSS诱导结肠炎小鼠模型的建模方法 |
1.2.3 疾病活动指数(disease activity index, DAI)评分
自造模起,每日记录各组小鼠的体质量,观察并记录小鼠的粪便性状及大便隐血情况,根据参考文献进行评分[16]。
1.2.4 结肠长度测量、HE染色及HPS评分造模完成后,对各组小鼠采用颈椎脱臼术处死。取各组小鼠结肠组织测量其长度后,去除盲肠,随后将结肠组织沿肠系膜纵行剪开,用预冷的PBS冲洗肠腔,迅速吸干水分,展平肠腔裹成瑞士卷,10%的中性福尔马林浸泡24 h后送病理切片,切片HE染色后由病理科专业人员参考文献进行盲法阅片[16]。
1.2.5 RT-qPCR检测结肠组织炎症因子mRNA的表达水平取近端结肠组织2 cm于盛有1 mL TRIzol的研磨管中,用匀浆机充分研磨结肠组织,采用氯仿-异丙醇方法提取结肠组织总RNA。根据逆转录试剂盒说明书将RNA逆转录为cDNA,然后采用实时荧光定量聚合酶链式反应(RT-qPCR)技术对cDNA进行定量检测。所有反应均以β-肌动蛋白(β-catenin)为内源性对照,并使用ΔΔCT方法归一化到实验对照组。所用引物序列见表 1。
| 引物名称 | 引物序列(5'→3') |
| IL-17A | 上游TTCACTTTCAGGGICGAGA |
| 下游GGGGTTTCTTAGGGGICA | |
| IL-21 | 上游TGAAGTGAGAACCAGACCAA |
| 下游CCCAAGAAGATGACTACCAGA | |
| IL-22 | 上游ATCTCTGATGGCTGICCTG |
| 下游GTATGGCTGCTGGAAGTTG | |
| IL-1β | 上游AGTTGACGGACCCCAAA |
| 下游TCTTGTTGATGIGCTGCTG | |
| IL-6 | 上游ACAGAAGGAGTGGCTAAGGA |
| 下游AGGCATAACGCACTAGGTTT | |
| IFN-γ | 上游ACTGGCAAAAGGATGGTG |
| 下游GTTGCTGATGGCCTGATT | |
| TGF-β | 上游TGGGGACTICTIGGCACT |
| 下游ATAGGGGCGTCTGAGGAAC |
1.2.6 多因子试剂盒检测小鼠结肠组织中相关细胞因子的含量
造模结束后处死小鼠,取各组小鼠结肠组织称重,按100 mg结肠组织加入200 μL EBC裂解液,随后使用高通量研磨仪进行匀浆。匀浆完毕后取上清液,按照Th17多因子检测试剂盒厂家说明进行样本收集,所得样本最后用流式细胞术检测。
1.2.7 T细胞的体外培养根据Miltenyi公司的小鼠Naive CD4+ T细胞分离试剂盒说明书,从4周龄的C57BL/6小鼠的脾脏和外周淋巴结中分离富集得到初始CD4+ T细胞,铺板于预先用anti-CD3,anti-CD28抗体包板的48孔板中,每孔40万个细胞。所有细胞在含5% CO2的37 ℃加湿培养箱中培养,对于不同的T细胞亚群用不同的诱导方案进行极化培养[17]。细胞极化24 h后加入不同浓度(0、0.062 5、0.125、0.25 mmol/L) 的姜酮处理,继续培养3 d,后续用于流式抗体染色并检测细胞因子和核内因子的表达。
1.2.8 小鼠结肠组织固有层单核细胞的分离收集模型组和姜酮干预组小鼠的结肠组织,纵向剪开结肠,用预冷的PBS冲洗干净后,加入预消化溶液(含有5% 胎牛血清、1 mmol/L DTT、5 mmol/L EDTA的HBSS溶液),37 ℃连续涡旋震荡20 min以去除上皮细胞。再用消化液(含10%胎牛血清、1 mg/mL Ⅳ型胶原酶、0.1 mg/mL DNase Ⅰ的HBSS溶液)在37 ℃振荡器上涡旋震荡30 min得到固有层单个核细胞。离心后的细胞沉淀用40%~70% Percoll重悬,根据密度梯度离心得到淋巴细胞,后续用于流式抗体染色并检测相关细胞因子和核内因子的表达。
1.2.9 流式细胞术收获得到的淋巴细胞先用PMA、Ionomycin刺激4 h,再用Fixable Viability Dye eFluor©死活染料排除死细胞后用相应的细胞表面抗体进行染色。对于核内因子的检测,使用Foxp3/Transcription Factor Staining Buffer Set试剂盒固定、破膜细胞,最后用相应流式抗体染核内细胞因子。每次染色条件为4 ℃避光孵育30 min,PBS液洗涤2次,2 000 r/min,离心2 min; 弃上清弹匀细胞后,加入300 μL PBS重悬细胞,上流式细胞仪检测。
1.2.10 细胞培养及质粒转染293T细胞在DMEM培养基(含10%胎牛血清、100 U/mL青霉素、10 mg/L链霉素)中培养,培养条件:相对饱和湿度、37 ℃、5% CO2恒温培养箱中培养,细胞密度融合至80%时进行传代。将鼠源性的RORγ 79~518氨基酸对应的cDNA序列克隆在pFN26A (BIND) hRluc-neo载体上,将构建的重组质粒命名为RORγ 79~518 pFN26A (BIND) hRluc-neo。取对数期生长的293T细胞,胰酶消化后按照1.0×105个/孔的细胞数量种植在6孔板中,待细胞密度达到约40%时,分别进行以下转染:20 ng RORγ 79~518 pFN26A (BIND) hRluc-neo质粒和980 ng pGL4.35 (luc2P/9XGAL4 UAS/Hygro)载体共转染293T细胞以检测嵌合GAL4-RORγt的荧光素酶活性;pGL4-mRORc-promoter (-2 206~+138) 质粒与海肾荧光素酶(renilla luciferase,R-Luc)报告基因质粒共转染293T细胞以检测Rorc的启动子活性。
1.2.11 双荧光素酶报告基因检测按照双荧光素酶(luciferase)报告试剂盒说明书,6孔板每孔用100 μL细胞裂解液裂解蛋白,充分裂解后,14 000×g离心5 min,吸取20 μL上清液至避光的96孔板中,每组设置三个复孔,各孔中依次加入酶作用底物,于荧光计数仪上测定萤火虫荧光素酶(firefly luciferase,F-Luc)的活性。
1.3 统计学方法实验数据采用GraphPad Prism 8.0.2软件进行统计学处理,数据以x±se表示,两组间差异用非配对Student’s t检验分析,3组以上实验采用单因素方差分析,P < 0.05认为差异有统计学意义。
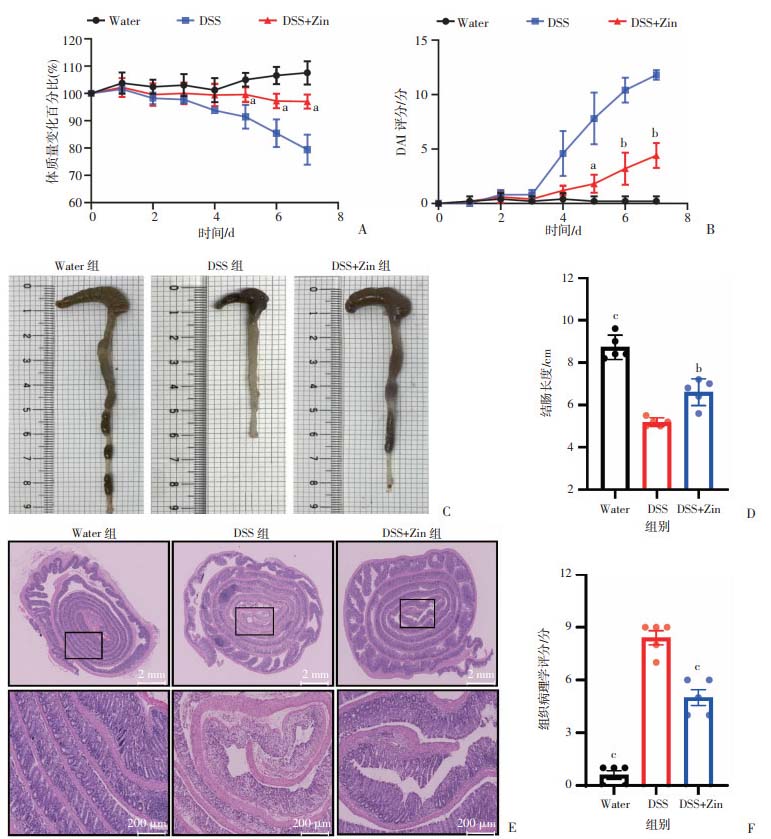
2 结果 2.1 小鼠的临床症状及组织病理学改变与对照组相比,DSS组小鼠在DSS喂养第4天开始出现活动减少、精神萎靡、腹泻、肛门处肉眼可见血便,体重下降(图 2A)、DAI评分增高(图 2B),且结肠长度明显缩短(图 2C);经姜酮干预后,小鼠上述临床症状减轻,体重较DSS组下降缓慢(P < 0.05,图 2A),DAI评分下降(P < 0.05,图 2B)、结肠长度有一定增加,差异有统计学意义(P < 0.001,图 2C~D)。
|
|
a:P < 0.05,b:P < 0.01,c:P < 0.001,与DSS组比较 A:小鼠体质量变化统计图; B: DAI评分统计图 a:P < 0.05,b:P < 0.01,c:P < 0.001,与DSS组比较 C:DSS诱导前后各组小鼠结肠长度代表图;D:结肠长度统计图;E:各组小鼠结肠组织HE代表图;F:结肠组织病理学评分统计图 图 2 DSS诱导前后临床症状及组织病理学比较 (n=5,x±se) |
光镜下见:对照组小鼠的结肠黏膜上皮连续完整,腺体排列规则,隐窝均匀分布,黏膜下血管清晰可见,少见炎性细胞浸润及肌肉增厚。DSS组小鼠可见黏膜上皮结构破坏,腺体紊乱,隐窝缺失,黏膜有水肿、充血、溃疡,黏膜及黏膜下层可见大量炎性细胞浸润,杯状细胞减少,黏膜肌层有不同程度增厚。姜酮干预后小鼠结肠黏膜相对完整,腺体基本规则,充血水肿较轻,炎性浸润较DSS组减轻(图 2E),其组织病理学评分低于DSS组(P < 0.001,图 2F)。
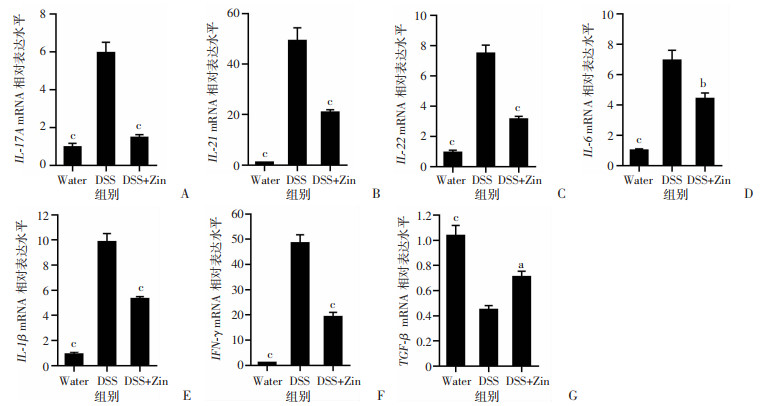
2.2 小鼠结肠组织中炎症因子mRNA水平的变化DSS组小鼠结肠组织中的IL-17A、IL-21、IL-22、IL-6、IL-1β、IFN-γ促炎因子的mRNA水平均较对照组明显升高,有显著性差异,而抑炎因子TGF-β的mRNA水平降低(P < 0.001,图 3)。经姜酮干预后,上述促炎因子的mRNA的表达水平有明显下调,TGF-β的mRNA水平呈上升趋势,差异均有统计学意义(P < 0.05,图 3)。
|
| a:P < 0.05,b:P < 0.01,c:P < 0.001,与DSS组比较 A:IL-17A mRNA;B:IL-21 mRNA;C:IL-22 mRNA;D:IL-6 mRNA;E:IL-1β mRNA;F:IFN-γ mRNA;G:TGF-β mRNA 图 3 各组小鼠结肠组织RT-qPCR结果比较 (n=5,x±se) |
2.3 多因子试剂盒检测结肠组织中相关细胞因子的蛋白含量变化
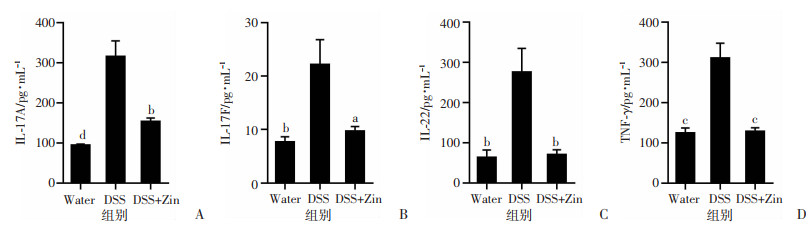
与对照组相比,DSS诱导的急性结肠炎小鼠模型肠道中促炎因子如IL-17A、IL-17F、IL-22和IFN-γ的蛋白表达水平显著增高(P < 0.05),而姜酮干预后的小鼠结肠组织中上述炎症因子蛋白含量下降(P < 0.05,图 4)。
|
|
a:P < 0.05,b:P < 0.01,c:P < 0.001,d:P < 0.000 1,与DSS组比较 A:结肠组织IL-17A含量;B:结肠组织IL-17F含量;C:结肠组织IL-22含量;D:结肠组织IFN-γ含量 图 4 各组小鼠结肠组织IL-17A、IL-17F、IFN-γ、IL-22蛋白水平比较 (n=5,x±se) |
2.4 小鼠结肠组织固有层淋巴细胞CD4+ T细胞的变化
分离得到小鼠结肠固有层单个核细胞后,首先通过多色流式对不同的CD4+ T细胞亚群进行圈门分析(图 5)。结果显示,与DSS组小鼠相比,姜酮干预后小鼠结肠组织固有层淋巴细胞中IL-17A+ CD4+ T细胞比例明显下调,而CD25+Foxp3+ T细胞数量高于模型组,差异均有统计学意义(P < 0.05,图 6)。在两组小鼠中,IFN-γ+CD4+ T细胞的发育均未受到影响(P > 0.05,图 6)。
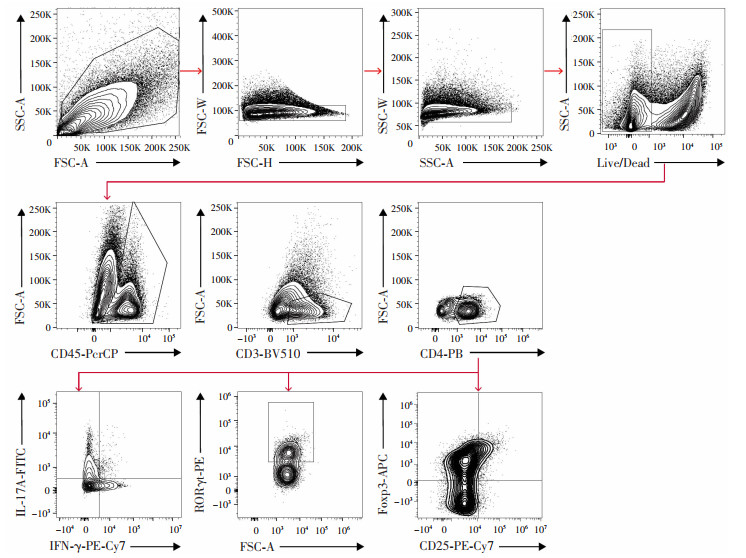
|
| 图 5 小鼠结肠固有层淋巴细胞多色流式圈门策略图 |
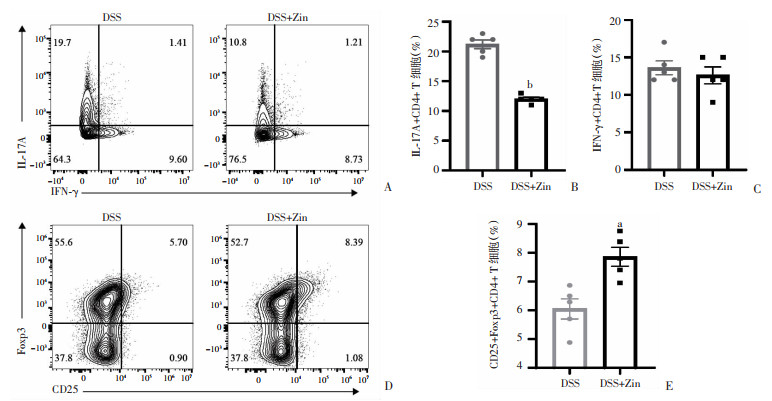
|
| a:P < 0.01;b:P < 0.000 1,与DSS组比较 A、D:流式分析小鼠LP组织中不同CD4+ T细胞亚群的代表流式图;B、C、E:各CD4+ T细胞亚群统计分析结果 图 6 小鼠结肠固有层淋巴组织中CD4+ T细胞亚群分型比较 (n=5,x±se) |
2.5 姜酮对初始CD4+ T细胞体外诱导分化的影响
体外诱导分化的流式结果显示:与DMSO组相比,姜酮对Th1亚群的分化并无影响(P > 0.05,图 7),而以剂量依赖性的方式抑制Th17细胞的分化并诱导Treg细胞分化增强(图 7A),分别表现为其特征性的效应因子IL-17A分泌减少,Foxp3表达增加(图 7B), 组间差异有统计学意义(P < 0.05,图 7B)。
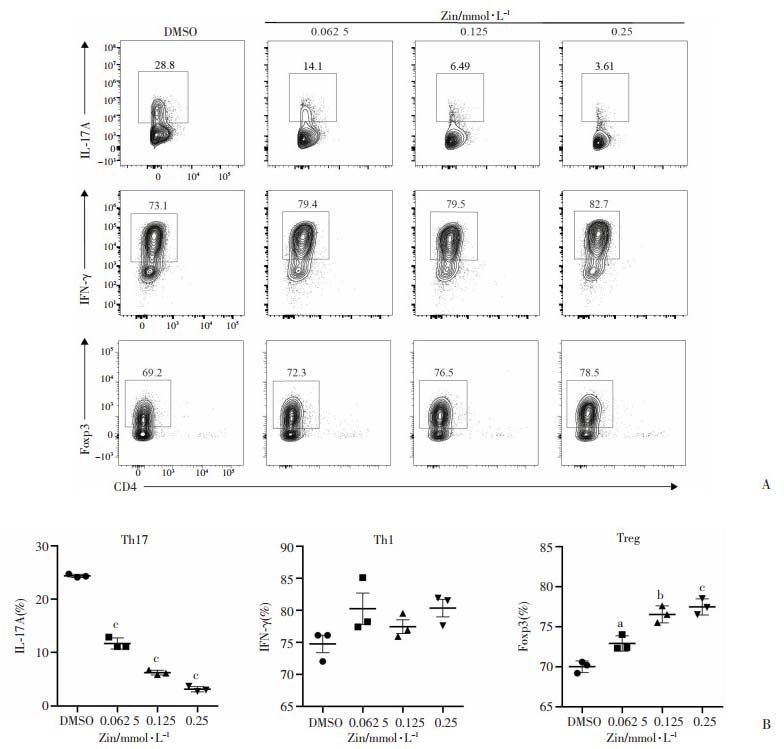
|
|
A:不同浓度的姜酮对Th17、Th1、Treg细胞分化的影响 B:各浓度间统计分析结果 a:P < 0.05, b:P < 0.001, c:P < 0.000 1,与DMSO组比较 图 7 不同浓度的姜酮对初始CD4+ T细胞亚群分化的影响 (n=3,x±se) |
2.6 姜酮在Th17细胞中抑制RORγt表达
体内流式结果显示:与DSS组相比,给予姜酮干预后,小鼠结肠固有层淋巴细胞中RORγt+ Th17细胞比例降低(P < 0.001,图 8A~B),体内多色流式门控策略见图 5。体外诱导分化结果显示:与DMSO组相比,姜酮处理后以剂量依赖性的方式抑制RORγt的平均荧光强度值(mean fluorescence intensity, MFI)(P < 0.05,图 8C~D)。上述结果表明,姜酮可能通过抑制RORγt的表达抑制Th17细胞分化。
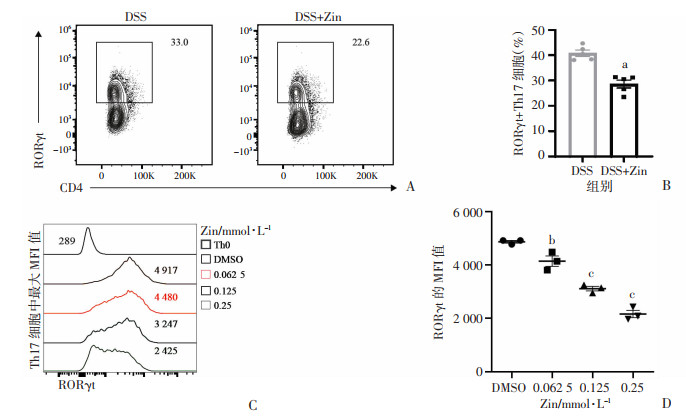
|
| A:小鼠结肠固有层淋巴细胞中CD4+RORγt+ Th17细胞的代表流式图;B:RORγt+ Th17细胞统计分析结果 a:P < 0.001,与DSS组相比;C:不同浓度的姜酮对体外Th17亚群中RORγt表达的最大MFI值总结图;D:Th17亚群中RORγt的MFI值统计分析结果 b:P < 0.05, c:P < 0.01,与DMSO组比较 图 8 姜酮对Th17细胞中RORγt的影响 |
2.7 姜酮在转录水平对RORγt活性的影响
嵌合GAL4-RORγt报告系统广泛适用于核受体蛋白配体结合域(ligand binding domain, LBD)的研究(图 9A),可测试感兴趣蛋白质序列的转录激活域。Luciferase实验结果显示,姜酮以浓度依赖的方式抑制RORγt的转录活性(P < 0.000 1,图 9B)。此外,Rorc启动子驱动的Luciferase实验结果表明:低浓度(0.5 mmol/L) 姜酮处理293T细胞时,Rorc启动子活性的差异无统计学意义;1、2 mmol/L浓度下的姜酮处理均可抑制Rorc启动子的活性(P < 0.000 1,图 9C),且这种抑制效应为浓度依赖性。
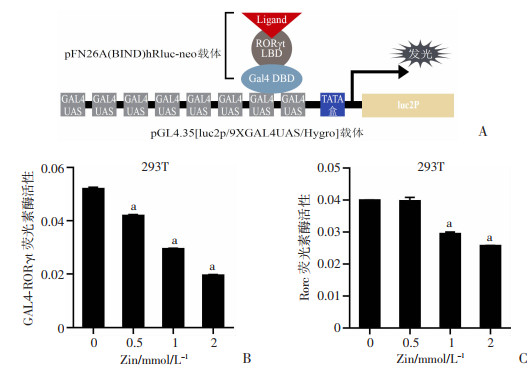
|
|
a:P < 0.000 1,与0 mmol/L药物浓度比较 A:嵌合GAL4-RORγt报告系统原理;B:GAL4-RORγt的转录活性统计结果;C:Rorc启动子荧光素酶活性统计结果 图 9 姜酮在293T细胞中对RORγt转录水平的影响 |
3 讨论
UC是一种反复发作且有癌变可能性的慢性疾病,被世界卫生组织列为现代难治性疾病之一。姜酮具有广泛的药理活性,对多种组织器官的炎症具有良好的抗炎效应,但在肠道炎症中的作用尚不清楚,本研究基于DSS诱导的急性结肠炎模型对姜酮改善肠道炎症的机制进行了初步探索。
3.1 姜酮对DSS小鼠模型临床症状的改善作用适合的动物疾病模型对药物临床前评价十分重要。目前,UC的动物模型主要分为三类:自发模型、诱导模型及基因修饰模型。DSS诱导的结肠炎属于化学药物诱导模型中的一种,其诱导的结肠炎症状、体征及病理与人类UC基本一致,是目前研究UC比较成熟的模型之一。本研究采用2%~3%浓度的DSS溶液饲喂小鼠,持续一周,成功建立了急性结肠炎模型,并对DSS诱导后的肠道炎性介质进行了测定。研究结果显示,DSS组小鼠的体重下降、DAI评分升高、结肠缩短,结肠黏膜出现严重的病理损伤,且结肠组织中促炎细胞因子如IL-17A、IL-21、IL-22、IL-6、IL-1β、IFN-γ的mRNA水平显著上调,分泌蛋白如IL-17A、IL-17F、IL-22、IFN-γ表达也有所增加,这与既往报道的DSS结肠炎小鼠模型结果相符[18-19]。这些突出的临床症状及促炎因子的上调,提示DSS组小鼠的结肠发生了显著的急性炎症。经过姜酮治疗后,小鼠的肠道炎症得到明显缓解,表明姜酮对DSS诱导的结肠炎具有良好的治疗效果,并且这种治疗效果可能与恢复小鼠肠道细胞因子紊乱有关。
3.2 姜酮抑制Th17细胞分化,促进Treg细胞分化肠道中CD4+ T细胞介导的免疫失调是导致UC发病的重要因素之一。初始的CD4+ T细胞被激活时可分化为不同的辅助性T细胞(helper T cell, Th),主要包括Th1、Th2、Th17、Treg细胞[20-21],不同的Th谱系可产生特异性的细胞因子参与免疫反应。现有文献表明,Th17细胞及其分泌的细胞因子如IL-6、IL-17、IL-21在UC中显著升高,可促进炎症的发展;Treg细胞则作为一种具有免疫抑制效应的细胞在肠道免疫耐受中发挥重要作用,其分泌的抗炎因子TGF-β、IL-10等可抑制炎症发生[22-23]。目前有大量文献报道,通过改善肠道中Th17细胞和Treg细胞的平衡可限制结肠炎的发展[24-27]。本研究发现姜酮可调控促炎因子IL-6、IL-17A、IL-21、IL-22及抑炎因子TGF-β的表达,提示姜酮可能是通过影响Th17/Treg细胞的分化,进而调节了相关效应细胞因子的分泌。结合体内多色流式分析,姜酮选择性地抑制了DSS结肠炎小鼠肠道固有层淋巴细胞中致病性的IL-17A+ Th17细胞,促进了Treg细胞在肠道中的积累,说明姜酮的确具有发挥T细胞免疫调节的药理能力[15],可通过调节肠道中Th17/Treg细胞平衡维持肠道稳态,从而缓解了结肠炎。同时,初始CD4+ T细胞体外诱导分化实验进一步验证了姜酮对不同Th细胞分化的作用。这种在体外诱导T细胞分化的方法排除了体内复杂生物因素的影响,可单独、直接的观察姜酮对不同Th谱系分化的作用,有力地论证了姜酮具有选择性调控T细胞分化的能力。然而,T细胞的分化伴随着细胞活化、增殖、凋亡等一系列生理过程,并且在体内受到细胞微环境复杂精密的调控,姜酮是否特异性靶向Th17/Treg细胞的转分化来减轻结肠炎仍需要更多的动物模型进行验证。
3.3 姜酮抑制RORγt表达由于在实验中发现姜酮具有调节Th17细胞分化的作用,本研究对影响Th17细胞命运的关键转录因子RORγt进行了初步探索。体内外的流式结果显示,姜酮可抑制RORγt的表达。RORγt的主要作用是促进Th17细胞分化和产生IL-17。IL-17是一种促炎细胞因子,主要由Th17细胞分泌,可参与许多炎症性疾病的进展。文献证实,在炎症性肠病、自身免疫性脑脊髓炎以及多发性硬化等多种小鼠模型中,特异性地抑制IL-17可减轻小鼠炎症的发生[28-30]。由于RORγt是IL-17的主要转录因子,因此抑制RORγt的活性已成为治疗由IL-17驱动的自身免疫性疾病的重要策略[31]。研究报道,地高辛和SR1001是RORγt的有效抑制剂,可抑制IL-17表达并减轻自身免疫性脑脊髓炎的疾病程度[32-33]。此外,熊果酸、胆汁酸代谢物3-oxoLCA以及多种地高辛衍生物可通过结合RORγt抑制其转录活性,从而抑制Th17细胞分化[34-35]。本研究结果发现,姜酮也可以抑制RORγt的转录活性,从而初步解释了姜酮抑制Th17细胞分化并改善小鼠结肠炎的原因。同时,基于GAL4-RORγt双荧光素酶报告系统原理,该实验还说明了姜酮可作为一种外源性小分子配体,具有直接结合RORγt配体结构域(ligand binding domain, LBD)的潜在能力,很有可能成为一种新型的RORγt抑制剂,但关于这一结论还需要更多的机理研究。此外,考虑到RORγt是由Rorc基因编码,且Rorc启动子水平的调控也是影响Th17细胞分化的重要机制[36],本研究还利用Rorc荧光素酶报告基因证实了姜酮在启动子水平即可影响RORγt基因的表达,这可能也是姜酮破坏Th17稳定性的机制之一。
综上所述,姜酮对DSS诱导的UC具有较好的治疗作用,其机制上可能是通过调控Th17/Treg细胞平衡和抑制RORγt表达改善肠道炎症反应。本项研究首次证明了姜酮通过调节T细胞免疫应答发挥抗炎活性,丰富了其在炎症免疫调节上的机制探索,不仅为姜酮在治疗UC提供了机制上的见解,而且为开发基于生姜提取物用于药物治疗UC和相关自身免疫性疾病提供了新的思路。但是该研究关于姜酮通过何种途径调控Th17/Treg细胞平衡目前尚未阐清,其抑制RORγt的机理也需要进一步探索。
| [1] |
KAPLNA G G, NG S C. Understanding and preventing the global increase of inflammatory bowel disease[J]. Gastroenterology, 2017, 152(2): 313-321. |
| [2] |
XAVIER R J, PODOLSKY D K. Unravelling the pathogenesis of inflammatory boweldisease[J]. Nature, 2007, 448(7152): 427-434. |
| [3] |
DE SOUZA H S, FIOCCHI C. Immunopathogenesis of IBD: current state of the art[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(1): 13-27. |
| [4] |
PRINZ I, KLEMM U, KAUFMANN S H, et al. Exacerbated colitis associated with elevated levels of activated CD4+T cells in TCR alpha chain transgenic mice[J]. Gastroenterology, 2004, 126(1): 170-181. |
| [5] |
DAVIDSON N J, LEACH M W, FORT M M, et al. T helper cell 1-type CD4+ T cells, but not B cells, mediate colitis in interleukin 10-deficient mice[J]. J Exp Med, 1996, 184(1): 241-251. |
| [6] |
徐燕, 何树泉, 李洪亮. 溃疡性结肠炎的肠黏膜免疫细胞研究进展[J]. 赣南医学院学报, 2013, 33(1): 156-160. XU Y, HE S Q, LI H L. Research progress of intestinal mucosal immune cells in ulcerative colitis[J]. J Gannan Med Univ, 2013, 33(1): 156-160. |
| [7] |
UENO A, JEFFERY L, KOBAYASHI T, et al. Th17 plasticity and its relevance to inflammatory bowel disease[J]. J Autoimmun, 2018, 87: 38-49. |
| [8] |
YAN J B, LUO M M, CHEN Z Y, et al. The function and role of the Th17/treg cell balance in inflammatory bowel disease[J]. J Immunol Res, 2020, 2020: 8813558. |
| [9] |
DANESE S, VUITTON L, PEYRIN-BIROULET L. Biologic agents for IBD: practical insights[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(9): 537-545. |
| [10] |
NEURATH M F. Current and emerging therapeutic targets for IBD[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(5): 269-278. |
| [11] |
AHMAD B, REHMAN M U, AMIN I, et al. A review on pharmacological properties of zingerone[4-(4-hydroxy-3-methoxyphenyl)-2-butanone][J]. Sci World J, 2015, 2015: 816364. |
| [12] |
BALIGA M S, HANIADKA R, PEREIRA M M, et al. Update on the chemopreventive effects of ginger and its phytochemicals[J]. Crit Rev Food Sci Nutr, 2011, 51(6): 499-523. |
| [13] |
KIYAMA R. Nutritional implications of ginger: chemistry, biological activities and signaling pathways[J]. J Nutr Biochem, 2020, 86: 108486. |
| [14] |
HSIANG C Y, LO H Y, HUANG H C, et al. Ginger extract and zingerone ameliorated trinitrobenzene sulphonic acid-induced colitis in mice via modulation of nuclear factor-κB activity and interleukin-1β signalling pathway[J]. Food Chem, 2013, 136(1): 170-177. |
| [15] |
KAZEMI M, JAFARZADEH A, NEMATI M, et al. Zingerone improves the immune responses in an animal model of breast cancer[J]. J Complement Integr Med, 2021, 18(2): 303-310. |
| [16] |
KIM J J, SHAJIB M S, MANOCHA M M, et al. Investigating intestinal inflammation in DSS-induced model of IBD[J]. J Vis Exp, 2012(60): 3678. |
| [17] |
FLAHERTY S, Reynolds J M. Mouse naïve CD4+ T cell isolation and in vitro differentiation into T cell subsets[J]. J Vis Exp, 2015, Apr 16(98): 52739. |
| [18] |
ZHAO Y, LUAN H, JIANG H, et al. Gegen qinlian decoction relieved DSS-induced ulcerative colitis in mice by modulating Th17/Treg cell homeostasis via suppressing IL-6/JAK2/STAT3 signaling[J]. Phytomedicine, 2021, 84: 153519. |
| [19] |
EICHELE D D, KHARBANDA K K. Dextran sodium sulfate colitis murine model: an indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis[J]. World J Gastroenterol, 2017, 23(33): 6016-6029. |
| [20] |
ZHOU L, CHONG M M, LITTMAN D R. Plasticity of CD4+ T cell lineage differentiation[J]. Immunity, 2009, 30(5): 646-655. |
| [21] |
TUMES D J, PAPADOPOULOS M, ENDO Y, et al. Epigenetic regulation of T-helper cell differentiation, memory, and plasticity in allergic asthma[J]. Immunol Rev, 2017, 278(1): 8-19. |
| [22] |
XU M, DUANX Y, CHEN Q Y, et al. Effect of compound sophorae decoction on dextran sodium sulfate (DSS)-induced colitis in mice by regulating Th17/Treg cell balance[J]. Biomed Pharmacother, 2019, 109: 2396-2408. |
| [23] |
SCHMITT H, ULMSCHNEIDER J, BILLMEIER U, et al. The TLR9 agonist cobitolimod induces IL10-producing wound healing macrophages and regulatory T cells in ulcerative colitis[J]. J Crohns Colitis, 2020, 14(4): 508-524. |
| [24] |
CUI H, CAI Y, WANG L, et al. Berberine regulates treg/Th17 balance to treat ulcerative colitis through modulating the gut microbiota in the colon[J]. Front Pharmacol, 2018, 9: 571. |
| [25] |
LIU Y J, TANG B, WANG F C, et al. Parthenolide ameliorates colon inflammation through regulating Treg/Th17 balance in a gut microbiota-dependent manner[J]. Theranostics, 2020, 10(12): 5225-5241. |
| [26] |
WEN S, HE L, ZHONG Z, et al. Stigmasterol restores the balance of treg/Th17 cells by activating the butyrate-PPARγ axis in colitis[J]. Front Immunol, 2021, 12: 741934. |
| [27] |
CHANG Y, ZHAI L, PENG J, et al. Phytochemicals as regulators of Th17/Treg balance in inflammatory bowel diseases[J]. Biomed Pharmacother, 2021, 141: 111931. |
| [28] |
FITZPATRICK L R. Inhibition of IL-17 as a pharmac-ological approach for IBD[J]. Int Rev Immunol, 2013, 32(5/6): 544-555. |
| [29] |
KOMIYAMA Y, NAKAE S, MATSUKI T, et al. IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis[J]. J Immunol, 2006, 177(1): 566-573. |
| [30] |
WAISMAN A, HAUPTMANN J, REGEN T. The role of IL-17 in CNS diseases[J]. Acta Neuropathol, 2015, 129(5): 625-637. |
| [31] |
IVANOV I I, MCKENZIE B S, ZHOU L, et al. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells[J]. Cell, 2006, 126(6): 1121-1133. |
| [32] |
HUH J R, LEUNG M W, HUANG P, et al. Digoxin and its derivatives suppress TH17 cell differentiation by antagonizing RORγt activity[J]. Nature, 2011, 472(7344): 486-490. |
| [33] |
SOLT L A, KUMAR N, NUHANT P, et al. Suppression of TH17 differentiation and autoimmunity by a synthetic ROR ligand[J]. Nature, 2011, 472(7344): 491-494. |
| [34] |
X UT, WANG X, ZHONG B, et al. Ursolic acid suppresses interleukin-17 (IL-17) production by selectively antagonizing the function of RORgamma T protein[J]. J Biol Chem, 2011, 286(26): 22707-22710. |
| [35] |
HANG S, PAIK D, YAO L, et al. Bile acid metabolites control TH17 and Treg cell differentiation[J]. Nature, 2019, 576(7785): 143-148. |
| [36] |
ICHIYAMA K, SEKIYA T, INOUE N, et al. Transcription factor Smad-independent T helper 17 cell induction by transforming-growth factor-β is mediated by suppression of eomesodermin[J]. Immunity, 2011, 34(5): 741-754. |




