精索静脉曲张(varicocele, VC)是一种以一侧或双侧精索静脉丛的血管扩张或扭曲为表现的解剖学结构异常改变疾病,同时也是导致男性不育症的首位病因,在原发性不育患者群体中,患有精索静脉曲张的比例达35%~44%,而在继发性不育患者中则高达45%~81%[1]。尽管致病因素较为明确,但其致男性不育的机制仍未完全阐明。既往研究发现精索静脉曲张可能通过氧化应激、局部高温、血管活性物质返流、免疫因素、生精细胞凋亡、性激素紊乱、精子DNA损伤等多种途径共同作用致不育[2-5]。2021年LUNDY等[6]和BAJIC等[7]发表在Eur Urol上的研究中,通过16sRNA测序技术探索不育人群的泌尿生殖道、肠道中菌群的结构、功能改变,结果发现,不育人群的泌尿生殖道菌群及肠道菌群相较于健康对照人群的菌群存在显著性差异,而精索静脉曲张可导致局部血流改变,可能对睾丸、附睾、泌尿生殖道中厌氧菌的富集存在促进作用。精索静脉曲张患者与健康对照人群的肠道菌群特征及组成,目前并不明确。因此,本研究通过分析精索静脉曲张患者肠道菌群特征,寻找精索静脉曲张患者肠道菌群及代谢通路的差异,为疾病机制与临床诊疗提供实验证据。
1 资料与方法 1.1 一般资料选取2020年1~12月就诊于陆军军医大学第二附属医院的精索静脉曲张患者15例。纳入标准:①年龄18~40岁;②诊断为精索静脉曲张;③近2月无抗生素或益生菌服用史;④无胃肠道手术史;⑤患者知情同意。排除标准:①合并心血管疾病、糖尿病等其他全身疾病;②近期有腹泻、便秘。并在门诊就诊人群中选取年龄、BMI相匹配的健康对照人群15例。本研究获得陆军军医大学第二附属医院伦理委员会批准(2022-研第510-01)。
1.2 样品采集将新鲜粪便收集在无菌采样管中,立即送至实验室并将其等份分装到1.5 mL无菌EP管中;液氮速冻后保存于-80 ℃。
1.3 宏基因组DNA提取与高通量测序粪便样本使用离心柱法进行总DNA提取(天根生化科技有限公司),用紫外分光光度计(Thermo Scientific)检测浓度及纯度后,用蒸馏水调整终体积为50 μL,送北京诺禾致源科技股份有限公司进行高通量测序。
1.4 测序数据的质控和去宿主测序得到的原始数据会存在一定比例的低质量数据,为了保证后续分析结果的可靠性,需要去除宿主和引物,获取用于后续分析的有效数据,具体处理步骤如下:
用Trimmomatic软件包去除碱基质量小于38且所占测序片段超过40 bp的reads;去除N碱基达到10 bp的reads;去除与引物之间的重叠区域超过15 bp的reads。用Bowtie2软件包过滤掉源于人体宿主的reads(参数设置:--end-to-end,--sensitive,-I 200,-X400)。
1.5 HUMAnN3计算物种和功能组成使用Kraken2软件包将高质量reads与NCBI数据库(ftp://ftp.ncbi.nlm.nih.gov/ncbi-asn1)已知的微生物(细菌、病毒、真菌、古细菌)序列进行对比,在界、门、纲、目、科、属、种等各水平进行分类,并统计丰度。使用Diamond软件包比对到UniRef90注释的泛基因组数据库对每个样品检测到的所有物种进行Pfam蛋白家族分析和KEGG代谢富集通路分析。
1.6 统计学分析年龄、BMI、精液质量报告参数以M(Pmin,Pmax)表示,数据处理和分析采用GraphPad Prism 8.0.2软件进行。通过Chao1指数、Shannon指数和Simpson指数评估菌群的丰富度和均匀度。应用基于Jaccard距离算法的主坐标分析(principal coordinates analysis, PCoA)评估组间物种组成结构的差异性。并使用Anosim非参数检验进行验证。组间群落差异分析(LDA EffectSize, LEfse)采用非参数统计检验发现丰度差异明显的物种。采取偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)筛选组间差异菌。Student’s t检验用于比较两组间基因表达水平和相关代谢通路表达水平差异。P<0.05被认为差异具有统计学意义。
2 结果 2.1 研究对象特征研究对象包括:精索静脉曲张患者15名,健康对照人群15名。两组的年龄、BMI均无统计学差异(P>0.05),精液质量分析报告中,非前向运动精子率、形态正常精子率、精子畸形率存在显著性差异(P<0.05),其余指标均无统计学差异(P>0.05)。见表 1。
| 变量 | 患者组 | 对照组 | P |
| 年龄/岁 | 21(17,38) | 28(20,33) | 0.949 |
| BMI/kg·m-2 | 21.45(17.13,29.38) | 22.86(20.42,27.68) | 0.429 |
| 精液量/mL | 2.50(0.80,7.00) | 4.47(1.20,6.40) | 0.113 |
| 液化时间/min | 30.00(15.00,30.00) | 30.00(30.00,60.00) | 0.408 |
| pH值 | 7.30(7.20,7.50) | 7.50(7.20,7.50) | 0.331 |
| 精子浓度/Mo·mL-1 | 36.60(6.30,81.30) | 70.00(7.80,119.20) | 0.153 |
| 前向运动精子率(%) | 46.00(0.30,63.00) | 43.70(27.60,65.80) | 0.863 |
| 非前向运动精子率(%) | 12.00(6.00,24.20) | 19.40(5.70,38.70) | 0.032 |
| 不活动精子率(%) | 42.00(0.70,60.00) | 34.50(4.90,58.90) | 0.726 |
| 形态正常精子率(%) | 5.50(1.50,23.30) | 10.00(4.00,29.00) | <0.001 |
| 精子畸形率(%) | 94.50(76.70,98.50) | 90.00(71.00,96.00) | <0.001 |
2.2 组间肠道菌群差异分析 2.2.1 病例组与对照组的肠道菌群多样性存在显著性差异
Alpha多样性反映样本内的物种多样性,采用Chao1指数(估计样本中的物种总数)、Shannon指数(反映样本分类总数及其占比)和Simpson指数(表征物种分布的多样性和均匀度)表现,分析表明两组间的差异没有统计学意义(P>0.05)。通过Jaccard距离算法的PCoA评估Beta多样性。使用Anosim非参数检验显示两组间的差异具有统计学意义(P<0.01),见图 1。
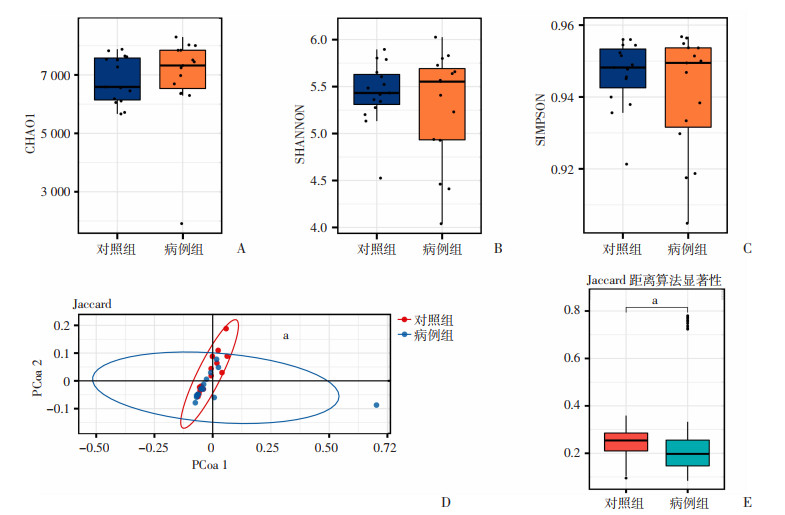
|
|
a:P<0.05,与对照组比较 A:CHAO1指数;B:SHANNON指数;C:SIMPSON指数;D:通过Jaccard距离算法的主坐标分析评估Beta多样性;E:使用Anosim非参数检验两组间的Beta多样性 图 1 精索静脉曲张患者与健康对照人群的肠道菌群多样性分析 |
2.2.2 病例组与对照组的肠道菌群各有不同的优势菌群物种
在门水平上,两组肠道细菌均以厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)、变形菌门(proteobacteria)、放线菌门(actinobacteria)、梭杆菌门(fusobacteria)为主,见表 2。
| 细菌(门) | 病例组相对丰度 | 对照组相对丰度 |
| Firmicutes | 34.05 | 39.17 |
| Bacteroidetes | 37.81 | 33.89 |
| Proteobacteria | 5.86 | 4.06 |
| Actinobacteria | 5.59 | 4.69 |
| Fusobacteria | 0.28 | 0.16 |
| 其他 | 16.41 | 18.03 |
| 总计 | 100 | 100 |
通过将两组肠道菌群进行LEfSe分析,筛选出两组间具有显著差异的物种共13种。病例组的差异肠道细菌在种水平上包括有黄杆菌属(flavonifractor plautii)、甲烷短杆菌属(methanobrevibacter smithii)、肠杆菌属(enterobacter roggenkampii)等,而对照组的差异肠道细菌在种水平则包括有考拉杆菌属(phascolarctobacterium faecium)、Romboutsia属(romboutsia ilealis)、双歧杆菌属(bifidobacterium bifidum)、普雷沃氏菌属(prevotella jejuni)、梭菌属(clostridium perfringens)等,见图 2。
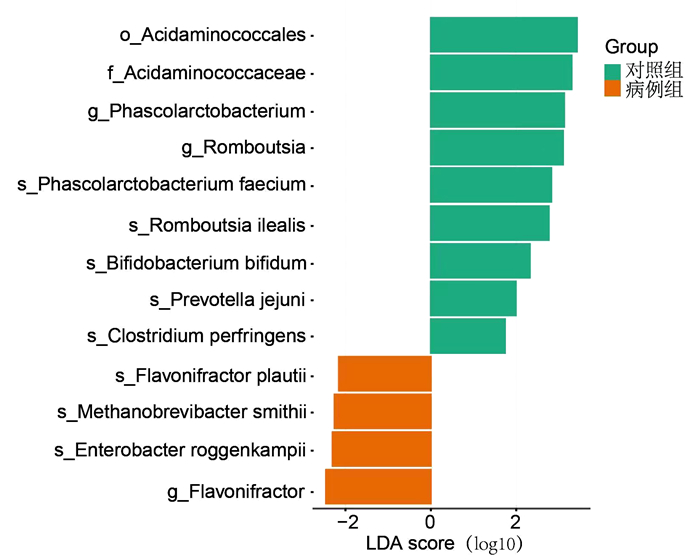
|
| 图 2 精索静脉曲张患者与健康对照人群的肠道菌群LEfSe分析 |
2.2.3 病例组较对照组有多条代谢通路表达水平上调
为了进一步探究两组间差异肠道菌群引起机体生理功能变化的机制,首先通过PLS-DA分析筛选出两组间的差异物种。PLS-DA评分图显示病例组与对照组的差异物种分为了两个不同的聚类(R2Y=0.799和Q2Y=0.392)。通过观察各物种的模型变量的变量权重值(variable important in projection, VIP),筛选出24种在病例组与对照组之间具有显著的相对丰度差异的物种,其中包括21种细菌、1种真菌、2种古细菌。诸如肠球菌属(enterococcus faecalis)、黄杆菌属(flavonifractor plautii)、拉乌尔菌属(raoultella terrigena)等10种差异物种在病例组中的相对丰度高于对照组,而弧菌属(vibrio aphrogenes)、梭菌属(clostridium autoethanogenum)、梭菌属(clostridium baratii)等14种差异物种在对照组中的相对丰度高于病例组,见图 3。
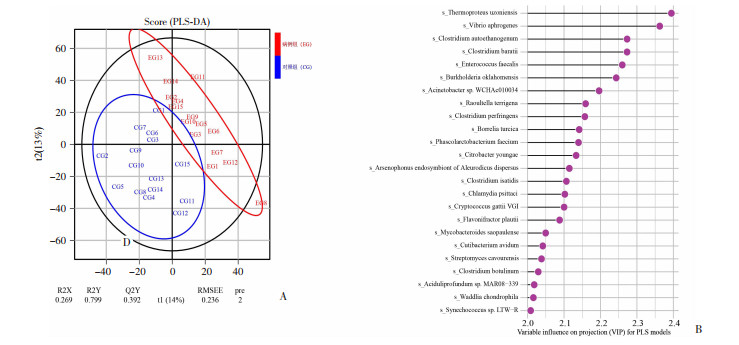
|
| A:PLS-DA得分图;B:差异物种VIP值图 图 3 精索静脉曲张患者与健康对照人群的肠道菌群PLS-DA分析 |
应用student’s t检验鉴别出两组间的差异基因表达与相关代谢通路。结果显示,病例组与对照组之间的基因家族表达也存在着较为显著的差异,相较于对照组,病例组中共有1 254个基因家族表达上调,同时有3 326个基因家族的表达下调。通过组间的差异代谢通路分析,寻找最受影响的代谢活动,总计筛选出480条代谢通路,其中有35条通路在病例组中获得了上调,其余445条通路在两组间无显著性差异,见图 4。
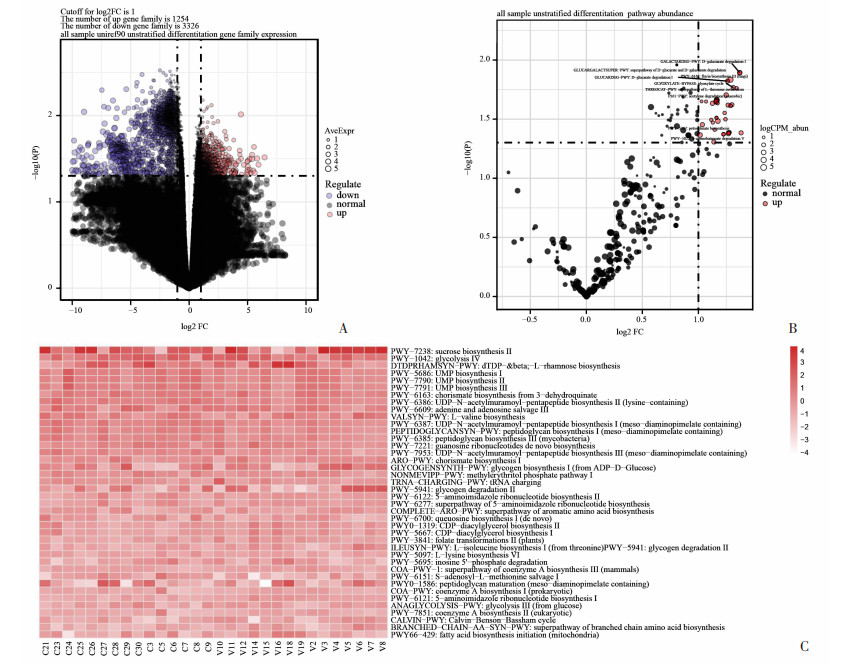
|
| A:差异基因表达火山图;B:差异代谢通路火山图;C:差异代谢通路热图 图 4 精索静脉曲张患者与健康对照人群的肠道菌群差异基因表达及差异代谢通路 |
3 讨论
肠道菌群是寄居在人体肠道中巨大微生态群落的总称,其细胞总数超过数百万亿,甚至高于人体本身的细胞总数,这些菌群与人体共生,与人体生理状态存在紧密联系。在早期,研究者们仅仅观察到肠道菌群的特征性变化与某些病理状态的产物存在统计学关联,但受限于研究方法并未进一步探究[8-9]。近年来,借助16sRNA测序技术、宏基因组测序技术等革新式的研究方法,我们认识到肠道菌群在多个环节中参与宿主的代谢、免疫调节并发挥着重要的作用,以至于有学者称肠道菌群为“人体另一大潜在器官”[10-12]。这种机制为许多疾病及其机制研究提供了新思路和新观点,通过分析特定疾病患者的肠道菌群特征,探究肠道菌群与特定疾病的发生发展之联系,催生出“肠-脑轴”、“肠-肝轴”、“肠-肺轴”等新发现[13-15]。
对于精索静脉曲张引起不育的机制,目前已发现的有氧化应激、局部高温、血管活性物质返流、免疫因素、生精细胞凋亡、性激素紊乱、精子DNA损伤等多种途径[16-23],而既往研究已初步表明男性不育症患者的肠道菌群存在特征性改变。而精索静脉曲张患者的肠道菌群特征及组成尚不明确,所以本研究采用宏基因组学方法分析精索静脉曲张相关肠道菌群特征,使用宏基因组功能分析筛选具有特征性差异的物种和代谢通路,结果发现,两组间Alpha多样性无显著性差异(P>0.05),Beta多样性有显著性差异(P<0.01),提示精索静脉曲张患者肠道菌群多样性及构成改变。相较于正常对照,精索静脉曲张患者肠道菌群有35条上调的代谢通路,而在这些上调的代谢通路中,最为显著的是D-galactarate degradation I、Superpathway of D-glucarate and D-galactarate degradation、D-glucarate degradation I等3条信号通路。这3条通路以葡萄糖酸、粘酸为原料,通过脱水、裂解、还原、磷酸化等步骤,最终生成2-磷酸甘油酸。在功能分类上,这3条信号通路分属于人体内D-半乳糖代谢通路的不同阶段。这一结果提示在精索静脉曲张患者体内的D-半乳糖代谢功能较健康对照人群的功能是明显上调的。而D-半乳糖代谢已被证明在代谢过程中生成氧自由基,借由氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应而对细胞造成损伤,最终通过整体或局部的氧化应激诱导机体衰老或器官老化,并据此建立起D-半乳糖致衰老/老化动物模型[24-32]。既往研究表明,在精索静脉曲张患者的性腺中,细胞的氧化应激水平较高,线粒体、内质网生成的氧自由基异常增多,氧自由基通过与细胞膜表面磷脂发生过氧化反应、与DNA碱基反应造成DNA链断裂等机制导致精子损伤,最终引起不育[33-35]。此外,我们还观察到4-aminobutanoate degradation V通路的上调,该通路能促进4-氨基丁酸(γ-氨基丁酸,GABA)降解,可能与精索静脉曲张时患者的紧张、焦虑、疼痛等临床症状相关[36];以及petroselinate biosynthesis通路的上调与抑制肠道丁酸生成、促进炎症相关,且已被发现在胃肠道肿瘤患者中表达上调[37-38],提示该通路与疾病发生发展存在联系,相关机制还有待进一步研究与探讨。
综上所述,本研究将精索静脉曲张患者的肠道菌群与健康对照人群的肠道菌群进行比较,发现了精索静脉曲张患者肠道菌群的多样性和结构组成的显著性差异,通过宏基因组学功能分析寻找到具有差异的代谢通路,并根据差异代谢通路的功能对肠道菌群在精索静脉曲张的病理改变中发挥作用的潜在机制提出了合理的猜想。但本研究是一项单中心、横断面、观察性研究,且纳入研究对象数量有限,其结果仅表明精索静脉曲张患者肠道菌群的多样性和结构组成改变,根据代谢组学分析结果提出的猜想尚未在实验性研究中进行验证,存在一定的局限性。基于本研究结论,在后续的研究中可对相关机制进行深入探索,加深对肠道菌群在疾病的发生发展中发挥作用的认识,为临床诊疗提供新思路和新证据。
| [1] |
ALSAIKHAN B, ALRABEEAH K, DELOUYA G, et al. Epidemiology of varicocele[J]. Asian J Androl, 2016, 18(2): 179-181. |
| [2] |
艾庆燕, 赵豫凤, 王艳梅, 等. 精索静脉曲张致男性不育机制研究进展[J]. 中国全科医学, 2011, 14(24): 2813-2815. AI Q Y, ZHAO Y F, WANG Y M, et al. Progress in the mechanism of varicocele-induced male infertility[J]. Chin Gen Pract, 2011, 14(24): 2813-2815. |
| [3] |
MASSON P, BRANNIGAN R E. The varicocele[J]. Urol Clin North Am, 2014, 41(1): 129-144. |
| [4] |
JENSEN C F S, OSTERGREN P, DUPREE J M, et al. Varicocele and male infertility[J]. Nat Rev Urol, 2017, 14(9): 523-533. |
| [5] |
HASSANIN A M, AHMED H H, KADDAH A N. A global view of the pathophysiology of varicocele[J]. Andrology, 2018, 6(5): 654-661. |
| [6] |
LUNDY S D, SANGWAN N, PAREKH N V, et al. Functional and taxonomic dysbiosis of the gut, urine, and semen microbiomes in male infertility[J]. Eur Urol, 2021, 79(6): 826-836. |
| [7] |
BAJIC P, WOLFE A J. The microbiome of male infertility: paving the road ahead[J]. Eur Urol, 2021, 79(6): 837-838. |
| [8] |
BÄCKHED F, LEY R E, SONNENBURG J L, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920. |
| [9] |
CASH H L, WHITHAM C V, BEHRENDT C L, et al. Symbiotic bacteria direct expression of an intestinal bactericidal lectin[J]. Science, 2006, 313(5790): 1126-1130. |
| [10] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. |
| [11] |
CHOW J, LEE S M, SHEN Y, et al. Host-bacterial symbiosis in health and disease[J]. Adv Immunol, 2010, 107: 243-274. |
| [12] |
LEE K A, LUONG M K, SHAW H, et al. The gut microbiome: what the oncologist ought to know[J]. Br J Cancer, 2021, 125(9): 1197-1209. |
| [13] |
RELMAN D A, LIPSITCH M. Microbiome as a tool and a target in the effort to address antimicrobial resistance[J]. Proc Natl Acad Sci USA, 2018, 115(51): 12902-12910. |
| [14] |
BUTEL M J, WALIGORA-DUPRIET A J, WYDAU-DEMATTEIS S. The developing gut microbiota and its consequences for health[J]. J Dev Orig Health Dis, 2018, 9(6): 590-597. |
| [15] |
BISHEHSARI F, VOIGT R M, KESHAVARZIAN A. Circadian rhythms and the gut microbiota: from the metabolic syndrome to cancer[J]. Nat Rev Endocrinol, 2020, 16(12): 731-739. |
| [16] |
SAHIN Z, CELIK-OZENCI C, AKKOYUNLU G, et al. Increased expression of interleukin-1alpha and interleukin-1beta is associated with experimental varicocele[J]. Fertil Steril, 2006, 85(Suppl 1): 1265-1275. |
| [17] |
ISHIKAWA T, FUJIOKA H, ISHIMURA T, et al. Increased testicular 8-hydroxy-2'-deoxyguanosine in patients with varicocele[J]. BJU Int, 2007, 100(4): 863-866. |
| [18] |
LIANG M, WEN J, DONG Q, et al. Testicular hypofunction caused by activating p53 expression induced by reactive oxygen species in varicocele rats[J]. Andrologia, 2015, 47(10): 1175-1182. |
| [19] |
ALTINTAS R, EDIZ C, CELIK H, et al. The effect of varicocoelectomy on the relationship of oxidative stress in peripheral and internal spermatic vein with semen parameters[J]. Andrology, 2016, 4(3): 442-446. |
| [20] |
CHO C L, ESTEVES S C, AGARWAL A. Novel insights into the pathophysiology of varicocele and its association with reactive oxygen species and sperm DNA fragmentation[J]. Asian J Androl, 2016, 18(2): 186-193. |
| [21] |
SADEGHI N, ERFANI-MAJD N, TAVALAEE M, et al. Signs of ROS-associated autophagy in testis and sperm in a rat model of varicocele[J]. Oxid Med Cell Longev, 2020, 2020: 5140383. |
| [22] |
XIROPOTAMOU O, TSILI A C, ASTRAKAS L, et al. A preliminary study of the biochemical environment of infertile testes with clinical varicocele[J]. Eur J Radiol, 2020, 127: 108989. |
| [23] |
AGHAIE A, LECHAPLAIS C, SIRVEN P, et al. New insights into the alternative D-glucarate degradation pathway[J]. J Biol Chem, 2008, 283(23): 15638-15646. |
| [24] |
CHANG L, LIU X, LIU J, et al. D-galactose induces a mitochondrial complex I deficiency in mouse skeletal muscle: potential benefits of nutrient combination in ameliorating muscle impairment[J]. J Med Food, 2014, 17(3): 357-364. |
| [25] |
ZHANG S C, DONG Z Q, PENG Z S, et al. Anti-aging effect of adipose-derived stem cells in a mouse model of skin aging induced by D-galactose[J]. PLoS One, 2014, 9(5): e97573. |
| [26] |
DU Z D, YANG Q, ZHOU T, et al. D-galactose-induced mitochondrial DNA oxidative damage in the auditory cortex of rats[J]. Mol Med Rep, 2014, 10(6): 2861-2867. |
| [27] |
HADZI-PETRUSHEV N, STOJKOVSKI V, MITROV D, et al. D-galactose induced changes in enzymatic antioxidant status in rats of different ages[J]. Physiol Res, 2015, 64(1): 61-70. |
| [28] |
FABER F, TRAN L, BYNDLOSS M X, et al. Host-mediated sugar oxidation promotes post-antibiotic pathogen expansion[J]. Nature, 2016, 534(7609): 697-699. |
| [29] |
朱亚珍, 朱虹光. D-半乳糖致衰老动物模型的建立及其检测方法[J]. 复旦学报(医学版), 2007, 34(4): 617-619. ZHU Y Z, ZHU H G. Establishment and measurement of D-galactose induced aging model[J]. Fudan Univ J Med Sci, 2007, 34(4): 617-619. |
| [30] |
李文彬, 韦丰, 范明, 等. D-半乳糖在小鼠上诱导的拟脑老化效应[J]. 中国药理学与毒理学杂志, 1995, 9(2): 93-95. LI W B, WEI F, FAN M, et al. Mimetic brain aging effect induced by D-galactose in mice[J]. Chin J Pharmacol Toxicol, 1995, 9(2): 93-95. |
| [31] |
SONG X, BAO M, LI D, et al. Advanced glycation in D-galactose induced mouse aging model[J]. Mech Ageing Dev, 1999, 108(3): 239-251. |
| [32] |
AZMAN K F, ZAKARIA R. D-Galactose-induced accelerated aging model: an overview[J]. Biogerontology, 2019, 20(6): 763-782. |
| [33] |
VAN CAUWENBERGHE O R, MAKHMOUDOVA A, MCLEAN M D, et al. Plant pyruvate-dependent gamma-aminobutyrate transaminase: identification of an arabidopsisc DNA and its expression in escherichia coli[J]. Can J Bot, 2002, 80(9): 933-941. |
| [34] |
AGARWAL A, HAMADA A, ESTEVES S C. Insight into oxidative stress in varicocele-associated male infertility: part 1[J]. Nat Rev Urol, 2012, 9(12): 678-690. |
| [35] |
HAMADA A, ESTEVES S C, AGARWAL A. Insight into oxidative stress in varicocele-associated male infertility: part 2[J]. Nat Rev Urol, 2013, 10(1): 26-37. |
| [36] |
MEKHEDOV S, CAHOON E B, OHLROGGE J. An unusual seed-specific 3-ketoacyl-ACP synthase associated with the biosynthesis of petroselinic acid in coriander[J]. Plant Mol Biol, 2001, 47(4): 507-518. |
| [37] |
SCHUJMAN G E, DE MENDOZA D. Transcriptional control of membrane lipid synthesis in bacteria[J]. Curr Opin Microbiol, 2005, 8(2): 149-153. |
| [38] |
PENG Z, CHENG S Y, KOU Y, et al. The gut microbiome is associated with clinical response to anti-PD-1/PD-L1 immunotherapy in gastrointestinal cancer[J]. Cancer Immunol Res, 2020, 8(10): 1251-1261. |




