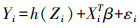2. 400038 重庆,陆军军医大学(第三军医大学) 军事预防医学系毒理学研究所,电磁辐射医学防护教育部重点实验室;
3. 401120 重庆,重庆市妇幼保健院(重庆医科大学附属妇女儿童医院):科教科临床研究中心;
4. 401120 重庆,重庆市妇幼保健院(重庆医科大学附属妇女儿童医院):妇产科
2. Institute of Toxicology, Key Lab of Medical Protection for Electromagnetic Radiation of Ministry of Education, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Clinical Research Center, Department of Scientific Research and Teaching Affairs, Women and Children's Hospital of Chongqing Medical University, Chongqing, 401120, China;
4. Department of Obstetrics and Gynecology, Women and Children's Hospital of Chongqing Medical University, Chongqing, 401120, China
半个多世纪以来,人类的人均寿命已得到显著提高,但国内外诸多研究报道人类的生殖能力却呈下降趋势。世界卫生组织人类生殖特别规划署报告全球人群不孕不育率至少为15%,不孕夫妇有6 000~8 000万对[1]。2021年最新发布的第七次人口普查结果显示我国人口增速放缓,育龄人群的不孕不育率升高到18%[2]。其中男性生殖健康受到广泛关注,研究显示男性对不孕的疾病贡献达到40%~70%[3-4]。可见男性在导致不孕不育中的作用与女性同等重要。因此筛选识别导致男性生育力下降的危险因素对于维护和促进男性生殖健康具有重要意义。
目前影响男性不育的因素主要分为遗传、环境、心理、行为(生活方式)等几类[5-7],其中环境因素特别值得重视。在众多环境因素中,空气污染仍是健康损害的重要因子。虽然近年来我国在空气污染治理方面取得了显著成就,但仍然未达到理想水平,仍有80%的人口暴露在浓度超过世界卫生组织空气质量指导值的环境中[8-10]。根据我国《环境空气质量标准(2012)》(GB3095-2012)[11],空气中的主要污染物包括可吸入颗粒物(particulate matter with an aerodynamic diameter smaller than 10 μm,PM10)和细颗粒物(particulate matter with an aerodynamic diameter smaller than 2.5 μm,PM2.5)以及二氧化硫(SO2)、一氧化碳(CO)、二氧化氮(NO2)和臭氧(O3)等气态污染物。越来越多的研究提示这些污染物对男性生殖功能可能产生不良影响[12-14]。然而既往研究大都集中于接受辅助生殖治疗的患者等特殊人群[15-16],可能导致研究样本代表性较差,研究结论外推到一般人群时受到限制。此外,该领域尚缺乏研究报道分析多种空气污染物联合暴露对不育的影响和污染物之间的交互作用,其原因可能是之前缺乏适宜的统计方法。贝叶斯核机器回归(Bayesian kernel machine regression,BKMR)模型可以同时进行联合效应和交互作用的分析,为研究环境污染物混合物暴露对健康的总体影响提供了一种新的研究工具[17]。
为进一步探讨育龄男性空气污染物暴露对生殖健康的影响,本研究采用前瞻性队列研究设计,通过机器学习的方法评估有生育计划的育龄男性的个体化污染物暴露水平,并纵向随访其在1年内的自然授孕情况,以评估男性空气污染物单一和联合暴露与不育风险的关联及污染物间的交互作用。
1 资料与方法 1.1 研究对象研究对象为参与重庆市孕前生殖健康和出生结局队列(Preconception Reproductive Health and Birth Outcomes Cohort,PREBIC)的有生殖意愿男性。PREBIC队列由陆军军医大学和重庆市妇幼保健院联合设计和实施,于2019年1月在重庆市妇幼保健院正式启动,至2021年4月招募有生育意愿的育龄夫妇[18]。男性志愿者按照以下标准纳入:①年龄22~49岁;②长期居住于重庆(居住2年以上);③2年内没有搬出重庆的计划。排除标准:①采取避孕措施;②有泌尿生殖系统疾病史;③参加本研究之前经临床诊断为不育。在研究对象参与队列时通过问卷收集包括居住地址信息、年龄、体质量指数以及吸烟、饮酒史在内的人口统计学数据。本研究通过重庆市妇幼保健院伦理委员会[2018伦审(科)020号]和陆军军医大学伦理学委员会(2019第003-02号)审查;并通过中国人类遗传资源采集审批(国科遗办审字[2021]CJ2417号)。
1.2 方法 1.2.1 空气污染数据与暴露评估基于卫星检索、地面监测和各种地理预测因子(如随机森林和神经网络)等数据集,通过随机森林-时空克里金等机器学习算法,以网格(0.1×0.1)为单位估算得到研究区域2018-2021年期间环境颗粒物(PM10和PM2.5)和气体污染物(SO2、NO2、CO和O3)的全覆盖日均浓度[19-21]。地面监测数据和气象数据(温度和相对湿度)分别从中国环境监测中心(http://www.cnemc.cn/)和中国气象数据服务中心(http://data.cma.cn/)获取。用于构建模型的环境协变量主要包括气象、归一化植被指数、行星边界层高度、海拔、人口密度、土地利用类型、国内生产总值、排放清单、道路密度等。
将研究对象的居住地址地理编码为经度和纬度,以匹配估算污染物数据集,从而获得每个研究对象的空气污染物暴露水平和所在地区的气象条件。由于精子发生生理过程的周期长度(90 d)和不同的时间窗[22-23],计算得到每位研究对象在入组前90 d环境空气污染物的平均暴露浓度,包括射精前0~9 d(附睾储存期)、10~14 d(精子活力发育期)、70~90 d(精子细胞发生期)和0~90 d(精子发生的整个周期)。
1.2.2 不育的随访与判定在招募研究对象后的2年里,每3个月通过自动推送的电子问卷和人工电话随访对其配偶(在基线阶段已同步招募入组)进行简短问卷调查。在每一轮随访中记录其是否成功实现临床诊断妊娠。随访成功妊娠时记录末次月经的日期。根据世界卫生组织建议的诊断标准,不育被定义为在12个月或更长时间的定期无保护性交后未能怀孕[24]。
1.3 统计学分析对研究对象的人口流行病学资料和空气污染数进行描述性分析。分类变量采用频数(%)形式描述,连续变量采用x±s以及中位数和四分位间距描述。环境因素间的相关性采用Spearman相关分析。采用二元Logistic回归模型分析单一污染物与不育风险的关联,并控制年龄、体质量指数(BMI)、吸烟、饮酒等混杂因素。由于环境暴露数据为非线性,将暴露数据分为四分位数(Q1~Q4),其中Q1为参考组。为了检验单污染物Logistic回归结果的稳健性,在单污染物模型基础上额外校正另一种污染物,建立双污染物模型进行敏感性分析。通过Logistic回归分析以下几个精子发生周期的特定易感性窗口:入组前0~9 d、10~14 d、70~90 d和0~90 d。进一步采用BKMR模型评价空气污染物对不育的联合效应及交互作用,在整体联合暴露的背景下量化和可视化整体暴露的效果,模型公式为:
在公式中,Yi是结果变量,Zi=(Zi1, …, Zim)T是暴露变量,XiT是协变量,β是系数的对应向量,函数h显示暴露-响应关系。
在BKMR模型中,首先评估所有污染物暴露的累积效应,通过与所有污染物暴露中位数水平比较,得到所有污染物处于特定百分位数(25%~75%)水平时暴露响应函数h的估计值,绘制所有污染物的累积效应图。其次利用双变量剂量-反应函数,将污染物分别固定在特定百分位数水平,其他污染物固定在中位数水平,探索和评估空气污染物间的交互作用。在单污染物Logistic回归分析中进行多重检验校正(Bonferroni法),以控制假阳性结果的概率,即Ⅰ类错误。检验水准为双侧α=0.05。
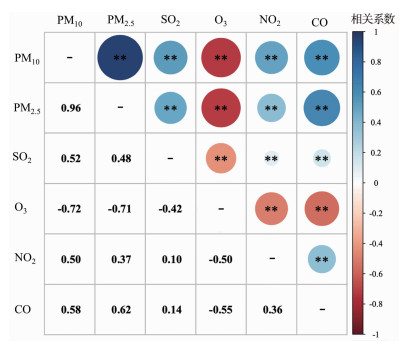
2 结果 2.1 研究对象的一般特征及采样前90 d的空气污染特征描述研究对象的一般描述性资料及采样前90 d的空气污染物暴露水平见表 1。本研究从PREBIC项目中总共选择了2 297名至少获得12个月随访的男性,平均年龄为33岁,基线平均BMI为24.25 kg/m2。不育人数占总样本的56.7%。采样前90 d的平均污染物浓度分别为34.47 μg/m3(PM2.5)、56.29 μg/m3(PM10)、8.18 μg/m3(SO2)、0.82 mg/m3(CO)、38.02 μg/m3 (NO2)和46.47 μg/m3(O3)。图 1为空气污染物与气象条件之间的Spearman相关性分析结果。PM2.5、PM10、SO2、NO2与CO两两之间存在正相关关系;O3与其他物种污染物均呈负相关;除O3外,平均气温与其他空气污染物及相对湿度呈负相关。
| 变量 | x±s,频数(%) | 中位数(四分位间距) |
| 年龄/岁 | 33±4 | 33(5) |
| 体质量指数 | 24.25±3.43 | 24.25(4.34) |
| 吸烟 | ||
| 从不吸烟 | 1 214(52.90) | |
| 6个月前已戒烟 | 789(34.30) | |
| 吸烟超过6个月 | 294(12.80) | |
| 饮酒 | ||
| 从不饮酒 | 726(31.60) | |
| 偶尔饮酒(< 1次/周) | 1 294(56.30) | |
| 6个月前已戒酒 | 85(3.70) | |
| 经常饮酒(≥1次/周) | 192(8.40) | |
| 结局 | ||
| 可育 | 994(43.30) | |
| 不育 | 1 303(56.70) | |
| 空气污染物 | ||
| PM10/μg·m-3 | 56.29±15.60 | 53.64(23.01) |
| PM2.5/μg·m-3 | 34.47±13.15 | 30.51(30.88) |
| SO2/μg·m-3 | 8.18±1.27 | 8.06(1.73) |
| O3/μg/m-3 | 46.47±16.72 | 51.57(25.77) |
| CO/mg·m-3 | 0.82±0.12 | 0.82(0.15) |
| NO2/μg·m-3 | 38.02±9.83 | 38.90(12.46) |
|
| **:P < 0.01 图 1 空气污染物的Spearman相关热图 |
2.2 男性空气污染物暴露90 d平均水平与不育的关联分析
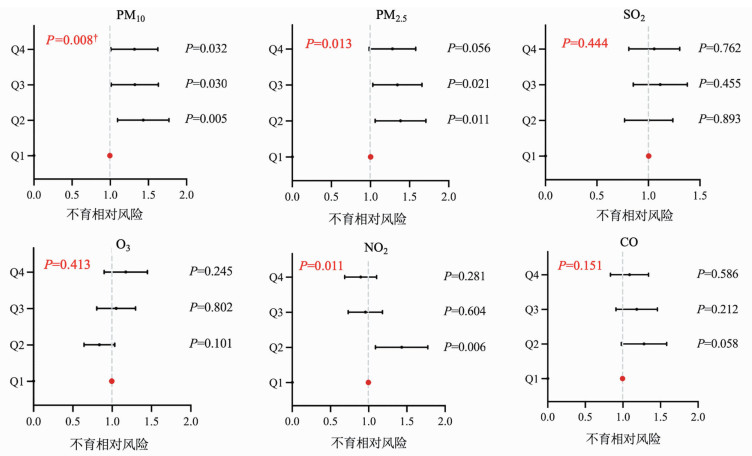
单污染模型显示,男性PM10(P=0.008)、PM2.5(P=0.013)、NO2(P=0.011)的90 d平均暴露水平与不育风险有关(图 2)。在经过Bonferroni校正后,PM10与不育的关联仍有统计学意义。将PM10暴露水平按四分位数分组,以最低四分位数(Q1)组为参照,Q2、Q3、Q4暴露水平组对应的不育相对风险分别为1.406(95%CI:1.110~1.782,P=0.005)、1.298(95%CI:1.026~1.642,P=0.030)和1.293(95%CI:1.022~1.636,P=0.032),其暴露水平与不育风险的关系呈现非线性形式。
|
| 对年龄、BMI、吸烟、饮酒和温度、相对湿度、风速、气压和归一化植被指数差异进行了校正;红色P值为整体P值:将污染物的四分位数视为无序分类变量进行Logistic回归的P值;黑色P值为以最低四分位数组为参照,Q2、Q3、Q4暴露水平组对应的不育相对风险P值;†: 表示经过Bonferroni多重校正后仍具有统计学意义 图 2 男性采样前90 d暴露于空气污染物与不育之间的关系: 单一污染物模型结果 |
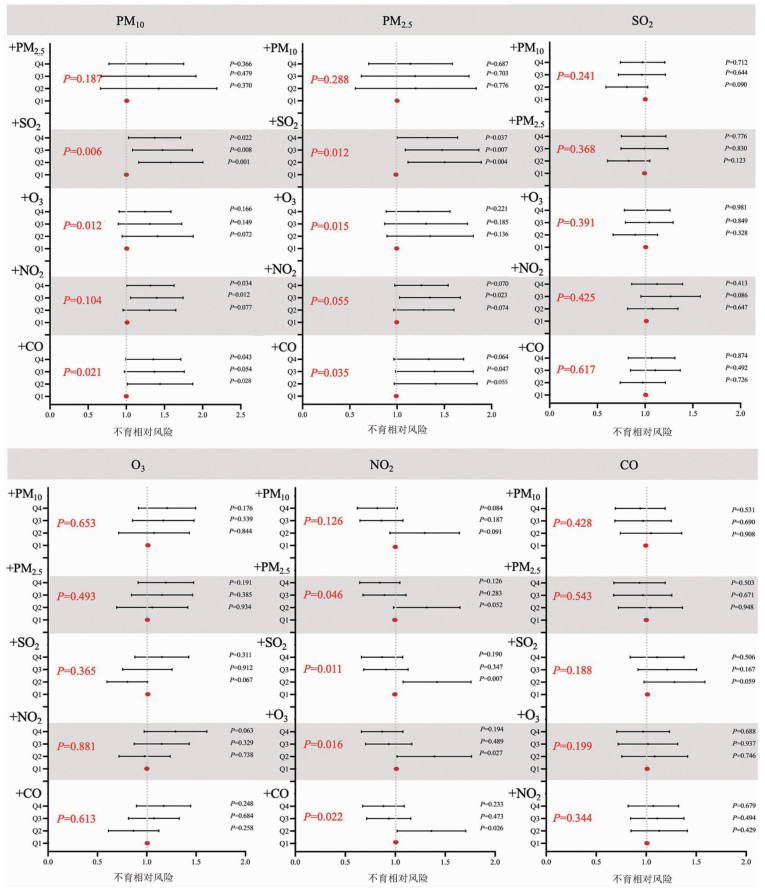
进一步通过双污染模型来评估模型的稳健性,结果与单污染物模型相似,如图 3所示。除与PM10相关性较强的PM2.5以外,其他污染物的校正并未显著影响PM10与不育风险的关联。
|
| 对年龄、BMI、吸烟、饮酒和温度、相对湿度、风速、气压和归一化植被指数差异进行了校正;红色P值为整体P值:将污染物的四分位数视为无序分类变量进行Logistic回归的P值;黑色P值为以最低四分位数组为参照,Q2、Q3、Q4暴露水平组对应的不育相对风险P值 图 3 男性采样前90 d暴露于空气污染物与不育之间的关系: 双污染物模型结果 |
2.3 男性空气污染物暴露与不育关联的易感窗口分析
本研究分析3个易感窗口:精液采样前0~9 d(附睾储存期)、10~14 d(精子活力发育期)和70~90 d (精子细胞发生期)。分析结果显示,男性0~9 d(OR=0.927,95%CI:0.861~0.099,P=0.046)、10~14 d (OR=0.938,95%CI:0.870~1.010,P=0.089)、70~90 d (OR=0.914,95%CI:0.848~0.985,P=0.018)的PM10暴露均呈现出与较高的不育风险的关联趋势(图 4)。PM2.5及NO2在各个窗口期的暴露与不育风险的关联结果也呈现与采样前90 d平均暴露相似的趋势。
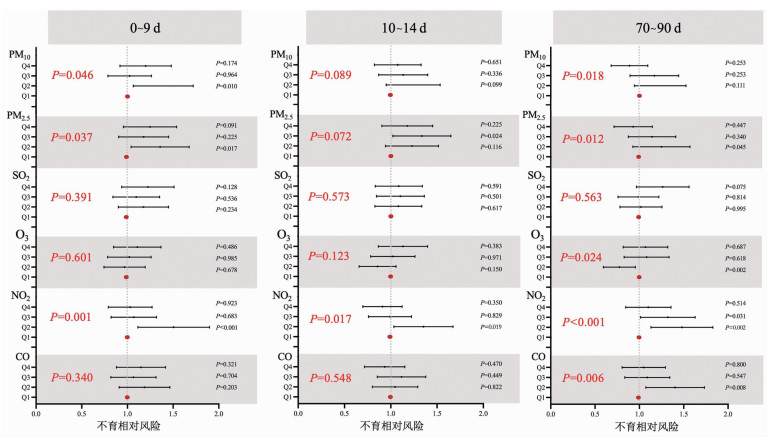
|
| 模型调整了年龄、BMI、吸烟、饮酒和温度、相对湿度、风速、气压和归一化植被指数差异;窗口期包括采样前0~9 d(附睾储存期)、10~14 d(精子活力发育期)、70~90 d(精子细胞发生期)和0~90 d;红色P值为整体P值:将污染物的四分位数视为无序分类变量进行Logistic回归的P值;黑色P值为以最低四分位数组(Q1)为参照,Q2、Q3、Q4暴露水平组对应的不育相对风险P值 图 4 男性空气污染物暴露对不育的关键易感性窗口分析 |
2.4 男性空气污染暴露的联合效应和交互作用分析
图 5显示了男性空气污染物暴露对不育的联合效应及交互作用分析结果。BKMR模型在分析联合效应时,当各空气污染物暴露水平均高于其第50百分位数时,若其对应的不育相对风险与污染物处于中位数时相比差异有统计学意义(95%置信区间不包含零),则视为存在联合效应。本研究结果显示,男性空气污染物暴露对不育的联合效应没有统计学意义(图 5A)。
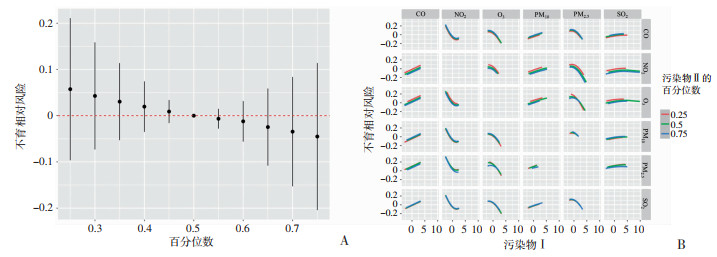
|
| A:空气污染物对不育的联合效应,该图显示了当6种污染物被设定在特定百分位数(从第25位到第75位)时,与所有污染物都处于第50百分位数时相比,不育风险的估计值变化,估计值结果的95%置信区间不包含零被认为有统计学意义;B:空气污染物的交互作用,图中的曲线表示为当污染物分别固定为25%(红线)、50%(绿线)和75%(蓝线)百分位数,其他污染物固定为其中位数时,各污染物的双变量剂量-反应曲线 图 5 BKMR模型分析空气污染物对不育的联合效应与交互作用 |
图 5B展示了6种污染物各自与不育的剂量-反应曲线,并根据另一种污染物的暴露水平进行了分层展示。若某污染物X在不同暴露剂量下,另一污染物Y与不育的剂量-反应曲线呈现明显不同的变化趋势,则提示两污染物之间存在交互作用。本研究结果显示,各污染物剂量-反应曲线在其他污染物的不同水平上均保持基本一致的变化趋势,未显示出显著的交互作用。
3 讨论本研究通过监测2 297名男性环境空气污染物暴露水平以及对研究对象为期12个月的随访,分析男性空气污染物暴露与不育的关联。结果显示,男性90 d PM10暴露水平与不育风险有关,与Q1暴露水平相比,PM10 Q4暴露水平者的不育相对风险增加29.3%。然而PM10暴露水平与不育风险的关系呈非线性。0~9 d、10~14 d、70~90 d等阶段的PM10暴露水平与不育风险均呈现类似关系,未发现明显的易感窗口。未观察到多种空气污染物对不育的联合效应或交互作用。
本研究显示,男性PM10暴露与不育风险呈正相关,这与意大利一项回顾性队列研究的结果一致[25]。另一项捷克共和国对1 916个研究对象的回顾性研究结果也显示男性空气PM2.5的短期暴露与较低的受孕概率有关[26]。在本研究中PM2.5虽然没有通过Bonferroni校正,但是PM2.5暴露与不育风险的关联结果也呈现与PM10暴露相似的趋势,而且PM2.5是PM10的组成成分,所以该结果未来值得进一步的验证。前期已发表的男性空气污染物暴露与不育关联的研究大都局限于横断面研究和回顾性研究,前瞻性的队列研究很少,仅有对捷克共和国2 585名研究对象的一项前瞻性队列研究侧重分析了SO2暴露与生育能力的关联,结果显示SO2短期暴露可能降低生育率,但该研究并未分析其他空气污染物对生育能力的影响[27]。而在本研究结果中未发现SO2与不育的关联有统计学意义,原因可能是在该研究中SO2的平均浓度大于45 μg/m3,本研究的SO2平均浓度仅8.18 μg/m3,这表明高浓度的SO2可能影响生育能力;另一项美国德克萨斯州和密歇根州的纵向研究结果显示居住地址靠近主要道路可能与生育力的降低有关[28],但是该研究未能分析具体的空气污染物对生育力的影响。本研究是国内首个基于前瞻性队列分析男性6种主要空气污染物暴露与不育关联的研究。
本领域的前期研究主要关注单一污染物暴露的效应,尚未见到有研究分析多种空气污染物对不育的联合效应及交互作用。但是在现实情况下,研究对象总是同时暴露于多种空气污染物的混合物中[29]。因此,多种空气污染物对不育的联合效应与交互作用分析十分必要。尽管本研究中未发现空气污染物对不育的联合效应和交互作用有统计学意义,但是在未来的研究中,联合效应及交互作用是否存在仍然值得通过更多的独立研究加以证实。此外,本研究还分析了男性空气污染暴露对不育的特定易感窗口。整个精子发生周期(90 d)中有3个关键时期,即射精前0~9 d附睾储存期、10~14 d精子活力发育期、70~90 d精子细胞发生期[30]。既往关于男性空气污染物暴露和不育的研究主要分析研究对象整个研究期间的平均暴露水平[26-27],没有对精子发生期间的特定暴露窗口进行细分。本研究结果显示,男性0~9 d、10~14 d、70~90 d的PM10暴露均呈现出与较高的不育风险的关联趋势,并且PM2.5及NO2在各个窗口期的暴露与不育风险的关联结果也呈现与90 d平均暴露相似的趋势。
关于空气污染物对生育力的作用机制,之前的研究中提出了4种可能的机制:①内分泌干扰,颗粒物中含有的多环芳烃和重金属等作为内分泌干扰物可通过激活芳香烃受体或雄激素受体,从而导致激素的紊乱[31]。②氧化应激诱导,NO2、O3或颗粒物(通过它们所含的重金属和多环芳烃等)可以产生活性氧,进而对精子造成损害[32-34]。③细胞脱氧核糖核酸(DNA)改变,一些污染物如颗粒物中的多环芳烃可以与DNA形成DNA加合物,从而导致遗传突变和异常的基因表达[35-36]。④表观遗传修饰,DNA甲基化的改变、核糖核酸(RNA)和/或组蛋白修饰等,均可能在精子发育的不同阶段引起基因表达异常。有研究显示空气污染物可扰乱参与不同表观遗传过程的细胞代谢物水平,这些表观遗传学改变可能与精子发生生理过程的受损有关[37-38]。上述损伤机制涉及精子发生生理过程的各个阶段,而空气污染物对男性不育风险的影响可能是上述各种机制的整体体现。本研究的结果也显示,在不同窗口期PM10均显示出不育风险的关联,与这一假说相吻合。
本研究尚存在以下不足之处:①本研究是前瞻性队列研究,但仍属于观察性研究设计。要验证空气污染物与不育之间是否存在因果关系,仍需要更多的独立研究加以论证。②本队列志愿者的招募仅在一所医疗机构开展,虽然问卷调查信息显示志愿者来自全重庆市所有38个区县,但考虑到交通便利性等因素的影响,研究人群的代表性可能受到一定限制。③本研究中志愿者的污染物个体暴露水平是基于研究对象居住地址室外空气污染物的估计值,未能考虑研究对象的动态活动及室内空气污染物的影响,可能增加了样本的无偏错分,从而可能使得研究中产生假阴性结果的可能性增加。④本研究虽然基于男性精子发生的周期长度分析了90 d暴露空气污染暴露与不育的关系,并发现PM10暴露可能与不育风险增加有关,但本研究并未直接探讨空气污染暴露与精液质量的关联,未考虑内暴露的直接作用结果。⑤不育的风险因素较为复杂,本研究观察的因素较为局限,使结果可能存在混杂偏倚。⑥本研究未能有效区分男性研究对象配偶的空气污染物暴露在不育风险中的影响。由于夫妇双方的居住地址和生活环境往往存在较高的一致性,未来有必要进一步开展研究对两者的独立贡献分别进行分析。不育与女性伴侣的生理、心理和病理状态也有一定关系,本研究中未观察女性影响因素对不育的影响。
综上所述,这项前瞻性队列研究结果显示,育龄男性PM10暴露可能会增加不育的风险。研究未发现空气污染物对不育的联合效应及交互作用。鉴于我国仍然广泛存在的空气污染,以及日益严峻的生殖健康挑战,本研究警示了空气颗粒污染物暴露与不育发生可能的相关性,进一步突出了污染防治的迫切需要。上述研究结果有必要通过更多独立研究加以验证。
| [1] |
SALAS-HUETOS A, MAGHSOUMI-NOROUZABAD L, JAMES E R, et al. Male adiposity, sperm parameters and reproductive hormones: an updated systematic review and collaborative meta-analysis[J]. Obes Rev, 2021, 22(1): e13082. |
| [2] |
ZHOU Z, ZHENG D, WU H, et al. Epidemiology of infertility in China: a population-based study[J]. Br J Obstet Gynecol, 2018, 125(4): 432-441. |
| [3] |
AGARWAL A, MULGUND A, HAMADA A, et al. A unique view on male infertility around the globe[J]. Reprod Biol Endocrinol, 2015, 13: 37. |
| [4] |
ANDERSON J E, FARR S L, JAMIESON D J, et al. Infertility services reported by men in the United States: national survey data[J]. Fertil Steril, 2009, 91(6): 2466-2470. |
| [5] |
NAINA K, KANT S A. Impact of environmental factors on human Semen quality and male fertility: a narrative review[J]. Environ Sci Eur, 2022, 34(1): 6. |
| [6] |
MARGIANA R, YOUSEFI H, AFRA A, et al. The effect of toxic air pollutants on fertility men and women, fetus and birth rate[J]. Rev Environ Health, 2022. |
| [7] |
MINHAS S, BETTOCCHI C, BOERI L, et al. European association of urology guidelines on male sexual and reproductive health: 2021 update on male infertility[J]. Eur Urol, 2021, 80(5): 603-620. |
| [8] |
CHENG J, TONG D, ZHANG Q, et al. Pathways of China's PM2.5 air quality 2015-2060 in the context of carbon neutrality[J]. Natl Sci Rev, 2021, 8(12): nwab078. |
| [9] |
WANG Q, LI T. Estimation of PM2.5-associated disease burden in China in 2020 and 2030 based on population and air quality scenarios[J]. Environ Epidemiol, 2019, 3: 426. |
| [10] |
YUE H B, HE C Y, HUANG Q X, et al. Stronger policy required to substantially reduce deaths from PM2.5 pollution in China[J]. Nat Commun, 2020, 11(1): 1462. |
| [11] |
国家质量监督检验检疫总局, 中国国家标准化管理委员会. 环境空气质量标准: GB 3095-2012[S]. 北京: 中国环境科学出版社, 2016. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Ambient air quality standard: GB 3095-2012[S]. Beijing: China Environmental Science Press, 2016. |
| [12] |
WANG F R, CHEN Q, ZHAN Y, et al. Acute effects of short-term exposure to ambient air pollution on reproductive hormones in young males of the MARHCS study in China[J]. Sci Total Environ, 2021, 774: 145691. |
| [13] |
KUMAR S, SHARMA A, THAKER R. Air pollutants and impairments of male reproductive health-an overview[J]. Rev Environ Health, 2021, 36(4): 565-575. |
| [14] |
POLICHETTI G, CAPONE D, POLICHETTI R, et al. Ambient air pollution and male reproduction: a review of literature and future purposes[J]. Toxicol Lett, 2012, 211: S80. |
| [15] |
WDOWIAK A, WDOWIAK E, BIEŃN A, et al. Air pollution and semen parameters in men seeking fertility treatment for the first time[J]. Int J Occup Med Environ Health, 2019, 32(3): 387-399. |
| [16] |
NASSAN F L, CHAVARRO J E, MÍNGUEZ-ALARCÓN L, et al. Residential distance to major roadways and Semen quality, sperm DNA integrity, chromosomal disomy, and serum reproductive hormones among men attending a fertility clinic[J]. Int J Hyg Environ Health, 2018, 221(5): 830-837. |
| [17] |
BOBB J F, VALERI L, CLAUS HENN B, et al. Bayesian kernel machine regression for estimating the health effects of multi-pollutant mixtures[J]. Biostatistics, 2015, 16(3): 493-508. |
| [18] |
陈卿, 周文正, 周妮娅, 等. 重庆市孕前生殖健康与出生结局队列: 设计简介与建设概况[J]. 中华流行病学杂志, 2022, 43(7): 1134-1139. CHEN Q, ZHOU W Z, ZHOU N Y, et al. Preconception reproductive health and birth outcome cohort in Chongqing: the cohort profile[J]. Clin J Epidemiol, 2022, 43(7): 1134-1139. |
| [19] |
ZHAN Y, LUO Y Z, DENG X F, et al. Satellite-based estimates of daily NO2 exposure in China using hybrid random forest and spatiotemporal kriging model[J]. Environ Sci Technol, 2018, 52(7): 4180-4189. |
| [20] |
ZHAN Y, LUO Y Z, DENG X F, et al. Spatiotemporal prediction of continuous daily PM2.5 concentrations across China using a spatially explicit machine learning algorithm[J]. Atmos Environ, 2017, 155: 129-139. |
| [21] |
ZHANG H Y, DI B F, LIU D R, et al. Spatiotemporal distributions of ambient SO2 across China based on satellite retrievals and ground observations: substantial decrease in human exposure during 2013-2016[J]. Environ Res, 2019, 179(Pt A): 108795. |
| [22] |
CHEN H G, LU Q, TU Z Z, et al. Identifying windows of susceptibility to essential elements for semen quality among 1428 healthy men screened as potential sperm donors[J]. Environ Int, 2021, 155: 106586. |
| [23] |
SOKOL R Z, KRAFT P, FOWLER I M, et al. Exposure to environmental ozone alters semen quality[J]. Environ Health Perspect, 2006, 114(3): 360-365. |
| [24] |
Practice Committee of the American Society for Reproductive Medicine. Definitions of infertility and recurrent pregnancy loss: a committee opinion[J]. Fertil Steril, 2020, 113(3): 533-535. |
| [25] |
IODICE S, PAGLIARDINI L, CANTONE L, et al. Association between short-term exposure to particulate matter air pollution and outcomes of assisted reproduction technology in Lombardy, Italy: a retrospective cohort study[J]. Reprod Toxicol, 2021, 105: 148-155. |
| [26] |
SLAMA R, BOTTAGISI S, SOLANSKY I, et al. Short-term impact of atmospheric pollution on fecundability[J]. Epidemiology, 2013, 24(6): 871-879. |
| [27] |
DEJMEK J, JELÍNEK R, SOLANSKY I, et al. Fecundability and parental exposure to ambient sulfur dioxide[J]. Environ Health Perspect, 2000, 108(7): 647-654. |
| [28] |
MENDOLA P, SUNDARAM R, LOUIS G M B, et al. Proximity to major roadways and prospectively-measured time-to-pregnancy and infertility[J]. Sci Total Environ, 2017, 576: 172-177. |
| [29] |
KIOUMOURTZOGLOU M A, ZANOBETTI A, SCHWARTZ J D, et al. The effect of primary organic particles on emergency hospital admissions among the elderly in 3 US cities[J]. Environ Health, 2013, 12(1): 68. |
| [30] |
HUANG G H, ZHANG Q, WU H S, et al. Sperm quality and ambient air pollution exposure: a retrospective, cohort study in a Southern Province of China[J]. Environ Res, 2020, 188: 109756. |
| [31] |
DE COSTER S, VAN LAREBEKE N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action[J]. J Environ Public Health, 2012, 2012: 713696. |
| [32] |
AGARWAL A, ALLAMANENI S S. Free radicals and male reproduction[J]. J Indian Med Assoc, 2011, 109(3): 184-187. |
| [33] |
AGARWAL A, SHARMA R K, NALLELLA K P, et al. Reactive oxygen species as an independent marker of male factor infertility[J]. Fertil Steril, 2006, 86(4): 878-885. |
| [34] |
AGARWAL A, VIRK G, ONG C, et al. Effect of oxidative stress on male reproduction[J]. World J Mens Health, 2014, 32(1): 1-17. |
| [35] |
JENG H A, YU L. Alteration of sperm quality and hormone levels by polycyclic aromatic hydrocarbons on airborne particulate particles[J]. J Environ Sci Health A, 2008, 43(7): 675-681. |
| [36] |
JENG H A, PAN C H, CHAO M R, et al. Sperm DNA oxidative damage and DNA adducts[J]. Mutat Res Toxicol Environ Mutagen, 2015, 794: 75-82. |
| [37] |
VECOLI C, MONTANO L, ANDREASSI M G. Environ-mental pollutants: genetic damage and epigenetic changes in male germ cells[J]. Environ Sci Pollut Res, 2016, 23(23): 23339-23348. |
| [38] |
ZHOU L X, SU X, LI B H, et al. PM2.5 exposure impairs sperm quality through testicular damage dependent on NALP3 inflammasome and miR-183/96/182 cluster targeting FOXO1 in mouse[J]. Ecotoxicol Environ Saf, 2019, 169: 551-563. |