2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院全军烧伤研究所,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Burns, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
脓肿分枝杆菌(Mycobacterium abscessus)是一种快速生长的分枝杆菌,于1953年被首次分离[1]。脓肿分枝杆菌已在土壤、水源、污水以及腐烂的植被中发现,它被认为是一种条件致病菌,可导致广泛的临床疾病,例如肺病、皮肤和软组织感染(包括皮肤下的脂肪和肌肉层、肌腱、软骨以及骨组织)[2-3]。脓肿分枝杆菌感染来源隐匿,可由非医源性原因[4]和医源性原因引起。医源性的脓肿分枝杆菌感染近年来被广泛报道,例如隆乳术和乳房重建术[5]、抽脂术[6]、心脏手术[7]和神经外科手术[8]等手术后的伤口脓肿分枝杆菌感染均已引起重视。非医源性的脓肿分枝杆菌感染多与外伤相关[9]。脓肿分枝杆菌感染率逐年上升,但其起病隐匿、耐药性高,对于较严重的感染,常需半年及以上的多种抗生素联合应用,应用期间药物不良反应较多,且病情易反复[3, 10-11]。目前,脓肿分枝杆菌感染的治疗给临床医师带来了较大挑战,新的治疗药物备受期待。
青蒿作为一种中药,自古以来就被用于治疗创伤、溃疡和感染,并且也被报道具有抗炎和免疫调节作用[12]。已有研究表明,青蒿提取物可与抗生素产生协同作用,使得部分抗生素对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度降低数倍[13];青蒿对脓肿分枝杆菌具有抑菌活性[14]。基于上述原因,我们认为青蒿对脓肿分枝杆菌感染发挥积极的治疗作用。本研究应用网络药理学和分子对接技术探究青蒿应用于脓肿分枝杆菌感染的作用机制,将其筛选得到的青蒿主要活性成分进行体外抑菌实验研究,并探讨青蒿提取物与常用抗脓肿分枝杆菌抗生素的体外协同作用。
中药通常含有多种有效成分,通过多靶点协同调节人体,但很难确定具体的作用机制。网络药理学是一种融合计算机科学和临床医学的新兴方法。同时,它构建并可视化了“多基因、多靶点、多通路”的相互作用网络,以评估药物的分子机制[15]。这种方法特别适用于研究中药等多组分药物[16]。分子对接是新药结构分子生物学和计算机辅助药物设计的途径[17]。
网络药理学发现的靶点被认为是受体,网络药理学与分子对接的融合有助于加速实验验证和靶点发现。借助网络药理学和分子对接,本研究探索青蒿治疗脓肿分枝杆菌感染的分子机制,为研究青蒿治疗脓肿分枝杆菌感染的分子基础奠定基础。同时,开展了对脓肿分枝杆菌的体外抑菌活性研究,以评估青蒿用于脓肿分枝杆菌感染的治疗潜力。
1 材料与方法本研究结合网络药理学、分子对接技术及其体外实验,探讨青蒿应用于脓肿分枝杆菌感染的作用机制,研究过程如图 1。
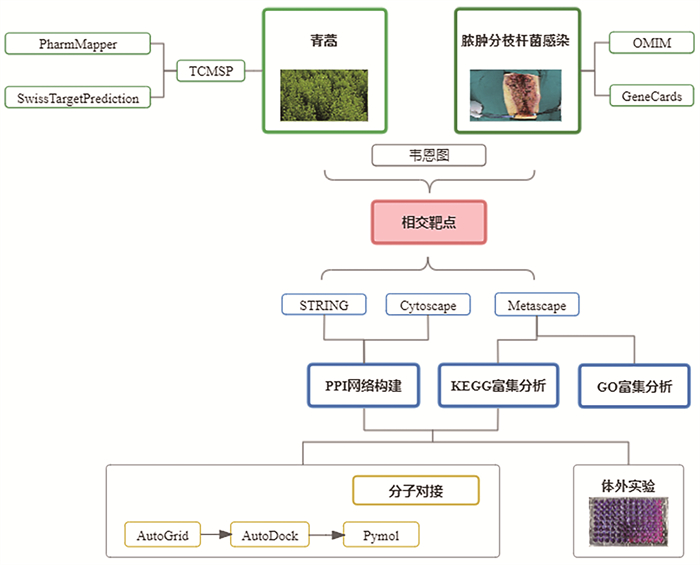
|
| 图 1 本研究的整体分析流程图 |
1.1 网络药理学分析 1.1.1 青蒿活性成分筛选
在中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)(http://tcmspw.com/tcmsp.php)[18]中的“Herb name”项下,以“青蒿”为检索词,获取青蒿已知的化学成分。根据口服生物利用度(OB)≥30%且类药性(DL)≥0.18进行活性成分初步筛选。
1.1.2 青蒿活性成分靶点预测活性成分分子结构获取:使用PubChem (https://pubchem.ncbi.nlm.nih.gov/)、TCMSP、OpenBabel-3.1.1[19]软件获得活性成分分子结构的mol2格式和标准smiles格式。
反向筛选以预测活性成分靶点:(1)药效团筛选方法:将活性成分分子结构的mol2格式上传到PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/)[20],将Pharmacophore Mapping设置为“Human Protein Targets Only (v2010, 2241)”,以预测活性成分蛋白质靶点,删除重复项后使用UniProtKB (https://www.uniprot.org/)将预测的蛋白质靶点转化为基因名。(2)形状筛选方法:将活性成分分子结构的标准smiles格式上传到SwissTargetPrediction (http://www.swisstargetprediction.ch/)[21],以预测活性成分靶点。
1.1.3 脓肿分枝杆菌感染靶点筛选因脓肿分枝杆菌感染多以伤口感染为主,设置“Mycobacterium abscessus infection”“Mycobacterium abscessus infections”及“Wound infection”“Wound infections”为关键词,挖掘GeneCards数据库(https://www.genecards.org/)[22]和OMIM数据库(http://omim.org/)[23]中脓肿分枝杆菌感染的相关靶点。合并所有靶点,为脓肿分枝杆菌感染相关靶点(以下简称疾病靶点)。
1.1.4 蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络构建将1.1.2和1.1.3获取的青蒿相关靶点和疾病相关靶点,使用微生信在线工具(http://www.bioinformatics.com.cn/)做韦恩图获取相交靶点。将交集靶点导入STRING 11.5数据库(https://string-db.org/)构建和分析蛋白质-蛋白质相互作用(PPI)网络,“Homo sapiens”为选择物种,最小互作阈值设定为“medium confidence(>0.4)”,其余为默认设置。将STRING 11.5导出.tsv格式文件使用Cytoscape 3.9.1[24]分析和可视化PPI网络,以可视化其潜在靶点之间的复杂关系。在网络中,节点代表靶点,它们之间的连接代表相互作用,分子度值反映了网络中分子与目标之间的连接数,较大的度值表明该组件更有可能成为青蒿治疗脓肿分枝杆菌感染的关键靶点。
1.1.5 生物功能富集及通路分析将潜在靶点导入Metascape数据库(https://metascape.org/gp/index.html#/main)[25],设置物种为“H.sapiens”,进行基因本体(gene ontology, GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路富集分析,并以P<0.01为条件进行筛选分析。使用微生信在线工具(http://www.bioinformatics.com.cn/) 将结果可视化。
在KEGG通路富集结果中,筛选出与青蒿治疗脓肿分枝杆菌感染相关的核心通路。使用Cytoscape 3.9.1分析和可视化活性成分-靶点-信号通路网络。
1.2 分子对接验证青蒿潜在活性成分与靶标的结合作用将1.1.4中PPI网络的重要靶点与1.1.5中所筛选出重要通路相关重要靶点相交,得到的靶点所对应的蛋白质作为分子对接的受体。使用Uniprot和PDB蛋白质数据筛选靶点对应目标蛋白(筛选标准包括来源物种、细化分辨率、发布日期、配体结构等),下载核心靶点的蛋白晶体结构,使用PyMol 3.10去除水及小分子配体后,在AutoDockTools 1.5.7[26]软件中打开,添加非极性氢,并将其定义为受体后,保存为.pdbqt文件。
将1.1.5中所筛选出核心通路相关主要潜在活性成分作为分子对接的配体。将活性成分的.mol2格式使用AutoDockTools 1.5.7打开,进行加氢,设置为配体(自动分配电荷),检测扭转键并设置扭转键后,保存为.pdbqt文件。
把准备好的受体和配体的.pdbqt文件导入AutoDockTools 1.5.7,设置对接盒子,导出为.gpf格式,运行AutoGrid4。设置对接参数及运算方法,使用局部搜索参数进行半柔性分子对接,运行AutoDock4。记录每次分子对接的最低结合能。综合目标蛋白分子对接的最低结合能和氢键形成情况,选择生成的最佳构象在PyMol 3.10中可视化。
1.3 体外抑菌实验 1.3.1 实验菌株脓肿分枝杆菌标准株(ATCC 19977)。
1.3.2 实验试剂根据网络药理学结果,共筛选出9种主要青蒿活性化合物。根据国内外治疗指南[3, 11],拟对克拉霉素、阿奇霉素、阿米卡星、亚胺培南、头孢西丁、替加环素共6种常用抗脓肿分枝杆菌抗生素进行体外联合药敏实验研究。
7H9、7H10肉汤培养基购自北京索莱宝科技有限公司(批号20231202);柽柳黄素(Tamarixetin,货号R112662-5 mg)、线蓟素(Cirsiliol,货号DT0132)、灰绿曲霉酰胺(Asperglaucide,货号R095563-10 mg)、Resazurin(货号HY-111391-1g)均购自重庆唯尚立德生物科技有限公司;青蒿提取物(Artemisia Annua L.)、异鼠李素(Isorhamnetin)、山奈酚(Kaempferol)、艾黄素(Artemetin)、木犀草素(Luteolin)、双氢青蒿素(Dihydroartemisinin)、槲皮素(Quercetin)、克拉霉素(Clarithromycin)、阿奇霉素(Azithromycin)、阿米卡星(Amikacin)、亚胺培南(Imipenem)、头孢西丁(Cefoxitin)、替加环素(Tigecycline)均购自Selleck公司(货号L2000)。
1.3.3 单独药物的最小抑菌浓度(MIC)测定接种环挑取复苏活化后的单个菌落于7H9肉汤培养基中,37 ℃摇床恒温振摇菌液生长至对数期(在600 nm波长下光密度值约为0.5时),取菌液与新鲜7H9肉汤培养基稀释制备菌悬液备用(约1×104 CFU/mL)。
采用96孔板微量稀释法测定药物的最小抑菌浓度。每排第1孔为抑菌对照,每排第12孔为生长对照,2~11孔为10级倍比稀释,抗生素药物浓度为0.20~100 μg/mL,青蒿提取物及青蒿活性成分药物浓度为0.78~400 μg/mL。每个浓度设置3个复孔。37 ℃培养3 d后,每孔加入10 μL 0.1%刃天青溶液并孵育24 h。颜色从蓝色变为粉红色表明细菌生长。酶标仪检测96孔板光密度值,按公式计算抑菌率。抑菌率≥90%对应的最低药物浓度为该药对脓肿分枝杆菌的MIC。
1.3.4 体外联合药敏实验青蒿提取物与抗脓肿分枝杆菌药物联合应用的体外药物敏感性实验采用棋盘式设计的微量液基稀释法。将青蒿提取物与一种抗脓肿分枝杆菌药物于96孔板上以二维棋盘的纵(A~H)横(2~11)两方向进行二倍比的稀释。最终96孔板上青蒿提取物浓度分别为100、50、25、12.5、6.25、3.13 μg/mL,抗生素浓度分别为25、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.10、0.05 μg/mL。37 ℃培养4 d后,酶标仪检测96孔板光密度值。实验重复3次。
药物相互作用包括协同作用、拮抗作用和无关作用,本研究采用部分抑制浓度指数(fractional inhibitory concentration index,FICI)对青蒿提取物与抗脓肿分枝杆菌药物之间的相互作用进行评价。FICI计算公式如下:FICI=A药联合MIC/A药单用MIC+B药联合MIC/B药单用MIC。评价标准:FICI指数越小两药协同作用越强,当FICI≤0.5时,两药的相互作用确定为协同作用;0.5 < FICI≤4时为无关作用;当FICI>4时两药产生拮抗作用。
1.3.5 不同药物对脓肿分枝杆菌活力影响的测量接种环挑取复苏活化后的单个菌落于7H9肉汤培养基中,将脓肿分枝杆菌培养至光密度值0.1(约1×107 CFU/mL)。每份菌液加入等体积柽柳黄素、艾黄素、双氢青蒿素、青蒿提取物,使其最终药物浓度分别为200、100、100、100 μg/mL,对照组加入等体积的DMSO溶液。5组菌液放置于37 ℃、200 r/min培养箱中培养7 d,分别于第0、1、2、4、7天使用连续稀释法计算细菌浓度。
2 结果 2.1 青蒿活性成分筛选在TCMSP中搜索“青蒿”后获得216个化合物,设定口服生物利用度(oral bioavailability, OB)≥30%和药物相似性(drug-like, DL)≥0.18,得到化合物22个(表 1)。
| Mol ID | 活性成分英语名称 | 活性成分汉语名称 | OB(%) | DL |
| MOL002235 | Eupatin | 泽兰黄醇素 | 50.8 | 0.41 |
| MOL000354 | Isorhamnetin | 异鼠李素 | 49.6 | 0.31 |
| MOL000359 | Sitosterol | 没食子酸 | 36.91 | 0.75 |
| MOL004083 | Tamarixetin | 柽柳黄素 | 32.86 | 0.31 |
| MOL004112 | Patuletin | 藤菊黄素 | 53.11 | 0.34 |
| MOL000422 | Kaempferol | 山奈酚 | 41.88 | 0.24 |
| MOL000449 | stigmasterol | 豆甾醇 | 43.83 | 0.76 |
| MOL004609 | areapillin | 茵陈黄酮 | 48.96 | 0.41 |
| MOL005229 | artemetin | 艾黄素 | 49.55 | 0.48 |
| MOL000006 | luteolin | 木犀草素 | 36.16 | 0.25 |
| MOL007274 | skrofulein | 蓟黄素 | 30.35 | 0.3 |
| MOL007389 | artemisitene | 青蒿烯 | 54.36 | 0.31 |
| MOL007400 | vicenin-2_qt | 维采宁-2 | 45.84 | 0.21 |
| MOL007401 | cirsiliol | 线蓟素 | 43.46 | 0.34 |
| MOL007404 | vitexin_qt | 牡荆苷 | 52.18 | 0.21 |
| MOL007412 | DMQT | 甲氧基万寿菊素 | 42.6 | 0.37 |
| MOL007415 | asperglaucide | 灰绿曲霉酰胺 | 58.02 | 0.52 |
| MOL007423 | 6, 8-di-c-glucosylapigenin_qt | 芹菜素-6, 8-C-二葡萄糖苷 | 59.85 | 0.21 |
| MOL007424 | artemisinin | 青蒿素 | 49.88 | 0.31 |
| MOL007425 | dihydroartemisinin | 双氢青蒿素 | 50.75 | 0.3 |
| MOL007426 | deoxyartemisinin | 脱氧青蒿素 | 54.47 | 0.26 |
| MOL000098 | quercetin | 槲皮素 | 46.43 | 0.28 |
2.2 青蒿活性成分靶点预测
PharmMapper预测出410个靶点,SwissTarget-Prediction预测出475个靶点,去除133个重复靶点后,752个靶点被确定为青蒿的潜在作用靶点(图 2),用于后续分析。
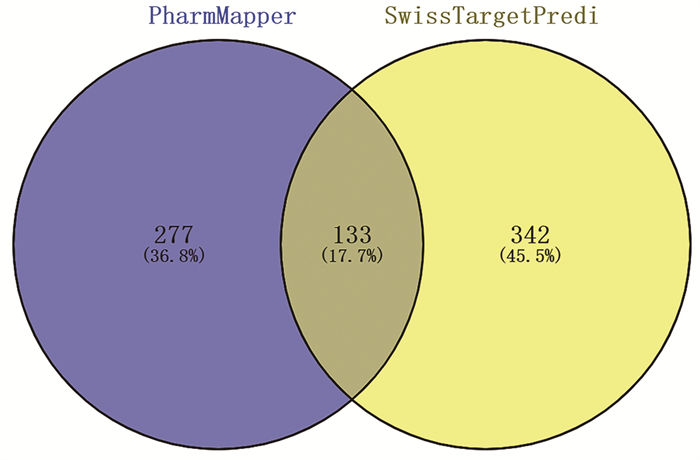
|
| 图 2 青蒿活性成分预测靶点 |
2.3 脓肿分枝杆菌感染靶点筛选
通过检索疾病关键词在GeneCards数据库和OMIM数据库中分别获得靶点195个和253个,合并两者靶点并删除重复值后得到疾病靶点318个。
2.4 蛋白质-蛋白质相互作用(PPI)网络构建青蒿相关靶点和脓肿分枝杆菌感染靶点取交集,获取两者共有靶点48个(图 3)。使用STRING 11.5数据库得到靶点相互作用关系并导入至Cytoscape 3.9.1软件。在Cytoscape 3.9.1软件中,使用Tool中的Analyze Network计算PPI网络的拓扑参数后,构建PPI网络(图 4),有48个点和331个边。节点的面积大小、颜色、透明度和标签字体大小用于描述目标的拓扑参数,度数较大的节点有较大的面积、偏红的颜色、偏低的透明度和较大的标签字体。取度值的组中值20,度值小于20的节点位于外圈。度值≥20的11个重要靶点位于内圈。
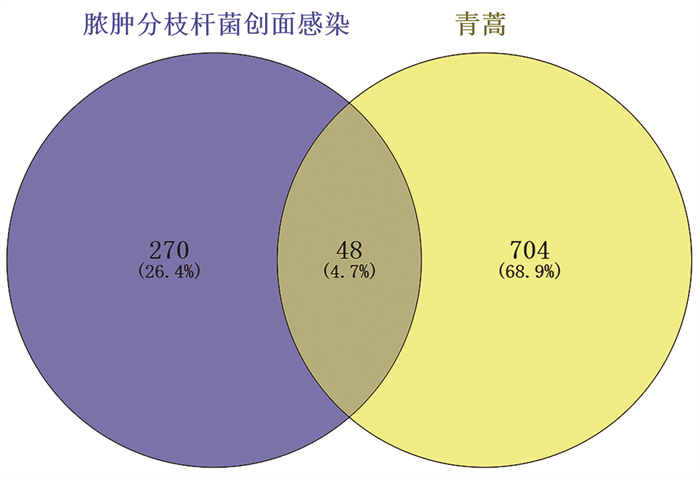
|
| 图 3 青蒿与脓肿分枝杆菌感染潜在靶点的Venn图 |
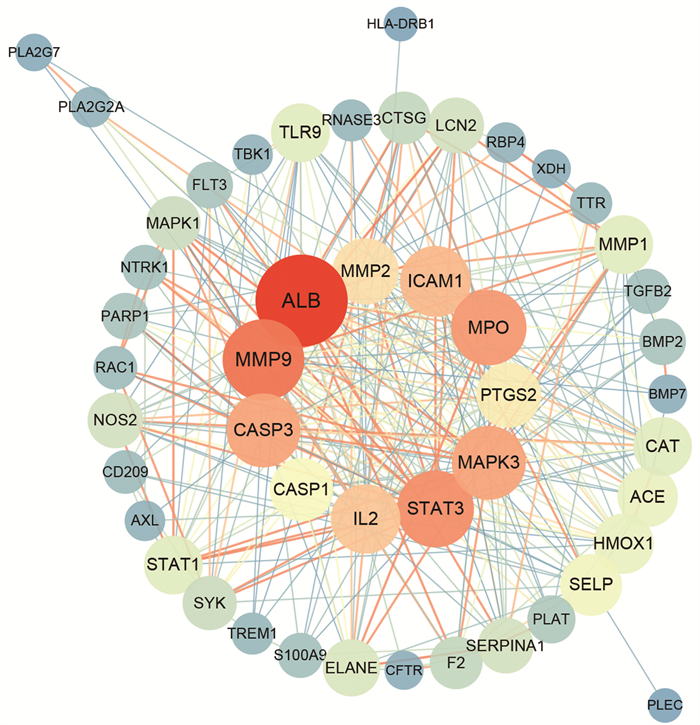
|
| 图 4 青蒿干预疾病潜在靶点的蛋白质-蛋白质相互作用(PPI)网络图 |
2.5 GO富集分析
GO功能富集分析包括生物过程(biological processes, BP)、细胞组成(cellular components, CC)、分子功能(molecular functions, MF)3个部分。根据GO富集分析结果(图 5),青蒿主要参与的生物过程(BP)包括对细菌的反应、炎症反应、蛋白质磷酸化的正调节、对细菌来源分子的反应、对细菌的防御反应等;在分子功能(MF)层面上,主要与分泌颗粒管腔、胞质囊泡腔、囊泡腔、细胞外基质、含胶原细胞外基质有关;在细胞组分(CC)方面,主要作用于丝氨酸型肽酶活性、丝氨酸水解酶活性、内肽酶活性、丝氨酸型内肽酶活性、肽酶活性等。
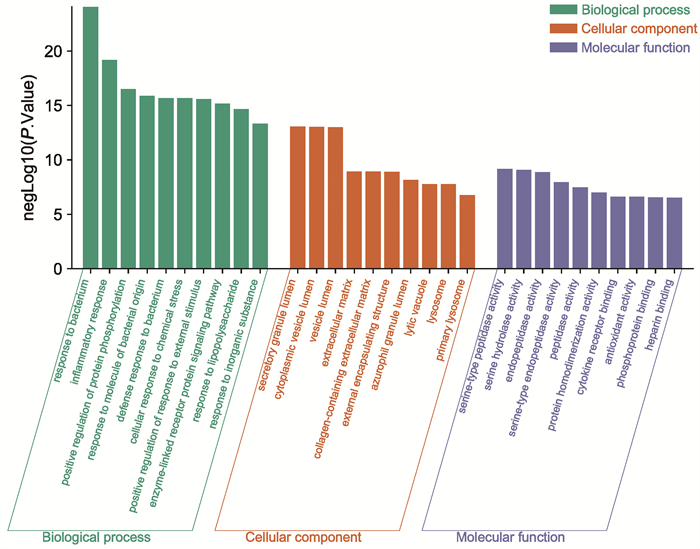
|
| 图 5 青蒿与脓肿分枝杆菌感染共有靶点GO富集分析 |
2.6 KEGG富集分析
为了全面阐明青蒿治疗脓肿分枝杆菌感染的众多机制,进行KEGG通路富集分析。Metascape数据平台对KEGG通路进行富集分析结果显示,有119条信号通路具有显著相关性(P < 0.01),主要富集于免疫和炎症相关信号通路、病原体感染相关途径和癌症相关通路等。使用微生信在线工具将P值最小的前30个结果可视化(图 6)。
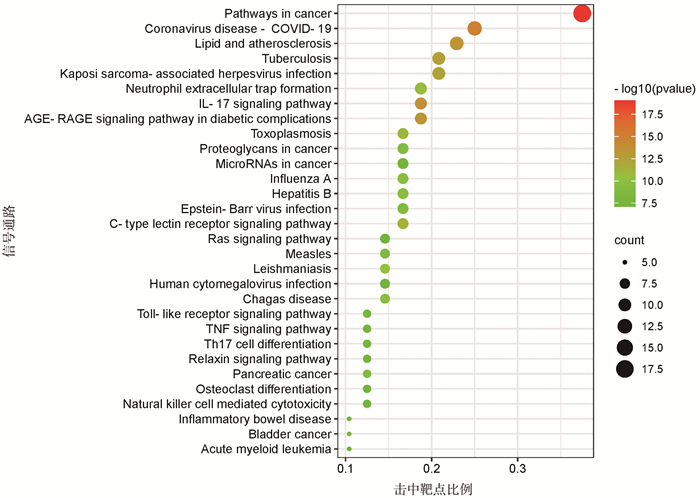
|
| 图 6 青蒿与脓肿分枝杆菌感染共有靶点KEGG通路富集分析:P值最小的前30条信号通路 |
通过检索信号通路相关信息共筛选出38条与青蒿治疗脓肿分枝杆菌感染相关的核心通路(图 7),主要涉及IL-17信号通路、C型凝集素受体信号通路、中性粒细胞胞外陷阱形成、Toll样受体信号通路、Th17细胞分化、肿瘤坏死因子信号通路、自然杀伤细胞介导的细胞毒性、Th1和Th2细胞分化、MAPK信号通路、TGF-β信号通路等。将核心通路使用Cytoscape3.9.1构建活性成分-靶点-信号通路网络(图 8),并进行分析。把成分-靶点-信号通路网络中度值大于20的靶点作为重要靶点,包括MAPK1、SYK、F2、MMP9、MAPK3、PARP1、CASP3、IL2、NOS2、CASP、ELANE、MMP2、RAC1、STAT1、FLT3。将网络中度值前9(度值为26~29)的化合物作为核心化合物,包括双氢青蒿素、灰绿曲霉酰胺、线蓟素、艾黄素、柽柳黄素、山奈酚、异鼠李素、槲皮素、木犀草素。
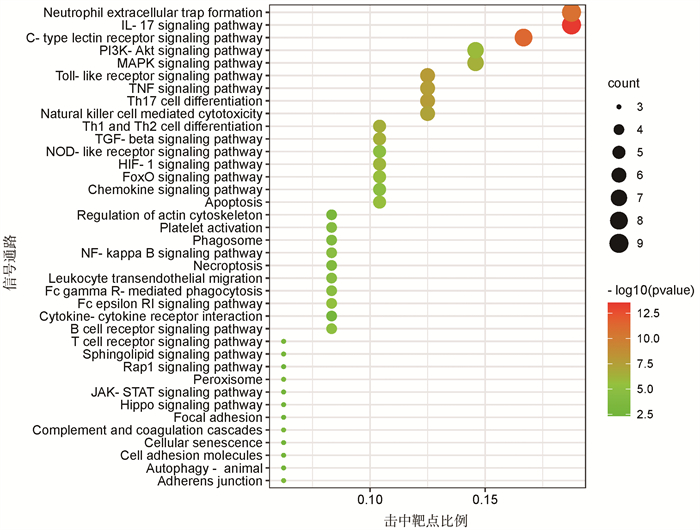
|
| 图 7 青蒿与脓肿分枝杆菌感染共有靶点KEGG通路富集分析:与疾病最相关的38条核心信号通路 |
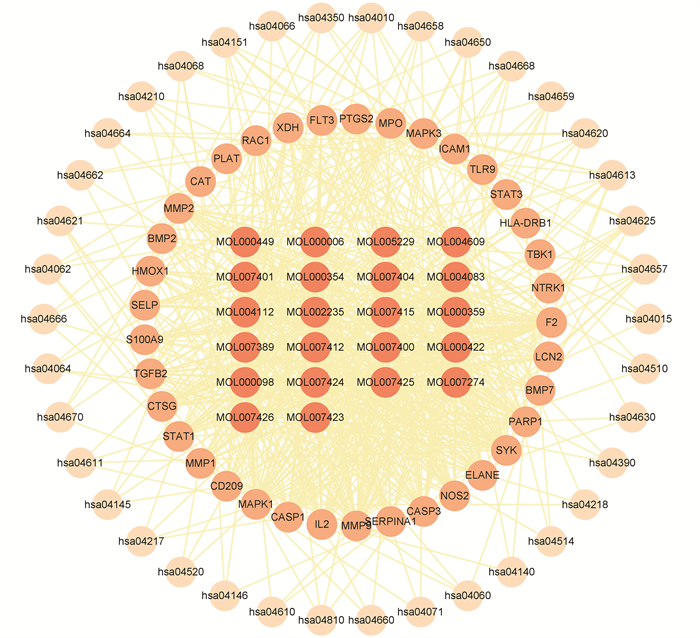
|
| 由内向外依次为活性成分、靶点、信号通路 图 8 活性成分-靶点-核心信号通路网络 |
2.7 分子对接
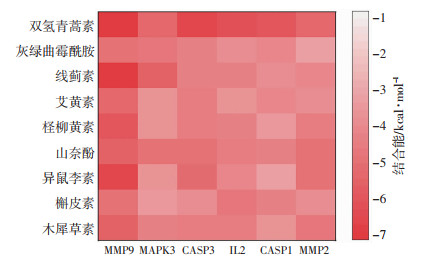
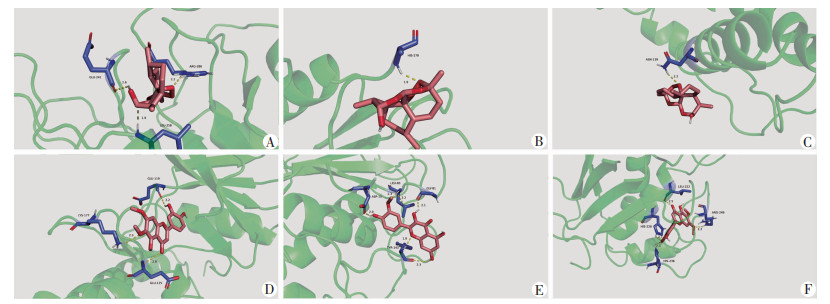
将2.4中PPI网络的重要靶点与2.6中所筛选出核心通路相关重要靶点相交,筛选得到6个核心靶点(表 2)。将其与2.6中筛选得到的核心化合物做分子对接。对接结果显示,青蒿的潜在活动成分与靶标蛋白的结合能均小于-3 kcal/mol-1(图 9),具有低结合能稳定性。青蒿和靶蛋白可以通过在很近距离与残基结合不同的氢键形成稳定的复合物(图 10)。表明青蒿与靶标蛋白MMP9、MAPK3、CASP3、IL2、CASP1、MMP2具有很强的亲和力。
| 序号 | 靶点名称 | 基因全称 | HGNC ID | Degree值 |
| 1 | MMP9 | matrix metallopeptidase 9 基质金属蛋白酶9 |
HGNC: 7176 | 32 |
| 2 | MAPK3 | mitogen-activated protein kinase 3 丝裂原活化蛋白激酶3 |
HGNC: 6877 | 27 |
| 3 | CASP3 | caspase 3 半胱天冬酶3 |
HGNC: 1504 | 27 |
| 4 | IL2 | interleukin 2 白细胞介素2 |
HGNC: 6001 | 24 |
| 5 | MMP2 | matrix metallopeptidase 2 基质金属蛋白酶2 |
HGNC: 7166 | 22 |
| 6 | CASP1 | caspase 1 半胱天冬酶1 |
HGNC: 1499 | 20 |
|
| 图 9 青蒿主要活性成分与6个核心靶标蛋白的分子对接结合能热图 |
|
| A:CASP1与双氢青蒿素;B:CASP3与双氢青蒿素;C:IL2与双氢青蒿素;D:MAPK3与线蓟素;E:MMP2与线蓟素;F:MMP9与线蓟素 图 10 青蒿活性成分与6个核心靶标蛋白分子对接 |
2.8 药物的最低抑菌浓度
微量稀释法测定MIC实验结果表明,针对脓肿分枝杆菌的体外抑菌活性,单独使用药物时,克拉霉素、阿奇霉素、阿米卡星、亚胺培南、头孢西丁、替加环素的MIC分别为0.39、0.39、6.25、12.50、25.00、0.20 μg/mL,柽柳黄素、艾黄素、双氢青蒿素、青蒿提取物的MIC分别为200、100、100、100 μg/mL。异鼠李素、山奈酚、木犀草素、线蓟素、灰绿曲霉酰胺、槲皮素在最大实验浓度400 μg/mL下,均未对脓肿分枝杆菌表现出体外抑菌活性。
2.9 青蒿提取物与抗脓肿分枝杆菌药物相互作用以棋盘式微量稀释法检测青蒿提取物与抗脓肿分枝杆菌药物合用在体外对脓肿分枝杆菌的相互作用。结果显示:青蒿提取物对阿米卡星、头孢西丁对体外抗脓肿分枝杆菌均显示出协同作用。合用青蒿提取物后,克拉霉素、阿奇霉素、阿米卡星、亚胺培南、头孢西丁的MIC值都较单独使用时下降,下降倍数为2~8倍(表 3)。
| 抗生素 | MIC单独 | MIC联合 | FICI | 相互作用 | |||
| 抗生素 | 青蒿提取物 | 抗生素 | 青蒿提取物 | ||||
| 0.20 | 100 | 1.51 | |||||
| 克拉霉素 | 0.39 | 100 | 0.20 | 100 | 1.51 | 无关 | |
| 0.39 | 100 | 2.00 | |||||
| 0.20 | 100 | 1.51 | |||||
| 阿奇霉素 | 0.39 | 100 | 0.20 | 50 | 1.01 | 无关 | |
| 0.20 | 50 | 1.01 | |||||
| 0.78 | 25 | 0.37 | |||||
| 阿米卡星 | 6.25 | 100 | 0.78 | 25 | 0.37 | 协同 | |
| 0.78 | 25 | 0.37 | |||||
| 6.25 | 50 | 1.00 | |||||
| 亚胺培南 | 12.50 | 100 | 3.13 | 50 | 0.75 | 无关 | |
| 3.13 | 50 | 0.75 | |||||
| 6.25 | 12.5 | 0.38 | |||||
| 头孢西丁 | 25.00 | 100 | 6.25 | 12.5 | 0.38 | 协同 | |
| 6.25 | 25 | 0.50 | |||||
| 0.20 | 100 | 2.00 | |||||
| 替加环素 | 0.20 | 100 | 0.20 | 100 | 2.00 | 无关 | |
| 0.20 | 100 | 2.00 | |||||
2.10 不同药物对脓肿分枝杆菌活力的影响
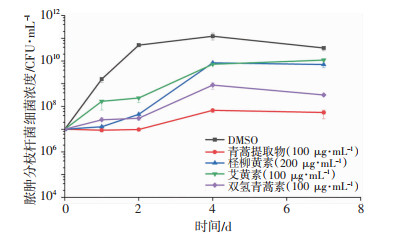
在体外情况下,柽柳黄素、艾黄素、双氢青蒿素、青蒿提取物均表现出对脓肿分枝杆菌活力的抑制(图 11)。其中,青蒿提取物及双氢青蒿素对脓肿分枝杆菌的生长抑制效果优于怪柳黄素及艾黄素。
|
| 图 11 不同药物下对脓肿分枝杆菌活力影响 |
3 讨论
脓肿分枝杆菌是最具耐药性的分枝杆菌物种之一,对多数种类的抗生素具有内在耐药性[27]。脓肿分枝杆菌也是伤口感染中分离出的最常见的快速生长分枝杆菌[28]。青蒿已被证实具有抗炎、抗菌和抗微生物的特性,并曾被添加在纳米纤维伤口敷料中研究其对伤口愈合的促进作用[29]。目前仅有一项研究表明青蒿提取物在体外对脓肿分枝杆菌具有抑菌活性[14],但该研究并未对发挥脓肿分枝杆菌抑菌作用的青蒿活性成分进行筛选。并且,目前尚无研究阐述青蒿应用于脓肿分枝杆菌感染的相关分子机制,也没有对青蒿提取物与常用抗脓肿分枝杆菌抗生素的相互作用的研究。使用网络药理学和分子对接来识别和筛选生物靶标、生物过程、功能通路和预测分子结合能力是研究中药应用于疾病的系统且高效的方法。本研究在此基础上,还将网络药理学和分子对接筛选得到的青蒿主要活性成分进行脓肿分枝杆菌抑菌作用的体外研究,并探讨了青蒿提取物与常用抗脓肿分枝杆菌抗生素的相互作用。
3.1 青蒿作用于脓肿分枝杆菌感染的核心靶点、主要信号通路在查找并筛选青蒿活性成分作用靶点和脓肿分枝杆菌感染靶点后,本研究采用韦恩图得到了潜在的治疗靶点,并利用这些潜在的治疗靶点构建了PPI网络,联合筛选出的KEGG富集核心信号通路所对应靶点,最终确定了MMP9、MAPK3、CASP3、IL2、CASP1、MMP2共6个核心靶点。基质金属蛋白酶(MMP)是钙依赖性的含锌内肽酶,属于金属蛋白酶[30]。对慢性创面分子水平的详细分析表明,MMP2和MMP9的过度表达会降解皮肤的细胞外基质,创面上的微生物病原体生长引发的长期慢性炎症会刺激其产生增加[31-33]。通过在伤口区域应用抗菌剂或抗炎剂来抑制/减少MMP2和MMP9的过度表达可能是慢性伤口愈合的重要策略,但目前尚未开发出有效的治疗剂。脓肿分枝杆菌皮肤软组织感染由于病程较长,常伴随着慢性创面的形成,本研究表明青蒿或可作用于MMP2和MMP9对其发挥积极的治疗作用,弥补针对该靶点治疗策略的空白。靶蛋白CASP1、CASP3、MAPK3在炎症反应、细胞免疫以及细胞因子释放等过程中发挥关键调控作用[34-37]。脓肿分枝杆菌感染可刺激白介素2 (IL2)的产生[38]。IL2通过与淋巴细胞表达的IL2受体结合来介导其作用,IL2的主要来源是活化的CD4+ T细胞和活化的CD8+ T细胞[39]。青蒿或可以通过作用于IL2调控免疫应答,在治疗脓肿分枝杆菌感染中发挥积极作用。本研究运用网络药理学的方法,发现青蒿多个成分可能通过上述多个靶点协同发挥抗脓肿分枝杆菌感染效果,具有良好的开发前景。
基于活性成分-靶点-信号通路网络,本研究富集并筛选出了青蒿作用于脓肿分枝杆菌感染的主要信号通路。中性粒细胞胞外陷阱形成是重要的细胞外脓肿分枝杆菌清除机制,无论是光滑型还是粗糙型脓肿分枝杆菌,都对该清除机制敏感[40]。脓肿分枝杆菌诱导的肉芽肿形成被认为严格地依赖于TNF信号传导[41-42],MAPK信号通路和Toll样受体信号通路也被认为是脓肿分枝杆菌期间肉芽肿形成的关键信号通路[43-45]。研究表明,相较大肠杆菌、链球菌和粪肠球菌,脓肿分枝杆菌可特异性地诱导大量IL-17的产生[46]。故我们推测青蒿可通过作用于上述通路和其他炎症、感染相关核心通路作用于脓肿分枝杆菌感染的治疗。
3.2 青蒿作用于脓肿分枝杆菌感染的核心化合物网络药理学分析筛选出了青蒿作用于脓肿分枝杆菌感染的核心化合物,通过分子对接发现双氢青蒿素、线蓟素与核心靶点具有优异的结合能,并能与蛋白质残基以氢键结合形成稳定的化合物。双氢青蒿素是所有青蒿素化合物(青蒿素、青蒿琥酯、蒿甲醚等)的活性代谢物,本身也可作为药物使用,是青蒿素的半合成衍生物,已被广泛应用于治疗疟疾[47]。在药物研发中,利用老药探索新适应证将大大缩短药物研发时间。同时,已有研究表明双氢青蒿素可通过多种分子机制促进免疫功能、诱导细胞自噬和内质网应激[48],这些分子机制都可能在脓肿分枝杆菌感染的治疗中发挥积极作用。
3.3 青蒿既具有独立抑菌能力,也可与部分抗脓肿分枝杆菌抗生素产生协同作用通过体外实验,本研究发现青蒿提取物及部分青蒿活性化合物具有独立的抑菌能力,提示其或可作为脓肿分枝杆菌抑菌药物被应用,其应用形式或可选择口服、伤口冲洗、软膏、含有青蒿的伤口敷料等多种方法的单独应用或联合应用。联合用药实验观察到青蒿提取物与部分常用抗脓肿分枝杆菌抗生素具有协同作用,可降低抗生素的MIC值。联合用药或可降低抗生素的药物剂量、减低其毒副作用,缩短疗程,增强杀菌效果,防止耐药发生。因此,我们认为青蒿具有治疗脓肿分枝杆菌感染的潜力,值得进一步研究。
本研究系统地探讨了青蒿的潜在机制,发现其可能通过多靶点和多途径作用于脓肿分枝杆菌感染,主要与炎症反应和免疫调节有关;进一步采用体外实验验证了部分青蒿主要活性物质对脓肿分枝杆菌的体外抑菌作用,以及青蒿提取物可降低抗生素的MIC值,提示青蒿可发展为一种很有前景的抗脓肿分枝杆菌感染药物。同时,本研究结果表明青蒿活性成分双氢青蒿素在分子对接和体外脓肿分枝杆菌抑菌实验中均表现优秀,可作为有潜力的化合物进行进一步研究。然而,网络药理学和分子对接在其预测方面存在局限性,后续课题组还会进一步了解青蒿抑制脓肿分枝杆菌感染的机制。
| [1] |
MOORE M, FRERICHS J B. An unusual acid-fast infection of the knee with subcutaneous, abscess-like lesions of the gluteal region; report of a case with a study of the organism, Mycobacterium abscessus, n. sp[J]. J Invest Dermatol, 1953, 20(2): 133-169. |
| [2] |
BROWN-ELLIOTT B A, JR WALLACE R J. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria[J]. Clin Microbiol Rev, 2002, 15(4): 716-746. |
| [3] |
GRIFFITH D E, AKSAMIT T, BROWN-ELLIOTT B A, et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. 17675453[J]. Am J Respir Crit Care Med, 2007, 175(4): 367-416. |
| [4] |
PETRINI B, FARNEBO F, HEDBLAD M A, et al. Concomitant late soft tissue infections by Cladophialophora bantiana and Mycobacterium abscessus following tsunami injuries[J]. Med Mycol, 2006, 44(2): 189-192. |
| [5] |
AL-HALABI B, VIEZEL-MATHIEU A, SHULMAN Z, et al. Breast implant mycobacterial infections: an epidemiologic review and outcome analysis[J]. Plast Reconstr Surg, 2018, 142(5): 639e-652e. |
| [6] |
HILDY M, BROWN-ELLIOTT B A, DOUGLAS M, et al. An outbreak of Mycobacterium chelonae infection following liposuction[J]. Clin Infect Dis, 2002, 34(11): 1500-1507. |
| [7] |
BAKER A W, MAZIARZ E K, LEWIS S S, et al. Invasive Mycobacterium abscessus complex infection after cardiac surgery: epidemiology, management, and clinical outcomes[J]. Clin Infect Dis, 2021, 72(7): 1232-1240. |
| [8] |
TALATI N J, ROUPHAEL N, KUPPALLI K, et al. Spectrum of CNS disease caused by rapidly growing mycobacteria[J]. Lancet Infect Dis, 2008, 8(6): 390-398. |
| [9] |
DICKISON P, HOWARD V, O'KANE G, et al. Mycobacterium abscessus infection following penetrations through wetsuits[J]. Australas J Dermatol, 2019, 60(1): 57-59. |
| [10] |
JOHANSEN M D, HERRMANN J L, KREMER L. Non-tuberculous mycobacteria and the rise of Mycobacterium abscessus[J]. Nat Rev Microbiol, 2020, 18(7): 392-407. |
| [11] |
中华医学会结核病学分会. 非结核分枝杆菌病诊断与治疗指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(11): 918-946. Tuberculosis Branch of Chinese Medical Association. Guidelines for diagnosis and treatment of nontuberculous mycobacterial diseases (2020 edition)[J]. Chin J Tuberc Respir Dis, 2020, 43(11): 918-946. |
| [12] |
FENG X C, CAO S J, QIU F, et al. Traditional application and modern pharmacological research of Artemisia annua L[J]. Pharmacol Ther, 2020, 216: 107650. |
| [13] |
ROLTA R, SHARMA A, SOURIRAJAN A, et al. Combination between antibacterial and antifungal antibiotics with phytocompounds of Artemisia annua L: a strategy to control drug resistance pathogens[J]. J Ethnopharmacol, 2021, 266: 113420. |
| [14] |
MARTINI M C, ZHANG T B, WILLIAMS J T, et al. Artemisia annua and Artemisia afra extracts exhibit strong bactericidal activity against Mycobacterium tuberculosis[J]. J Ethnopharmacol, 2020, 262: 113191. |
| [15] |
YUAN H D, MA Q Q, CUI H Y, et al. How can synergism of traditional medicines benefit from network pharmacology?[J]. Molecules, 2017, 22(7): 1135. |
| [16] |
BOEZIO B, AUDOUZE K, DUCROT P, et al. Network-based approaches in pharmacology[J]. Mol Inform, 2017, 36(10): 1700048. |
| [17] |
SAIKIA S, BORDOLOI M. Molecular docking: challenges, advances and its use in drug discovery perspective[J]. Curr Drug Targets, 2019, 20(5): 501-521. |
| [18] |
RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. |
| [19] |
O'BOYLE N M, BANCK M, JAMES C A, et al. Open Babel: an open chemical toolbox[J]. J Cheminform, 2011, 3: 33. |
| [20] |
WANG X, SHEN Y H, WANG S W, et al. PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Res, 2017, 45(W1): W356-W360. |
| [21] |
DAINA A, MICHIELIN O, ZOETE V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res, 2019, 47(W1): W357-W364. |
| [22] |
PAOLACCI S, PRECONE V, ACQUAVIVA F, et al. Genetics of lipedema: new perspectives on genetic research and molecular diagnoses[J]. Eur Rev Med Pharmacol Sci, 2019, 23(13): 5581-5594. |
| [23] |
AMBERGER J S, BOCCHINI C A, SCHIETTECATTE F, et al. OMIM.org: Online Mendelian Inheritance in Man (OMIMⓇ), an online catalog of human genes and genetic disorders[J]. Nucleic Acids Res, 2015, 43(Database issue): D789-D798. |
| [24] |
SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13(11): 2498-2504. |
| [25] |
ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1): 1523. |
| [26] |
HUEY R, MORRIS G M, OLSON A J, et al. A semiempirical free energy force field with charge-based desolvation[J]. J Comput Chem, 2007, 28(6): 1145-1152. |
| [27] |
BOUDEHEN Y M, KREMER L. Mycobacterium abscessus[J]. Trends Microbiol, 2021, 29(10): 951-952. |
| [28] |
KUMAR C, SHRIVASTAVA K, SINGH A, et al. Skin and soft-tissue infections due to rapidly growing mycobacteria: an overview[J]. Int J Mycobacteriology, 2021, 10(3): 293-300. |
| [29] |
MIRBEHBAHANI F S, HEJAZI F, NAJMODDIN N, et al. Artemisia annua L. as a promising medicinal plant for powerful wound healing applications[J]. Prog Biomater, 2020, 9(3): 139-151. |
| [30] |
VERMA R P, HANSCH C. Matrix metalloproteinases (MMPs): chemical-biological functions and (Q)SARs[J]. Bioorg Med Chem, 2007, 15(6): 2223-2268. |
| [31] |
MAJTAN J, BOHOVA J, GARCIA-VILLALBA R, et al. Fir honeydew honey flavonoids inhibit TNF-α-induced MMP-9 expression in human keratinocytes: a new action of honey in wound healing[J]. Arch Dermatol Res, 2013, 305(7): 619-627. |
| [32] |
EMING S, SMOLA H, HARTMANN B, et al. The inhibition of matrix metalloproteinase activity in chronic wounds by a polyacrylate superabsorber[J]. Biomaterials, 2008, 29(19): 2932-2940. |
| [33] |
WIEGAND C, SCHÖNFELDER U, ABEL M, et al. Protease and pro-inflammatory cytokine concentrations are elevated in chronic compared to acute wounds and can be modulated by collagen type I in vitro[J]. Arch Dermatol Res, 2010, 302(6): 419-428. |
| [34] |
THORNBERRY N A, BULL H G, CALAYCAY J R, et al. A novel heterodimeric cysteine protease is required for interleukin-1 beta processing in monocytes[J]. Nature, 1992, 356(6372): 768-774. |
| [35] |
BALL D P, TAABAZUING C Y, GRISWOLD A R, et al. Caspase-1 interdomain linker cleavage is required for pyroptosis[J]. Life Sci Alliance, 2020, 3(3): e202000664. |
| [36] |
NICHOLSON D W, ALI A, THORNBERRY N A, et al. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis[J]. Nature, 1995, 376(6535): 37-43. |
| [37] |
YUE J C, LÓPEZ J M. Understanding MAPK signaling pathways in apoptosis[J]. Int J Mol Sci, 2020, 21(7): 2346. |
| [38] |
MAUCH R, JENSEN P Ø, QVIST T, et al. Adaptive immune response to Mycobacterium abscessus complex (MABSC) in cystic fibrosis and the implications of cross-reactivity[J]. Front Cell Infect Microbiol, 2022, 12: 858398. |
| [39] |
LIAO W, LIN J X, LEONARD W J. IL-2 family cytokines: new insights into the complex roles of IL-2 as a broad regulator of T helper cell differentiation[J]. Curr Opin Immunol, 2011, 23(5): 598-604. |
| [40] |
MALCOLM K C, CACERES S M, POHL K, et al. Neutrophil killing of Mycobacterium abscessus by intra-and extracellular mechanisms[J]. PLoS One, 2018, 13(4): e0196120. |
| [41] |
AUDREY B, MAI N C, IMAN H, et al. Mycobacterium abscessus-induced granuloma formation is strictly dependent on TNF signaling and neutrophil trafficking[J]. PLoS Pathog, 2016, 12(11): e1005986. |
| [42] |
KAM J Y, HORTLE E, KROGMAN E, et al. Rough and smooth variants of Mycobacterium abscessus are differentially controlled by host immunity during chronic infection of adult zebrafish[J]. Nat Commun, 2022, 13(1): 952. |
| [43] |
BONAY M, ROUX A L, FLOQUET J, et al. Caspase-independent apoptosis in infected macrophages triggered by sulforaphane via Nrf2/p38 signaling pathways[J]. Cell Death Discov, 2015, 1: 15022. |
| [44] |
AULICINO A, DINAN A M, MIRANDA-CASOLUENGO A A, et al. High-throughput transcriptomics reveals common and strain-specific responses of human macrophages to infection with Mycobacterium abscessus Smooth and Rough variants[J]. BMC Genomics, 2015, 16: 1046. |
| [45] |
LEE S J, SHIN S J, LEE S J, et al. Mycobacterium abscessus MAB2560 induces maturation of dendritic cells via Toll-like receptor 4 and drives Th1 immune response[J]. BMB Rep, 2014, 47(9): 512-517. |
| [46] |
JÖNSSON B, RIDELL M, WOLD A E. Non-tuberculous mycobacteria and their surface lipids efficiently induced IL-17 production in human T cells[J]. Microbes Infect, 2012, 14(13): 1186-1195. |
| [47] |
ASSEFA D, YISMAW G, MAKONNEN E. Comparative effect of dihydroartemisinin-piperaquine and artemether-lumefantrine on gametocyte clearance and haemoglobin recovery in children with uncomplicated Plasmodium falciparum malaria in Africa: a systematic review and meta-analysis of randomized control trials[J]. Int J Infect Dis IJID Off Publ Int Soc Infect Dis, 2021, 113: 136-147. |
| [48] |
DAI X S, ZHANG X Y, CHEN W, et al. Dihydroartemisinin: a potential natural anticancer drug[J]. Int J Biol Sci, 2021, 17(2): 603-622. |





