自体干细胞移植是将患者自身干细胞作为移植细胞来源,通过各种不同的途径移植入体内,恢复或重建损伤组织器官的结构和功能的一种组织细胞工程技术,具有安全有效,创伤小,无免疫排斥反应,移植并发症少的优势。然而,目前的自体骨髓间充质干细胞,脂肪干细胞均是采用侵入性的有创方法获取,需要患者保持整体良好状态,并提前进行细胞动员,随后采集、净化、保存,过程繁琐且细胞来源有限[1-2]。尿源性干细胞(urine-derived stem cells, USCs)是从尿液中提取出来的一种干细胞,来源方便,取材无创,易于分离培养,具有很强增殖功能以及某些间充质干细胞特征,课题组前期也经多次实验证明USCs表达间充质干细胞表面标志物CD24, CD29, CD73, CD90及CD105,同时表达周细胞标志物CD146, 而不表达造血干细胞表面标志物CD31, CD34, CD45[3-4]。多次传代扩增后仍具有自我更新及多向分化潜能,前期结果也提示其具有成脂肪、成骨、成软骨分化能力[5]。目前USCs已被认作种子细胞,应用于膀胱和尿道重建、神经再生和伤口愈合等再生医学的各个方面[6-8]。
本课题组前期研究发现:USCs经外周静脉移植入四氯化碳诱导的急性或慢性肝损伤小鼠模型,可在一定程度上修复损伤的肝脏组织结构及功能[9]。外周静脉移植损伤小,但仅有少量的细胞进入肝组织,USCs移植前经低氧预处理48小时,可显著提高USCs在损伤部位的定植[10],但具体的机制尚不明确。
细胞骨架由微丝、微管及中间丝构成,除维持细胞的大小和形状外,在细胞增殖、迁移、融合,甚至转录调控等过程中也发挥着重要作用[11-13]。细胞极性由细胞骨架体系介导,参与多种生物学过程并且对于细胞正常功能的维持也有重要意义。因此,本研究将进一步探讨低氧对体外USCs细胞迁移及细胞融合的影响及该过程中细胞骨架结构和极性的改变,为低氧预处理改善USCs体内移植的肝损伤修复作用提供重要的理论和实验依据。
1 材料及方法 1.1 材料人尿源性干细胞培养基:由角质形成细胞无血清培养基、DMEM培养基、Hamm’s F12培养基及胎牛血清按体积比500:337:113:50组成,含牛垂体提取物20 μg/mL、2.5 μg/mL胰岛素、2.5 μg/mL转铁蛋白、0.24 μg/mL氢化可的松、136 ng/mL 3, 3′, 5-三碘-L-甲状腺原氨酸、5 ng/mL表皮生长因子、1 μmol/mL谷氨酰胺、90 nmol/mL腺嘌呤、100 U/mL氨苄青霉素及1 mg/mL链霉素[14],均购自Gibco公司。小鼠胚胎肝祖细胞[15]由本实验室保存(hepatic progenitor cells,HP14-19),人肝肿瘤细胞HepG2购自ATCC,transwell小室购自Corning公司,PKH-67及PKH26荧光细胞标记试剂盒购自Sigma公司,鬼笔环肽-Alexa Fluor 488购自上海碧云天公司,细胞极性蛋白引物由华大基因公司合成,Simply P总RNA提取试剂盒购自北京博迈斯科技发展有限公司,PrimeScriptTM RT reagent Kit试剂盒购自日本Takara公司,SYBR Green qPCR Master Mix购自MCE公司,抗体RhoA购自杭州华安生物技术有限公司,Cdc42及Rac1购自成都正能生物技术有限责任公司,山羊抗鼠/兔二抗购自北京中杉金桥生物技术有限公司。
1.2 尿源性干细胞的分离培养分别收集3个正常健康男性的200 mL无菌清洁中段尿液,加入40 mL尿源性干细胞培养基,分装至50 mL离心管,1 500 rpm,离心5 min;弃上清,保留细胞沉淀,每个离心管加入2~4 mL尿源性干细胞培养基,吹打成细胞悬液,补充尿源性干细胞培养基至24 mL,轻轻吹匀后种入24孔细胞培养板,1 mL/孔,置于5% CO2的细胞培养箱,37 ℃培养;约10~14 d,出现细胞克隆,将24孔板中所有细胞传代至60mm培养板,此后每3~5 d,待细胞生长至90%以上,按1 ∶3~1 ∶4比例传代。选取P3-P5代USCs用于后续实验。
1.3 细胞迁移实验划痕实验:USCs细胞接种于6孔板中,接种密度约为30%,细胞融合率达100%时,用枪头进行划痕,PBS洗3次去除漂浮细胞,加入新鲜培养基,放置于常氧(20%)和低氧(3%)的37 ℃培养箱,于0、24、36、48 h在同一部位镜下观察划痕愈合情况并拍照。测量划痕宽度,计算划痕愈合率(%)=(0 h划痕宽度-实验时间划痕宽度)/0 h划痕宽度×100%。
Transwell迁移实验:USCs胰酶消化后重悬于无血清培养基,将含约5×104个细胞的100 μL细胞悬液加入transwell上室,下室加入500 μL含5% FBS的培养基,每组3个复孔,分别放置于常氧(20%)和低氧(3%)的37 ℃培养箱中培养48 h,吸弃孔内培养基,PBS洗3次,每孔加4%多聚甲醛500 μL,室温固定30 min,PBS洗3次后每孔加500 μL结晶紫染液,室温孵育30 min,取出小室,用湿棉签轻拭去上室细胞,PBS洗3次后镜下拍照。
1.4 细胞融合实验PKH67染料孵育小鼠肝祖细胞HP14-19、人肝癌细胞HepG2,PKH26染料孵育USCs 24 h进行细胞膜荧光标记。将HP14-19或HepG2细胞与等量的USCs(约2×105)混合接种于共聚焦培养皿,分别放置于常氧(20%)和低氧(3%)的37 ℃培养箱中培养48 h,激光共聚焦显微镜观察并拍照。
将HP14-19或HepG2细胞与等量的USCs(约1×106)混合接种于100 mm培养皿,分别放置于常氧(20%)和低氧(3%)的37 ℃培养箱中培养48 h,胰酶消化细胞,流式细胞术上机检测细胞膜荧光表达情况。
1.5 免疫荧光实验将细胞以适宜密度接种于24孔爬片中,分别置于常氧(20%)及低氧(3%)的培养箱中(37 ℃,5%CO2)培养48 h后取出,4%多聚甲醛溶液固定30 min,0.3% Triton-100对细胞膜通透打孔10 min,5% BSA室温封闭1 h,一抗(RhoA、Cdc42、Rac1, 1 ∶200)4 ℃孵育过夜,二抗FITC标记山羊抗兔IgG(1 ∶200)室温避光孵育1 h,DAPI避光染色5 min, PBS洗涤后加抗荧光淬灭剂封片保存,激光共聚焦显微镜下拍照观察。
1.6 实时荧光定量PCR实验(real-time quantitative PCR, qRT-PCR)将适量USCs(约1×106)接种于100 mm培养皿,分别放置于常氧(20%)和低氧(3%)的37 ℃培养箱中培养48 h,使用Simply P总RNA提取试剂盒提取细胞总RNA,测定浓度,随后按照PrimeScriptTM RT reagent Kit使用说明将RNA反转录为cDNA。使用SYBR Green PCR试剂及相关引物进行实时荧光定量PCR实验扩增基因片段。反应条件:95 ℃预变性(30 s)→95 ℃(5 s)→60 ℃(31 s),共循环40次;95 ℃(15 s)→60 ℃(1 min)→95 ℃(15 s)退火延伸一步完成。以GAPDH为内参,结果采用2-ΔΔCt表示,引物序列见表 1。
| Gene | Primer sequence (5’-3’) |
| RhoA | F:CAAGGACCAGTTCCCAGAGG R:CGCAGGCGGTCATAATCTTC |
| Cdc42 | F:TACGACCGCTGAGTTATCCACA R:GTCCCAACAAGCAAGAAAGG |
| Rac1 | F:CTTAGGGATGATAAAGACACGA R:GCCGAGCACTCCAGGTAT |
| GAPDH | F:GCACCGTCAAGGCTGAGAAC R:TGGTGAAGACGCCAGTGGA |
1.7 流式细胞分析技术
USCs细胞接种于100 mm培养皿中,接种密度约为30%,将细胞分别放置于常氧(20%)和低氧(3%)的37 ℃培养箱培养48 h。胰酶消化,离心,收集细胞沉淀于流式管内,4%多聚甲醛溶液固定20 min,离心收集细胞沉淀,0.3%Triton-100通透细胞膜5min,5% BSA封闭30 min, 室温孵育一抗(RhoA、Cdc42、Rac1, 1 ∶200) 45 min,PBS洗涤后加入二抗FITC标记山羊抗兔/鼠IgG(1 ∶200),室温避光孵育30 min,加入200 μL PBS上机检测。
1.8 透射电子显微镜(transmission electron microscope, TEM) 观察USCs超微结构按上述步骤对细胞进行常氧及低氧培养,将不少于5×106细胞量的USCs胰酶消化,收集细胞悬液于1.5 mL EP管中,1000 rpm离心10 min,弃上清,向EP管中加入1 mL戊二醛溶液固定24 h,4 ℃储存,送往重庆医科大学电镜室进行后续操作及检测。
1.9 Alexa Fluor 488-鬼笔环肽标记丝状肌动蛋白细胞以适宜密度接种于24孔爬片中,分别置于常氧(20%)及低氧(3%)的培养箱中(37 ℃,5%CO2)培养48h后取出,4%多聚醛溶液固定15 min,0.3% Triton-100对细胞膜室温通透打孔10 min,PBS洗3次,每次5 min, Alexa Fluor 488标记的鬼笔环肽工作液(1 ∶100)滴加于片子上,室温避光孵育40 min后PBS洗3次,共聚焦激光扫描显微观察结果。
PKH26染料孵育HP14-19细胞24 h进行细胞膜荧光标记。将HP14-19细胞与等量的USCs(约2×105)混合接种于共聚焦培养皿,分别放置于常氧(20%)和低氧(3%)的37 ℃培养箱中培养48 h,Alexa Fluor 488-鬼笔环肽染色步骤同上所述。
1.10 统计学分析采用SPSS统计软件进行数据分析,结果用x±s表示,两组间差异的分析采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 低氧促进USCs体外迁移USCs具有较强的体外迁移能力。低氧处理48 h后,细胞伤痕愈合率显著提高,24 h愈合率达(42.40%± 3.65%),48 h基本愈合(88.33%±4.96%),显著高于常氧组(65.93±9.48%),差异具有统计学意义(图 1A,P < 0.05)。Transwell显示相似结果,48 h的细胞迁移数量在低氧组显著多于常氧组(图 1B,P < 0.05),提示低氧处理能促进USCs的体外平行及垂直迁移能力。
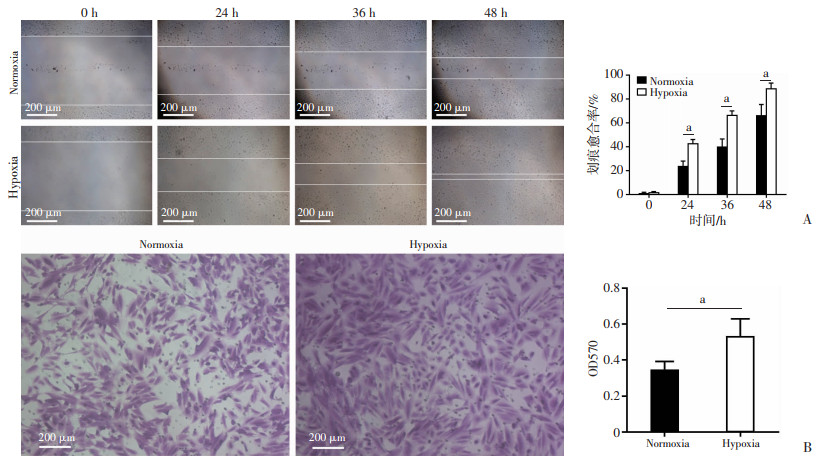
|
|
a: P < 0.05 A:划痕实验检测USCs水平迁移能力及统计分析;B:Transwell实验检测USCs垂直迁移能力及统计分析 图 1 低氧处理促进USCs体外迁移 |
2.2 低氧处理促进USCs与肝细胞的体外融合
PKH67标记的小鼠肝祖细胞14-19或人肝肿瘤细胞HepG2和PKH26标记的USCs共培养48 h后,部分细胞的胞膜上同时呈现绿色及红色荧光,提示USCs与肝细胞之间发生了细胞融合,且低氧组中双荧光的细胞数量高于常氧组(图 2A)。流式细胞术结果显示低氧组中双荧光的细胞比例显著高于常氧组,差异具有统计学意义(图 2B,P < 0.05)。低氧处理可促进细胞的体外融合。
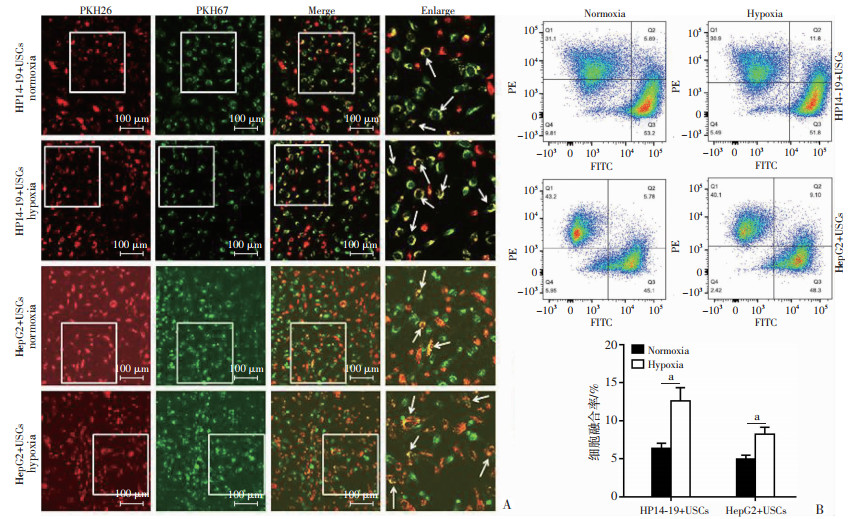
|
|
a: P < 0.05 A:共聚焦显微镜下观察USCs与肝细胞体外融合,PKH67(绿色荧光)标记HP14-19或HepG2, PKH26(红色荧光)标记USCs,箭头指示融合细胞;B:流式细胞术检测USCs与肝细胞体外融合 图 2 低氧处理促进USCs与肝细胞的体外融合 |
2.3 低氧处理诱导USCs骨架结构改变
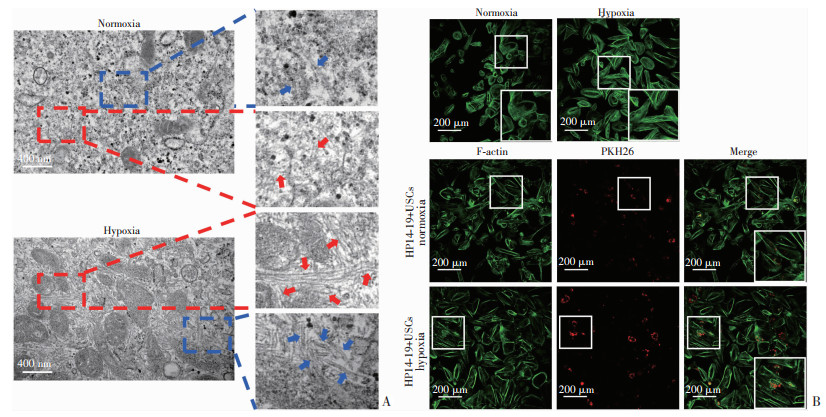
微丝又称肌动蛋白丝,由肌动蛋白(F-actin)分子螺旋状聚合而成,微管是微管蛋白的管状聚合物,微丝微管与中间丝共同构成真核细胞的细胞骨架。透射电镜扫描可见,常氧组USCs微丝微管排列紊乱且松散,而低氧处理后,微丝微管排列有序且规则。
Alexa Fluor 488-鬼笔环肽对F-actin进行荧光标记后发现,大量绿色荧光标记的微丝结构,常氧组微丝排列呈细丝拉网状,较紊乱且松散, 而低氧处理后可见大量平行排列的微丝结构,层次清晰。HP14-19细胞与USCs融合实验显示类似结果,PKH26标记的HP14-19呈红色,低氧组USCs微丝结构较常氧组更加整齐有序。
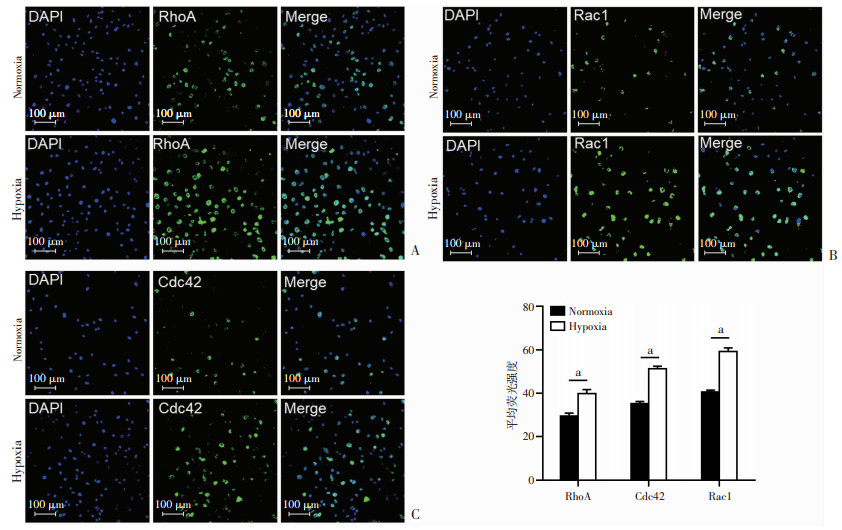
2.4 低氧处理上调USCs极性蛋白及mRNA表达水平常氧及低氧组USCs均可表达RhoA、Cdc42及Rac1三种极性相关蛋白分子,平均荧光强分析可见USCs低氧组较常氧组蛋白表达量增加,差异具有统计学意义(图 4A~C,P < 0.001)。
|
| A:红色箭头指示微丝结构,蓝色箭头指示微管结构;B:绿色荧光示F-actin,红色荧光示PKH26标记的HP14-19细胞 图 3 透射电镜(TEM)及鬼笔环肽荧光染色观察USCs骨架结构的改变 |
|
| A~C: 激光共聚焦显微镜观察RhoA、Cdc42及Rac1免疫荧光染色及其统计分析;a: P < 0.001 图 4 免疫荧光检测RhoA、Cdc42及Rac1蛋白表达水平 |
流式细胞术结果显示低氧组中RhoA、Cdc42及Rac1表达比例显著高于常氧组,差异具有统计学意义(图 5A、B,P < 0.000 1)。提示低氧处理可上调极性蛋白的表达。
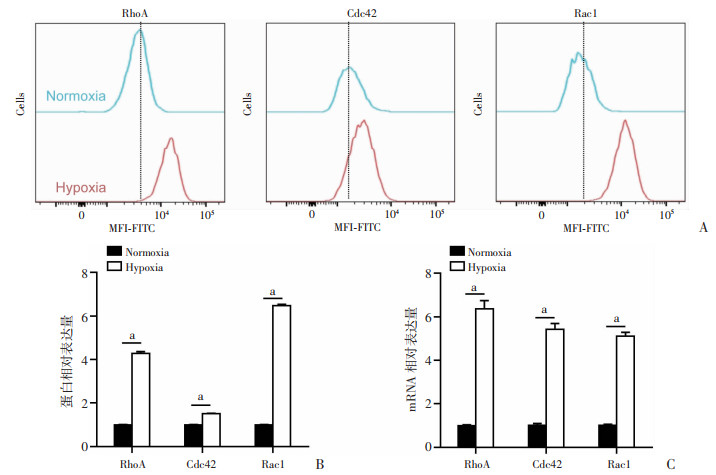
|
| A和B流式细胞术检测结果的代表性图片(A)和统计分析结果(B),P < 0.000 1;C:实时荧光定量PCR统计分析P < 0.000 1 图 5 流式细胞术及实时荧光定量PCR实验分析Cdc42,Rac1及RhoA蛋白及mRNA表达水平 |
实时荧光定量PCR结果显示,低氧组RhoA、Cdc42及Rac1的mRNA表达水平较常氧组明显升高(图 5C,P < 0.000 1)。提示低氧处理可上调细胞极性相关mRNA表达水平。
3 讨论目前关于间充质干细胞归巢定义最为全面的一种为非机制性的,即在目标组织的脉管系统里停滞,随后跨越血管内皮进行迁移的过程[16]。研究证明机体内或者外源性MSCs具有向损伤部位优势分布的特质,故USCs的迁移归巢能力对体内发挥治疗作用具有重要意义[17]。此外,研究发现细胞融合常发生于损伤、炎症及感染组织内,可促进组织修复及免疫防御[18-19]。课题组前期研究发现,低氧处理可促进USCs在损伤部位的定植,提高肝脏损伤的修复效率。因此,本研究在体外实验中进一步探讨了低氧处理USCs对细胞迁移及融合能力的影响。结果表明,低氧处理可提高USCs的迁移能力且促进USCs与肝细胞的融合。细胞融合与迁移能力的增强可能是低氧促进USCs在体内发挥治疗作用的重要原因。
各种细胞移植前预处理,包括基因改造,药物治疗,细胞共培养等方法[20-22],用于提高移植细胞在体内的迁移能力和存活能力。此外,低氧培养也被认为是改善体内外MSC功能的关键策略。研究表明,低氧处理可增强MSC的增殖能力,促进细胞归巢和血管生成从而提高了MSC的移植效率[23-25]。这可能是由于生理状态下,生物体组织的氧含量为1%-7%,而在体外培养过程中,细胞暴露于正常氧含量(20% O2)培养箱中,其移植后在体内的适应性可能会受到影响。据报道,在20%氧含量环境中培养骨髓间充质干细胞可能会引起细胞应激并损害遗传稳定性[26]。我们先前研究表明,低氧可明显增强USCs的增殖、迁移和集落形成能力但不影响其分化能力,低氧处理还可有效增强USCs对肝损伤的恢复作用[10]。
前期研究中,我们将Hoechst及PKH26标记的USCs移植入小鼠体内后进行示踪,发现USCs定植于受损肝组织,并表达成熟肝细胞标志物ALB,体外实验进一步证实USCs能与肝祖细胞和肝癌细胞发生融合,提示USCs可能通过与肝细胞融合发挥修复损伤肝细胞的作用。本部分中,我们也证实了低氧预处理后,USCs的迁移能力增高,与肝细胞的融合率也显著增加。
细胞迁移的关键在于肌动蛋白骨架的重塑。迁移过程中,改变细胞骨架,建立细胞前后极性。微管及分子马达向细胞前部传递信号分子及mRNA,同时肌动蛋白细胞骨架的动态重构产生前向推力,微管在迁移细胞后部调控肌动球蛋白的收缩也促使细胞发生移位[27]。本研究中,低氧处理USCs后细胞骨架发生改变,电镜观察微丝微管排列更加规则致密。低氧可能通过USCs细胞骨架结构的重塑促进细胞迁移归巢至损伤部位,从而提高其修复能力。
细胞极性是不同种类细胞发挥特异性功能的基础,其特征在于细胞器、黏附分子及细胞骨架等在胞内的不对称分布[28]。研究证明,低氧可以通过上皮间质转化促进肿瘤细胞的融合与迁移[29],EMT过程中上皮细胞失去顶-底极性,获得间质表型相关的前-后极性从而促进肿瘤细胞的增殖与侵袭,细胞极性状态的改变是EMT的关键特征。本研究中,低氧处理USCs后极性相关蛋白RhoA、CDC42及Rac1的蛋白及mRNA表达水平均明显提高。Rho GTPases是一个信号蛋白家族,其家族核心成员为Rho、Cdc42及Rac[30],Rho GTPases可通过细胞骨架蛋白的调节和粘着斑的重排,在细胞的极化和迁移过程中发挥中心枢纽的作用[31]。低氧通过EMT增强肿瘤细胞的侵袭迁移能力,而在USCs中低氧上调细胞极性,重塑细胞骨架,促进USCs的体外迁移及融合。
细胞骨架及极性受到多种信号通路的调控,如Rho、PCP、PKA通路等[32-34],其中Rho/ROCK参与肿瘤、高血压、糖尿病肾病、白血病等多种疾病的发生,因而受到广泛关注。Rho存在与GDP结合失活而与GTP结合激活两种生物学状态。ROCK又称Rho激酶,具有调节细胞收缩、迁移、黏附和增殖等多种功能[35]。在Rho/ROCK信号通路中,Rho与GTP结合会激活下游ROCK,进而磷酸化下游底物,从而调节微管动力,诱导肌动蛋白-肌球蛋白收缩,重塑细胞骨架[36]。本研究中发现RhoA、Cdc42及Rac1蛋白及转录水平在USCs低氧处理后可明显上调,3种分子作为Rho GTP酶的主要成员,其可能受到Rho/ROCK信号通路的调控,在接下来的研究中我们将重点关注低氧对于Rho/ROCK信号通路的调节,明确低氧处理对细胞迁移及融合作用的机制,为低氧处理改善USCs移植修复肝损伤作用提供重要的理论和实验依据。
综上所述,在体外实验中低氧培养可促进USCs的迁移能力及与肝细胞融合能力,细胞骨架结构在此过程中发生重塑,微丝重新分布成应力纤维并平行排列,微管呈条索状排列其中,同时低氧组极性相关RhoA、Cdc42及Rac1分子在基因及蛋白水平表达量较常氧组均有所增加。因此,细胞骨架结构及极性的改变可能是低氧促进USCs迁移与融合能力的原因之一,为低氧处理改善USCs体内移植的肝损伤修复作用提供重要的基本理论基础。
| [1] |
NICOLAS C T, WANG Y J, NYBERG S. Cell therapy in chronic liver disease[J]. Curr Opin Gastroenterol, 2016, 32: 189-194. |
| [2] |
BALIGAR P, KOCHAT V, ARINDKAR S K, et al. Bone marrow stem cell therapy partially ameliorates pathological consequences in livers of mice expressing mutant human α1-antitrypsin[J]. Hepatology, 2017, 65(4): 1319-1335. |
| [3] |
HU C Q, HE Y, FANG S Y, et al. Erratum: Urine-derived stem cells accelerate the recovery of injured mouse hepatic tissue[J]. Am J Transl Res, 2021, 13(3): 1904. |
| [4] |
胡超群, 方姝煜, 龚梦嘉, 等. 人尿源性干细胞及人脐带间充质干细胞的生物学性状比较[J]. 中国细胞生物学学报, 2020, 42(2): 239-247. HU C Q, FANG S Y, GONG M J, et al. Comparison of biological characteristics of human urine-derived stem cells and human umbilical cord mesenchymal stem cells[J]. Chin J Cell Biol, 2020, 42(2): 239-247. |
| [5] |
ZHANG N N, ZHAO L, LIU D J, et al. Characterization of urine-derived stem cells from patients with end-stage liver diseases and application to induced acute and chronic liver injury of nude mice model[J]. Stem Cells Dev, 2021, 30(22): 1126-1138. |
| [6] |
BHARADWAJ S, LIU G H, SHI Y G, et al. Multipotential differentiation of human urine-derived stem cells: potential for therapeutic applications in urology[J]. Stem Cells, 2013, 31(9): 1840-1856. |
| [7] |
SHI T Y, CHEUNG M. Urine-derived induced pluripotent/neural stem cells for modeling neurological diseases[J]. Cell Biosci, 2021, 11(1): 85. |
| [8] |
ZHANG X R, HUANG Y Z, GAO H W, et al. Hypoxic preconditioning of human urine-derived stem cell-laden small intestinal submucosa enhances wound healing potential[J]. Stem Cell Res Ther, 2020, 11(1): 150. |
| [9] |
胡超群, 方姝煜, 龚梦嘉, 等. 尿源性干细胞移植修复慢性肝损伤裸鼠肝脏功能[J]. 中国细胞生物学学报, 2019, 41(5): 851-858. HU C Q, FANG S Y, GONG M J, et al. Urine-derived stem cells repair liver function in nude mice with chronic liver injury[J]. Chin J Cell Biol, 2019, 41(5): 851-858. |
| [10] |
HU C Q, HE Y, LIU D J, et al. Hypoxia preconditioning promotes the proliferation and migration of human urine-derived stem cells in chronically injured liver of mice by upregulating CXCR4[J]. Stem Cells Dev, 2021, 30(10): 526-536. |
| [11] |
NETWORK T C. Comprehensive genomic characterization defines human glioblastoma genes and core pathways[J]. Nature, 2008, 455(7216): 1061-1068. |
| [12] |
LUCAS L, COOPER T A. Insights into cell-specific functions of microtubules in skeletal muscle development and homeostasis[J]. Int J Mol Sci, 2023, 24(3): 2903. |
| [13] |
YANG Y H, ZHANG Y, LI W J, et al. Spectraplakin induces positive feedback between fusogens and the actin cytoskeleton to promote cell-cell fusion[J]. Dev Cell, 2017, 41(1): 107-120.e4. |
| [14] |
BI Y, HE Y, HUANG J Y, et al. Functional characteristics of reversibly immortalized hepatic progenitor cells derived from mouse embryonic liver[J]. Cell Physiol Biochem, 2014, 34(4): 1318-1338. |
| [15] |
毕杨, 张楠楠, 何昀, 等. 一种用于肝细胞移植的自体干细胞制剂及其制备方法[P]. 中国发明专利: ZL202011537970.7. Bi Y, Zhang N, et al An autologous stem cell for hepatocyte transplantation strategy and its preparation method [P]. Chinese Invention Patent: ZL202011537970.7. |
| [16] |
SZYDLAK R. Mesenchymal stem cells' homing and cardiac tissue repair[J]. Acta Biochim Pol, 2019, 66(4): 483-489. |
| [17] |
SAEEDI M, NEZHAD M S, MEHRANFAR F, et al. Biological aspects and clinical applications of mesenchymal stem cells: key features You need to be aware of[J]. Curr Pharm Biotechnol, 2021, 22(2): 200-215. |
| [18] |
BERNDT B, ZÄANKER K S, DITTMAR T. Cell fusion is a potent inducer of aneuploidy and drug resistance in tumor cell/ normal cell hybrids[J]. Crit Rev Oncog, 2013, 18(1-2): 97-113. |
| [19] |
DITTMAR T, HASS R. Extracellular events involved in cancer cell-cell fusion[J]. Int J Mol Sci, 2022, 23(24): 16071. |
| [20] |
MOYA A, LAROCHETTE N, PAQUET J, et al. Quiescence preconditioned human multipotent stromal cells adopt a metabolic profile favorable for enhanced survival under ischemia[J]. Stem Cells, 2017, 35(1): 181-196. |
| [21] |
SAPAROV A, OGAY V, NURGOZHIN T, et al. Preconditioning of human mesenchymal stem cells to enhance their regulation of the immune response[J]. Stem Cells Int, 2016, 2016: 3924858. |
| [22] |
HOCH A I, LEACH J K. Concise review: optimizing expansion of bone marrow mesenchymal stem/stromal cells for clinical applications[J]. Stem Cells Transl Med, 2014, 3(5): 643-652. |
| [23] |
LEE J, YOON Y, LEE S. Hypoxic preconditioning promotes the bioactivities of mesenchymal stem cells via the HIF-1α-GRP78-Akt axis[J]. Int J Mol Sci, 2017, 18(6): 1320. |
| [24] |
DOS SANTOS F, ANDRADE P Z, BOURA J S, et al. Ex vivo expansion of human mesenchymal stem cells: a more effective cell proliferation kinetics and metabolism under hypoxia[J]. J Cell Physiol, 2010, 223(1): 27-35. |
| [25] |
SANTOS NASCIMENTO D, MOSQUEIRA D, SOUSA L M, et al. Human umbilical cord tissue-derived mesenchymal stromal cells attenuate remodeling after myocardial infarction by proangiogenic, antiapoptotic, and endogenous cell-activation mechanisms[J]. Stem Cell Res Ther, 2014, 5(1): 5. |
| [26] |
FUJISAWA K, HARA K, TAKAMI T, et al. Evaluation of the effects of ascorbic acid on metabolism of human mesenchymal stem cells[J]. Stem Cell Res Ther, 2018, 9(1): 93. |
| [27] |
MASNER M, LUJEA N, BISBAL M, et al. Linoleic and oleic acids enhance cell migration by altering the dynamics of microtubules and the remodeling of the actin cytoskeleton at the leading edge[J]. Sci Rep, 2021, 11(1): 1-17. |
| [28] |
HIKITA T, MIRZAPOURSHAFIYI F, BARBACENA P, et al. PAR-3 controls endothelial planar polarity and vascular inflammation under laminar flow[J]. EMBO Rep, 2018, 19(9): e45253. |
| [29] |
HUANG C M, YAN T L, XU Z, et al. Hypoxia enhances fusion of oral squamous carcinoma cells and epithelial cells partly via the epithelial-mesenchymal transition of epithelial cells[J]. Biomed Res Int, 2018, 2018: 5015203. |
| [30] |
AL-KOUSSA H, ATAT O E, JAAFAR L, et al. The role of rho GTPases in motility and invasion of glioblastoma cells[J]. Anal Cell Pathol (Amst), 2020, 2020: 9274016. |
| [31] |
EBNET K, GERKE V. Rho and rab family small GTPases in the regulation of membrane polarity in epithelial cells[J]. Front Cell Dev Biol, 2022, 10: 948013. |
| [32] |
ASLAN J E, MCCARTY O J T. Rho GTPases in platelet function[J]. J Thromb Haemost, 2013, 11(1): 35-46. |
| [33] |
DAVEY C F, MOENS C B. Planar cell polarity in moving cells: think globally, act locally[J]. Development, 2017, 144(2): 187-200. |
| [34] |
CAPUANA L, BOSTRÖM A, ETIENNE-MANNEVILLE S. Multicellular scale front-to-rear polarity in collective migration[J]. Curr Opin Cell Biol, 2020, 62: 114-122. |
| [35] |
SHI J J, WEI L. Rho kinases in embryonic development and stem cell research[J]. Arch Immunol Ther Exp, 2022, 70(1): 1-22. |
| [36] |
KANN A P, HUNG M, WANG W, et al. An injury-responsive Rac-to-Rho GTPase switch drives activation of muscle stem cells through rapid cytoskeletal remodeling[J]. Cell Stem Cell, 2022, 29(6): 933-947. |




