2. 252000 山东聊城,聊城市人民医院麻醉科
2. Department of Anesthesiology, Liaocheng People's Hospital, Liaocheng, Shandong Province, 252000, China
术后肌松残余(postoperative residual curarization,PORC)[1]是由于肌松药在麻醉恢复期不能完全代谢而残留体内,致使神经肌肉功能不能完全恢复而产生的不良反应。PORC可导致呼吸抑制和低氧血症,可增加术后肺部并发症[2],并且明显延长患者术后恢复时间以及降低医疗资源的利用率[3]。深度肌松能够改善腹腔内的手术操作空间,减少腹腔脏器和膈肌运动,提供较好的手术条件,确保手术能安全顺利进行,并降低术中出血及术后疼痛的发生率[4-6]。因此,腹腔镜下胃肠手术多采用深度肌松技术。由于腹腔镜手术时间短,神经肌肉阻滞程度深,所以患者的PORC发生率比其他手术方式更高[7-8]。
为了降低PORC的发生率,可以尽早停用肌松药,也可以适时使用肌松拮抗药[9]。舒更葡糖钠作用迅速,能够减少PORC,并能够降低术后肺部并发症[10]和术后30天再入院率[3]。然而,随着其临床应用的增加,出现了过敏反应和凝血功能障碍等不良反应,而且其价格昂贵,增加了患者经济负担。这些都限制了其在临床上的应用[11-14]。新斯的明是一种抗胆碱酯酶药物。由于其价格低廉,对所有的非去极化肌松药都有拮抗效应,也是常用的非去极化肌松药拮抗药[15-17]。
研究表明[9],使用新斯的明后仍有20%~40%的患者发生PORC,并且新斯的明的用法和用量能否满足腹腔镜下胃肠手术后的残余肌松拮抗要求目前尚不清楚。本研究选择腹腔镜下胃肠择期手术患者,通过探讨新斯的明的不同用药时机和剂量对其拮抗全麻恢复期罗库溴铵残余肌松作用的效果的影响,实现新斯的明的最佳拮抗效能,从而降低PORC的发生,保证患者围术期安全。
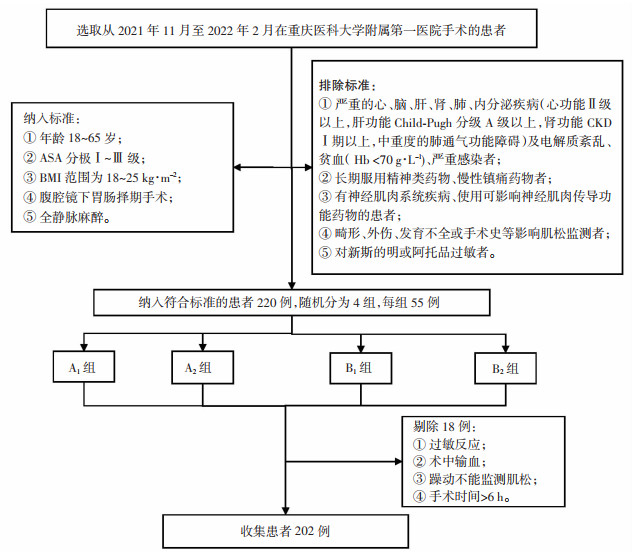
1 资料和方法 1.1 研究对象本研究采用平行随机对照研究设计方案,通过重庆医科大学附属第一医院伦理委员会批准[2018年科伦药审(20186501)号],在中国临床试验注册中心审批注册(注册号:ChiCTR2100052809)。所有受试患者签署了知情同意书。选取从2021年11月至2022年2月于重庆医科大学附属第一医院经腹腔镜下行胃肠择期手术的患者,共220例。按手术实施的先后顺序编号,采用随机数字表法分为4组(n=55):4个成串刺激计数(train-of-four count,TOFC)=1时,给予0.04 mg/kg新斯的明+0.02 mg/kg阿托品组(A1组);TOFC=1时,给予0.06 mg/kg新斯的明+0.03 mg/kg阿托品组(A2组);4个成串刺激比值(train-of-four ratio,TOFr)=0.4时,给予0.04 mg/kg新斯的明+0.02 mg/kg阿托品组(B1组);TOFr=0.4时,给予0.06 mg/kg新斯的明+0.03 mg/kg阿托品组(B2组)。
纳入标准:①年龄18~65岁;②ASA分级Ⅰ~Ⅲ级;③体质指数(body mass index,BMI)范围为18~25 kg·m-2;④腹腔镜下胃肠择期手术;⑤全静脉麻醉。排除标准:①严重的心、脑、肝、肾、肺、内分泌疾病(心功能Ⅱ级以上,肝功能Child-Pugh分级A级以上,肾功能CKDⅠ期以上,中重度的肺通气功能障碍)及电解质紊乱、贫血(Hb <70 g·L-1)、严重感染者;②长期服用精神类药物、慢性镇痛药物者;③有神经肌肉系统疾病、使用可影响神经肌肉传导功能药物的患者;④畸形、外伤、发育不全或手术史等影响肌松监测者;⑤对新斯的明或阿托品过敏者。剔除标准:①过敏反应;②术中输血;③躁动不能监测肌松;④手术时间>6 h。
样本量计算:本研究临床试验过程从末次应用肌松药开始,到肌松恢复至TOFr=1.0(即完全恢复)为止。新斯的明拮抗肌松的推荐剂量为0.04~0.07 mg/kg[17],并且当使用最大剂量即0.07 mg/kg时,除了不能增强拮抗效果,出现新斯的明过量导致的肌松效应及胆碱能危象(睫状肌痉挛、心律失常和冠状动脉痉挛等)外,还会导致肺不张的发生,延长患者术后的恢复时间。因此,本研究选择了新斯的明的两个剂量即0.04、0.06 mg/kg。由于使用抗胆碱酯酶药拮抗非去极化肌松药的最适用药时机是在肌松药作用出现自然消退,而肌张力开始恢复时[18],所以本研究选定了2个新斯的明的用药时间:①TOFC=1;②TOFr=0.4。
根据新斯的明的用药时机和用药剂量,在预试验中将患者分为4组,每组15名。当肌松自主恢复到TOFC=1时,第1组和第2组分别静脉给予0.04 mg/k g新斯的明+0.02 mg/kg阿托品、0.06 mg/kg新斯的明+0.03 mg/kg阿托品;当肌松自主恢复到TOFr=0.4时,第3组和第4组分别静脉给予0.04 mg/kg新斯的明+0.02 mg/kg阿托品、0.06 mg/kg新斯的明+0.03 mg/kg阿托品。从末次应用罗库溴铵开始,第1组、第2组、第3组和第4组肌松恢复至TOFr=1.0所需时间的均值分别为89.93、85.20、78.73和68.13 min。其中,4组最小差异为4.73。利用PASS 15.0中的“Multiple Comparisons”计算样本量,设置一类错误为α=0.05,检验效能为1-β=0.8,4组比例为1 ∶1 ∶1 ∶1,标准差为4,利用Tukey-Kramer法进行两两比较,结果显示每组最少需要43例。同时考虑到临床试验中病例脱落和剔除的风险而可能造成约20%失访率,最后每组纳入55例。
1.2 方法研究采取配药者、术中试验实施者、数据统计分析者之间三盲的方式进行。所有患者采用标准统一的麻醉诱导与麻醉维持方案。患者手术前未使用药物。常规监测患者的血压(blood pressure,BP)、心电图(electrocardiogram,ECG)、心率(heart rate,HR)和血氧饱和度(oxygen saturation,SpO2)、脑电双频指数(bispectral index,BIS)、呼气末二氧化碳分压(partial pressure of endtidal carbon dioxide,PETCO2)和鼻咽温度(nasopharyngeal temperature,T)。
利用咪达唑仑0.05 mg/kg、舒芬太尼0.3 μg/kg和丙泊酚2 mg/kg进行静脉全身麻醉的快速诱导。经面罩吸氧辅助呼吸。患者意识和睫毛反射消失后,将电极贴放于患者左侧腕部尺神经沟处,使用Veryark-TOF监测仪监测左侧前臂尺神经拇内收肌收缩。肌松监测选择4个成串刺激(train-of-four,TOF。频率2 Hz、波宽2 ms、电流强度30 mA和串间间隔15 s)模式,调整校准TOF第1个颤搐反应高度(first response in the train of four,T1),使其尽量稳定并接近100%作为定标。
全程使用加温毯、液体加温仪和棉垫覆盖包裹前臂以保持大鱼际肌皮温≥32 ℃。经静脉给予罗库溴铵0.6 mg/kg,肌松监测仪在TOF模式下监测。每分钟测量1次TOF值直至TOF为0,并且心率减慢而趋于稳定,颈部肌肉松弛时,进行经口气管插管,实现人工机械通气。术中,静脉泵注丙泊酚3~5 mg/(kg·h) 复合瑞芬太尼0.10~0.20 μg/(kg·min)维持麻醉,BIS维持在45~60。在麻醉维持阶段,每当T1恢复到定标值的10%时,立即静脉推注罗库溴铵0.2 mg/kg,以维持T1始终< 定标值的10%。维持术中平均动脉压(mean arterial pressure,MAP)变化不超过基础值的20%,否则给予麻黄碱5 mg。HR < 50次/min时给阿托品0.5 mg。术中体温维持在36.0~36.9 ℃。手术结束后,带管送麻醉恢复室。
患者入恢复室后均接受温毯机保温,监测BP、ECG、HR、SpO2、PETCO2和T,复查血气和电解质以保持患者内环境稳定。当肌松自主恢复到至TOFC=1时,A1、A2组分别静脉给予0.04 mg/kg新斯的明+ 0.02 mg/kg阿托品、0.06 mg/kg新斯的明+0.03 mg/kg阿托品;当肌松自主恢复到TOFr=0.4时,B1、B2组分别静脉给予0.04 mg/kg新斯的明+0.02 mg/kg阿托品、0.06 mg/kg新斯的明+0.03 mg/kg阿托品。当TOFr达到1.0时,患者意识、自主呼吸、咳嗽和吞咽反射均恢复,清除气道及口咽部分泌物,拔除气管导管。在拔管以后,持续面罩吸氧,氧流量2~4 L/min。拔管后5和30 min进行动脉血气分析。在拔管后60 min内每10 min测量并记录TOFr值。当出现TOFr再下降时,密切关注患者情况。当TOFr < 0.9时,立即加大氧流量,判断患者意识,检查患者呼吸道通畅与否,保持气道通畅。在患者血气正常,苏醒及镇静评分正常,TOFr保持1.0,并且无不良反应后,将其送回病房。随访24 h内患者在病房有无打鼾、复视及肌无力等症状。
1.3 监测指标监测给予拮抗药物前后血流动力学改变及恶心呕吐、支气管痉挛等不良反应;分析肌松恢复:从末次用肌松药开始到肌松恢复到TOFC=1、TOFC=3、TOFr=0.4、TOFr=0.7及TOFr=1.0所需时间;监测拔管后10、20、30、40、50和60 min的TOFr值。
1.4 统计学处理利用SAS9.4进行数据分析。根据quantile-quantile (QQ)图判断计量资料是否服从正态分布。采用x±s描述正态分布的计量资料,采用方差分析非重复测量的资料,采用SNK-q检验进行两两比较,采用重复测量方差分析重复测量的资料。采用M(P25,P75)描述偏态分布的计量资料,采用Kruskal-Wallis检验进行组间比较。采用例数和率进行描述分类资料,采用Fisher精确检验或者χ2检验进行组间比较。P < 0.05被认为具有统计学意义。
2 结果本研究按照纳入、排除和剔除标准选取患者以进行统计分析的流程见图 1。研究初始纳入220例患者。在临床试验过程中,3例发生过敏反应、5例需要输血治疗、3例因躁动不能监测肌松、7例患者的手术时长> 6 h,共计18例被剔除,最终收集202例患者的数据进行统计分析。
|
| A1组:TOFC=1时给予0.04 mg/kg新斯的明+0.02 mg/kg阿托品组;A2组:TOFC=1时给予0.06 mg/kg新斯的明+0.03 mg/kg阿托品组;B1组:TOFr=0.4时给予0.04 mg/kg新斯的明+0.02 mg/kg阿托品组;B2组:TOFr=0.4时给予0.06 mg/kg新斯的明+0.03 mg/kg阿托品组 图 1 新斯的明用于腹腔镜胃肠手术后拮抗残余肌松的患者纳入流程 |
2.1 术前身体和生理特征和术中患者数据对比分析
4组患者间的手术前的身体和生理特征(如性别、年龄、身高、体质量、BMI等)与手术中的用药量、手术时长、麻醉时长、出血量以及苏醒评分和镇静评分等相关数据相比无统计学差异(P>0.05,表 1)。
| 指标 | A1组 | A2组 | B1组 | B2组 | χ2/F | P |
| 总例数 | 49 | 51 | 52 | 50 | ||
| 性别 | 0.187 | 0.999 | ||||
| 男/例 | 26 | 26 | 27 | 26 | ||
| 女/例 | 23 | 25 | 25 | 24 | ||
| ASA健康状况分级 | 1.274 | 0.938 | ||||
| Ⅱ级/例 | 34 | 38 | 36 | 37 | ||
| Ⅲ级/例 | 15 | 13 | 16 | 13 | ||
| 年龄/岁 | 54(48,60) | 54(48,59) | 53(48,58) | 56(47,61) | 3.378 | 0.642 |
| 身高/cm | 161.88±7.15 | 161.25±7.14 | 163.56±7.18 | 162.14±7.75 | 0.626 | 0.680 |
| 体质量/kg | 58.72±7.87 | 58.63±7.81 | 59.88±7.61 | 58.58±8.47 | 0.305 | 0.910 |
| BMI/kg·m-2 | 22.49(20.83,24.44) | 23.11(20.06,24.67) | 22.83(21.10,24.22) | 22(20.58,24.34) | 3.304 | 0.653 |
| ALB/g·L-1 | 40.98±3.96 | 41.37±3.59 | 40.60±3.93 | 40.46±3.72 | 0.501 | 0.776 |
| HGB/g·L-1 | 154.39±9.77 | 153.94±6.77 | 155.5±7.93 | 153.6±11.82 | 0.370 | 0.869 |
| 血气 | ||||||
| pH | 7.4±0.02 | 7.4±0.03 | 7.4±0.03 | 7.4±0.02 | 0.530 | 0.754 |
| Na+/mmol·L-1 | 140.47±1.96 | 140.71±2.36 | 140.85±2.25 | 140.94±2.24 | 0.796 | 0.553 |
| K+/mmol·L-1 | 4.33±0.38 | 4.32±0.43 | 4.42±0.37 | 4.40±0.37 | 1.790 | 0.115 |
| Ca++/mmol·L-1 | 2.35±0.12 | 2.38±0.10 | 2.35±0.12 | 2.35±0.11 | 1.519 | 0.184 |
| 肾功 | ||||||
| UREA/mmol·L-1 | 5.1(4.4,6.1) | 5(4.3,5.9) | 5(4.3,5.9) | 5.2(4.5,5.9) | 5.544 | 0.353 |
| CREA/μmol·L-1 | 85(69,100) | 81(68,90) | 87(67,98) | 81(69,88) | 8.536 | 0.129 |
| 肝功 | ||||||
| ALT/U·L-1 | 38.04±12.86 | 39.69±5.63 | 41.42±12.90 | 40.34±12.93 | 1.287 | 0.269 |
| AST/U·L-1 | 31.69±8.10 | 30.41±6.25 | 30.10±8.43 | 32.02±7.47 | 0.678 | 0.641 |
| 鼻咽温度/℃ | 36.45±0.27 | 36.46±0.19 | 36.47±0.17 | 36.48±0.19 | 0.232 | 0.948 |
| 丙泊酚/mg·kg-1·h-1 | 4(3,4) | 4(3,4) | 4(3,4) | 4(3,5) | 4.475 | 0.483 |
| 舒芬太尼/mg·kg-1 | 18(14,22) | 18(14,22) | 18(17,22) | 21(16,24) | 5.822 | 0.324 |
| 瑞芬太尼/μg·kg-1·min-1 | 0.1±0.02 | 0.1±0.02 | 0.1±0.02 | 0.1±0.02 | 0.332 | 0.893 |
| 罗库溴铵/mg·kg-1 | 1.65±0.32 | 1.70±0.37 | 1.57±0.29 | 1.67±0.32 | 1.134 | 0.342 |
| 手术时间/min | 182.78±47.03 | 184.65±53.05 | 174.00±47.55 | 179.70±63.65 | 0.414 | 0.839 |
| 麻醉时间/min | 207.76±48.37 | 213.43±55.88 | 202.88±47.99 | 207.80±63.80 | 0.275 | 0.927 |
| 出血量/mL | 50(20,50) | 50(30,60) | 50(20,50) | 30(20,50) | 6.170 | 0.290 |
| 镇静评分/分 | 3(3,3) | 3(3,3) | 3(3,3) | 3(3,3) | 7.077 | 0.215 |
| 苏醒评分/分 | 2(2,2) | 2(2,2) | 2(2,2) | 2(2,2) | 1.280 | 0.937 |
2.2 新斯的明的不良反应
4组患者间在应用新斯的明拮抗后,拮抗剂的起效期内的血流动力学变化见表 2:各组患者的血流动力学变化没有统计学意义(P>0.05)。从给拮抗药开始到出恢复室为止的这段时间内,各组患者均未出现恶心呕吐、支气管痉挛等不良反应。返回病房后,各组均未监测到打鼾、复视及肌无力等症状。
| 指标 | 组别 | 用药时 | 用药后1 min | 用药后3 min | 用药后5 min | 用药后10 min | 用药后20 min | F | P |
| HR/min-1 | |||||||||
| A1 | 74.69±8.00 | 74.37±7.26 | 74.88±7.20 | 74.84±6.90 | 75.20±6.81 | 75.39±7.45 | 0.633 | 0.674 | |
| A2 | 75.25±8.11 | 75.88±8.00 | 75.31±8.12 | 75.65±7.85 | 75.61±8.02 | 75.75±8.21 | 0.615 | 0.688 | |
| B1 | 75.52±7.42 | 76.08±7.59 | 75.98±7.67 | 75.00±7.92 | 75.90±7.36 | 74.88±7.55 | 1.445 | 0.209 | |
| B2 | 74.96±7.26 | 75.80±6.84 | 76.00±7.00 | 75.90±7.15 | 75.34±7.33 | 75.90±7.74 | 1.185 | 0.317 | |
| SBP/mmHg | |||||||||
| A1 | 125.43±14.59 | 125.65±14.59 | 125.14±13.99 | 125.94±14.44 | 124.51±13.60 | 124.55±13.66 | 1.480 | 0.197 | |
| A2 | 122.33±14.82 | 121.67±12.77 | 121.55±13.09 | 119.84±19.51 | 121.84±12.59 | 122.12±12.82 | 1.097 | 0.362 | |
| B1 | 122.41±12.98 | 122.31±12.54 | 123.79±13.45 | 123.11±12.90 | 122.52±12.39 | 122.11±13.22 | 1.692 | 0.137 | |
| B2 | 120.24±15.23 | 120.02±13.61 | 120.38±13.75 | 120.86±13.75 | 120.18±13.60 | 120.08±13.82 | 1.567 | 0.170 | |
| DBP/mmHg | |||||||||
| A1 | 73.20±8.70 | 73.22±8.83 | 73.51±8.73 | 72.82±9.36 | 72.90±9.68 | 72.47±9.88 | 0.820 | 0.536 | |
| A2 | 72.02±7.49 | 71.82±6.83 | 72.12±6.65 | 72.18±7.13 | 72.08±6.94 | 72.24±6.84 | 0.485 | 0.787 | |
| B1 | 74.21±7.57 | 74.10±7.57 | 74.38±7.36 | 74.56±8.24 | 74.94±7.64 | 74.38±7.96 | 0.403 | 0.847 | |
| B2 | 72.40±7.14 | 72.68±6.63 | 72.84±6.64 | 72.58±6.48 | 72.72±6.53 | 73.02±6.53 | 1.827 | 0.108 | |
| MAP /mmHg | |||||||||
| A1 | 90.61±9.24 | 90.70±9.33 | 90.72±9.03 | 90.52±8.97 | 90.10±9.74 | 89.83±9.55 | 1.484 | 0.196 | |
| A2 | 88.79±8.58 | 88.44±7.52 | 88.59±7.49 | 88.07±9.02 | 88.67±7.42 | 88.86±7.56 | 0.823 | 0.534 | |
| B1 | 90.28±8.51 | 90.17±8.32 | 90.85±8.18 | 90.74±8.54 | 90.80±7.76 | 90.26±8.09 | 0.740 | 0.594 | |
| B2 | 88.35±8.99 | 88.46±8.17 | 88.69±8.16 | 88.67±8.10 | 88.54±7.95 | 88.71±8.06 | 1.020 | 0.406 |
2.3 不同组间肌松恢复情况比较
肌松恢复到不同阶段时患者的临床表现见表 3。各组患者从末次给罗库溴铵开始到肌松自主恢复至TOFC=1、TOFC=3、TOFr=0.4、TOFr=0.7及TOFr=1.0时所用时间见表 4:从末次给予罗库溴铵开始,各组患者肌松自主恢复至TOFC=1所需时间的差异没有统计学意义(P>0.05)。在新斯的明给药时机相同时,即无论TOFC=1时给药,或TOFr=0.4时给药,0.06 mg/kg新斯的明+0.03 mg/kg阿托品组患者肌松自主恢复至TOFr=1.0所需时间短于0.04 mg/kg新斯的明+0.02 mg/kg阿托品组患者;即A2组肌松恢复快于A1组,B2组肌松恢复快于B1组,且差异有统计学意义(P < 0.05)。在新斯的明给药剂量相同时,无论0.04 mg/kg新斯的明+0.02 mg/kg阿托品剂量组,还是0.06 mg/kg新斯的明+0.03 mg/kg阿托品组,TOFC=1时给药的肌松恢复时间长于TOFr=0.4时给药;即B1组肌松恢复快于A1组,B2组肌松恢复快于A2组,差异有统计学意义(P < 0.05)。从末次给予罗库溴铵计时,4组患者肌松完全恢复(即TOFr=1.0)所需时间由长到短的排列顺序为A1、A2、B1、B2。
| 肌松恢复程度 | 呼吸频率/次·min-1 | 潮气量/mL·kg-1 | 胸廓、下腹起伏性活动 | 睁眼情况 | 视物情况 | 指令动作 |
| TOFC=1 | 1.79±0.70 | 1.81±0.70 | 极弱 | 不能睁眼 | — | — |
| TOFC=3 | 16.49±2.37 | 3.20±0.95 | 弱 | 不能睁眼 | — | — |
| TOFr=0.4 | 18.60±1.78 | 7.10±0.85 | 正常 | 睁眼无力 | 视物模糊 | 不能抬腿或举手 |
| TOFr=0.7 | 18.86±1.61 | 8.22±0.87 | 正常 | 能睁眼 | 视物不清 | 能抬腿或举手,持续时间 < 5 s,握力弱 |
| TOFr=1.0 | 18.93±1.60 | 9.52±1.24 | 正常 | 睁眼有力 | 视物清晰 | 能抬腿或举手持续时间>5 s,握力正常 |
| 组别 | n | TOFC=1 | TOFC=3 | TOFr=0.4 | TOFr=0.7 | TOFr=1.0 |
| A1 | 49 | 41.35(40.00,42.69) | 43.80(42.50,45.09) | 49.51(48.29,50.73) | 70.39(68.58,72.20) | 94.53(92.84,96.23) |
| A2 | 51 | 41.37(40.03,42.72) | 43.78(42.45,45.12) | 49.49(48.38,50.60) | 67.65(65.96,69.33)a | 85.88(84.91,86.86)a |
| B1 | 52 | 41.23(40.27,42.20) | 46.13(45.10,47.16)ab | 52.12(51.03,53.20)ab | 59.98(58.77,61.19)ab | 75.08(72.95,77.20)ab |
| B2 | 50 | 41.24(40.09,42.39) | 46.26(45.22,47.30)ab | 52.18(51.15,53.21)ab | 57.18(56.18,58.18)abc | 68.30(66.53,70.07)abc |
| F | 0.015 | 5.577 | 7.620 | 72.858 | 185.638 | |
| P | 0.998 | 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| a:P < 0.05,与A1组比较;b:P < 0.05,与A2组比较; c:P < 0.05,与B1组比较 | ||||||
2.4 气管拔管后PORC的发生
图 2显示拔除气管导管后60 min内各组患者TOFr的再下降(TOFr < 0.9时,即发生了术后PORC)。TOFr再下降主要发生在拔管后30 min内。由图 2可见,各组患者TOFr再下降所达到的最低值为0.85。4组中PORC的发生率分别是14.29%、7.84%、1.92% 和0。按照新斯的明的剂量分析,新斯的明0.04 mg/kg组PORC发生率大于0.06 mg/kg组;按照新斯的明给药时机分析,肌松恢复至TOFr=0.4时给药组PORC发生率明显低于TOFC=1时给药组。
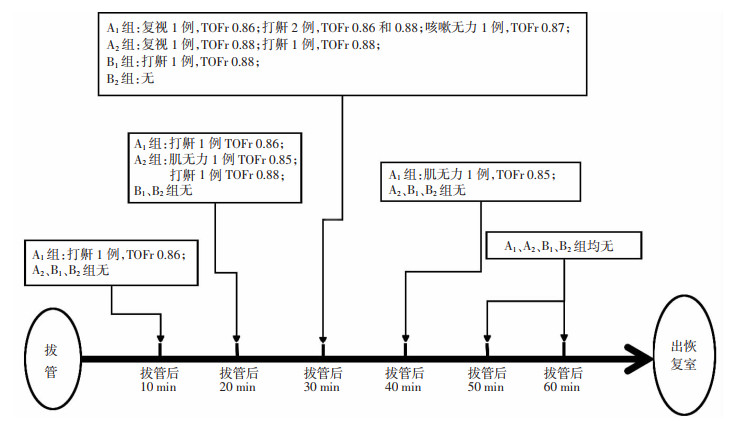
|
| 图 2 拔管后60 min内各组患者TOF再下降及其对应临床症状 |
在发生PORC的患者主要表现为打鼾,其他症状有复视、肌无力或咳嗽无力等。表 5列出了拔管后10、20、30、40、50及60 min各组患者的TOFr值,可见在上述拔管后各时间点,B1、B2组的TOFr值均高于其他组,而且B2组更高于B1组;从新斯的明的用药时机分析,TOFr=0.4时给药的患者组的PORC发生率明显较低;从新斯的明的用药剂量分析,0.06 mg/kg的新斯的明用药剂量比0.04 mg/kg的拮抗肌松效果更优,患者更安全。
| 组别 | n | 拔管后10 min | 拔管后20 min | 拔管后30 min | 拔管后40 min | 拔管后50 min | 拔管后60 min |
| A1 | 49 | 97.08±2.17cd | 97.10±2.56cd | 97.47±3.73cd | 98.24±2.64cd | 99.88±0.86 | 100±0 |
| A2 | 51 | 97.18±1.56 cd | 97.43±2.58cd | 97.76±2.30cd | 98.10±1.35cd | 100±0 | 100±0 |
| B1 | 52 | 98.29±1.23abd | 98.81±0.91abd | 99.13±1.01abd | 99.23±1.10abd | 100±0 | 100±0 |
| B2 | 50 | 98.96±0.95abc | 99.72±0.45abc | 99.80±0.40abc | 99.90±0.30abc | 100±0 | 100±0 |
| F | 10.564 | 7.493 | 6.307 | 11.205 | 1.033 | - | |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.398 | - | |
| a:P < 0.05,与A1组比较;b:P < 0.05,与A2组比较; c:P < 0.05,与B1组比较;d:P < 0.05,与B2组比较 | |||||||
3 讨论 3.1 影响PORC发生的因素
PORC的发生与患者的生理病理情况、肌松药的种类、剂量、使用时机以及复合使用的其他药物对肌松药的药物代谢动力学和药效动力学的影响有关。例如,吸入性麻醉药与肌松药之间存在协同效应[19]。此外,低温可降低肌松药的血浆清除速率,导致肌松药在体内的残留时间延长,从而会延长神经肌肉阻滞的持续时间。本研究各组患者基线资料及术中情况差异没有统计学意义(P>0.05,表 1)。已有研究[20-21]证明,TOFr=0.9时上呼吸道肌肉的张力并未完全恢复,因而此时存在咽部和呼吸功能受损。而以更高的TOFr阈值作为肌张力恢复的指标,有利于减少术后肺部并发症[22]。与以前的研究[23-24]不同的是,在本研究中新斯的明的拮抗效果是根据从末次应用罗库溴铵开始至肌松自主恢复至TOFr=1.0所需时间来进行评估的。
3.2 新斯的明拮抗术后肌松残余的可行性新斯的明可抑制胆碱酯酶分泌,从而减少乙酰胆碱分解,导致神经肌肉接头部位乙酰胆碱浓度增加,使肌力恢复。同时,新斯的明对受自主神经节后纤维支配的毒蕈碱乙酰胆碱受体的作用可能会引起各种不良反应,如迷走神经张力增加引起的心血管不良反应。因此,抗胆碱能药应与新斯的明联合使用,以消除毒蕈碱反应。本研究中使用的阿托品是一种快速起效的抗胆碱药,可抑制心血管不良反应。如表 2所示,应用新斯的明前后,患者血流动力学改变不显著,也没有出现毒蕈碱样反应,这说明本研究中使用的阿托品剂量是合适的。
肌松监测仪能够监测肌松药的起效、维持和消退,从而能够帮助实现肌松药的科学合理使用,减少不良反应的发生;并且能够在手术结束时,帮助及时正确地使用拮抗药,从而逆转肌松药的残余作用[25]。然而,临床实践中并未常规使用肌松监测仪。因此,临床上评估残余神经肌肉阻滞的最常用方法仍然是检查是否存在肌无力的临床体征。表 3总结了本研究中患者在肌松自主恢复至每个阶段时的临床特征和表现。当无法进行肌松监测时,表 3中的数据信息可为临床医生提供判断肌松恢复的依据和实施准确有效的肌松拮抗的参考。
3.3 新斯的明拮抗术后肌松残余的应用剂量利用新斯的明进行肌松拮抗的推荐剂量为0.04~0.07 mg/kg。在本研究的预试验中,应用0.04、0.05、0.06和0.07 mg/kg的新斯的明对全麻恢复期内罗库溴铵的肌松作用进行拮抗。结果显示新斯的明的拮抗作用是存在剂量依赖性的,而且0.05 mg/kg和0.04 mg/kg新斯的明之间,或0.07 mg/kg和0.06 mg/kg新斯地明之间的拮抗效果没有显著差异。在临床实践中,既要保证肌松拮抗效果,又要使副作用最小,应遵循剂量尽可能低的原则。因此,本研究中使用了两种较低剂量,即0.04、0.06 mg/kg。对于相同的用药时机,新斯的明的拮抗效果存在正的剂量依赖性(表 4),在给药时机相同时,0.06 mg/kg新斯的明可以帮助更快速地实现肌力恢复,更快速地实现安全拔管,保证患者安全。
新斯的明的最大拮抗剂量为0.07 mg/kg,该最大拮抗剂量可完全抑制胆碱酯酶活性[26]。由于存在封顶效应,在此剂量基础上再追加任何额外药量对于非去极化肌松药的残余神经肌肉阻滞均不能进一步增强拮抗效果。而过大的剂量反而会引起肌松效应和胆碱能危象(如睫状肌痉挛、心律失常和冠状动脉痉挛),甚至会增加肺不张的发生率,延长术后住院时间[27]。研究表明,在超过0.06 mg/kg新斯的明的给药剂量时,可能会诱发短暂性肌无力[28-29]。
根据本研究的结果,B2组完全没有发生肌无力,但A2确实发生了肌无力,这表明新斯的明给药的时间可能会影响肌无力的发生率。此外,A2组中肌无力的偶然发生不应认为是由新斯的明的过量引起的,因为B2组中根本没有发生肌无力。
3.4 新斯的明拮抗术后肌松残余的应用时机抗胆碱酯酶药物拮抗非去极化肌松剂的最佳给药时间是当肌松剂作用已经开始自然消退,肌肉张力开始恢复时。此时,抗胆碱酯酶药物也能促进肌肉张力的恢复。本研究采用的两个用药时机均是在早期研究中得到推荐的[30-31]。根据本研究结果,当TOFr=0.4时,新斯的明的拮抗效果最好(表 4)。因此,本研究获得认识有助于进一步细化和完善新斯的明的给药时间,进而为麻醉恢复方案的优化提供参考依据。
除了研究新斯的明在不同给药时间和剂量下的拮抗效果外,本研究还密切监测了拔管后TOFr的再次降低,对比分析了PORC的发生率。拔管后,几乎所有组的患者TOFr都出现了不同程度的再降低(表 5);除B2外,所有组都有患者发生了PORC(图 2)。值得注意的是,尽管拔管后所有患者的TOFr值均大于0.8,但一些患者仍有打鼾和复视等临床症状。根据本研究结果的统计分析,所有组患者的PORC发生率为5.9%,而91.7% 的PORC发生出现在拔管后30 min内。
气管拔管后出现TOFr的再下降可能与新斯的明和罗库溴铵的药理学有关。作为胆碱酯酶抑制剂,新斯的明抑制乙酰胆碱的分解,从而增加神经肌肉连接处乙酰胆碱的浓度,并诱导肌肉力量的恢复。然而,新斯的明并不促进肌松药的代谢。值得注意的是,新斯的明的药效达峰时间仅为7~11 min。正如本研究中所发现的,新斯的明给药时间越早,拔管后TOFr再下降的发生率越高(图 2)。可见TOFr=0.4给予拮抗是合适的时机。
综上所述,对于择期腹腔镜胃肠手术患者全身麻醉恢复期内的罗库溴铵的肌松残余作用的拮抗,推荐在TOFr=0.4时给予0.06 mg/kg的新斯的明伍用0.03 mg/kg的阿托品。由于儿童和老年患者的特殊生理特征,新斯的明作为拮抗肌松剂在儿童和老年人中的用药方案值得进一步研究。
| [1] |
CHEN A T, PATEL A, MCKECHNIE T, et al. Sugammadex in colorectal surgery: a systematic review and meta-analysis[J]. J Surg Res, 2022, 270: 221-229. |
| [2] |
MOON T S, REZNIK S, PAK T, et al. Sugammadex versus neostigmine for reversal of rocuronium-induced neuromuscular blockade: a randomized, double-blinded study of thoracic surgical patients evaluating hypoxic episodes in the early postoperative period[J]. J Clin Anesth, 2020, 64: 109804. |
| [3] |
MCMAHON A J, O'DWYER P J, BAXTER J N. Laparoscopic interventions in the gut: yesterday, today, and tomorrow[J]. Dig Dis, 1996, 14(1): 14-26. |
| [4] |
RICHEBÉ P, BOUSETTE N, FORTIER L P. A narrative review on the potential benefits and limitations of deep neuromuscular blockade[J]. Anaesth Crit Care Pain Med, 2021, 40(4): 100915. |
| [5] |
BOGGETT S, CHAHAL R, GRIFFITHS J, et al. A randomised controlled trial comparing deep neuromuscular blockade reversed with sugammadex with moderate neuromuscular block reversed with neostigmine[J]. Anaesthesia, 2020, 75(9): 1153-1163. |
| [6] |
ÖZDEMIR-VAN BRUNSCHOT D M D, BRAAT A E, VAN DER JAGT M F P, et al. Deep neuromuscular blockade improves surgical conditions during low-pressure pneumoperitoneum laparoscopic donor nephrectomy[J]. Surg Endosc, 2018, 32(1): 245-251. |
| [7] |
王婷婷, 孙申, 王琦, 等. 腹腔镜与开腹手术中单次输注罗库溴铵或顺式阿曲库铵后神经肌肉阻滞时间的比较[J]. 复旦学报(医学版), 2017, 44(2): 150-154, 174. WANG T T, SUN S, WANG Q, et al. Comparison of the duration of neuromuscular blockade following a single bolus dose of rocuronium or cisatracurium in laparoscopic gynaecological surgery and conventional open surgery[J]. Fudan Univ J Med Sci, 2017, 44(2): 150-154, 174. |
| [8] |
高航. 妇科腹腔镜手术与开腹手术术后罗库溴铵残余作用比较[J]. 检验医学与临床, 2013, 10(11): 1453-1455. GAO H. Comparison of residual effects of rocuronium after laparoscopic surgery and open surgery[J]. Lab Med Clin, 2013, 10(11): 1453-1455. |
| [9] |
BRULL S J, KOPMAN A F. Current status of neuromuscular reversal and monitoring: challenges and opportunities[J]. Anesthesiology, 2017, 126(1): 173-190. |
| [10] |
KIRSCHNIAK A, POINTNER R, GRANDERATH F A. Laparoscopic toupet-fundoplication[J]. Zentralbl Chir, 2013, 138(4): 397-399. |
| [11] |
陈浩聪, 陆志俊. 舒更葡糖钠不良反应的研究进展[J]. 国际麻醉学与复苏杂志, 2021, 42(1): 53-57. CHEN H C, LU Z J. Research progress on adverse effects of sugammadex[J]. Int J Anesthesiol Resusc, 2021, 42(1): 53-57. |
| [12] |
MAURIN M P, MULLINS R A, SINGH A, et al. A systematic review of complications related to laparoscopic and laparoscopic-assisted procedures in dogs[J]. Vet Surg, 2020, 49(Suppl 1): O5-O14. |
| [13] |
ORIHARA M, TAKAZAWA T, HORIUCHI T, et al. Comparison of incidence of anaphylaxis between sugammadex and neostigmine: a retrospective multicentre observational study[J]. Br J Anaesth, 2020, 124(2): 154-163. |
| [14] |
闻大翔, 怀晓蓉. 肌肉松弛药及其拮抗剂的研究进展[J]. 药学进展, 2017, 41(5): 346-354. WEN D X, HUAI X R. Research progress in muscle relaxants and their antagonists[J]. Prog Pharm Sci, 2017, 41(5): 346-354. |
| [15] |
高佳栋, 陈海, 肖海峰, 等. 新斯的明拮抗老年患者米库氯铵肌松残余的临床效果[J]. 临床麻醉学杂志, 2017, 33(3): 252-256. GAO J D, CHEN H, XIAO H F, et al. Effect of antagonism of neostigmine on residual neuromuscular blockade from mivacurium chloride in the elderly patients[J]. J Clin Anesthesiol, 2017, 33(3): 252-256. |
| [16] |
KHETERPAL S, VAUGHN M T, DUBOVOY T Z, et al. Sugammadex versus neostigmine for reversal of neuromuscular blockade and postoperative pulmonary complications (STRONGER): a multicenter matched cohort analysis[J]. Anesthesiology, 2020, 132(6): 1371-1381. |
| [17] |
中华医学会麻醉学分会. 2017版中国麻醉学指南与专家共识[M]. 北京: 人民卫生出版社, 2017: 34-35. Anesthesiology Branch of Chinese Medical Association. Chinese anesthesiology guide and expert consensus (2017)[M]. Beijing: People's Health Publishing House, 2017: 34-35. |
| [18] |
陈伯銮. 临床麻醉药理学[M]. 北京: 人民卫生出版社, 2000: 340-342. CHEN B L. Anesthetic pharmacology[M]. Beijing: People's Health Publishing House, 2000: 340-342. |
| [19] |
刘力, 闵苏, 李炜, 等. 七氟醚和异氟醚对罗库溴铵阻滞大鼠骨骼肌成人型乙酰胆碱受体的影响[J]. 中华麻醉学杂志, 2011(7): 805-808. LIU L, MIN S, LI W, et al. Effects of sevoflurane and isoflurane on blockade of adult type nicotinic acetylcholine receptors of skeletal muscle of rats by rocuronium[J]. Chin J Anesth, 2011(7): 805-808. |
| [20] |
BROENS S J L, BOON M, MARTINI C H, et al. Reversal of partial neuromuscular block and the ventilatory response to hypoxia: a randomized controlled trial in healthy volunteers[J]. Anesthesiology, 2019, 131(3): 467-476. |
| [21] |
CARRON M, ANDREATTA G, PESENTI E, et al. Impact on grafted kidney function of rocuronium-sugammadex vs cisatracurium-neostigmine strategy for neuromuscular block management. An Italian single-center, 2014-2017 retrospective cohort case-control study[J]. Perioper Med, 2022, 11(1): 3. |
| [22] |
李世勇, 罗爱林. 2021英国麻醉医师协会《麻醉和恢复期间监测标准推荐意见》解读[J]. 临床外科杂志, 2022, 30(1): 36-39. LI S Y, LUO A L. Interpretation of recommendations for monitoring standards during anaesthesia and recovery by the British society of anesthesiologists(2021)[J]. J Clin Surg, 2022, 30(1): 36-39. |
| [23] |
KIM K S, CHEONG M A, LEE H J, et al. Tactile assessment for the reversibility of rocuronium-induced neuromuscular blockade during propofol or sevoflurane anesthesia[J]. Anesth Analg, 2004, 99(4): 1080-1085. |
| [24] |
KIRKEGAARD H, HEIER T, CALDWELL J E. Efficacy of tactile-guided reversal from cisatracurium-induced neuromuscular block[J]. Anesthesiology, 2002, 96(1): 45-50. |
| [25] |
郭曲练, 姚尚龙. 临床麻醉学[M]. 4版. 北京: 人民卫生出版社, 2016: 104-105. GUO Q L, YAO S L. Clinical anesthesiology[M]. 4th Edition. Beijing: People's Health Publishing House, 2016: 104-105. |
| [26] |
FUCHS-BUDER T, MEISTELMAN C, ALLA F, et al. Antagonism of low degrees of atracurium-induced neuromuscular blockade: dose-effect relationship for neostigmine[J]. Anesthesiology, 2010, 112(1): 34-40. |
| [27] |
KOPMAN A F, EIKERMANN M. Antagonism of non-depolarising neuromuscular block: current practice[J]. Anaesthesia, 2009, 64(Suppl 1): 22-30. |
| [28] |
MCLEAN D J, DIAZ-GIL D, FARHAN H N, et al. Dose-dependent association between intermediate-acting neuromuscular-blocking agents and postoperative respiratory complications[J]. Anesthesiology, 2015, 122(6): 1201-1213. |
| [29] |
FORTIER L P, MCKEEN D, TURNER K, et al. The RECITE study: a Canadian prospective, multicenter study of the incidence and severity of residual neuromuscular blockade[J]. Anesth Analg, 2015, 121(2): 366-372. |
| [30] |
邓小明, 姚尚龙, 于布为. 现代麻醉学[M]. 4版. 北京: 人民卫生出版社, 2014: 876-886. DENG X M, YAO S L, YU B W. Modern anesthesiology[M]. 4th Edition. Beijing: People's Health Publishing House, 2014: 876-886. |
| [31] |
邓小明. 米勒麻醉学[M]. 8版. 北京: 北京大学医学出版社, 2016: 898-927. DENG X M. Millers anesthesia[M]. 8th edition. Beijing: Peking University Medical Press, 2016: 898-927. |




