糖尿病性骨质疏松(diabetic osteoporosis,DOP)是大多数糖尿病患者的严重并发症之一,以骨显微结构受损、骨强度减弱、骨密度异常和骨量减少为主要特征,可导致患者骨脆性增加,致残、致死率升高[1];因此,针对DOP的研究很有现实意义。虽然线粒体活性氧(reactive oxygen species, ROS)的过度产生被认为是糖尿病各种慢性并发症发展的启动因素[2],但是DOP的发病机制仍不清楚。研究表明,在糖尿病中,高水平的葡萄糖和脂肪会导致线粒体功能障碍和线粒体呼吸传递链损伤,进而产生大量的ROS[3]。此外,已有研究表明,ROS诱导的成骨细胞凋亡在骨质疏松症的发展中至关重要[4]。因此,保护线粒体有望成为DOP预防和治疗的新靶点。
沉默信息调节因子2相关酶1(sirtuin-1,Sirt1)/基因过氧化物酶体增殖物激活受体γ辅活化因子1α(peroxlsome proliferator-activated receptor coactivator-1α,PGC-1α)通路在减少氧化应激和维持线粒体正常功能及稳态中发挥重要作用[5]。研究表明,大豆苷元可通过激活Sirt1/PGC-1α通路调控细胞线粒体的生物发生进而维持正常的线粒体功能[6-7]。雌马酚(equol,Eq)是大豆苷元的代谢产物,比其前体更稳定,清除率更低,具有更强的雌激素和抗氧化作用[8]。研究发现Eq在预防心血管疾病、更年期综合征和恶性肿瘤等方面发挥重要作用[9]。然而,目前Eq能否通过改善线粒体功能和抗氧化应激防治DOP仍不清楚。本研究通过葡萄糖(glucose, GLU)联合棕榈酸钠(sodium palmitate, PA)诱导成骨细胞高糖高脂环境,观察Eq的干预效应并探讨其作用机制。
1 材料和方法 1.1 试剂Eq(上海大赛璐),PA(西安鲲创科技),Hoechst 33342染液试剂盒(北京Solarbio),Annexin V-FITC/PI细胞凋亡检测试剂盒(武汉赛维尔),HE染液、Mito-Tracker CMXRos、DCHF-DA、RIPA裂解缓冲液、BCA蛋白检测试剂盒、CCK-8试剂盒、Sirt1和PGC-1α一抗(上海碧云天),Bcl-2、Bax和Cleaved caspase-3一抗(上海Abmart),GAPDH一抗(上海生工),过氧化物酶偶联的二抗(美国Abcam)。
1.2 方法 1.2.1 细胞培养ROS1728细胞购自Procell(武汉,中国)。在37 ℃、5%CO2孵箱中用完全培养基(DMEM培养基补充10%胎儿小牛血清和1%青霉素/链霉素)常规培养,细胞2 d换液1次,待细胞融合至80%~90%时,用胰酶消化进行传代处理,取3~5代细胞进行实验。
1.2.2 不同浓度Eq、GLU+PA干预后细胞活力的测定取3~5代ROS1728细胞,在96孔板中以4×104个细胞/mL的密度在完全培养基中孵育细胞,每孔体积100 μL。24 h后,用含有5%血清的DMEM培养基培养,同时分别加入不同浓度的Eq或GLU+PA,孵育48 h,每个浓度设5个复孔,重复3次。干预结束后将CCK-8试剂加入到每个孔中,在37 ℃孵箱中孵育1 h。随后,使用全波长多功能酶标仪在450 nm处检测吸光度,计算细胞相对活力值。
1.2.3 不同浓度的GLU+PA诱导ROS1728细胞凋亡取3~5代ROS1728细胞,在6孔板中以8×104个细胞/孔的密度在完全培养基中孵育细胞,每孔体积2 mL。24 h后,用含有5%血清的DMEM培养基培养,同时分别加入不同浓度的GLU+PA,每组三个重复,孵育48 h后弃掉培养基,PBS漂洗3次,4%多聚甲醛固定液固定30 min,之后将细胞核用苏木精染色2 min,用1%盐酸醇分离颜色(10~30)s,并用1%曙红Y溶液染色细胞质1 min。风干后,使用正置荧光显微镜观察细胞形态学改变。
1.2.4 细胞分组及干预根据1.2.2和1.2.3步骤确定的Eq、GLU和PA适宜浓度,将细胞分为对照(Control)组(GLU,5.5 mmol/L)、模型(Model)组(GLU,30 mmol/L+PA,250 μmol/L)、LEq组(Model+1× 10-8mol/L Eq)、MEq组(Model+1×10-7 mol/L Eq)、HEq组(Model+1×10-6 mol/L Eq),干预48 h后进行相关检测。
1.2.5 Eq干预后细胞活力测定按实验分组干预48 h后,按照1.2.2步骤检测各组细胞吸光度,计算细胞相对活力值。
1.2.6 细胞HE染色按实验分组干预48 h后,按照1.2.3 HE染色步骤对细胞进行染色,使用正置荧光显微镜观察细胞形态学改变。
1.2.7 Annexin V-FITC/PI染色检测细胞凋亡率取3~5代ROS1728细胞接种至培养瓶,各组细胞干预48 h后,胰酶消化离心收获细胞,PBS重新悬浮离心,清洗2次后弃上清依次加入100 μL的Binding Buffer、5 μL的Annexin V-FITC和5 μL的PI染色液,轻轻混匀室温下在黑暗中反应10 min后加入400 μL的Binding Buffer,上机检测细胞凋亡率。
1.2.8 Hoechst33342染色观察凋亡细胞核取3~5代ROS1728细胞,以8×104个细胞/孔的密度接种在6孔板中,各组细胞干预48 h后,去掉培养基,用PBS洗涤2次,依次加入1 mL细胞染色缓冲液和5 μL Hoechst染色液,避光在4 ℃冰箱染色25 min,染色后PBS洗涤1次,加入1 mL PBS后使用倒置荧光显微镜观察并拍照并计算凋亡细胞核占有率。正常胞核出现弥散均匀的弱蓝色荧光;凋亡细胞核呈固缩形态或颗粒状强亮蓝色荧光。
1.2.9 透射电镜观察线粒体结构取3~5代ROS1728细胞接种至培养瓶,各组细胞干预48 h后,胰酶消化离心收获细胞,PBS重新悬浮离心,清洗2次后弃上清并向细胞沉淀中加入4%戊二醛固定过夜。然后,将细胞洗涤并在1%锇酸中固定1 h,通过梯度丙酮脱水并用环氧树脂聚合,用铀酸和柠檬酸铅染色超薄切片,使用透射电子显微镜观察切片并拍照。
1.2.10 细胞线粒体膜电位(mitochondrial membrane potential,MMP)测量取3~5代ROS1728细胞,以8×104个细胞/孔的密度接种在6孔板中,各组细胞干预48 h后,PBS冲洗2遍,加入Mito-Tracker Red CMXRos工作液后在37 ℃孵箱里孵育25 min,PBS冲洗2遍后使用倒置荧光显微镜观察拍摄荧光图片并计算荧光强度。
1.2.11 细胞ROS测量取3~5代ROS1728细胞,以8×104个细胞/孔的密度接种在6孔板中,各组细胞干预48 h后,去除培养基,用不含血清的培养基冲洗3遍,加入适当体积无血清培养基稀释好的DCFH-DA探针(浓度为10 μmol/L),在37 ℃孵箱中孵育30 min后用不含血清的培养基冲洗3遍,使用倒置荧光显微镜观察拍摄荧光图片并计算荧光强度。
1.2.12 Western blot各组细胞干预48 h后,收集细胞置于冰上用RIPA裂解液匀浆,之后保持4 ℃ 1.0× 104×g离心10 min,取上清液测定蛋白浓度和检测细胞蛋白Sirt1、PGC-1α、Bcl-2、Bax、Cleaved caspase-3和GAPDH的表达情况,蛋白条带均用Image J软件计算灰度值进行统计分析。
1.3 统计分析所有实验均进行3次,使用SPSS 22.0软件进行数据分析,数值以x±s表示,组间差异采用单因素方差分析,P < 0.05即差异具有统计学意义。
2 结果 2.1 不同浓度Eq、PA+GLU对细胞活力的影响与对照组相比,Eq浓度为1×10-4mol/L时细胞活力显著降低(P < 0.05),见图 1A,本研究选取1×10-8、1×10-7、1×10-6 mol/L 3个浓度作为Eq干预浓度;与对照组相比,当GLU和PA浓度分别为30 mmol/L和200 μmol/L时细胞活力显著降低(P < 0.05),且当PA浓度为250 μmol/L时,细胞存活率为56.35%,见图 1B。
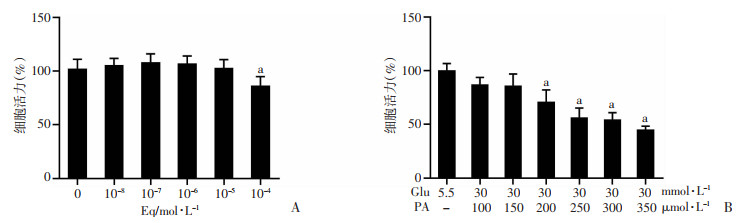
|
|
a: P < 0.05与对照组比较 A: Eq对ROS1728细胞活力的影响; B: 高糖高脂对ROS1728细胞活力的影响 图 1 不同浓度Eq、PA+GLU对细胞活力的影响 |
2.2 不同浓度PA+GLU对细胞形态学变化的影响
与对照组相比,当GLU和PA浓度分别为30 mmol/L和200 μmol/L时视野内细胞数量和正常长梭形成骨细胞减少,而细胞变圆胞核浓缩凋亡细胞增多,且随着PA浓度升高,细胞形态学变化更加明显,见图 2。结合GLU和PA对细胞存活率和细胞核凋亡表现的影响,选取30 mmol/L GLU+250 μmol/L PA作为诱导成骨细胞高糖高脂环境的适宜浓度。
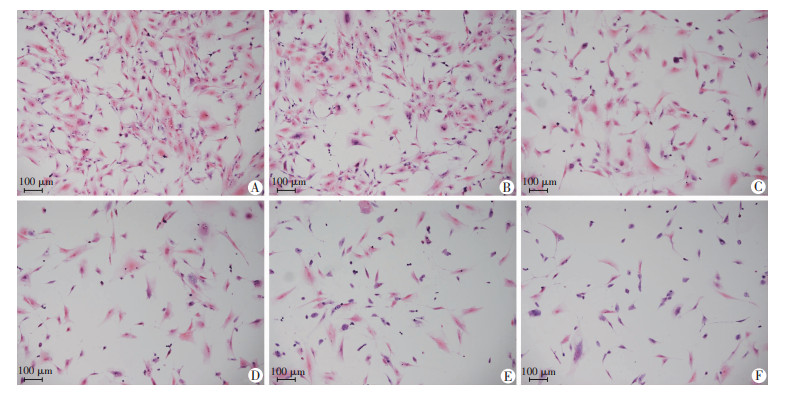
|
| A:对照组;B:30 mmol/L GLU+150 μmol/L PA;C:30 mmol/L GLU+200 μmol/L PA;D:30 mmol/L GLU+250 μmol/L PA;E:30 mmol/L GLU+300 μmol/L PA;F:30 mmol/L GLU+350 μmol/L PA 图 2 不同浓度PA+GLU对细胞形态学变化的影响 (HE染色) |
2.3 Eq干预对各组细胞活力及形态学变化的影响
与对照组比较,模型组细胞存活率显著下降(P < 0.05),Eq干预后细胞存活率较模型组显著升高(P < 0.05),在一定范围内,随着Eq浓度升高,干预效应更加明显,见图 3F;HE染色结果提示:与对照组比较,模型组正常长梭形细胞减少而细胞变圆胞核浓缩凋亡细胞增多,Eq干预后,正常长梭形细胞逐渐增多而细胞变圆胞核浓缩凋亡细胞逐渐减少,一定范围内Eq干预效果呈浓度依赖效应,见图 3A~E。
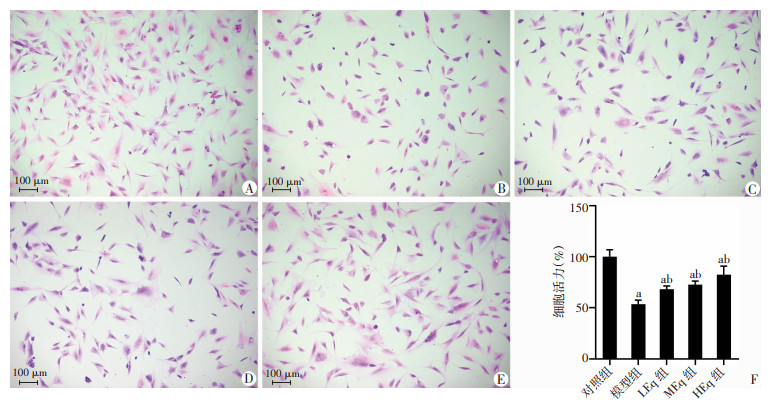
|
| A:对照组;B:模型组;C:LEq组;D:MEq组;E:HEq组;F:细胞存活率 a:P<0.05与对照组比较;b:P<0.05与模型组比较 图 3 Eq干预对各组细胞活力及形态学变化的影响 (HE染色) |
2.4 Eq干预对各组细胞凋亡率的影响
与对照组(10.00±0.39)% 相比,模型组细胞凋亡率(22.02±0.22)% 显著增多(P < 0.05);Eq干预后LEq、MEq、HEq三组细胞凋亡率分别为(18.59±0.18)%、(15.48±0.44)%、(13.04±0.39)%,均较模型组显著减少(P < 0.05),随着干预浓度增加,Eq的效应增强,见图 4。
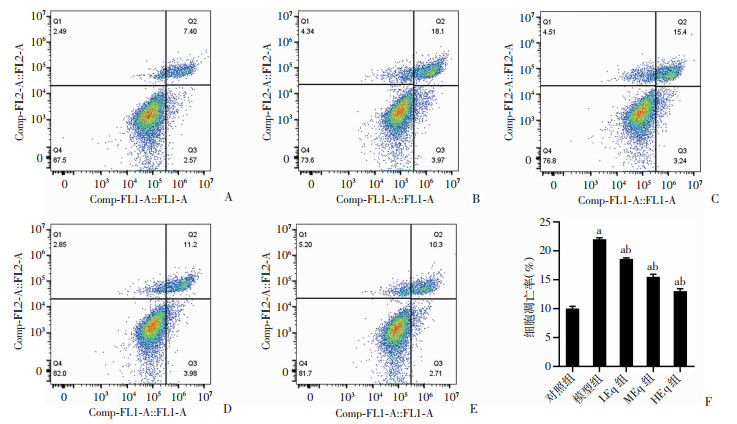
|
| A:对照组;B:模型组;C:LEq组;D:MEq组;E:HEq组;F:各组凋亡率 a:P<0.05与对照组比较;b:P<0.05与模型组比较 图 4 Eq干预对各组细胞凋亡率的影响 |
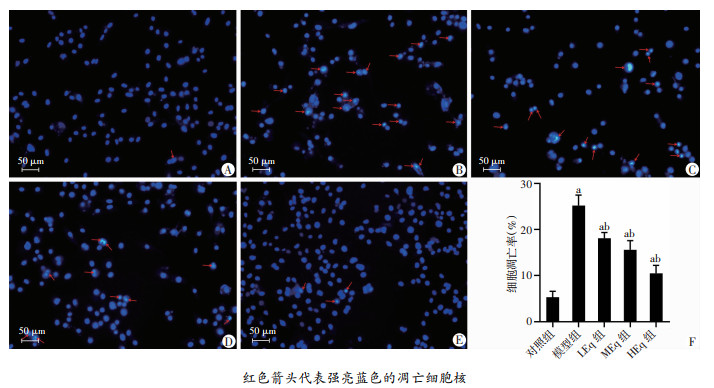
2.5 Eq干预对各组细胞核凋亡表现的影响
与对照组相比,模型组细胞核呈固缩形态或颗粒状强亮蓝色荧光显著增多(P < 0.05);不同浓度Eq干预后,呈固缩形态或颗粒状强亮蓝色荧光的凋亡核均有所减少(P < 0.05),在一定范围内Eq干预效果呈现浓度依赖效应,该凋亡率统计结果趋势与流式细胞术检测结果趋势基本一致,见图 5。
|
| A:对照组;B:模型组;C:LEq组;D:MEq组;E:HEq组;F:各组凋亡率 a:P<0.05,与对照组比较;b:P<0.05,与模型组比较 图 5 Eq干预对各组细胞凋亡细胞核的影响 (Hoechst33342染色) |
2.6 Eq干预对各组细胞线粒体结构的影响
与对照组相比,模型组高糖高脂诱导后线粒体整体形态呈肿胀状态,内部电子密度降低,嵴减少甚至消失形成空泡结构;各浓度Eq干预后线粒体整体形态改善明显,肿胀程度降低,电子密度升高,嵴数量增多或呈完整的嵴结构,随着干预浓度增加,Eq的效应增强,见图 6。

|
| A:对照组;B:模型组;C:LEq组;D:MEq组;E:HEq组 标尺为1 μm 图 6 Eq干预对各组细胞线粒体结构的影响 (透射电镜) |
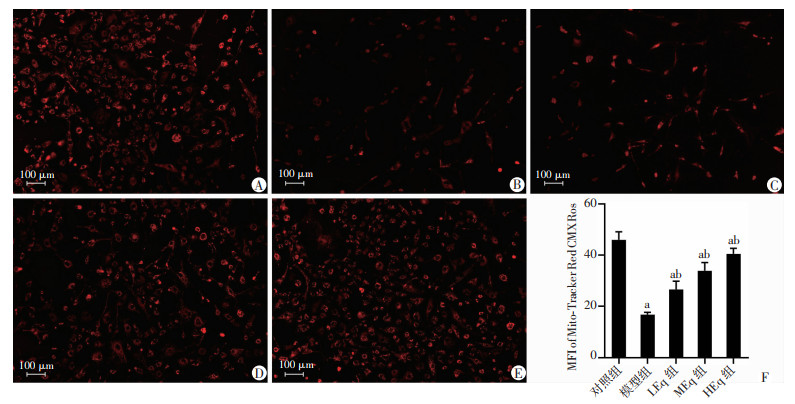
2.7 Eq干预对各组细胞线粒体膜电位(MMP)的影响
造模48 h后,成骨细胞内反映MMP大小的平均荧光强度(mean fluorescence intensity, MFI)从(46.0±3.1)(对照组)降到(16.8±0.9)(P < 0.05);Eq干预后LEq、MEq、HEq三组MFI分别从(16.8±0.9)提高到(26.6±3.2)、(33.9±3.2)、(40.5±2.2),均较模型组显著升高(P < 0.05),在一定范围内Eq干预效果呈现浓度依赖效应,见图 7。
|
| A:对照组;B:模型组;C:LEq组;D:MEq组;E:HEq组;F:各组平均荧光强度 a:P<0.05,与对照组比较;b:P<0.05,与模型组比较 图 7 Eq干预对各组细胞线粒体膜电位的影响 (Mito-Tracker Red CMXRos) |
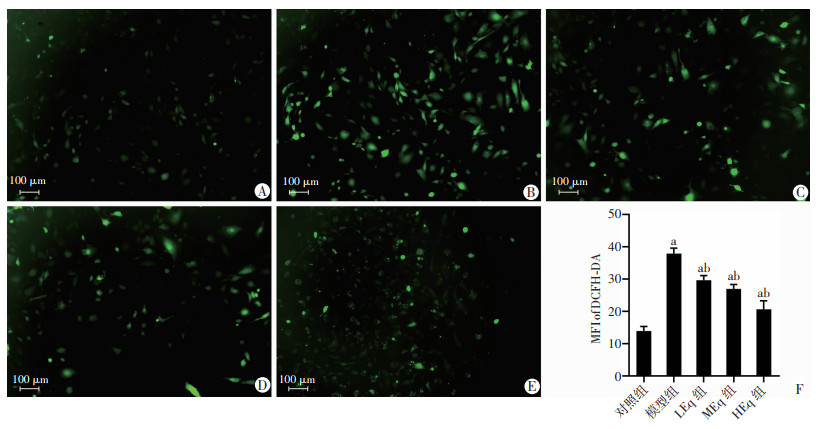
2.8 Eq干预对各组细胞活性氧(ROS)的影响
与对照组比较,模型组成骨细胞DCFH-DA探针平均荧光强度(MFI)显著增强(P < 0.05),提示细胞ROS产生明显增多;然而Eq干预后,DCFH-DA探针平均荧光强度(MFI)逐渐减弱(P < 0.05),提示不同浓度的Eq均能抑制高糖高脂诱导的ROS异常生成作用且随着干预浓度增加,Eq的效应增强,见图 8。
|
| A:对照组;B:模型组;C:LEq组;D:MEq组;E:HEq组;F:各组平均荧光强度 a:P<0.05, 与对照组比较;b:P<0.05,与模型组比较 图 8 Eq干预对各组细胞活性氧的影响 (DCFH-DA) |
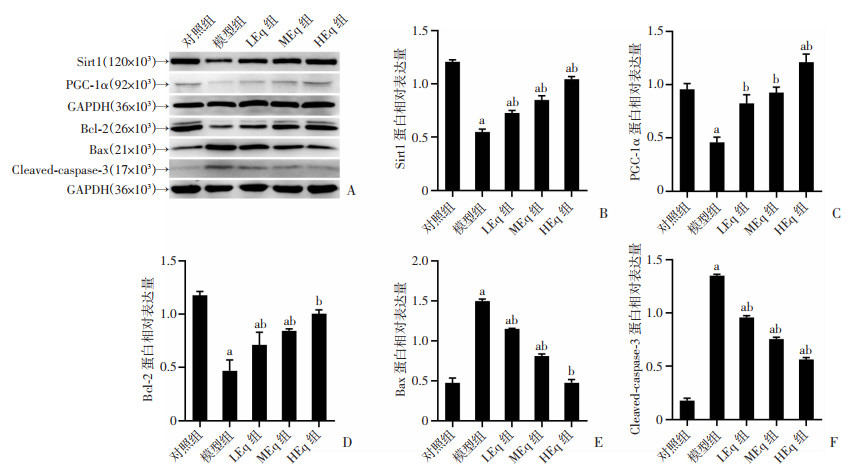
2.9 Eq干预对各组细胞Sirt1、PGC-1α、Bcl-2、Bax和Cleaved caspase-3蛋白表达的影响
与对照组比较,模型组细胞Sirt1、PGC-1α、抗凋亡蛋白Bcl-2表达水平显著降低(P < 0.05),而凋亡蛋白Bax、Cleaved caspase-3蛋白表达水平显著升高(P < 0.05);与模型组比较,各浓度Eq干预后细胞Sirt1、PGC-1α、抗凋亡蛋白Bcl-2表达水平显著升高(P < 0.05),而凋亡蛋白Bax、Cleaved caspase-3蛋白表达水平显著降低(P < 0.05),在一定范围内Eq干预效果呈现浓度依赖效应,见图 9。
|
|
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较 A:Western blot检测分析图;B~F:各蛋白相对表达量;B:Sirt1;C:PGC-1α;D:Bcl-2;E:Bax;F:Cleaved-caspase-3 图 9 Eq干预对各组细胞Sirt1、PGC-1α、Bcl-2、Bax和Cleaved caspase-3蛋白表达的影响 |
3 讨论
目前中国人群中糖尿病的发病率已经达到了11.9%[10]。DOP是大多数糖尿病患者的严重并发症之一,表现为骨强度减弱、骨量减少并伴有骨脆性增加,具有致残、致死率高等特点,给患者及社会带来沉重负担[1]。糖尿病各种并发症中的线粒体功能障碍已被证实由高血糖引起,同时线粒体功能障碍是高血糖状态下ROS产生增多的主要途径之一[11];过量的ROS产生会改变线粒体基因组并增加蛋白质的氧化,导致线粒体功能障碍,两者相互促进,产生恶性循环[12]。本实验使用30 mmol/L GLU+250 μmol/L PA诱导成骨细胞高糖高脂环境,干预结束后模型组线粒体结构受损、MMP降低和ROS产生增多,这些结果表明高糖高脂促进成骨细胞的线粒体损伤和氧化应激。
PGC-1α是多功能因子,不仅在能量平衡、线粒体氧化代谢及糖、脂代谢等中发挥重要作用,同时是线粒体生物合成的关键因子,对线粒体的维护和修复至关重要[13-14]。研究表明,糖尿病肾病、糖尿病心肌病和糖尿病神经病变等多种糖尿病并发症中PGC-1α表达明显下调[15-17],提示PGC-1α低表达在糖尿病相关并发症的发生发展中起着至关重要的作用。Sirt1是PGC-1α的上游蛋白,属于sirtuin家族,是一种烟酰胺腺苷二核苷酸依赖性转录蛋白,其介导广泛的生理功能,包括能量代谢、细胞凋亡和氧化应激等[18]。研究发现,在成骨细胞中激活Sirt1、PGC-1α可以通过抑制ROS的生成发挥抗氧化应激的作用,同时在高糖条件下培养的足细胞中检测到Sirt1、PGC-1α表达下调会导致线粒体MMP下降、细胞总ROS和线粒体ROS生成增多[19-20]。本次研究中,模型组Sirt1、PGC-1α表达显著下调,Eq干预后细胞Sirt1、PGC-1α蛋白表达水平显著升高,且线粒体结构损伤得到改善、MMP显著升高和ROS显著减少。
在糖尿病中,线粒体功能障碍和氧化应激已被证实与内皮细胞、骨骼肌细胞和心机细胞的凋亡损伤有关[11, 21],本实验高糖高脂造模后,细胞凋亡率和凋亡蛋白Cleaved caspase-3、Bax表达显著升高,而抗凋亡蛋白Bcl-2表达显著降低,提示高糖高脂诱导的线粒体损伤和氧化应激可导致成骨细胞凋亡。研究表明,Eq前体大豆苷元能有效保护线粒体和促进抗凋亡蛋白Bcl-2表达,同时抑制凋亡蛋白Bax、caspase-3表达进而减少细胞凋亡[22]。本研究不同浓度的Eq干预后细胞凋亡率和凋亡蛋白Bax、Cleaved caspase-3表达水平降低,而抗凋亡蛋白Bcl-2表达升高,提示Eq可通过减少线粒体损伤和氧化应激抑制高糖高脂诱导的细胞凋亡。
综上所述,Eq干预可有效减少高糖高脂诱导的成骨细胞线粒体损伤、氧化应激和细胞凋亡,其部分机制与Eq促进Sirt1、PGC-1α蛋白表达有关。但Eq如何调控Sirt1/PGC-1α信号通路具体机制仍不清楚,需要在下一步工作中进一步验证。本研究为揭示Eq临床防治DOP提供了新的实验依据,需要注意的是本结论基于体外研究结果,其在动物和人群中的具体作用和相关机制仍有待研究。总之,Eq作为一种天然的、副作用较小的植物雌激素,有望成为DOP的有效干预选择。
| [1] |
PASCHOU S A, DEDE A D, ANAGNOSTIS P G, et al. Type 2 diabetes and osteoporosis: a guide to optimal management[J]. J Clin Endocrinol Metab, 2017, 102(10): 3621-3634. |
| [2] |
DANDONA P, ALJADA A, CHAUDHURI A, et al. Endothelial dysfunction, inflammation and diabetes[J]. Rev Endocr Metab Disord, 2004, 5(3): 189-197. |
| [3] |
LINDBLOM R, HIGGINS G, COUGHLAN M, et al. Targeting mitochondria and reactive oxygen species-driven pathogenesis in diabetic nephropathy[J]. Rev Diabet Stud, 2015, 12(1/2): 134-156. |
| [4] |
JING Z, WANG C Y, WEN S J, et al. Phosphocreatine promotes osteoblastic activities in H2O2-induced MC3T3-E1 cells by regulating SIRT1/FOXO1/PGC-1α signaling pathway[J]. Curr Pharm Biotechnol, 2021, 22(5): 609-621. |
| [5] |
CHANDRASEKARAN K, ANJANEYULU M, CHOI J, et al. Role of mitochondria in diabetic peripheral neuropathy: influencing the NAD+-dependent SIRT1-PGC-1α-TFAM pathway[J]. Int Rev Neurobiol, 2019, 145: 177-209. |
| [6] |
YOSHINO M, NAKA A, SAKAMOTO Y, et al. Dietary isoflavone daidzein promotes Tfam expression that increases mitochondrial biogenesis in C2C12 muscle cells[J]. J Nutr Biochem, 2015, 26(11): 1193-1199. |
| [7] |
RASBACH K A, SCHNELLMANN R G. Isoflavones promote mitochondrial biogenesis[J]. J Pharmacol Exp Ther, 2008, 325(2): 536-543. |
| [8] |
江国虹, 王卓, 田颖. 雌马酚生理功能的研究进展[J]. 中华疾病控制杂志, 2010, 14(4): 341-344. JIANG G H, WANG Z, TIAN Y. Progress in the study of equol physiological function[J]. Chin J Dis Control Prev, 2010, 14(4): 341-344. |
| [9] |
MAYO B, VÁZQUEZ L, FLÓREZ A B. Equol: a bacterial metabolite from the daidzein isoflavone and its presumed beneficial health effects[J]. Nutrients, 2019, 11(9): 2231. |
| [10] |
中华医学会糖尿病学分会, 国家基层糖尿病防治管理办公室. 国家基层糖尿病防治管理指南(2022)[J]. 中华内科杂志, 2022, 61(3): 249-262. Branch of Chinese Medical Association, National Primary Diabetes Prevention and Management Office. National guidelines for the prevention and management of diabetes at primary level (2022)[J]. Chin J Intern Med, 2022, 61(3): 249-262. |
| [11] |
PINTI M V, FINK G K, HATHAWAY Q A, et al. Mitochondrial dysfunction in type 2 diabetes mellitus: an organ-based analysis[J]. Am J Physiol Endocrinol Metab, 2019, 316(2): E268-E285. |
| [12] |
RIZWAN H, PAL S, SABNAM S, et al. High glucose augments ROS generation regulates mitochondrial dysfunction and apoptosis via stress signalling cascades in keratinocytes[J]. Life Sci, 2020, 241: 117148. |
| [13] |
RIUS-PÉREZ S, TORRES-CUEVAS I, MILLÁN I, et al. PGC-1 α, inflammation, and oxidative stress: an integrative view in metabolism[J]. Oxid Med Cell Longev, 2020, 2020: 1452696. |
| [14] |
HANDSCHIN C. The biology of PGC-1α and its therapeutic potential[J]. Trends Pharmacol Sci, 2009, 30(6): 322-329. |
| [15] |
QIN X, JIANG M, ZHAO Y, et al. Berberine protects against diabetic kidney disease via promoting PGC-1α-regulated mitochondrial energy homeostasis[J]. Br J Pharmacol, 2020, 177(16): 3646-3661. |
| [16] |
WALDMAN M, COHEN K, YADIN D, et al. Regulation of diabetic cardiomyopathy by caloric restriction is mediated by intracellular signaling pathways involving 'SIRT1 and PGC-1α'[J]. Cardiovasc Diabetol, 2018, 17(1): 111. |
| [17] |
CHOI J, CHANDRASEKARAN K, INOUE T, et al. PGC-1α regulation of mitochondrial degeneration in experimental diabetic neuropathy[J]. Neurobiol Dis, 2014, 64: 118-130. |
| [18] |
SHARMA N, SHANDILYA A, KUMAR N, et al. Dysregulation of SIRT-1 signaling in multiple sclerosis and neuroimmune disorders: a systematic review of SIRTUIN activators as potential immunomodulators and their influences on other dysfunctions[J]. Endocr Metab Immune Disord Drug Targets, 2021, 21(10): 1845-1868. |
| [19] |
JING Z, WANG C Y, WEN S J, et al. Phosphocreatine promotes osteoblastic activities in H2O2-induced MC3T3-E1 cells by regulating SIRT1/FOXO1/PGC-1α signaling pathway[J]. Curr Pharm Biotechnol, 2021, 22(5): 609-621. |
| [20] |
ZHANG T, CHI Y Q, REN Y Z, et al. Resveratrol reduces oxidative stress and apoptosis in podocytes via Sir2-related enzymes, Sirtuins1 (SIRT1)/peroxisome proliferator-activated receptor γ Co-activator 1α (PGC-1α) axis[J]. Med Sci Monit, 2019, 25: 1220-1231. |
| [21] |
WANG S Q, WANG J, ZHAO A R, et al. SIRT1 activation inhibits hyperglycemia-induced apoptosis by reducing oxidative stress and mitochondrial dysfunction in human endothelial cells[J]. Mol Med Rep, 2017, 16(3): 3331-3338. |
| [22] |
任艳青, 田宇柔, 王心茹, 等. 染料木素及大豆苷元调控线粒体介导的细胞凋亡减轻京尼平诱导的肝细胞损伤[J]. 中药药理与临床, 2021, 37(1): 130-135. REN Y Q, TIAN Y R, WANG X R, et al. Genistein and daidzein regulating mitochondrial-mediated apoptosis to alleviate genipin-induced hepatocyte injury[J]. Pharmacol Clin Chin Mater Med, 2021, 37(1): 130-135. |




