骨质疏松症(osteoporosis,OP)以骨量减低、易发骨折为主要表现,其中骨质疏松性骨折是致死、致残的主要原因之一[1]。非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是全世界最常见的慢性非感染性肝病,可从单纯性脂肪变性发展为非酒精性脂肪性肝炎、肝纤维化、肝硬化,甚至肝细胞癌[2]。研究发现,肥胖可促使骨髓脂肪细胞增加、成骨细胞生成下降,通过炎细胞因子的表达、增强破骨细胞活性,以及增加瘦素、减少脂联素的分泌等途径,导致骨密度(bone mineral density,BMD)下降,增加OP的发病风险[3]。
流行病学调查显示,绝经后女性NAFLD、OP的发病率高于绝经前[4],绝经后体内循环雌激素水平下降与NAFLD和OP发病密切相关。激素代替疗法(hormone replacement therapy, HRT)曾一度成为绝经后NAFLD和OP的治疗方案[5],但长期使用会增加心脑血管疾病和肿瘤的患病风险,因此不建议长期使用,通过膳食补充植物雌激素已成为更好的选择。大豆异黄酮(soy isoflavone,SIF)是一种天然的植物化合物,其分子结构和生物活性与体内雌激素相似,研究表明,SIF可有效改善NAFLD,且SIF可通过促进胰岛素样生长因子-1 (insulin-like growth factor-1, IGF-1)表达促进成骨细胞生长[6]。雌马酚(equol,Eq)是SIF在肠道的代谢产物,Eq比其前体更稳定,清除率更低,具有类雌激素活性,同时没有人工合成雌激素相关的副作用,表现出很强的抗炎、抗氧化作用[7]。
IGF-1及炎症因子在骨重塑中发挥重要作用。IGF-1可通过促进成骨细胞的增殖,增强骨骼的生长和骨矿化,改善BMD,预防OP的发生[8];白细胞介素(interleukin,IL)-6和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎症因子的释放,可促进破骨细胞活性,导致BMD下降[9]。研究发现NAFLD中IGF-1表达降低、炎症因子增多[10],通过改善NAFLD可能有助于骨质疏松的防治。研究发现,IGF-1的表达受雌激素信号的调控,雌激素和SIF均可上调IGF-1表达[11-12];Eq可通过调节炎症和骨代谢来抑制类风湿关节炎的发展,发挥骨保护效应[13]。但目前国内外关于Eq对绝经后NAFLD合并OP的作用研究甚少。本研究通过高脂饮食(high-fat diet,HFD)联合去卵巢(ovariectomized,OVX)建立绝经后NAFLD模型,通过检测BMD、IGF-1、炎症因子等表达情况观察Eq对大鼠骨组织的影响,并探讨其作用机制,为绝经后女性的膳食指导提供新的理论支撑。
1 材料与方法 1.1 主要试剂与仪器高脂饲料成分:15%猪油+5%蛋黄粉+2%胆固醇+1%白糖+77%普通饲料(华阜康生物科技,北京),普通饲料由陆军军医大学实验动物中心提供。戊巴比妥钠(Sigma公司, 美国);Eq及雌二醇(estradiol,E2),(大赛璐药物手性技术有限公司,上海);超敏ECL化学发光试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、cDNA第一链合成试剂盒(Beyotime公司,上海);大鼠雌激素、TNF-α、IL-6 ELISA试剂盒(慧嘉生物科技有限公司,厦门);总RNA提取试剂盒、IGF-1抗体、GAPDH抗体、过氧化物酶偶联的二抗、引物(生工Sangon Biotech,上海);SYBR Green染料qPCR试剂(ABclonal生物科技有限公司,武汉); 全波长多功能酶标仪(THERMO,美国);电泳槽、转膜槽(美国Bio-rad);超灵敏化学发光成像系统(FluorQuant AC600,美国ACURONBIO);PCR仪(CFX connect,美国Bio-rad);双能X射线骨密度仪(GE Lunar_iDXA,美国);Micro-CT(SkyScan1272;德国Bruker)。
1.2 动物模型建立与干预Sprague Dawley(SD)大鼠48只,6周龄,雌性,体质量(200±20) g,购自北京华阜康生物科技股份有限公司。动物饲养于陆军军医大学动物实验中心,12 h昼夜节律,室温(24±2)℃,湿度50%~60%,自由进食水。适应性喂养2周后,大鼠腹腔注射戊巴比妥钠40 mg/kg麻醉,进行去卵巢手术(OVX)或假手术(仅切除卵巢周边脂肪组织)。大鼠分为对照组(Con)、模型组(Mod)、雌马酚低剂量组[Eq-L,20 mg/(kg·d)]、雌马酚中剂量组[Eq-M,40 mg/(kg·d)]、雌马酚高剂量组[Eq-H,80 mg/(kg·d)]、雌二醇干预组[E2,2.5 mg/(kg·d)],每组8只,对照组进行假手术和普通饲料喂养,其余各组进行OVX及高脂饲料喂养。手术1周后,对各组大鼠进行灌胃干预,Eq和E2溶解于二甲基亚砜(DMSO)及玉米油中,对照组给予等量DMSO+玉米油,每周定期称体质量,连续灌胃16周。
1.3 取材和样本处理干预结束后,GE Lunar_iDXA双能X射线骨密度仪检测双侧股骨干骺端BMD;采用Micro-CT平扫检测股骨结构并进行三维重建,选取距生长板1 mm为起点,长3 mm为分析区域,使用CTvox软件进行微结构参数分析,主要包括骨体积分数(bone volume/total volume,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数目(trabecular number,Tb.N)和骨小梁间隙(trabecular separation,Tb.Sp);大鼠禁食12 h后,测量大鼠身长(鼻尖至肛门长度)并称体质量,使用戊巴比妥钠麻醉后,处死并取材。按照以下公式计算BMI和Lee’s指数评估肥胖程度。
1.3.1 血液样本取大鼠股动脉血,血液静置分层后,4 ℃,4 000 r/min,离心10 min,后获得血清,置于-80 ℃储存。
1.3.2 肝脏样本使用PBS反复灌注大鼠循环系统后,取肝脏,并称量,将部分肝组织用4%多聚甲醛固定进行形态学检测,其余部分-80 ℃保存。
1.3.3 股骨样本剔除股骨多余肌肉组织,将左侧股骨置于4%多聚甲醛中固定,用于形态学检测,右侧股骨置于-80 ℃,用于蛋白和基因表达检测。
1.4 形态学检测 1.4.1 苏木精伊红(hematoxylin-eosin,HE)染色将4%多聚甲醛中固定的肝组织行脱水处理、股骨组织用15%EDTA进行脱钙处理,石蜡包埋,常规切片3~5 μm,苏木精、伊红染色后显微镜观察肝、骨组织形态学变化。
1.4.2 油红O染色股骨组织切片后放入60%异丙醇中浸洗2 min,油红O染液染色10 min后,60%异丙醇分化至背景干净后使用蒸馏水漂洗,苏木精复染5 min,再次使用蒸馏水漂洗,干燥后封片,显微镜下观察脂滴累积情况。
1.5 血清指标检测按照ELISA试剂盒说明书检测血清雌激素、IL-6和TNF-α的含量。
1.6 Western blot检测分别取大鼠肝组织和股骨组织提取总蛋白,BCA法测定浓度并定量处理,按照常规操作进行电泳、转膜,脱脂牛奶封闭后,4 ℃一抗孵育过夜,TBST洗膜后二抗室温孵育1 h,TBST洗涤3次后曝光显影,以GAPDH为内参,ImageJ软件分析各组蛋白相对表达量。
1.7 qRT-PCR检测用TRIzol试剂提取大鼠肝组织和股骨总RNA,测定总RNA浓度及纯度,用cDNA第一链合成试剂盒将RNA返转录为cDNA。Real-time PCR反应体系为10 μL(引物1 μL,cDNA 4 μL,Mix 5 μL),反应条件:95 ℃预变性5 min,95 ℃ 5 s,59 ℃ 15 s,72 ℃ 20 s,65~95 ℃共45个循环,各组样品扩增反应的Ct值,以GAPDH作为内参基因,比较周期阈值(CT),2-ΔΔCt法计算mRNA的相对表达量。引物序列见表 1。
| 基因 | 引物序列(5′→3′) |
| IGF-1 | F: ACAGACGGGCATTGTGGAT R: GATAGGGGCTGGGACTTCTG |
| GAPDH | R: GCCAGCCTCGTCTCATAGACA F: AGAGAAGGCAGCCCTGGTAAC |
1.8 统计学分析
采用SPSS 26.0统计软件进行分析,计量资料使用x±s表示,多组间使用单因素方差分析(ANOVA)进行比较,然后进行Tukey事后检验。P < 0.05被认为差异具有统计学意义。
2 结果 2.1 各组大鼠BMD、BMI和Lee’s指数比较与Con组比较,Mod组BMI和Lee’s指数分别上升了24.5%、7.2%,BMD下降8.3%,差异具有统计学意义(P < 0.05);与Mod组相比,Eq-M、Eq-H和E2干预,可使BMI和Lee’s指数显著下降,并显著增加BMD水平(P < 0.05),且可观察到Eq-H和E2组的BDM水平改善较好,与Con组接近;Eq干预各组、E2组组间比较,除Eq-H组BMD较Eq-L显著升高(P < 0.05),干预各组BMI、Lee’s和BMD比较差异均无统计学意义(P>0.05),见图 1。
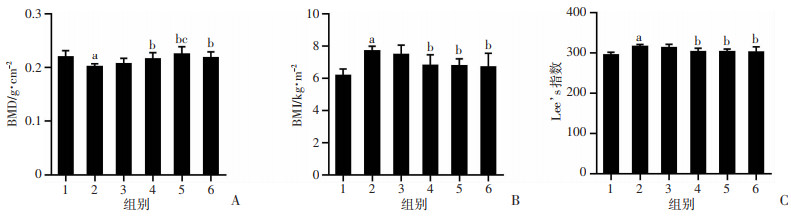
|
|
1: Con组; 2: Mod组; 3: Eq-L组; 4: Eq-M组; 5: Eq-H组; 6: E2组;a: P < 0.05, 与Con组比较; b: P < 0.05, 与Mod组比较;c: P < 0.05, 与Eq-L组比较 A:BMD;B:BMI;C:Lee’s指数 图 1 各组大鼠BMD、BMI、Lee’s指数比较(n=8) |
2.2 Eq对肝组织形态学的影响
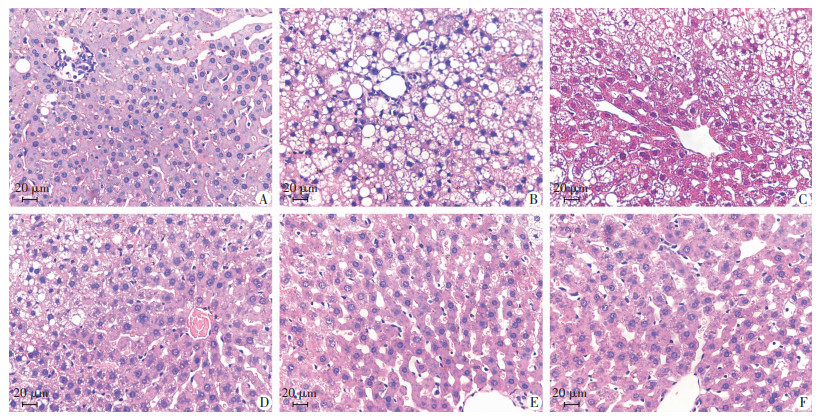
肝组织HE染色可观察到,Con组肝细胞排列整齐规则,中央静脉完整,肝小叶结构清晰(图 2A),Mod组肝细胞肿胀明显,排列紊乱,可见大量脂滴空泡和炎性细胞浸润(图 2B);Eq-L组仍可见少了脂滴空泡,Eq-M、Eq-H组肝细胞排列逐步恢复正常,脂肪病变减轻,与E2组干预效果相似(图 2C~F)。
|
| A: Con组; B: Mod组; C: Eq-L组; D: Eq-M组; E: Eq-H组; F: E2组 图 2 各组大鼠肝脏HE染色观察 |
2.3 Eq对各组股骨微结构变化的影响
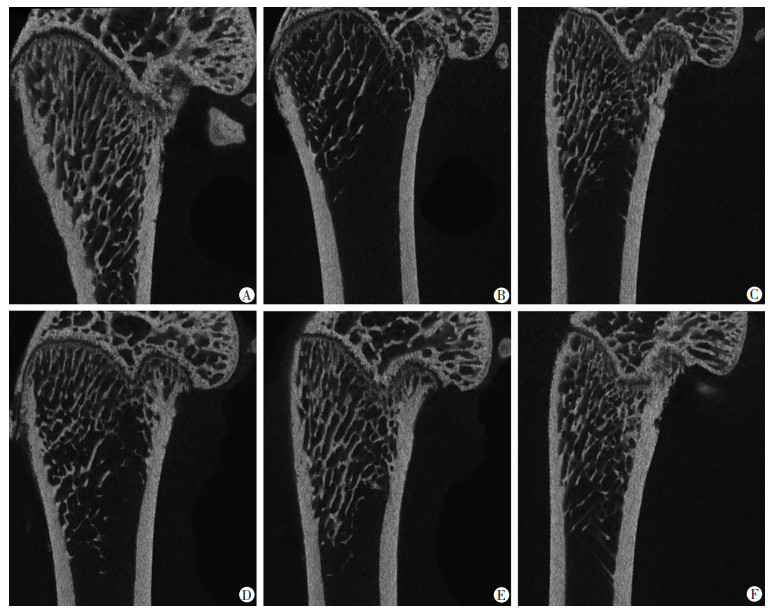
Micro-CT结果显示,与Con组相比,Mod组大鼠骨小梁组织缺失明显,排列稀疏、紊乱,间隔较大;与Mod组相比,Eq和E2干预后,各组大鼠骨小梁数量增多,厚度变厚,组织完整,排列整齐,间隔缩小(图 3)。Mod组骨体积分数、骨小梁厚度、骨小梁数均显著低于Con组,骨小梁间隙显著高于Con组(P < 0.05);Eq-M、Eq-H和E2组骨体积分数、骨小梁厚度、骨小梁数均显著高于Mod组和Eq-L组,骨小梁间隙显著低于Mod组(P < 0.05);Eq-H和E2组干预效果相似,接近Con组水平, 见表 2。
|
| A: Con组; B: Mod组; C: Eq-L组; D: Eq-M组; E: Eq-H组; F: E2组 图 3 各组大鼠股骨形态学结构 |
| 组别 | 例数 | 骨体积分数(%) | 骨小梁厚度/mm | 骨小梁数/1·mm-1 | 骨小梁间隙/mm |
| Con | 8 | 27.16±6.335 | 0.080±0.003 | 3.298±0.435 | 0.194±0.065 |
| Mod | 8 | 10.37±2.444a | 0.065±0.002a | 0.623±0.414a | 0.533±0.118a |
| Eq-L | 8 | 9.14±2.703 | 0.070±0.003b | 1.069±0.285 | 0.399±0.093b |
| Eq-M | 8 | 20.97±4.255b | 0.078±0.002b | 3.012±0.815b | 0.328±0.018b |
| Eq-H | 8 | 25.48±1.896b | 0.083±0.003b | 3.653±0.841b | 0.222±0.021b |
| E2 | 8 | 28.78±3.71b | 0.081±0.002b | 3.385±0.882b | 0.252±0.049b |
| a: P < 0.05:与Con组比较;b: P < 0.05,与Mod组比较 | |||||
2.4 Eq对髓腔内脂肪细胞的影响
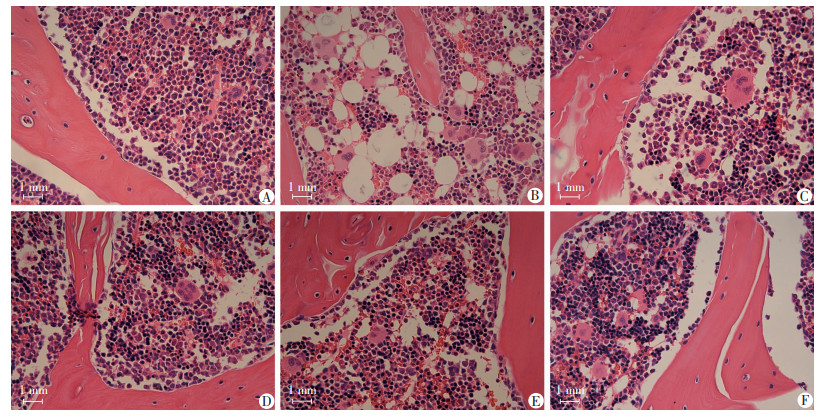
HE染色可观察到,与Con组相比,Mod组髓腔内存在大量空泡状脂滴分布,有核细胞数量显著减少,巨核细胞数量无明显变化(图 4A、B);与Mod组相比,Eq和E2干预后,髓腔内脂滴聚集逐步减少,其中Eq-M和Eq-H组的改善效果较好,与E2组效果相似,(图 4C~F)。油红O染色可观察到,与Con组相比,Mod组股骨内有大量红染脂滴蓄积(图 5A、B); 与Mod组比较,Eq干预各组可见股骨内脂滴随Eq干预剂量上升而逐步减少,其中高剂量Eq干预效果与E2组相似(图 5C~F)。
|
| A: Con组; B: Mod组; C: Eq-L组; D: Eq-M组; E: Eq-H组; F: E2组 图 4 各组大鼠股骨HE染色观察 |

|
| A: Con组; B: Mod组; C: Eq-L组; D: Eq-M组; E: Eq-H组; F: E2组 图 5 各组大鼠股骨油红O染色观察(×200) |
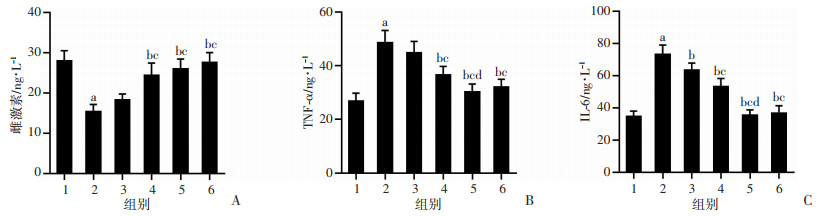
2.5 Eq对血清雌激素、TNF-α和IL-6的影响
与Con组比较,Mod组血清雌激素水平显著下降44.9%(P < 0.05),血清TNF-α、IL-6分别升高1.8、2.1倍,差异具有统计学意义(P < 0.05);Eq-M、Eq-H和E2组雌激素水平显著高于Mod组(P < 0.05),Eq-M、Eq-H和E2组间雌激素水平相比差异无统计学意义。与Mod组比较,Eq-M、Eq-H和E2组TNF-α、IL-6水平显著降低(P < 0.05);Eq和E2干预各组之间相比,干预各组的TNF-α、IL-6水平显著低于Eq-L组(P < 0.05),Eq-H组的TNF-α水平显著低于Eq-M组,高剂量Eq干预与E2干预效果相当,水平与Con组接近,其余组内之间差异无统计学意义,见图 6。
|
|
1: Con组; 2: Mod组; 3: Eq-L组; 4: Eq-M组; 5: Eq-H组; 6: E2组;a: P < 0.05,与Con组比较; b: P < 0.05,与Mod组比较; c: P < 0.05与,Eq-L组比较; d: P < 0.05,与Eq-M组比较 A: 雌激素;B: TNF-α;C: IL-6 图 6 各组大鼠血清雌激素、TNF-α和IL-6含量比较(n=8) |
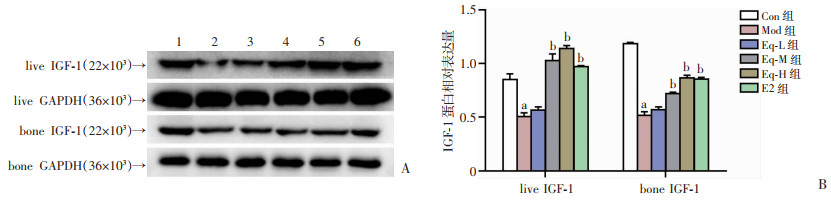
2.6 Eq对IGF-1蛋白表达的影响
与Con组相比,Mod组肝和股骨组织中IGF-1的蛋白表达显著减少(P < 0.05)。相比于Mod组,中、高剂量Eq和E2干预后,肝和骨组织中IGF-1蛋白的表达均显著上调(P < 0.05),见图 7。
|
| A: Western blot检测结果1: Con组; 2: Mod组; 3: Eq-L组; 4: Eq-M组; 5: Eq-H组; 6: E2组; B: 半定量分析(n=3);a: P < 0.05,与Con组比较; b: P < 0.05,与Mod组比较 图 7 各组大鼠肝和股骨IGF-1蛋白表达水平比较 |
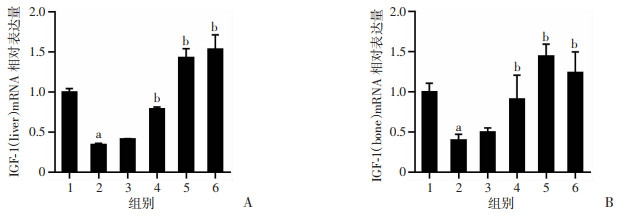
2.7 Eq对IGF-1 mRNA表达的影响
与Con组相比,Mod组肝和骨组织中IGF-1的mRNA表达显著降低(P < 0.05)。相比于Mod组,Eq-M、Eq-H、E2组大鼠肝和骨组织中IGF-1的mRNA表达水平升高(P < 0.05),与Western blot结果一致,见图 8。
|
|
1: Con组; 2: Mod组; 3: Eq-L组; 4: Eq-M组; 5: Eq-H组; 6: E2组; a: P < 0.05,与Con组比较; b: P < 0.05,与Mod组比较 A: 肝组织IGF-1 mRNA相对表达量; B: 股骨组织IGF-1 mRNA相对表达量(n=3) 图 8 各组大鼠肝和股骨IGF-1 mRNA表达水平比较 |
3 讨论
OP是以骨量减少和骨微结构恶化为特征的疾病,导致骨脆性和骨折的风险增加。雌激素对OP具有保护作用,绝经后女性由于卵巢功能衰退引起循环雌激素水平下降导致骨质吸收远高于骨质形成,致使绝经后女性OP发病率远高于绝经前[14]。更年期女性雌激素水平下降会增加胰岛素抵抗(IR)和内脏脂肪积累的风险,这是肥胖和NAFLD关键因素。研究发现,NAFLD患者发生OP风险是对照组的1.35倍,提示肥胖也是OP的发病因素,绝经后女性合并NAFLD会增加患者发生OP的风险[15-16]。肥胖引起的骨髓内脂肪细胞增多可影响成骨细胞的分化和功能,增加破骨细胞活性并影响骨矿化[17],因此针对NAFLD的防治可能有益于改善绝经后女性OP。HRT虽可以降低绝经后女性NAFLD和OP的患病风险,但不推荐把HRT作为一种长期治疗手段,因此探索一种安全有效、易于长期坚持的治疗方法很有意义。Eq在改善女性更年期症状、预防心血管疾病以及乳腺癌等方面显示出良好的干预效果,相比于其他异黄酮类化合物,其结构更稳定、易于吸收、清除率低,具有更强的类雌激素效应[18]。
本研究通过OVX+HFD诱导NAFLD模型,模拟绝经后女性NAFLD和OP相关病变,验证Eq对绝经后NAFLD大鼠的骨保护效应,通过检测炎症因子和IGF-1表达,探讨其作用机制。本研究干预结束时,与Con组比较,Mod组雌激素水平显著降低,肝脏组织学检查可见大面积的脂肪变性,反映肥胖的Lee’s指数及BMI显著升高[19],对骨组织的检测发现Mod组股骨髓腔内脂滴累计明显增多,BMD显著下降,骨小梁间隙增大,排列紊乱,骨微结构破坏明显,提示模型建立成功。Eq和E2干预可减少肝脏的脂肪变性,降低BMI和Lee’s指数,同时BMD水平显著增高,骨微结构明显改善,这表明Eq可通过类雌激素效应缓解绝经后NAFLD大鼠的骨量丢失。
TNF-α、IL-6可促进NAFLD发生发展,一方面TNF-α和IL-6可通过诱发IR导致肝脂质合成增加,另一方面IR状态下脂质合成增加造成脂质异常累积会促进TNF-α、IL-6等炎症因子的释放,造成炎症、IR和NAFLD的恶性循环[20]。同时,肥胖状态下脂肪细胞会增加TNF-α、IL-6等炎症细胞因子分泌使机体长期保持慢性低度炎症反应[21]。炎性细胞因子也是OP的主要介质,其水平上升可导致骨量丢失增多。研究发现TNF-α可抑制成骨细胞分化,诱导成骨细胞及其前体细胞凋亡,并且能通过促进破骨细胞分化、抑制其凋亡,促进OP的发生[22]。雌激素水平与炎症反应密切相关,雌激素水平下降会导致TNF-α、IL-6分泌增多诱发机体炎症反应[23]。有研究表明,Eq可通过抑制TNF-α、IL-6等炎症因子表达减轻炎症反应[24]。在本研究中,与Con组比较,Mod组雌激素水平显著降低,股骨骨髓腔内有大量脂滴蓄积,循环TNF-α、IL-6水平显著升高。本研究干预结束时,Eq干预组血清雌激素水平维持在较高水平,股骨骨髓腔内脂滴减少,同时血清TNF-α、IL-6较Mod组显著降低,中高剂量Eq效果更为显著,Eq-H与E2干预效果相当。
IGF-1是调节骨骼生长的重要细胞因子,一方面可通过旁分泌、自分泌和内分泌等形式,促进成骨细胞(osteoblast,OB)增殖、分化,另一方面可通过抑制胶原酶合成减少胶原降解,促进骨基质合成与矿化[25]。IGF-1主要在肝脏合成,研究发现NAFLD会引起IGF-1水平下降,导致OB数量及活性下降,引起骨质流失,导致OP发生[26]。同时IGF-1受雌激素信号通路的调控,雌激素可以促进IGF-1的表达[27]。绝经后女性IGF-1水平较绝经前女性显著降低,从而会增加OP的患病风险[28]。研究发现,SIF可通过促进大鼠成骨细胞分泌IGF-1增加成骨细胞形成[6];另有研究发现,Eq前体大豆苷元可促进肝组织IGF-1表达对OP发挥保护效应[29]。本研究干预结束时,Mod组BMD水平、肝脏和股骨组织IGF-1表达水平较Con组显著降低,经过不同剂量Eq干预,大鼠BMD水平,肝脏和股骨组织IGF-1表达均较Mod组显著升高,具有一定的剂量依赖效应,与E2干预效果相似。
综上所述,Eq对绝经后NAFLD具有一定的骨保护效应,其部分机制可能与Eq通过提高机体雌激素水平、抑制炎症因子表达和促进IGF-1表达有关。但本研究仍存在一定的局限性:①仅检测了IGF-1蛋白和mRNA的表达,未对骨组织中IGF-1下游相关信号通路进行验证,缺乏IGF-1对骨保护作用的直接验证;②Eq是直接促进了IGF-1表达,还是通过改善脂肪肝从而使IGF-1含量升高仍不明确;③Eq改善NAFLD、OP的机制可能并不唯一,能否在人群中发挥保护效应仍需验证,这些需要在后续实验中进行完善。
本研究为揭示Eq防治绝经后女性NAFLD合并OP提供了新的实验依据,Eq作为一种天然的、副作用较小的植物雌激素,有望成为改善绝经后女性NAFLD合并骨密度下降的有效干预药物。
| [1] |
ARCEO-MENDOZA R M, CAMACHO P M. Postmenopausal osteoporosis: latest guidelines[J]. Endocrinol Metab Clin North Am, 2021, 50(2): 167-178. |
| [2] |
SHEN Z, CEN L, CHEN X F, et al. Increased risk of low bone mineral density in patients with non-alcoholic fatty liver disease: a cohort study[J]. Eur J Endocrinol, 2020, 182(2): 157-164. |
| [3] |
鲍晓雪, 王娜, 李玉坤. 肥胖与骨质疏松症关系的研究进展[J]. 中华临床医师杂志(电子版), 2015, 9(14): 2749-2753. BAO X X, WANG N, LI Y K. Advances in the relationship between obesity and osteoporosis[J]. Chin J Clin Electron Ed, 2015, 9(14): 2749-2753. |
| [4] |
LEE D Y, PARK J K, HUR K Y, et al. Association between nonalcoholic fatty liver disease and bone mineral density in postmenopausal women[J]. Climacteric, 2018, 21(5): 498-501. |
| [5] |
MANSON J E, CHLEBOWSKI R T, STEFANICK M L, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative Randomized Trials[J]. JAMA, 2013, 310(13): 1353-1368. |
| [6] |
田玉慧, 李万里, 杨献军, 等. 大豆异黄酮对成骨细胞生长因子表达的影响[J]. 中国公共卫生, 2003, 19(12): 1438-1439. TIAN Y H, LI W L, YANG X J, et al. Effect of soybean isoflavone on ICF-1 expression of osteoblstic cells[J]. China Public Health, 2003, 19(12): 1438-1439. |
| [7] |
MUTHYALA R S, JU Y H, SHENG S B, et al. Equol, a natural estrogenic metabolite from soy isoflavones: convenient preparation and resolution of R- and S-equols and their differing binding and biological activity through estrogen receptors alpha and beta[J]. Bioorg Med Chem, 2004, 12(6): 1559-1567. |
| [8] |
陈小香, 邓伟民, 魏秋实, 等. 从GH/IGF-1轴与PI3K/Akt通路探讨老年骨质疏松症的发病机制[J]. 中国骨质疏松杂志, 2015, 21(11): 1412-1415. CHEN X X, DENG W M, WEI Q S, et al. Investigation of the pathogenesis of senile osteoporosis from GH/IGF-1 axis and PI3K/Akt pathway[J]. Chin J Osteoporos, 2015, 21(11): 1412-1415. |
| [9] |
李崇, 罗晓婷, 纪舒妤, 等. 炎症因子在骨质疏松发病机理中的研究进展[J]. 中国骨质疏松杂志, 2021, 27(10): 1516-1522. LI C, LUO X T, JI S Y, et al. Research on the progress of inflammatory factors in the pathogenesis of osteoporosis[J]. Chin J Osteoporos, 2021, 27(10): 1516-1522. |
| [10] |
陈景娴, 栾晓军, 陈劲松. 非酒精性脂肪肝与骨密度关联研究的相关进展[J]. 中国骨质疏松杂志, 2018, 24(10): 1396-1400. CHEN J X, LUAN X J, CHEN J S. Progress in research on the association between nonalcoholic fatty liver disease and bone mineral density[J]. Chin J Osteoporos, 2018, 24(10): 1396-1400. |
| [11] |
CARDIM H J P, LOPES C M C, GIANNELLA-NETO D, et al. The insulin-like growth factor-I system and hormone replacement therapy[J]. Fertil Steril, 2001, 75(2): 282-287. |
| [12] |
GEORGE K S, MUñOZ J, AKHAVAN N S, et al. Is soy protein effective in reducing cholesterol and improving bone health?[J]. Food Funct, 2020, 11(1): 544-551. |
| [13] |
LIN I C, YAMASHITA S, MURATA M, et al. Equol suppresses inflammatory response and bone erosion due to rheumatoid arthritis in mice[J]. J Nutr Biochem, 2016, 32: 101-106. |
| [14] |
MALAIRUNGSAKUL O, WIWATANADATE P. Factors related to osteoporosis of postmenopausal women in Phayao, Thailand[J]. Arch Osteoporos, 2013, 8(1): 154. |
| [15] |
CHEN H J, YANG H Y, HSUEH K C, et al. Increased risk of osteoporosis in patients with nonalcoholic fatty liver disease: a population-based retrospective cohort study[J]. Medicine, 2018, 97(42): e12835. |
| [16] |
CHEN D Z, XU Q M, WU X X, et al. The combined effect of nonalcoholic fatty liver disease and metabolic syndrome on osteoporosis in postmenopausal females in Eastern China[J]. Int J Endocrinol, 2018, 2018: 2314769. |
| [17] |
GUNARATNAM K, VIDAL C, GIMBLE J M, et al. Mechanisms of palmitate-induced lipotoxicity in human osteoblasts[J]. Endocrinology, 2014, 155(1): 108-116. |
| [18] |
SETCHELL K D R, CLERICI C, LEPHART E D, et al. S-equol, a potent ligand for estrogen receptor beta, is the exclusive enantiomeric form of the soy isoflavone metabolite produced by human intestinal bacterial flora[J]. Am J Clin Nutr, 2005, 81(5): 1072-1079. |
| [19] |
朱磊, 路瑛丽, 冯连世, 等. 不同配方高脂饲料构建SD大鼠肥胖模型的实验研究[J]. 中国运动医学杂志, 2016, 35(7): 642-647. ZHU L, LU Y L, FENG L S, et al. Experimental study on establishing obese model of male SD rat with different fat percentages in high-fat diet[J]. Chin J Sports Med, 2016, 35(7): 642-647. |
| [20] |
FRIEDMAN S L, NEUSCHWANDER-TETRI B A, RINELLA M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24(7): 908-922. |
| [21] |
MONTEIRO R, AZEVEDO I. Chronic inflammation in obesity and the metabolic syndrome[J]. Mediators Inflamm, 2010, 2010: 289645. |
| [22] |
MUNDY G R. Osteoporosis and inflammation[J]. Nutr Rev, 2007, 65(12 pt 2): S147-S151. |
| [23] |
陈怡洁, 金雪静, 王雪, 等. 雌激素及炎症因子与绝经后骨质疏松症相关研究进展[J]. 国际妇产科学杂志, 2020, 47(6): 712-715. CHEN Y J, JIN X J, WANG X, et al. Research progress on the relationship between estrogen, inflammatory factors and postmenopausal osteoporosis[J]. J Int Obstet Gynecol, 2020, 47(6): 712-715. |
| [24] |
SUBEDI L, JI E, SHIN D, et al. Equol, a dietary daidzein gut metabolite attenuates microglial activation and potentiates neuroprotection in vitro[J]. Nutrients, 2017, 9(3): 207. |
| [25] |
GAO S T, LV Z T, ZHOU C K, et al. Association between IGF-1 polymorphisms and risk of osteoporosis in Chinese population: a meta-analysis[J]. BMC Musculoskelet Disord, 2018, 19(1): 141. |
| [26] |
覃玉君. 脂肪肝与骨质疏松症的相关性[J]. 医学理论与实践, 2020, 33(2): 207-208, 206. QIN Y J. Correlation between fatty liver and osteoporosis[J]. J Med Theory Pract, 2020, 33(2): 207-208, 206. |
| [27] |
薛歆, 董进. 雌激素对成骨细胞增殖及TGF-β1、IGF-1 mRNA表达的影响[J]. 中国医药指南, 2013, 11(14): 88-90. XUE X, DONG J. Effects of estrogen on osteoblast proliferation and TGF-β1 and IGF-1 mRNA expression[J]. Guide China Med, 2013, 11(14): 88-90. |
| [28] |
Y ZHAO H, M LIU J, NING G, et al. Relationships between insulin-like growth factor-I (IGF-I) and OPG, RANKL, bone mineral density in healthy Chinese women[J]. Osteoporos Int, 2008, 19(2): 221-226. |
| [29] |
高美. 成年雌性大鼠骨重建机理及大豆甙元干预作用研究[D]. 南京: 南京师范大学, 2009. GAO M. Study on the mechanism of bone remodeling in adult rats and the intervention effect of daidzein[D]. Nanjing: Nanjing Normal University, 2009. 10. 7666/d. d183248. |





