2. 400016 重庆,重庆医科大学免疫学教研室;
3. 400016 重庆,重庆医科大学生物化学与分子生物学教研室
2. Department of Immunology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China;
3. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
肺癌是癌症死亡的主要原因。肺癌包括小细胞肺癌及非小细胞肺癌[1]。肺腺癌是最常见的肺癌亚型(40%),患者5年总生存率为4%~17%[2-3]。目前手术后放化疗仍是其主要治疗手段,化疗药物主要通过靶向DNA损伤或有丝分裂进程诱导细胞凋亡,但由于化疗药物自身毒性且癌细胞易产生耐药性,严重制约了临床应用[3-4]。因此,筛选耐药相关基因,并阐明其在肿瘤发生发展及耐药中的分子机制,对发展联合治疗具有重要意义。
蛋白磷酸激酶在各种生命活动中起关键作用,且功能异常与多种疾病的发生密切相关[5]。丝裂源蛋白激酶激酶激酶激酶(mitogen-activated protein kinase kinase kinase kinase,MAP4Ks) 家族是细胞内的一类丝氨酸/苏氨酸蛋白激酶,属于哺乳动物Ste20激酶(sterile 20 kinase, Ste20) 家族的一员。MAP4Ks家族由MAP4K1~7共7个激酶成员组成,其中MAP4K4、畸形相关激酶(misshapen/NIK-related kinase,MINK1)和肿瘤坏死因子受体相关因子2与酪氨酸激酶衔接蛋白相关激酶(TRAF2 and Nck interacting kinase,TNIK)具有较高序列相似性,且研究报道显示其功能存在部分重叠[6-8]。如MAP4K4、MINK1和TNIK在修饰LAST1/2调控Hippo通路活性感受细胞外机械信号刺激过程中具有相似作用,但对于其在恶性肿瘤中的表达及功能仍知之甚少[9]。本课题组前期研究发现肺腺癌细胞中敲减MAP4K4表达可诱导细胞成簇生长,扰乱上皮-间质动态转换[10];而敲减TNIK表达细胞表型与敲减MAP4K4无显著相似性,且可扰乱微丝骨架组装并抑制细胞增殖、迁移[11],但肺癌细胞中TNIK调节微丝骨架组装牵涉的具体分子机制及潜在生物学意义仍不明确。
本研究综合利用免疫荧光及RNA-seq分析,观测肺腺癌A549细胞中敲减TNIK表达对微丝及微管骨架形态的影响,并探索其调控细胞骨架形态的潜在分子机制,以期深入解析MAP4Ks家族成员在生理及病理条件下对细胞生命活动的调节机制及在恶性肿瘤发生发展中的作用。
1 材料与方法 1.1 材料与试剂肺腺癌A549细胞系、人胚肾细胞HEK-293T细胞系和pLKO.1-Puro质粒均由本课题组保存。Opti-MEDTM培养基、转染试剂Lipofectamine3000和TRIzolTM均购于Thermo Scientific公司;胎牛血清(FBS)和青霉素-链霉素溶液购于百赛生物;DMEM高糖培养基、DMEM/F12培养基购于Gibco公司;总RNA提取试剂盒购于碧云天生物技术公司;逆转录试剂和TB GreenTM Premix Ex TaqTM (Tli RNaseH Plus) qRT-PCR试剂均购于TaKaRa公司;引物由擎科生物科技有限公司合成;BCA蛋白浓度检测试剂、蛋白裂解液RIPA、蛋白酶抑制剂苯甲基磺酰氟(PMSF)和聚偏二氟乙烯膜(PVDF)(0.22 μm/0.45 μm)均购于北京鼎国昌盛生物技术公司;SDS-PAGE凝胶试剂盒购于雅酶生物医药科技公司;CCK-8试剂盒购于Dojindo Laboratories Japan;TNIK、LIMK1、RhoA、RhoB、Cdc42和Rac1/2/3抗体均购于Cell Signaling Technology公司;α-Tubulin抗体和鬼笔环肽染料购于Sigma公司;GAPDH抗体和辣根过氧化物酶(HRP) 标记的二抗购于Proteintech公司;紫杉醇(paclitaxel, PTX)购于Selleck Chemicals公司。
1.2 方法 1.2.1 细胞培养A549细胞和HEK-293T细胞分别培养于含10% FBS和1% 双抗DMEM/F12培养基和DMEM高糖培养基中。在37 ℃、5% CO2的无菌条件下培养细胞。
1.2.2 构建pLKO.1-Puro-shTNIK载体及慢病毒包装使用网站(www.sigmaaldrich.cn) 设计靶向TNIK基因的shRNA序列,1号靶序列: 5′-GCCTCAAGAAC-AACTTCTAT-3′; 2号靶序列: 5′-CCATCTCATATTCA-GGGCAAT-3′,并由华大基因公司合成引物序列。pLKO.1-Puro-shTNIK质粒经测序确认后分别命名为shTNIK-1(敲减组1)和shTNIK-2(敲减组2),对照质粒为pLK0.1-Puro,命名为shCtrl(对照组)。在Opti-MEMTM培养基中将目的质粒(shTNIK-1、shTNIK-2和shCtrl)分别与包装质粒(PMD2G和PSPAXL)和Lipofectamine 3000混合后转染HEK-293T细胞,48~72 h后收集上清,用于感染目的细胞。
1.2.3 筛选表达差异的基因使用TRIzolTM试剂提取细胞总RNA,由华大基因公司进行RNA测序,将各组中检测到的Counts值小于10的基因剔除,并将变化大于2倍的表达值设定为筛选条件,从而获得表达差异的基因。并将筛选所得基因功能进行基因本体论(Gene Ontology,GO)聚类分析。
1.2.4 稳定敲减TNIK细胞构建使用1.2.2获得的病毒感染A549细胞,使用嘌呤霉素(1 μg/mL) 筛选阳性细胞。Real-time PCR和Western blot检测TNIK的敲降效率。
1.2.5 Real-time PCR检测参照试剂说明书提取细胞总RNA,将其逆转录成cDNA。Real-time PCR扩增以cDNA为模板检测目的基因mRNA表达。每组反应设置3个复孔,用2-ΔΔCt法计算目的基因mRNA的表达,引物序列见表 1。
| 基因 | 引物序列(5′→3′) |
| TNIK | 上游:TAAGGGTCGTCATGTCAAAACG |
| 下游:CCATGCCTGTGGGTTCTTT | |
| RhoA | 上游:AGCCTGTGGAAAGACATGCTT |
| 下游:TCAAACACTGTGGGCACATAC | |
| RhoB | 上游:CTGCTGATCGTGTTCAGTAAGG |
| 下游:TCAATGTCGGCCACATAGTTC | |
| ROCK1 | 上游:AACATGCTGCTGGATAAATCTGG |
| 下游:TGTATCACATCGTACCATGCCT | |
| ROCK2 | 上游:TCAGAGGTCTACAGATGAAGGC |
| 下游:CCAGGGGCTATTGGCAAAGG | |
| LIMK1 | 上游:CAAGGGACTGGTTATGGTGGC |
| 下游:CCCCGTCACCGATAAAGGTC | |
| LIMK2 | 上游:GGATTCCCTCACCAACTGGTA |
| 下游:AGCCACCATAAAAGGCCCTG | |
| Rac1 | 上游:ATGTCCGTGCAAAGTGGTATC |
| 下游:CTCGGATCGCTTCGTCAAACA | |
| Rac2 | 上游:CAACGCCTTTCCCGGAGAG |
| 下游:TCCGTCTGTGGATAGGAGAGC | |
| Rac3 | 上游:TCCCCACCGTTTTTGACAACT |
| 下游:GCACGAACATTCTCGAAGGAG | |
| CDC42 | 上游:CCATCGGAATATGTACCGACTG |
| 下游:CTCAGCGGTCGTAATCTGTCA | |
| PAK1 | 上游:CAGCCCCTCCGATGAGAAATA |
| 下游:CAAAACCGACATGAATTGTGTGT | |
| PAK2 | 上游:TGAGCACACCATCCATGTTGG |
| 下游:AGGTCTGTAGTAATCGAGCCC | |
| PAK4 | 上游:GGACATCAAGAGCGACTCGAT |
| 下游:CGACCAGCGACTTCCTTCG | |
| ARPC2 | 上游:CTGGAGGTGAACAACCGCAT |
| 下游:GACCCCATCGAAATCTGCAAA | |
| ARPC3 | 上游:GTGCAATTCCAAAAGCCAAGG |
| 下游:GGCTCTCATCACTTCATCTTCC |
1.2.6 Western blot检测
细胞总蛋白提取及Western blot检测方法参见文献[11]。一抗稀释比例为Anti-TNIK (1 ∶500),Anti-GAPDH (1 ∶5 000),Anti- LIMK1、Anti-RhoA、Anti-RhoB、Anti-Cdc42、Anti-Rac1/2/3抗体稀释比例均为1 ∶1 000;二抗稀释比例均为1 ∶5 000。
1.2.7 细胞增殖检测实验调整各组细胞数为30 000个/mL,每孔加100 μL细胞悬液,每组设3个重复检测孔。待细胞贴壁后,分别加入PTX (终浓度为: 0、0.05、0.1、0.5、1、2、4 μmol/L)[12]。48 h后,分别在各组细胞中加入10 μL CCK-8检测试剂,37 ℃孵育1 h后于酶标仪450 nm处检测光密度值并计算半数抑制浓度(IC50)及耐药指数(RI)。
1.2.8 流式细胞术检测细胞凋亡各组细胞种板贴壁后,分别加入PTX (1 μmol/L),48 h后消化细胞于离心管中,PBS洗涤2次后,加入300 μL 1×binding buffer悬浮细胞,用Annexin VFITC标记,上机前5 min加入5 μL PI染色,同时补加200 μL 1×binding buffer,上机分析细胞凋亡。
1.2.9 免疫荧光染色当细胞密度达到70%时,用PBS洗涤细胞2次;4%多聚甲醛固定细胞;通透:0.5% Triton X-100;封闭:5% BSA;PBST稀释Anti-α-Tubulin (1 ∶500),4 ℃过夜;PBST稀释荧光二抗;PBST稀释鬼笔环肽荧光染料(1 ∶1 000),37 ℃孵育1 h;使用DAPI进行核染色。最后, 利用共聚焦显微镜随机采图并进行分析。
1.3 统计学分析每组实验均独立重复3次,采用GraphPad Prism 8.0软件进行数据分析。结果以x±s表示,组内两两比较采用Student’s t检验,多组比较采用单因素方差分析。P < 0.05表示差异具有统计学意义。
2 结果 2.1 敲减TNIK表达下调微丝骨架系统组装调控通路Rho/ROCK/LIMK1利用RNA-seq分析对照组与TNIK敲减组差异基因表达情况,并对检测的差异基因进行GO聚类分析。获得稳定敲减TNIK肺腺癌A549细胞系后,通过Western blot和qRT-PCR检测TNIK的表达水平。TNIK稳定敲减细胞中mRNA及蛋白水平均显著低于对照组(P < 0.01,图 1A、B)。差异表达基因在生物学过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)中Padjust值前10位均显示与有丝分裂进程相关(图 1C)。进一步分析敲减TNIK后表达差异的基因,发现细胞微丝骨架聚合调控关键信号通路Rho/ROCK/LIMK1中的RhoA/B、ROCK1/2和LIMK1在转录水平显著下调;但另外两种微丝骨架关键调控因子CDC42和Rac1/2/3及其下游相关因子PAKs和ARP2/3基因表达无显著变化(图 1D、E)。同时,利用Real-time PCR检测敲减TNIK后相关基因的mRNA表达情况。结果显示,RhoA/B、ROCK1/2和LIMK1基因转录明显被抑制(P < 0.01,图 1F),与RNA-seq结果一致;而LIMK2、CDC42、Rac1/2/3、PAK1/2/4和ARP2/3的表达无显著变化(图 1F)。免疫印迹检测结果显示,敲减TNIK表达后RhoA/B和LIMK1的蛋白表达显著下调,而CDC42和Rac1/2/3蛋白表达无显著变化(图 1G)。结果表明,肺腺癌细胞中TNIK可能通过在转录水平调控Rho/ROCK/LIMK1表达从而控制微丝骨架系统形态。
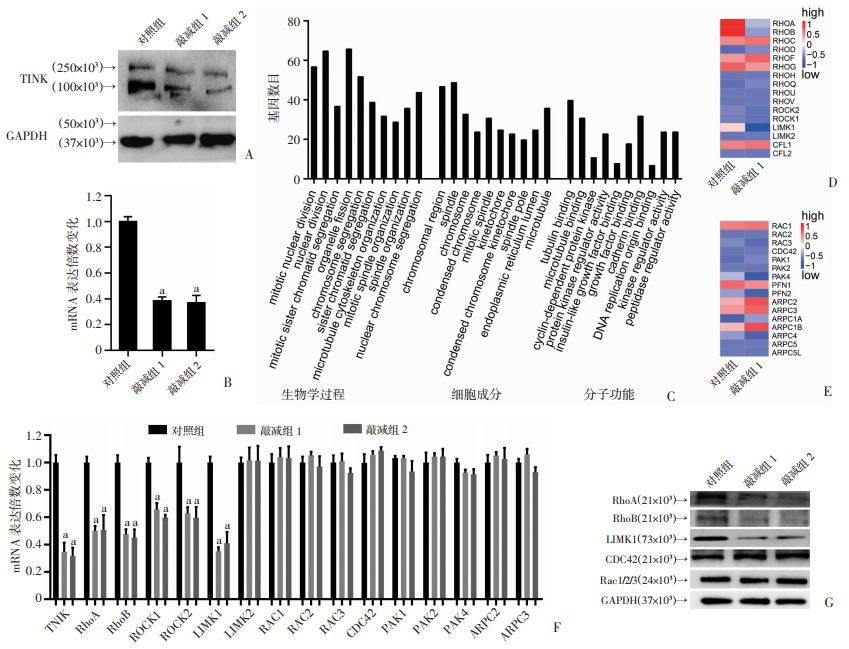
|
|
a:P < 0.01,与对照组比较 A:Western blot检测TNIK敲减后蛋白表达情况;B:RT-PCR检测TNIK敲减后mRNA的表达;C:RNA-seq差异基因的GO聚类分析;D:Rho通路调控微管骨架组装相关基因热图;E:Rac与CDC42通路调控微管骨架组装相关基因热图;F:TNIK敲减后RT-PCR检测微丝骨架聚合相关基因mRNA水平表达情况:G:TNIK敲减后Western blot检测微丝骨架组装相关基因蛋白水平表达情况 图 1 A549细胞中敲减TNIK后细胞微丝骨架调控因子的表达 |
2.2 敲减TNIK紊乱微丝-微管骨架系统形态
利用鬼笔环肽进行免疫荧光检测发现:对照组细胞微丝骨架沿着细胞边缘部位呈现富集;而TNIK敲减组细胞微丝骨架在细胞边缘部位富集不明显,且在细胞中的丝状分布紊乱,同时可见细胞核形态不规则,细胞数目显著增多(P < 0.01,图 2),进一步证明肺腺癌细胞中TNIK通过微丝骨架参与调控细胞周期进程。免疫荧光检测结果显示,对照组细胞微管骨架呈均匀绕核分布,在整个细胞中分布也较均一;而TNIK敲减组微管骨架系统排列在核周局部区域较强,同时可诱导部分细胞核形态异常(P < 0.01,图 3)。表明肺腺癌细胞中TNIK可能通过调控微丝骨架进而影响微管骨架系统组装。
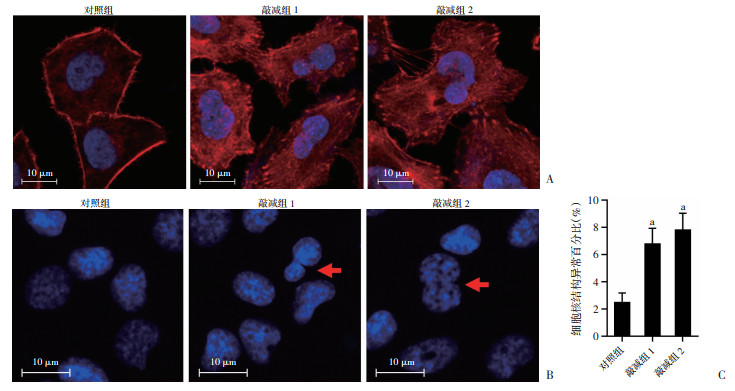
|
| A:鬼笔环肽染色观察各组细胞微丝骨架组装情况;B:DAPI染色观察敲减TNIK表达后细胞核形态;C:各组细胞核形态异常情况分析 a:P < 0.01,与对照组比较 图 2 A549细胞中敲减TNIK表达扰乱微丝骨架组装 |
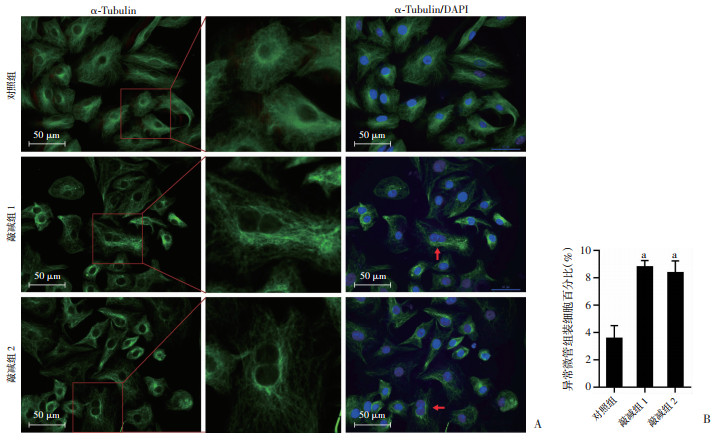
|
| A:Tubulin抗体检测各组微管骨分布情况;B:各组微管组装细胞异常情况分析 a:P < 0.01,与对照组比较 图 3 A549细胞中敲减TNIK表达扰乱微管骨架组装 |
2.3 敲减TNIK联合紫杉醇可显著诱导细胞凋亡
TNIK在肺腺癌细胞中可通过Rho/ROCK/LIMK1通路调控细胞微丝/微管骨架系统动态稳定。因此,在敲减TNIK表达的细胞中联用PTX检测对癌细胞杀伤效应。结果见图 4A、B,与紫杉醇组中PTX的半数抑制浓度IC50相比,TNIK敲减组PTX的IC50值明显降低(P < 0.01)。同时,相较于紫杉醇组,TNIK敲减组的RI分别为3.145和2.879。提示敲减TNIK表达后A549细胞对PTX治疗敏感性增加。进一步利用流式细胞仪检测细胞的凋亡情况,结果表明TNIK敲减组联合PTX处理细胞可显著诱导细胞凋亡(P < 0.01,图 4C、D)。结果表明,敲减TNIK表达可能扰乱微丝骨架聚合及有丝分裂进程从而增强PTX的杀伤作用。因此,联合处理显著增加肺腺癌A549细胞的药物敏感性。
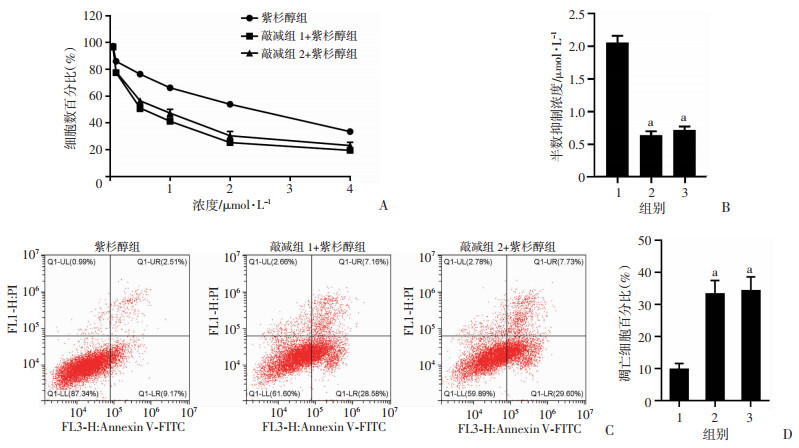
|
|
1:紫杉醇组; 2:敲减组1+紫杉醇组; 3:敲减组2+紫杉醇组; a:P < 0.01,与紫杉醇组比较 A:CCK-8检测各组细胞增殖情况;B:各组半数抑制浓度;C:流式细胞仪检测各组细胞凋亡情况;D:各组凋亡细胞百分比 图 4 A549细胞中稳定敲减TNIK表达并联用PTX处理后检测细胞生长情况 |
3 讨论
哺乳动物中Ste20激酶家族成员具有多种功能,广泛参与调控各种正常生理活动[13]。研究证明,Ste20激酶家族中的MYO3A/B(Myosin ⅢA/B)和PAKs亚家族成员可直接调控细胞中微丝骨架聚合及排列,从而影响细胞极性及迁移运动,参与胚胎发育、伤口愈合等过程,在恶性肿瘤细胞中其表达失常可促癌细胞恶性表型的形成[14-17]。MAP4K4、MINK1和TNIK属Ste20激酶家族成员,具有较高序列相似性。相关研究显示,其功能存在部分重叠[13];MAP4K4可直接通过磷酸化修饰ARP2调控细胞微丝骨架聚合,从而影响细胞迁移运动等过程[18]。最近,本课题组研究发现,肺腺癌细胞中稳定敲减MAP4K4表达可扰乱上皮-间质动态转换过程[10],但是否其通过微丝骨架控制这一过程仍有待更深入研究;同时,研究证明TNIK可调控肺腺癌细胞微丝骨架聚合及组装[11],但牵涉的具体分子机制未知。
研究显示,TNIK可通过WNT、JNK、NF-κB、PI3K等信号通路参与结直肠癌、胃癌和乳腺癌等肿瘤发生发展[19-22]。本课题组前期通过shRNA敲减肺腺癌A549细胞中TNIK的表达后发现微丝骨架聚合紊乱,推测TNIK可能通过扰乱微丝骨架系统影响黏着斑激酶活化,抑制了黏着斑动态周转,进而抑制细胞迁移运动与增殖[11]。另外基于我们未发表数据显示,肺腺癌A549细胞及293T细胞中TNIK与ARP2或ARP3均不存在相互作用,因此TNIK调节微丝骨架形态可能与MAP4K4存在差异。本研究发现敲减TNIK表达可影响微丝-微管骨架系统组装并导致有丝分裂异常。RNA-seq分析发现,TNIK可通过在mRNA水平上调控Rho通路相关基因RhoA/B、ROCK1/2和LIMK1的表达,进而调控微丝/微管骨架形态,最终调控细胞的有丝分裂进程。细胞有丝分裂进程中,微管骨架组成的纺锤丝聚合及解聚呈现高度动态,因此恶性肿瘤治疗中有丝分裂抑制剂常作为临床化疗药物。紫杉醇与微管骨架结合使其稳定,从而扰乱有丝分裂进程中微管解聚并抑制有分裂进程,最终导致细胞凋亡,被用于肺癌等恶性肿瘤一线治疗,但由于药物自身毒性及癌细胞耐药,寻找联合用药具有重要意义。本研究基于敲减TNIK表达细胞呈现的微丝-微管骨架系统形态异常,利用有丝分裂化疗药物处理细胞,结果显示敲减TNIK表达后联合紫杉醇可显著增加药物对癌细胞的杀伤作用。敲减TNIK表达后由于扰乱细胞微丝-微管骨架形态,因此联合紫杉醇处理时可显著下调药物半数抑制浓度。推测可能源于癌细胞中敲减TNIK表达抑制微丝-微管骨架系统正常组装与排列,导致有丝分裂阻滞,而紫杉醇对微管的稳定作用进一步紊乱有丝分裂中纺锤丝解聚并最终诱导细胞凋亡。
细胞内小GTP酶Rho家族包含RhoA/B、Rac1/2/3和CDC42 3种关键激酶,在调控微丝骨架聚合及排列中具有关键作用[23-24]。其中RhoA/B可磷酸化修饰ROCK1/2使其活化,而ROCK1/2可通过修饰LIMK1苏氨酸508位点增强其激酶活性,最终LIMK1直接修饰Cofilin丝氨酸3位点抑制其与微丝骨架结合,从而控制微丝骨架稳定及细胞生命活动[25-26]。研究表明,Rho信号通路下游蛋白激酶LIMK包含2个直系同源物LIMK1和LIMK2。LIMK1由N端的2个LIM结构域、中间区域的PDZ结构域(postsynaptic density 95, PSD-85; discs large, Dlg; zonula occludens-1, ZO-1)及C端的激酶活性区组成,其中LIM和PDZ结构域主要通过与其他相关蛋白互作调控C端激酶结构域活性[27]。Rho/ROCK/LIMK1信号通路参与微丝骨架聚合,而微丝骨架系统动态稳定对于微管骨架组装具有重要作用[16, 24]。LIMK1不仅可通过Cofilin控制微丝骨架动态组装,并可直接与微管结合调控细胞微管骨架系统从而调控有丝分裂[28]。另外,LIMK1可定位于中心体调节纺锤体组装从而控制有丝分裂进程[29]。本研究中稳定敲减TNIK表达导致微丝-微管骨架系统组装紊乱,提示TNIK可通过在转录水平调节Rho/ROCK/LIMK1通路基因表达调控细胞微丝/微管骨架系统。通常Rho/ROCK/LIMK通路在蛋白水平被修饰,从而影响微丝骨架系统动态稳定而调控细胞生理过程。本研究发现,TNIK在转录水平特异调节Rho通路中RhoA、RhoB、ROCK1、ROCK2和LIMK1 mRNA转录表达,进而调控微丝及微管骨架系统组装与排列,最终参与细胞有丝分裂、增殖等过程。但关于肺腺癌细胞中TNIK如何在转录水平调控Rho/ROCK/LIMK1信号通路相关基因表达,是否在其他恶性肿瘤中与报道的WNT、JNK、NF-κB、PI3K等信号途径有关,或亦通过未知途径仍需要深入研究。
综上所述,本研究结果表明,A549细胞中丝氨酸/苏氨酸激酶TNIK与微丝/微管骨架系统组装与排列密切相关,TNIK可通过在转录水平上调控Rho/ROCK/LIMK1通路中基因的表达参与有丝分裂过程,为后续深入研究奠定了基础。
| [1] |
KHWAJA R M, CHU Q S C. Present and emerging biomarkers in immunotherapy for metastatic non-small cell lung cancer: a review[J]. Curr Oncol, 2022, 29(2): 479-489. |
| [2] |
XU F, HUANG X L, LI Y Y, et al. m6A-related lncRNAs are potential biomarkers for predicting prognoses and immune responses in patients with LUAD[J]. Mol Ther Nucleic Acids, 2021, 24: 780-791. |
| [3] |
LI J W, ZHENG G R, KAYE F J, et al. PROTAC therapy as a new targeted therapy for lung cancer[J]. Mol Ther, 2023, 31(3): 647-656. |
| [4] |
GUO W W, QIAO T Y, LI T. The role of stem cells in small-cell lung cancer: evidence from chemoresistance to immunotherapy[J]. Semin Cancer Biol, 2022, 87: 160-169. |
| [5] |
KAMADA R, KUDOH F, ITO S, et al. Metal-dependent Ser/Thr protein phosphatase PPM family: evolution, structures, diseases and inhibitors[J]. Pharmacol Ther, 2020, 215: 107622. |
| [6] |
MENG Z P, QIU Y J, LIN K C, et al. RAP2 mediates mechanoresponses of the hippo pathway[J]. Nature, 2018, 560(7720): 655-660. |
| [7] |
LIU Y X, WANG T V, CUI Y F, et al. STE20 phosphorylation of AMPK-related kinases revealed by biochemical purifications combined with genetics[J]. J Biol Chem, 2022, 298(5): 101928. |
| [8] |
LI Q, NIRALA N K, CHEN H J, et al. The Misshapen subfamily of Ste20 kinases regulate proliferation in the aging mammalian intestinal epithelium[J]. J Cell Physiol, 2019, 234(12): 21925-21936. |
| [9] |
MENG Z P, MOROISHI T, GUAN K L. Mechanisms of Hippo pathway regulation[J]. Genes Dev, 2016, 30(1): 1-17. |
| [10] |
王茹, 尹讯, 张涛, 等. 建立稳定敲减MAP4K4表达的A549细胞系及初步分析[J]. 四川大学学报(医学版), 2022, 53(4): 611-618. WANG R, YIN X, ZHANG T, et al. Establishment and preliminary analysis of lung cancer cell line A549 with stable MAP4K4 knockdown[J]. J Sichuan Univ Med Sci, 2022, 53(4): 611-618. |
| [11] |
孙雪花, 尹讯, 王茹, 等. 建立稳定敲减TNIK表达的A549细胞系及对其初步分析[J]. 中国细胞生物学学报, 2022, 44(3): 421-428. SUN X H, YIN X, WANG R, et al. Establishment and preliminary analysis of cell line A549 with stable knockdown of TNIK expression[J]. Chin J Cell Biol, 2022, 44(3): 421-428. |
| [12] |
WANG M N, CHEN S Y, WEI Y Q, et al. DNA-PK inhibition by M3814 enhances chemosensitivity in non-small cell lung cancer[J]. Acta Pharm Sin B, 2021, 11(12): 3935-3949. |
| [13] |
GARLAND B, DELISLE S, AL-ZAHRANI K N, et al. The Ste20-like kinase—a jack of all trades?[J]. J Cell Sci, 2021, 134(9): jcs258269. |
| [14] |
LI X D, LI F. p21-activated kinase: role in gastrointestinal cancer and beyond[J]. Cancers, 2022, 14(19): 4736. |
| [15] |
MANENSCHIJN H E, PICCO A, MUND M, et al. Type-Ⅰ myosins promote actin polymerization to drive membrane bending in endocytosis[J]. eLife, 2019, 8: e44215. |
| [16] |
LUO M Y, WANG Z Q, WU J, et al. Effects of PAK1/LIMK1/cofilin-mediated actin homeostasis on axonal injury after experimental intracerebral hemorrhage[J]. Neuroscience, 2022, 490: 155-170. |
| [17] |
CHETTY A K, HA B H, BOGGON T J. Rho family GTPase signaling through type Ⅱ p21-activated kinases[J]. Cell Mol Life Sci, 2022, 79(12): 598. |
| [18] |
LECLAIRE L L, RANA M, BAUMGARTNER M, et al. The Nck-interacting kinase NIK increases Arp2/3 complex activity by phosphorylating the Arp2 subunit[J]. J Cell Biol, 2015, 208(2): 161-170. |
| [19] |
MASUDA M, SAWA M, YAMADA T. Therapeutic targets in the Wnt signaling pathway: feasibility of targeting TNIK in colorectal cancer[J]. Pharmacol Ther, 2015, 156: 1-9. |
| [20] |
LI Z L, LIM S K, LIANG X, et al. The transcriptional coactivator WBP2 primes triple-negative breast cancer cells for responses to Wnt signaling via the JNK/Jun kinase pathway[J]. J Biol Chem, 2018, 293(52): 20014-20028. |
| [21] |
SHKODA A, TOWN J A, GRIESE J, et al. The germinal center kinase TNIK is required for canonical NF-κB and JNK signaling in B-cells by the EBV oncoprotein LMP1 and the CD40 receptor[J]. PLoS Biol, 2012, 10(8): e1001376. |
| [22] |
YU D H, ZHANG X, WANG H, et al. The essential role of TNIK gene amplification in gastric cancer growth[J]. Oncogenesis, 2014, 2(2): e89. |
| [23] |
GHOSE D, ELSTON T, LEW D. Orientation of cell polarity by chemical gradients[J]. Annu Rev Biophys, 2022, 51: 431-451. |
| [24] |
WITTMANN T, DEMA A, VAN HAREN J. Lights, cytoskeleton, action: Optogenetic control of cell dynamics[J]. Curr Opin Cell Biol, 2020, 66: 1-10. |
| [25] |
PARK G B, KIM D. PI3K catalytic isoform alteration promotes the LIMK1-related metastasis through the PAK1 or ROCK1/2 activation in cigarette smoke-exposed ovarian cancer cells[J]. Anticancer Res, 2017, 37(4): 1805-1818. |
| [26] |
ZHOU Y J, SU J, SHI L, et al. DADS downregulates the Rac1-ROCK1/PAK1-LIMK1-ADF/cofilin signaling pathway, inhibiting cell migration and invasion[J]. Oncol Rep, 2013, 29(2): 605-612. |
| [27] |
CHATTERJEE D, PREUSS F, DEDERER V, et al. Structural aspects of LIMK regulation and pharmacology[J]. Cells, 2022, 11(1): 142. |
| [28] |
SCHIAVI-EHRENHAUS L J, ROMAROWSKI A, JABLOÑSKI M, et al. The early molecular events leading to COFILIN phosphorylation during mouse sperm capacitation are essential for acrosomal exocytosis[J]. J Biol Chem, 2022, 298(6): 101988. |
| [29] |
OU S R, TAN M H, WENG T, et al. LIM kinase1 regulates mitotic centrosome integrity via its activity on dynein light intermediate chains[J]. Open Biol, 2018, 8(6): 170202. |




