近红外光谱(near infrared spectroscopy,NIRS)是一种用于监测局部组织血氧饱和度的技术,具有灵敏、快捷、实时、无创的特点,可早期发现脑及相关组织缺氧情况,减少麻醉相关并发症,改善围术期预后,加速患者术后康复[1]。
目前,脑氧监测设备大量应用于心血管外科手术,颈内动脉剥脱术,肩关节镜手术等。越来越多的证据表明对这些患者进行脑氧监测可以大大降低术后精神紊乱、谵妄等发生率,改善手术病人的预后[2-4]。虽然市面上已有大量商业化的脑氧监测设备可供使用,但是绝大多数为国外品牌,如美国的INVOS系列、EQUANOX系列、FORE-SIGHT系列和日本的NIRO系列等,国产设备应用占比极低。随着我国医疗卫生事业的发展进步,国产医疗器械的生产研发及应用迅速增长,近两年陆续出现了以苏州爱琴、重庆名希、北京中科等为代表的国产近红外光谱仪,开始应用于临床。然而相较于INVOS等仪器有大量对比研究验证其效能,目前尚无国产脑氧仪器之间的对比研究,各仪器的准确性、一致性,基线值的确定及关键缺氧阈值检测等方面均无相关对比数据,使得临床医生使用时出现困惑。有研究发现不同的近红外光谱仪在不同情况下得到的局部脑组织氧饱和度(regional cerebral oxygen saturation,rSO2)并不相同,甚至可能出现非常显著的偏差[5]。HESSEL等[6]发现INVOS 5100C和FORE-SIGHT两种仪器在新生儿低氧时的差异率达到20%。由此可见每种设备监测的rSO2值对其自身是唯一的,相对于某种仪器的干预值可能对另一种仪器并未达到需介入的阈值,由此可知不同品牌的近红外光谱仪在氧浓度变化时对rSO2的反应可能是不同的。
本试验旨在对市面上主流的几种国产近红外光谱仪进行健康志愿者对比研究,比较其在低氧条件下rSO2的变化情况,仪器一致性和相关性以及检测出关键去饱和事件的能力,以改善仪器性能,为国产仪器的临床推广应用及持续改进提供数据支持。
1 资料与方法 1.1 仪器设备选择本试验选用INVOS 5100C(美国美敦力公司)作为对照组仪器,EGOS-600(苏州爱琴生物医疗电子有限公司)和BRS-1(北京中科搏锐科技公司)近红外脑氧仪作为试验组仪器对受试者进行无创rSO2监测,使用BLT A8 (广东宝莱特医用科技股份有限公司)监护仪监测受试者的心率、脉搏氧饱和度、无创血压等生命体征。使用Mindry WATO EX-55(深圳迈瑞生物医疗电子股份有限公司)麻醉机进行氮氧流量调节。
1.2 受试者选择本研究于2021年12月6日至2022年1月18日,招募陆军军医大学第二附属医院健康志愿者20名。其中男性11名,女性9名。受试者纳入标准为健康不吸烟的成年人,年龄18~50岁,无基础疾病;排除标准为既往有脑梗塞、脑出血、颅脑外伤以及神经外科手术病史,严重的贫血[血红蛋白(hemoglobin,HB) < 70 g/L,入组前使用美国迈心诺公司的Masimo Radical 7无创血红蛋白仪测量HB]、皮肤色素沉着及听觉、语言系统功能障碍者。试验过程中受试者出现严重不适或要求退出则试验终止。本试验采根据仪器种类将受试者随机分为2组,E组(INVOS 5100C/EGOS-600)和B组(INVOS 5100C/BRS-1),每组10人。本试验经陆军军医大学第二附属医院伦理委员会批准(批准号:2021-研第150-02),所有受试者签署了知情同意书。
1.3 样本量估算目前关于NIRS近红外光谱仪器的对比研究尚无明确的样本量标准,由于脉搏氧饱和度监测仪的工作原理与NIRS相似,因此根据美国食品药品监督管理局(food and drug adminstration,FDA)及中国医用脉搏氧饱和度监测仪准确度对比试验标准(YY 0784-201X/ISO 80601-2-61),脉搏氧饱和度对比研究需至少10名受试者或至少200组数据,考虑既往文献和本试验分组及数据采集情况[7],本研究最终招募了20名受试者。
1.4 研究方法试验开始后受试者采取坐位,使用酒精棉片清洁大脑前额皮肤,左前额贴INVOS 5100C专用电极片,右前额贴对应的国产仪器专用电极片。将电极片紧密贴合皮肤,电极侧缘位于前额中线,下缘在眉弓上方2 cm,避开额窦和矢状窦,并用黑色头带覆盖,防止光线干扰。每完成1例均立即同时更换新电极片,以避免偏倚。首次生命体征监测完成后,进行第一次降氧实验,麻醉机氧气端连接中心氧源,空气端连接氮气钢瓶,通过连接麻醉机的呼吸回路和面罩吸入气体。首先吸入氮气4 L/min,待外周脉搏氧饱和度降至90%后缓慢降低氮气流量至2.5 L/min,同时增加和氧气流量至0.35 L/min,直至脉搏氧饱和度稳定在70%左右(65%~75%),每次稳定至少30 s,至多5 min,使用不同类型的近红外光谱仪监测rSO2数值变化,首次降氧实验完成后迅速吸入6 L/min纯氧并关闭空气阀门中的氮气,待FeO2>85%,脉搏氧饱和度(pulse oxygen saturation,SPO2)稳定在99%以上,各项生命体征稳定后再重复一次降氧及复氧过程,完成后取下面罩,呼吸空气3 min后试验结束。试验期间每5秒记录一次数据,详细技术路线见图 1。
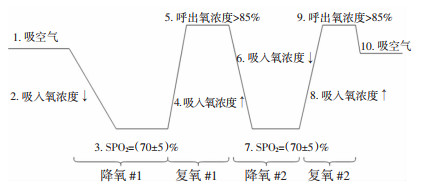
|
| 图 1 健康受试者诱导低氧及恢复氧饱和的方法步骤 |
1.5 观察指标 1.5.1 rSO2基线值变化情况
连续记录试验阶段各仪器rSO2测量值,比较各仪器在试验开始前,两次降氧和恢复氧饱和度阶段以及试验结束吸空气时rSO2测量值的范围及变化情况。
1.5.2 rSO2测量值一致性和相关性对比连续记录各仪器在降氧阶段的rSO2测量值,进行Bland-Altman和Deming分析,比较各仪器间rSO2值的一致性和相关性。
1.5.3 各仪器检测脑氧降低的效能降氧阶段,以INVOS 5100C测得的rSO2降低10%作为干预指标,比较EGOS-600和BRS-1的rSO2测量值检测低氧发生的效能。
1.6 统计学方法数据分析采用MedCalc20.01和GraphPad Prism8.0.2软件分析,计数资料和等级资料以频数和构成比表示。连续型变量资料采用x±s描述。使用配对样本的Wilcoxon Signed-Rank检验用于评估各个设备之间rSO2变化幅度(ΔrSO2%)和变化速率(ΔrSO2%/min)的差异,采用Bland-Altman和Deming回归分析几种近红外光谱仪的一致性及相关性。采用受试者ROC和约登(Youden)指数的截断值(cut-off)分析不同仪器在降氧阶段检测低氧的效能及最佳判断值。P < 0.05则认为差异具有统计学意义。
2 结果 2.1 受试者人口统计学资料本研究对20个健康成人受试者进行了试验,均成功完成。所有受试者人口统计学资料如表 1所示。
| 参数 | E组(美敦力/爱琴) | B组(美敦力/中科) | P |
| 男性 | 6 | 5 | 0.653 |
| 女性 | 4 | 5 | |
| 年龄/岁 | 29.00±3.50 | 26.60±3.24 | 0.728 |
| 身高/cm | 164.4±7.53 | 166.5±6.04 | 0.636 |
| 体质量/kg | 58.50±10.69 | 59.10±7.87 | 0.123 |
| 心率/bpm | 78.80±10.64 | 72.70±7.15 | 0.461 |
| 收缩压/mmHg | 120.50±5.23 | 115.2±5.33 | 0.262 |
| 舒张压/mmHg | 75.90±5.13 | 72.50±6.42 | 0.367 |
| 血红蛋白/g·L-1 | 124.2±8.19 | 126.5±10.31 | 0.587 |
2.2 各仪器rSO2基线值分布范围和变化趋势
本研究绘制了每组仪器测量的rSO2平均值随SPO2变化的曲线图(图 2),同时绘制了单个受试者降氧前的rSO2基线值及降氧后SPO2稳定在70%左右时的rSO2值(图 3),以便直观地比较每个设备的rSO2分布范围和变化趋势。所有仪器测得的rSO2值随氧浓度的改变呈现出相同的变化趋势,但各仪器之间rSO2的变化范围和幅度各不相同。随着吸入氧浓度(FiO2)变化,EGOS-600和BRS-1的rSO2变化幅度都明显低于INVOS 5100C。
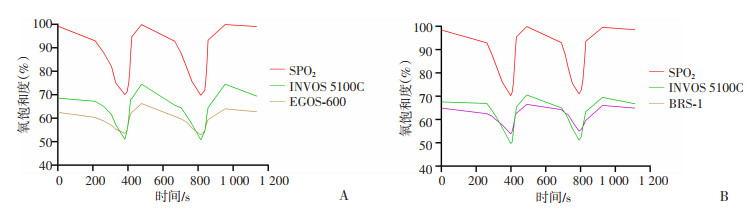
|
| A: :美敦力与爱琴;B:美敦力与中科 图 2 EGOS-600和BRS-1与INVOS 5100C测量的rSO2随SPO2变化时间趋势 |
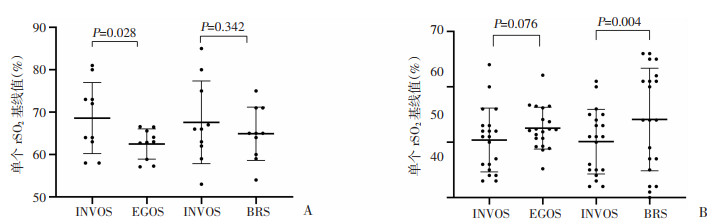
|
| A: 降氧前;B:降氧后 图 3 两组受试者降氧前后脑氧饱和度基线值分布范围及统计分析 |
降氧前单个基线值分布范围:INVOS 5100C为53%~85%,EGOS-600为57.1%~66.6%,BRS-1为54%~75%,EGOS-600基线rSO2中位数相比INVOS 5100C显著较低,差异有统计学意义(P=0.028)。而BRS-1中位数值与INVOS 5100C相比无统计学意义。在两次降氧到SPO2 70%阈值时,各仪器rSO2分布范围:INVOS 5100C为41%~64%,EGOS-600为45.2%~62.1%,BRS-1为40%~66%,此时EGOS-600的中位数值更接近INVOS 5100C,差异无统计学意义。而BRS-1中位数值则较INVOS 5100C更高,差异有统计学意义(P=0.004)。
2.3 降氧期间rSO2变化幅度及变化率SPO2代表全身氧饱和度,在两次降氧阶段,分别计算了每种仪器ΔrSO2和ΔSPO2的值, 其中INVOS(16%~34.15%)紧随SPO2(24.24%~32.32%)变化,变化率显著大于EGOS(6%~20.81%)和BRS(5%~23.81%),差异均有统计学意义(P < 0.05,成对样本的Wilcoxon Signed-Rank检验),见图 4。
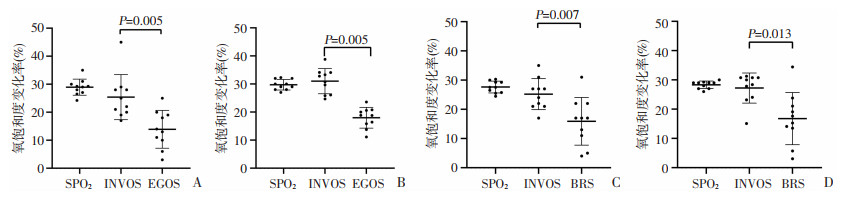
|
| A: 美敦力与爱琴初次降氧;B美敦力与爱琴再次降氧;C:美敦力与中科初次降氧;D:美敦力与中科再次降氧 图 4 两组受试者在两次降氧阶段各自rSO2及SPO2变化情况 |
表 2、3报告了INVOS 5100C和EGOS-600,BRS-1在低氧阶段ΔrSO2变化速率与ΔSPO2变化率的关系。在两次降氧过程中,相比于EGOS-600(1.50~2.14%/min)和BRS-1(1.77~2.41%/min)的ΔrSO2/min中位数范围,INVOS 5100C的rSO2变化率中值(2.81~4.40%/min)与SPO2(3.28~4.15%/min)最接近。
| 仪器 | 第一次降氧 [SPO2=4.02(2.14, 5.17)] |
第二次降氧 [SPO2=3.60(3.20, 4.62)] |
| INVOS 5100C | 3.32(2.00, 5.00) | 3.70(3.08, 4.87) |
| EGOS-600 | 1.50(0.75, 3.20) | 2.14(1.60, 3.37) |
| P | 0.005 | 0.005 |
| 仪器 | 第一次降氧 [SPO2=4.02(2.14, 5.17)] |
第二次降氧 [SPO2=3.60(3.20, 4.62)] |
| INVOS 5100C | 2.81(2.25, 3.86) | 4.40(2.58, 5.57) |
| BRS-1 | 1.77(0.71, 3.14) | 2.41(0.95, 4.21) |
| P | 0.022 | 0.014 |
2.4 各组仪器之间的一致性分析
降氧阶段数据Bland-Altman分析显示:INVOS 5100C与EGOS-600和BRS-1的差异均值分别为5.7、2.5;一致性界限值分别为-9.5~20.9、-9.3~14.3。绝大部分数据点位于±1.96倍标准差之间,表明两种国产仪器在降氧过程中rSO2测量值的变化情况与INVOS 5100C的一致性均较好(图 5)。
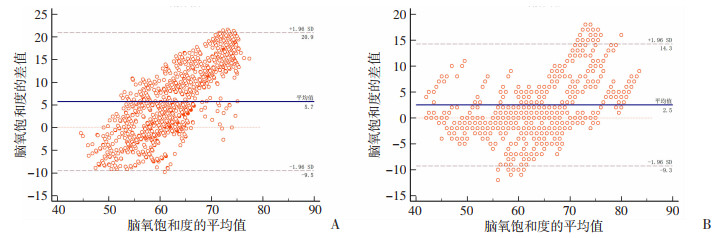
|
| A: 美敦力与爱琴;B美敦力与中科 图 5 EGOS-600和BRS-1与INVOS 5100C测量rSO2的一致性分析 |
2.5 各仪器之间的相关性分析
使用Deming回归分析EGOS-600和BRS-1在低氧期间与INVOS 5100C测量的rSO2值的相关性,分别计算得到回归方程,斜率与截距均有统计学意义。EGOS-600和BRS-1与INVOS 5100C的Pearson相关系数分别为0.722 4、0.845 9,表明其与INVOS 5100C呈线性相关且相关性均较好(图 6)。根据戴明回归方程的预测值计算残差分布,可见EGOS-600和BRS-1的rSO2脑氧数据与INVOS 5100C相比均大致呈正态分布,系统性偏倚较小(图 7)。
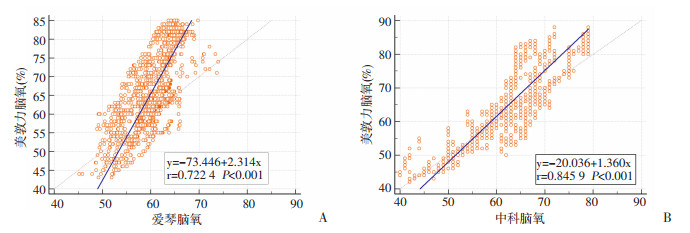
|
| A: 美敦力与爱琴;B美敦力与中科 图 6 EGOS-600和BRS-1与INVOS 5100C测量rSO2的相关性分析 |
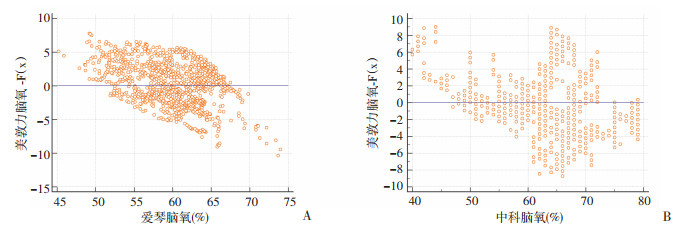
|
| A: 爱琴与美敦力;B:中科与美敦力 图 7 EGOS-600和BRS-1与INVOS 5100C测量rSO2的残差分析 |
2.6 低氧关键阈值的判断及ROC曲线变化
本研究观察了低氧时rSO2相对基线变化的情况,并将其有意义的阈值分为相对基线降低10%,20%和低于50%的绝对值3种情况,并记录了INVOS 5100C、EGOS-600和BRS-1降氧到各自相对基线下降10%的时间分别为(250.8±78.1)、(256.9±68.8)、(291.0±58.8)s。本研究将rSO2值下降超过基线的10%定义为早期缺氧的干预指标。发现降氧时INVOS 5100C均达到10%的相对变化,而EGOS-600有9例,BRS-1为8例。相对于基线降低20%作为阈值时,INVOS 5100C在E组和B组均出现9例,EGOS-600和BRS-1均检测到4例。而在rSO2达到低于50%的绝对值时,INVOS 5100C在E组和B组分别检出5例和4例,EGOS-600和BRS-1各自检测到4例。
本研究将两次降氧阶段采集的rSO2进行ROC分析,以INVOS 5100C测量值下降10%作为干预标准(图 8),EGOS-600及BRS-1的AUC值分别为0.893、0.715。预测缺氧的最佳cut-off值分别为59.3%、56.0%,不同仪器预测低氧发生的效能见表 4。EGOS-600、BRS-1与INVOS 5100C相比差异均有统计学意义(P < 0.001),临床运用时需要更加审慎的使用其数据结果。

|
| A:爱琴;B:中科 图 8 EGOS-600和BRS-1的rSO2测量值降氧过程的ROC曲线 |
| 仪器名称 | Youden指数 | cut-off(%) | 敏感性 | 特异性 | AUC | SE | 95%CI | P |
| EGOS-600 | 0.6878 | 59.3 | 86.03 | 82.74 | 0.893 | 0.0091 | 0.876~0.908 | < 0.001 |
| BRS-1 | 0.3167 | 56.0 | 44.62 | 87.05 | 0.715 | 0.0158 | 0.690~0.739 | < 0.001 |
3 讨论 3.1 各仪器rSO2基线值变化
本研究受试者人口统计学资料方面没有明显的差异,可以排除年龄,性别,身高,体质量对rSO2值的影响[8]。受试者试验开始前各仪器rSO2基线值各不相同,且差异有统计学意义,但与3种仪器厂商各自所提供的正常基线值范围(分别为58%~82%,58%~68%以及58%~82%)十分接近。表明不同仪器有着各自独特的rSO2绝对值范围,不能随意将其他仪器的rSO2值进行替换使用。但当降氧开始,SPO2达到70%左右的低氧阈值时,3种仪器rSO2测量值分别为41%~64%,45.2%~62.1%和40%~66%,并无显著差异。各仪器测得的rSO2基线值均随着氧浓度的变化而改变,变化趋势非常一致,EGOS-600和BRS-1变化幅度相近,INVOS 5100C较二者高,且与SPO2的变化幅度相似。在低氧的检出率及仪器响应时间上也无太大差异,表明虽然3种仪器rSO2基线值存在差异,但在反映组织缺氧方面,无论使用rSO2绝对值还是相对趋势变化,本试验的几种仪器均能达到良好的检测结果。
3.2 各仪器rSO2一致性及相关性使用Bland-altman和Deming回归分析显示两种国产仪器EGOS-600和BRS-1,与美敦力INVOS 5100C在整个降氧阶段具有较好的一致性和相关性,rSO2的趋势性变化较好,但在试验中也发现各仪器之间绝对rSO2值存在2%~13.5%的差异。国外多项试验也证实了这一点,有报道显示INVOS 5100C,FORSIGHT,EQUANOX 7600等主流NIRS仪器在健康志愿者缺氧期间的差异达到9.1%,而另一项研究发现NIRO 200、INVOS 5100C、FORSIGHT和SenSmart X-100 4种仪器之间的差异高达12.66%[9-11]。这可能与不同品牌NIRS监测仪采用不同的固定动静脉比例加权和头皮到大脑皮层穿透力有关;其次,光源数量,波长,算法,低氧环境、检测位置,受试者个体差异及仪器本身的校准也会影响检测数值[10, 12-13]。因此在临床上可能更需要关注rSO2的动态变化趋势。
3.3 各仪器rSO2检测缺氧的效能临床医生通常将rSO2值相对基线降低20%或者低于50%的绝对值作为不良神经系统预后的指征,并以此作为干预和逆转的指标[14]。然而有研究表明基线降低10%是脑血氧饱和度下降的早期指标,可能需要早期干预[15]。因此本试验据此设定了早期缺氧的预测值。通过比较ROC曲线,发现EGOS-600的AUC值大于BRS-1,且其敏感性和特异性均较高,因此EGOS-600可能更容易发现缺氧。而BRS-1敏感性较低,特异性却高达87%,在试验中也发现其与INVOS 5100C的rSO2数值最为接近,重复性最好。HYTTEL等[16]对3种NIRS仪器的对比研究中也发现良好的重复性是以对氧合作用变化的低敏感性为代价的。一项对FORE-SIGHT和INVOS 5100C的对比研究也建议应根据术前患者的特征选择合适的设备,并应考虑影响局部脑血氧饱和度值的因素,以确保正确解释测量值[17]。因此临床使用时需要根据情况选择合适的仪器。
虽然rSO2尚无公认的正常值范围,且绝对数值在人群中变化较大,但rSO2值可能仍有临床意义。有研究表明对于接受体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)的患者,其左右rSO2值的cut-off值为57%、58%,高于此值的患者28 d死亡率较低[18]。而本试验发现EGOS-600和BRS-1预测低氧的cut-off值分别为59.3%和56.0%,与上述试验结果接近,因此本试验所得的截断值可能仍有一定参考意义。
3.4 本试验存在的问题及局限性试验中发现3种仪器均出现了数据丢失或者出现极值等明显错误的情况,虽然都在很短的时间即自行恢复正常,但在临床实践中仍有可能导致判断错误。发生这种情况的原因可能是受到颅外组织的干扰,如汗液,或者是迅速变化的CO2浓度的影响。另外,试验中曾有1例光源发射器过热导致受试者头皮刺痛难耐,但脑氧数值仍正常显示的情况,更换电极片后未再发生。因此临床中长时间使用时可能需加以留意,避免发生前额灼伤。
本研究存在的局限性有:研究无法准确的计算试验的样本量,并且由于个体之间两侧大脑半球血流的差异以及各仪器独特的介入算法,可能导致试验结果的误差[19]。另外本试验并没有使用有创的颈静脉球氧饱和度分析作为金标准,而是选用无创的美敦力INVOS 5100C作为标准参照,可能导致系统误差发生。不同种类仪器的电极片近距离工作时相互之间是否存在干扰也无从得知。最后本研究招募的受试者为健康青年人,没有包含老年人和儿童以及其他的一些特殊群体,所得结果可能会有一定偏倚。
综上所述,所有近红外光谱仪都对氧合变化做出了相似的反应,虽然rSO2的测量值和变化率存在一定差异,但EGOS-600和BRS-1与INVOS 5100C一致性和相关性均较好, 可以准确地动态反应脑氧变化情况。
利益冲突 所有作者声明不存在利益冲突
| [1] |
麻醉学领域发展科学和临床规范《2017版中国麻醉学指南与专家共识》发布[J]. 中华医学信息导报, 2018(4): 7. The 2017 Chinese Anesthesiology Guidelines and Expert Consensus was released as a scientific and clinical norm for the development of anesthesiology[J]. China Med News, 2018(4): 7. |
| [2] |
UYSAL S, LIN H M, TRINH M, et al. Optimizing cerebral oxygenation in cardiac surgery: A randomized controlled trial examining neurocognitive and perioperative outcomes[J]. J Thorac Cardiovasc Surg, 2020, 159(3): 943-953. |
| [3] |
OH C S, SA M, PARK H J, et al. Effects of remote ischemic preconditioning on regional cerebral oxygen saturation in patients in the beach chair position during shoulder surgery: a double-blind randomized controlled trial[J]. J Clin Anesth, 2020, 61: 109661. |
| [4] |
SCHOLKMANN F, KLEISER S, METZ A J, et al. A review on continuous wave functional near-infrared spectroscopy and imaging instrumentation and methodology[J]. NeuroImage, 2014, 85: 6-27. |
| [5] |
PISANO A, GALDIERE N, IOVINO T P, et al. Direct comparison between cerebral oximetry by INVOSTM and EQUANOXTM during cardiac surgery: a pilot study[J]. Heart, lung and vessels, 2014, 6(3). |
| [6] |
HESSEL T W, HYTTEL SORENSEN S, GREISEN G. Cerebral oxygenation after birth-a comparison of INVOS® and FORE-SIGHTTM near-infrared spectroscopy oximeters[J]. Acta Paediatrica, 2014, 103(5): 488-493. |
| [7] |
TOMLIN K L, NEITENBACH A, BORG U. Detection of critical cerebral desaturation thresholds by three regional oximeters during hypoxia: a pilot study in healthy volunteers[J]. BMC Anesthesiology, 2017, 17(1). |
| [8] |
VALENCIA L, RODRIGUEZ-PEREZ A, OJEDA N, et al. Baseline cerebral oximetry values depend on non-modifiable patient characteristics[J]. Anaesth Crit Care Pain Med, 2015, 34(6): 345-348. |
| [9] |
DIX L M L, VAN BEL F, BAERTS W, et al. Comparing near-infrared spectroscopy devices and their sensors for monitoring regional cerebral oxygen saturation in the neonate[J]. Pediatr Res, 2013, 74(5): 557-563. |
| [10] |
BICKLER P E, FEINER J R, ROLLINS M D. Factors affecting the performance of 5 cerebral oximeters during hypoxia in healthy volunteers[J]. Anesth Analg, 2013, 117(4): 813-823. |
| [11] |
SCHNEIDER A, MINNICH B, HOFSTATTER E, et al. Comparison of four near-infrared spectroscopy devices shows that they are only suitable for monitoring cerebral oxygenation trends in preterm infants[J]. Acta Paediatr, 2014, 103(9): 934-938. |
| [12] |
HYTTEL-SORENSEN S, SORENSEN L C, RIERA J, et al. Tissue oximetry: a comparison of mean values of regional tissue saturation, reproducibility and dynamic range of four NIRS-instruments on the human forearm[J]. Biomed Opt Express, 2011, 2(11): 3047-3057. |
| [13] |
GOMERSALL C D, LEUNG P L, GIN T, et al. A comparison of the Hamamatsu NIRO 500 and the INVOS 3100 near-infrared spectrophotometers[J]. Anaesth Intensive Care, 1998, 26(5): 548-557. |
| [14] |
MOHANDAS B S, JAGADEESHA M, VIKRAM S B. Impact of monitoring cerebral oxygen saturation on the outcome of patients undergoing open heart surgery[J]. Ann Card Anaesth, 2013, 16(2): 102-106. |
| [15] |
DESCHAMPS A, HALL R, GROCOTT H, et al. Cerebral oximetry monitoring to maintain normal cerebral oxygen saturation during high-risk cardiac surgery: a randomized controlled feasibility trial[J]. Anesthesiology, 2016, 124(4): 826-836. |
| [16] |
HYTTEL-SORENSEN S, HESSEL T W, GREISEN G. Peripheral tissue oximetry: comparing three commercial near-infrared spectroscopy oximeters on the forearm[J]. J Clin Monit Comput, 2014, 28(2): 149-155. |
| [17] |
KOBAYASHI K, KITAMURA T, KOHIRA S, et al. Cerebral oximetry for cardiac surgery: a preoperative comparison of device characteristics and pitfalls in interpretation[J]. J Artif Organs, 2018, 21(4): 412-418. |
| [18] |
KIM H S, HA S O, YU K H, et al. Cerebral qxygenation as a monitoring parameter for mortality during venoarterial extracorporeal membrane oxygenation[J]. ASAIO J, 2019, 65(4): 342-348. |
| [19] |
ITO H, TAKAHASHI K, HATAZAWA J, et al. Changes in human regional cerebral blood flow and cerebral blood volume during visual stimulation measured by positron emission tomography[J]. J Cereb Blood Flow Metab, 2001, 21(5): 608-612. |




