结直肠癌是临床常见的恶性肿瘤之一,近年来发病率和死亡率持续攀升[1]。肿瘤转移是结直肠癌患者致死的主要原因。据统计,在每年新增肠癌患者中,约20%患者已经发生转移,还有约25%的肠癌患者在确诊后发生肿瘤转移。结直肠癌的转移形式包括血行转移、淋巴转移和腹腔种植转移。其中,腹腔种植转移(colorectal cancer peritoneal metastases,CRC-PM)约占结直肠癌死亡患者的80%[2],然而,临床暂无有效的CRC-PC防治策略[3]。因此,探究结直肠癌的转移机制具有重要意义。
肿瘤微环境(tumor microenvironment,TME)是肿瘤组织的重要组成部分,由免疫细胞、基质细胞等构成。TME可以通过抑制基于T细胞的抗肿瘤免疫,诱导免疫抑制,促使肿瘤细胞发生免疫逃逸,导致肿瘤转移[4]。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)是肿瘤微环境中数量最多的免疫细胞,对肿瘤的恶性进展发挥重要调控作用[5]。TAMs对肿瘤调控作用依赖于其异质性,现认为,巨噬细胞可分为M1型和M2型,其中M1型巨噬细胞主要通过分泌IL-1β、IL-6、TNFα和ROS等促炎因子,放大免疫反应,进而发挥抑瘤作用;而M2型巨噬细胞主要通过分泌IL-10、IL-13和TGF-β等抗炎因子,介导免疫抑制,发挥促瘤作用,并且二者间可以相互转化。因此,通过干预巨噬细胞的极化进而抑制肿瘤的恶性进展是潜在针对肿瘤转移的治疗策略。但是,TAMs极化的调控机制不清。
代谢重编程是巨噬细胞功能转换的重要方式,我们课题组前期研究发现,脂肪分解代谢中的单酰甘油脂肪酶(monoacylglycerol lipase,MGLL)介导的脂质堆积参与了TAMs的功能转化,并在肿瘤的恶性进展中发挥关键作用[6-7]。然而,巨噬细胞MGLL在腹腔种植转移中的效应和机制不清。因此,本研究构建了特异性敲除巨噬细胞MGLL小鼠,并利用其进一步构建结直肠癌腹腔种植转移模型,最后结合细胞生物学和高通量测序等方法探究巨噬细胞MGLL在小鼠结直肠癌细胞腹腔种植转移中的效应和机制。研究结果将为基于巨噬细胞的结直肠癌腹腔种植转移防治策略提供新的理论基础。
1 材料与方法 1.1 实验动物实验用Neo delete阳性杂合子(MGLLflox/+)小鼠和组织特异性表达Cre(Lyz-Cre)小鼠,由广州赛业生物科技有限公司在C57BL/6品系基础上进行构建,两种小鼠各交付8周龄一雄一雌2只老鼠,饲养于陆军军医大学实验动物中心SPF级环境。
1.2 主要仪器及试剂低温高速离心机(Thermo);PCR仪(BIO-RAD);水平电泳仪(BIO-RAD);流式细胞仪(Beckman);琼脂糖(LONZA);胰岛素注射器(BD);细胞培养瓶(康宁);DMEM基础培养基(Viva Cell);胎牛血清(BI);蛋白酶抑制剂(Roche);BCA检测试剂盒(碧云天);WB预制胶(ACE);MGLL抗体(Santa);TRIzon裂解液(康为世纪);巯基乙酸(北京奥博星);流式抗体(Biolegend)。
1.3 方法 1.3.1 MGLL敲除小鼠的构建及鉴定由Neo delete阳性杂合子(flox/+)自交得到Neo delete阳性纯合子(MGLLflox/flox), 将MGLLflox/flox小鼠与组织特异性表达Cre小鼠(Lyz-Cre)进行杂交,获得MGLLflox/flox-Lyz-Cre小鼠。对MGLLflox/flox-Lyz-Cre小鼠进行繁殖。实验以MGLLflox/flox小鼠为对照组,MGLLflox/flox-Lyz-Cre小鼠为实验组。
待小鼠长到3~4周龄,取小鼠尾部1~2 mm,每个样本添加变性裂解液(NaOH,50 mmol/L)300 μL后放置于96 ℃金属浴中加热1~2 h,待鼠尾融化后从金属浴中取出,每个样品中加入Tris-Hcl(1 mol/L,pH=6.8) 30 μL,混匀后作为PCR模板备用。用该DNA模板进行PCR反应后再进行琼脂糖凝胶电泳,最后根据电泳结果判断小鼠基因型。
1.3.2 PCR及琼脂糖凝胶电泳用1.3.1中快速提取的DNA作为模板,按照25 μL的体系进行配制(表 1)。MGLLflox/flox和Lyz-Cre基因型鉴定体系(表 2) 分别如下:
| 基因型 | MGLLflox/flox | Lyz-Cre |
| ddH2O/uL | 8 | 8.5 |
| PremixTaq/μL | 12.5 | 12.5 |
| Mgll-F或Cre-F/μL | 1 | 1 |
| Mgll-R或Cre-R/μL | 1 | 1 |
| 模板/μL | 2.5 | 2 |
| 总体积/μL | 25 | 25 |
| 编号 | 名称 | 序列(5′→3′) | 产物长度/bp |
| 1 | Mgll-F | TGGAACAGAACAGAGCAAGCCAAAG | MT:434 |
| Mgll-R | GCACATCAACATCCCCACACACATA | WT:321 | |
| 2 | Cre-F | CATATTGGCAGAACGAAAACGC | Cre:413 |
| Cre-R | CCTGTTTCACTATCCAGGTTACGG |
上述体系加不同引物分别进行PCR反应。MGLLflox/flox基因型反应程序为:94 ℃ 3 min;(94 ℃ 30 s,60 ℃ 35 s,72 ℃ 35 s)×33 cycles;72 ℃ 5 min;12~
16 ℃ forever。Lyz-Cre基因型反应程序为:94 ℃ 3 min;(94 ℃ 30 s,56 ℃ 35 s,72 ℃ 35 s)×33 cycles;72 ℃ 5 min;12~16 ℃ forever。PCR反应完成后,对反应产物进行琼脂糖凝胶电泳,并在凝胶成像系统中进行统计分析。
1.3.3 结直肠癌腹腔种植转移模型的构建将小鼠结直肠癌MC-38-luciferase细胞复苏扩大培养,用胰酶消化, 离心,弃上清后用PBS重悬,计数,冰上放置备用。用胰岛素注射器吸取MC-38-luciferase(1×106个细胞/只)细胞分别腹腔注射MGLLflox/flox组和MGLLflox/flox-Lyz-Cre组小鼠后放置于原SPF级环境中饲养(自由取食,昼夜节律各12 h),每3 d更换一次垫料、水和饲料。
1.3.4 动物活体成像技术将腹腔种植转移造模小鼠在不同时间点从动物房中取出,按照说明书,腹腔注射配制好的荧光素酶底物(现配现用),待5~8 min,将小鼠放置于活体成像配套气体麻醉仪中,小鼠麻醉后将小鼠腹部向上放置于活体成像检测仪载物台上,水平放置后选择适宜的程序采集并分析图像。
1.3.5 蛋白免疫印记实验(western blot)将小鼠巨噬细胞取出后,PBS洗2次,弃上清,加入含有蛋白酶抑制剂的RIPA裂解液,冰上放置10 min使其充分裂解,离心取上清。用BCA试剂盒测定蛋白浓度并标化后加入loading buffer,将样品放置于100 ℃金属浴中变性10 min,备用。通过聚丙烯酰胺凝胶电泳将目的蛋白分开后,取出凝胶放置于活化的PVDF膜(0.22 μm) 上,按照“三明治”结构将膜海绵、滤纸、凝胶、PVDF膜、滤纸、海绵夹好,250 mA恒流转膜90 min,取出PVDF膜,封闭,一抗和二抗孵育完成后,滴加ECL显色液,在化学发光仪中显影分析。
1.3.6 原代腹腔巨噬细胞诱导和提取小鼠腹腔注射3%巯基乙酸3 mL,4 d后,腹腔巨噬细胞诱导成功。在超净台中提取腹腔巨噬细胞,并放置于含有适量完全培养基的90 mm细胞培养皿中,37 ℃ 5%CO2培养箱中培养0.5~1 h,弃上清,用无菌PBS左右摇晃清洗2次,培养皿底部的贴壁细胞为腹腔巨噬细胞。
1.3.7 脂肪组织免疫细胞的提取及流式细胞术将荷瘤小鼠颈椎脱臼处死并取出腹腔内脏脂肪,用剪刀将脂肪剪成1 mm3左右的块状后放置于含有血清、Ⅳ胶原酶、透明质酸酶和DNase的DMEM基础培养基中,放置于磁力搅拌器上,在37 ℃孵箱中消化至无颗粒状组织为止。终止消化,PBS清洗,裂红,离心,弃上清后用FCAS Buffer重悬,冰上放置备用。
将小鼠脂肪组织中的免疫细胞制备成单细胞悬液,按照免疫细胞的标志物对不同类型的免疫细胞进行染色。染色终止后,用流式细胞仪检测,并使用FlowJo软件进行统计分析。
1.3.8 统计学分析将需要分析数据导入Graphpad prism 8.0软件中,根据样品类型选择合适的分析方法,用t检验、ANOVA方差分析或生存期等统计方法对数据进行统计分析。P < 0.05被认为差异具有统计学意义。
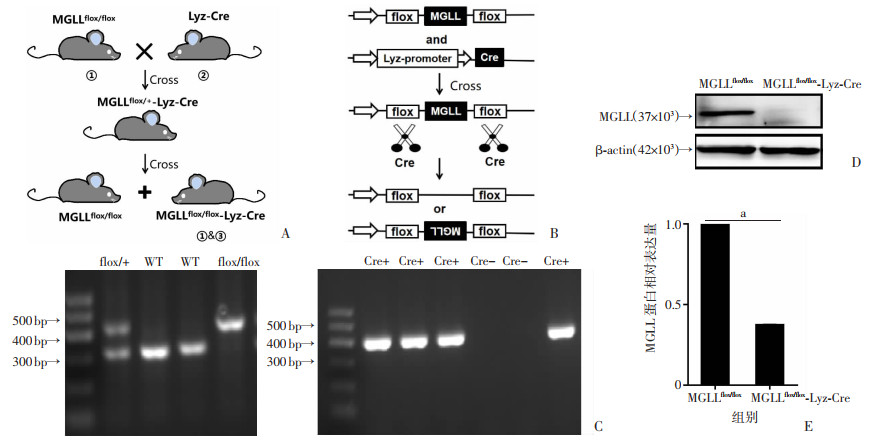
2 结果 2.1 巨噬细胞MGLL特异性敲除小鼠的构建和鉴定首先构建了C57BL/6背景的MGLLflox/+小鼠,并将其与Lyz-Cre小鼠进行杂交繁殖,直至获得纯合MGLLflox/flox-Lyz-Cre小鼠,繁殖策略及其基因型见图 1A~B。为了验证子代小鼠的基因型和检测巨噬细胞中MGLL的表达情况,利用PCR和球脂糖凝胶电泳实验对小鼠基因型进行鉴定(引物见表 2),结果显示:按照上述繁殖策略,可获得MGLLflox/flox及MGLLflox/flox-Lyz-Cre小鼠(图 1C)。然后,我们分别提取MGLLflox/flox及MGLLflox/flox-Lyz-Cre小鼠的腹腔巨噬细胞,并利用western blot检测MGLL表达情况,结果显示:相较于MGLLflox/flox小鼠巨噬细胞,MGLLflox/flox-Lyz-Cre小鼠巨噬细胞MGLL蛋白表达缺失(图 1D~E)。这些结果表明巨噬细胞MGLL特异性敲除小鼠构建成功。
|
| A~B:MGLL flox/flox-Lyz-Cre和MGLLflox/flox小鼠繁殖策略及基因型示意图;C:小鼠基因型电泳结果 flox/+为Neo delete阳性杂合子, WT为野生型,flox/flox为Neo delete阳性纯合子,Cre+为携带Cre基因,Cre-为不携带Cre基因;D~E:MGLLflox/flox-Lyz-Cre和MGLLflox/flox小鼠巨噬细胞MGLL蛋白水平及相对表达量 a:P < 0.01 图 1 巨噬细胞MGLL特异性敲除小鼠的构建和鉴定 |
2.2 巨噬细胞MGLL缺失促进小鼠结直肠癌腹腔种植转移
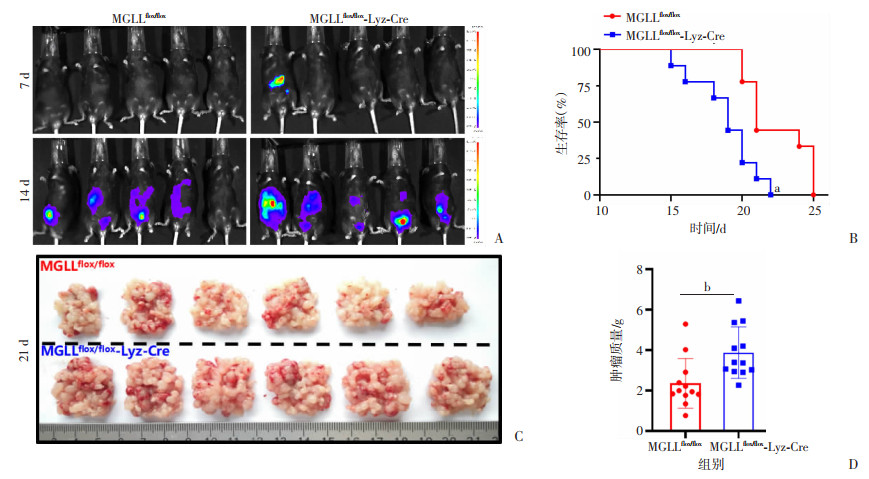
为探究巨噬细胞MGLL缺失对小鼠CRC-PM的影响,分别在MGLLflox/flox和MGLLflox/flox-Lyz-Cre小鼠上,通过腹腔注射MC-38-luciferase细胞以构建小鼠CRC-PM模型。然后,分别在7和14 d,利用动物活体成像技术检测腹腔种植转移情况。结果显示:与MGLLflox/flox小鼠相比,MGLLflox/flox-Lyz-Cre小鼠腹腔荧光强度明显增高(图 2A)。同时观察记录小鼠死亡时间并进行生存期统计,结果显示:MGLLflox/flox-Lyz-Cre小鼠较MGLLflox/flox小鼠生存期显著缩短(图 2B)。最后,腹腔注射造模21 d后取腹腔内所有肿瘤进行大体观测(图 2C)并统计两组小鼠腹腔内肿瘤质量(图 2D)。结果显示:与MGLLflox/flox小鼠相比,MGLLflox/flox-Lyz-Cre小鼠腹腔内肿瘤重量显著增加(P < 0.05)。这些结果表明巨噬细胞MGLL缺失促进结直肠癌细胞腹腔种植转移。
|
|
a:P < 0.01,与MGLLflox/flox组比较;b:P < 0.05 A:MGLLflox/flox和MGLLflox/flox-Lyz-Cre小鼠CRC-PM模型活体成像图(7、14 d);B:MGLLflox/flox和MGLLflox/flox-Lyz-Cre小鼠CRC-PM模型生存期统计图;C:MGLL flox/flox-Lyz-Cre和MGLLflox/flox小鼠CRC-PM模型肿瘤大体图;D:肿瘤质量统计图 图 2 巨噬细胞MGLL缺失促进结直肠癌细胞腹腔种植转移 |
2.3 巨噬细胞MGLL缺失抑制抗肿瘤免疫能力
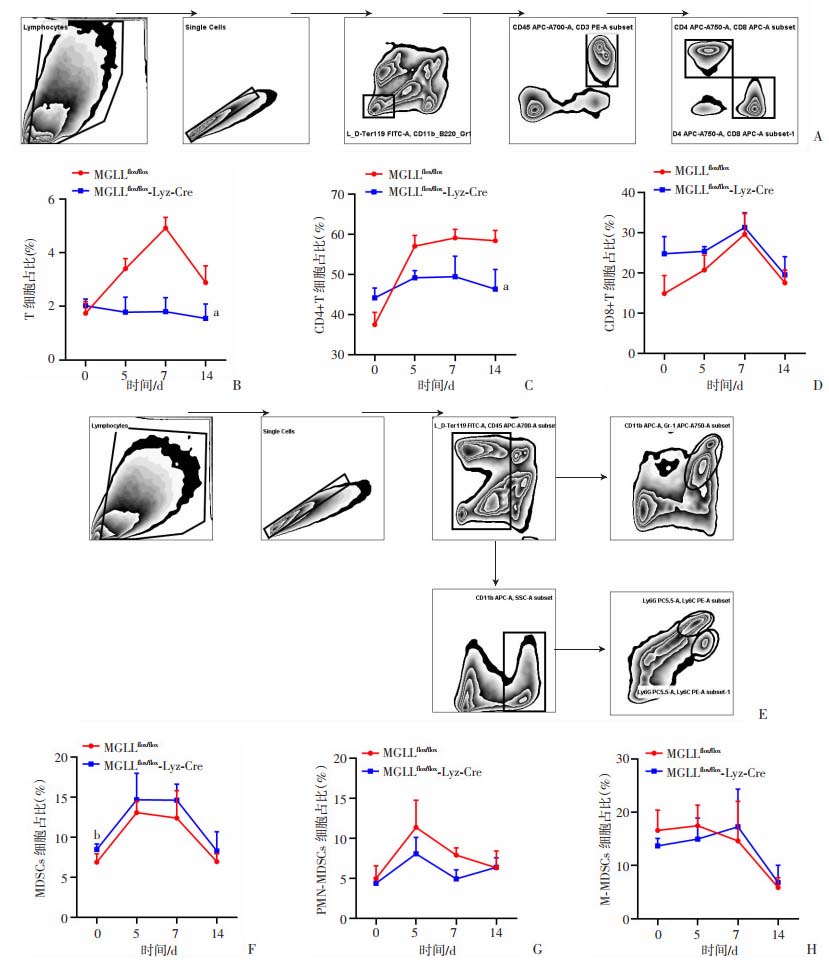
肿瘤微环境对肿瘤恶性进展起至关重要的作用。其中重要的效应细胞包括T细胞和骨髓来源的免疫抑制(MDSCs)细胞。且研究表明,内脏脂肪是CRC-PM的重要靶组织。因此,为探究T细胞和MDSCs是否参与巨噬细胞MGLL缺失介导的促CRC-PM效应,分别在模型构建0、5、7和14 d,利用流式细胞术检测小鼠内脏脂肪血管基质组分(stromal vascular fraction,SVF)中T细胞(图 3A)和MDSCs(图 3E)占比变化情况,结果显示:与MGLLflox/flox小鼠相比,MGLLflox/flox-Lyz-Cre小鼠脂肪SVF T细胞总量占比显著降低(P < 0.05, 图 3B),CD4+T细胞亚型占比也显著降低(P < 0.05, 图 3C),而CD8+T细胞无显著性差异(P>0.05, 图 3D)。与此同时,相较于MGLL flox/flox小鼠,MGLLflox/flox-Lyz-Cre小鼠内脏脂肪MDSCs总量及亚型占比无显著变化(P>0.05, 图 3F~H)。上述结果表明巨噬细胞MGLL缺失会降低肿瘤微环境中T细胞及其亚型CD4+T细胞占比,抑制抗肿瘤免疫。
|
|
a:P < 0.01,b:P < 0.05,与MGLLflox/flox组比较 A: 小鼠脂肪SVF流式细胞术检测T细胞分析策略;B~D:小鼠CRC-PM模型不同时间点脂肪SVF T细胞(CD45+CD3+)、CD4(CD45+CD3+CD4+)和CD8(CD45+CD3+CD8+)亚型占比;E.小鼠脂肪SVF流式细胞术检测MDSCs细胞分析策略 a:P < 0.01,b:P < 0.05,与MGLLflox/flox组比较 F~H: 小鼠CRC-PM模型不同时间点MDSCs(CD45+Gr1+CD11b+)细胞、PMN-MDSCs(CD45+CD11b+Ly6G+)和M-MDSCs(CD45+CD11b+Ly6Chig)亚型占比统计 图 3 巨噬细胞MGLL缺失抑制肿瘤免疫 |
2.4 MGLL缺失促进TAMs向M2型极化
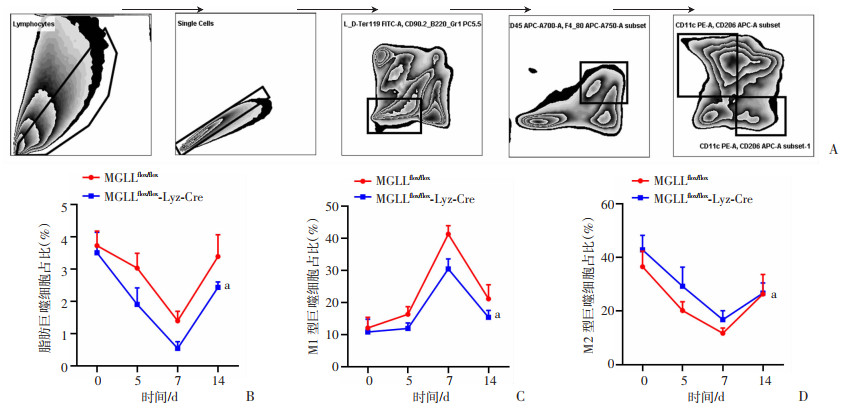
巨噬细胞异质性参与T细胞数量及功能调控。为了进一步探究巨噬细胞MGLL缺失如何介导T细胞的改变,在腹腔注射结直肠癌细胞后0、5、7和14 d后,利用流式细胞术检测小鼠内脏脂肪SVF中巨噬细胞极化情况(图 4A),结果显示:较MGLLflox/flox小鼠相比,MGLLflox/flox-Lyz-Cre小鼠腹腔脂肪中的M1型巨噬细胞占比显著降低(P < 0.05, 图 4B~C),而M2型巨噬细胞占比显著增高(P < 0.05, 图 4D)。这些结果表明巨噬细胞MGLL缺失促进TAMs向M2型极化。
|
| A: 小鼠脂肪SVF流式细胞术检测巨噬细胞分析策略;B~D:小鼠CRC-PM模型不同时间点脂肪SVF巨噬细胞(CD45+F4/80+)、M1(CD45+F4/80+CD11c+)和M2(CD45+F4/80+CD206+)亚型占比 a:P < 0.05,与MGLLflox/flox组比较 图 4 MGLL缺失促进巨噬细胞向M2极化 |
2.5 MGLL缺失促进TAMs向M2型极化的分子机制
为了解析MGLL缺失促进TAMs向M2型极化的具体分子机制,分别提取MGLLflox/flox和MGLLflox/flox-Lyz-Cre小鼠腹腔巨噬细胞,进行RNA-Seq高通量测序。结果显示:两组小鼠巨噬细胞间差异基因共257个,与MGLLflox/flox小鼠相比,MGLLflox/flox-Lyz-Cre小鼠腹腔巨噬细胞上调176个基因,下调81个基因(图 5A)。进一步对两组小鼠巨噬细胞间差异基因进行GO及KEGG分析(图 5B~C)均提示TLRs信号通路,特别是其下游的NFκ-B信号通路显著改变,这与我们的前期研究相一致。同时,KEGG分析提示:PD-1/PDL-1、HIF-1以及AMPK等信号通路也发生显著改变。
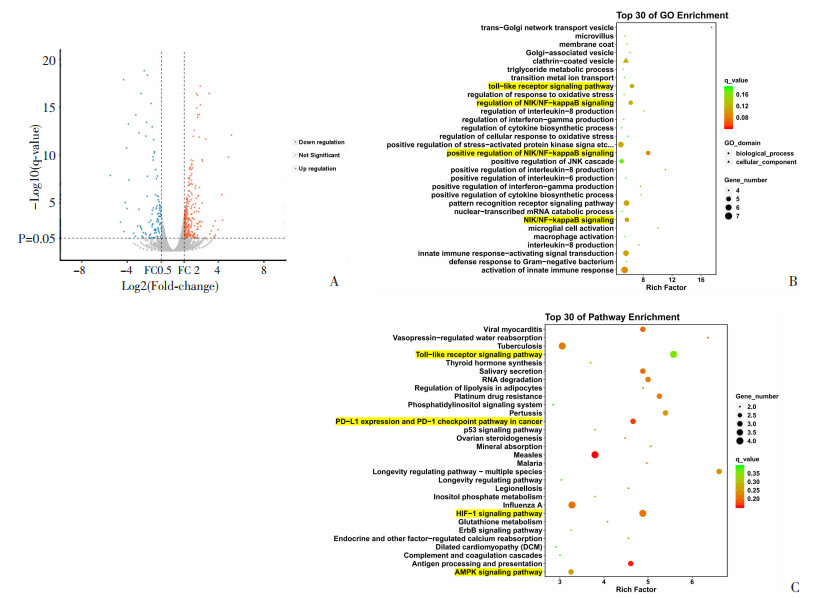
|
| A: 火山图; B: GO分析; C: KEGG分析 图 5 MGLL缺失促进巨噬细胞向M2极化机制的初步分析 |
研究表明,在肺癌中,PDL-1表达水平升高促进巨噬细胞向M2极化,导致肿瘤细胞免疫逃逸。此外,人前列腺肿瘤细胞通过上调巨噬细胞HIF-1α表达水平促进其向M2极化。AMPK作为调控能量稳态的重要激酶,与脂质代谢密切相关。在肺癌中,通过阻断巨噬细胞中的AMPK信号可以抑制巨噬细胞向M2型极化。因此推测:MGLL缺失可能通过调控PD-1/PDL-1、HIF-1以及AMPK信号通路进而促进TAMs向M2型极化。
3 讨论结直肠癌是危害人类健康的重大疾病,而结直肠癌的腹腔种植转移在临床上被认为是结直肠癌的晚期阶段,目前尚无有效的防治策略。研究表明肿瘤微环境在肿瘤的恶性进展中起重要作用[4]。TAMs作为肿瘤微环境中数量最多的免疫细胞,与肿瘤的转移密切相关[8]。而其功能又依赖于异质性,不同亚型的巨噬细胞在肿瘤转移中发挥不同的作用[9]。因此,通过调控不同亚型巨噬细胞间的功能转化可以成为潜在的肿瘤转移治疗策略,然而巨噬细胞功能转换的机制尚不清楚。
代谢重编程可以调控巨噬细胞的功能转化[10]。研究表明:在肥胖小鼠模型中,葡萄糖-6-磷酸脱氢酶介导的糖代谢重编程调控巨噬细胞功能[11]。在肝癌中,色氨酸含量变化介导的氨基酸代谢重编程可通过诱导TAMs产生大量的吲哚胺2, 3-双加氧酶(indoleamine-2, 3-dioxygenase, IDO),进而抑制T细胞功能[12]。此外,研究也表明:脂质代谢重编程参与肿瘤相关巨噬细胞的极化,特别是M2型巨噬细胞的极化[13-15]。在败血症中,巨噬细胞信号素7A(semaphorin 7A, Sema7A)通过激活mTOR和AKT2信号通路介导脂质代谢重编程进而促进其向M2极化[16]。但是在结肠癌腹腔种植转移中,脂质代谢重编程在巨噬细胞中的效应有待揭示。
MGLL是脂肪酸分解代谢中的重要酶,其主要生理功能是将单酰甘油脂肪分解为游离脂肪酶和甘油及水解2-花生四烯酸甘油(2-arachidonoylglycerol, 2-AG),为机体供能和调节体内大麻素系统信号转导[17]。肿瘤细胞的MGLL表达水平与其活性与肿瘤转移也密切相关。如在人前列腺癌中,MGLL的激活促进人前列腺癌细胞的侵袭[18];在鼻咽癌和在黑色素瘤中,MGLL表达水平增加均可促进癌细胞的转移[19-20]。机制研究表明,MGLL在肿瘤中主要发挥代谢酶的功能,可通过其水解产物-游离脂肪酸来维持肿瘤细胞中不同致癌脂质信号水平,如LPA、PEG2和溶血磷脂酰胆碱等,最终促进肿瘤的侵袭和转移[17, 21]。此外,课题组前期的研究表明,在结直肠癌皮下荷瘤和血行转移模型中,MGLL表达抑制介导的巨噬细胞脂质代谢重编程可促进结直肠癌的转移[5]。这些证据表明,MGLL介导的脂质代谢在肿瘤恶性进展中确实发挥重要作用。
本研究发现,在结直肠癌腹腔种植转移中,巨噬细胞MGLL表达缺失促进结直肠癌的腹腔种植转移。进一步研究发现,与MGLL直接影响肿瘤活性不同,巨噬细胞MGLL缺失会降低肿瘤微环境中T细胞及其亚型CD4+T细胞占比进而抑制抗肿瘤免疫。而这可能与巨噬细胞MGLL缺失促进了TAMs向M2型分化相关。为进一步探索巨噬细胞MGLL缺失促进肿瘤相关巨噬细胞向M2极化的具体机制,随后进行的RNA-Seq高通量测序分析提示:MGLL缺失可能通过调控PD-1/PDL-1、HIF-1以及AMPK信号通路进而促进脂肪巨噬细胞向M2极化[22-24],这进一步细化了MGLL作用机制。
同时,本研究也存在不足之处,虽然对巨噬细胞MGLL敲除后促进结直肠腹腔种植转移的具体机制进行了测序分析,但尚未对测序结果进行实验验证,下一步将结合文献提示和测序结果分析对测序结果进行验证。其次,由于目前的实验结果仅在小鼠上得到证明,需进一步在临床标本上验证关键靶点与通路。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. |
| [2] |
KOPPE M J, BOERMAN O C, OYEN W J, et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies[J]. Ann Surg, 2006, 243(2): 212-222. |
| [3] |
BREUER E, HEBEISEN M, SCHNEIDER M A, et al. Site of recurrence and survival after surgery for colorectal peritoneal metastasis[J]. J Natl Cancer Inst, 2021, 113(8): 1027-1035. |
| [4] |
WU T, DAI Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett, 2017, 387: 61-68. |
| [5] |
CIARDIELLO F, CIARDIELLO D, MARTINI G, et al. Clinical management of metastatic colorectal cancer in the era of precision medicine[J]. CA Cancer J Clin, 2022, 72(4): 372-401. |
| [6] |
XIANG W, SHI R C, KANG X, et al. Monoacylglycerol lipase regulates cannabinoid receptor 2-dependent macrophage activation and cancer progression[J]. Nat Commun, 2018, 9(1): 2574. |
| [7] |
DI FRANCO S, BIANCA, SARDINA D S, et al. Adipose stem cell niche reprograms the colorectal cancer stem cell metastatic machinery[J]. Nat Commun, 2021, 12(1): 5006. |
| [8] |
QIAN B Z, POLLARD J W. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010, 141(1): 39-51. |
| [9] |
GUERRIERO J L. Macrophages: the road less traveled, changing anticancer therapy[J]. Trends Mol Med, 2018, 24(5): 472-489. |
| [10] |
BATISTA-GONZALEZ A, VIDAL R, CRIOLLO A, et al. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages[J]. Front Immunol, 2019, 10: 2993. |
| [11] |
HAM M, LEE J W, CHOI A H, et al. Macrophage glucose-6-phosphate dehydrogenase stimulates proinflammatory responses with oxidative stress[J]. Mol Cell Biol, 2013, 33(12): 2425-2435. |
| [12] |
ZHAO Q Y, KUANG D M, WU Y, et al. Activated CD69+ T cells foster immune privilege by regulating IDO expression in tumor-associated macrophages[J]. J Immunol, 2012, 188(3): 1117-1124. |
| [13] |
KANG S J, NAKANISHI Y, KIOI Y, et al. Semaphorin 6D reverse signaling controls macrophage lipid metabolism and anti-inflammatory polarization[J]. Nat Immunol, 2018, 19(6): 561-570. |
| [14] |
SU P, WANG Q, BI E G, et al. Enhanced lipid accumulation and metabolism are required for the differentiation and activation of tumor-associated macrophages[J]. Cancer Res, 2020, 80(7): 1438-1450. |
| [15] |
MARTINEZ F O, GORDON S, LOCATI M, et al. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: new molecules and patterns of gene expression[J]. J Immunol, 2006, 177(10): 7303-7311. |
| [16] |
KÖRNER A, BERNARD A, FITZGERALD J C, et al. Sema7A is crucial for resolution of severe inflammation[J]. Proc Natl Acad Sci USA, 2021, 118(9): e2017527118. |
| [17] |
GIL-ORDÓÑEZ A, MARTÍN-FONTECHA M, ORTEGA-GUTIÉRREZ S, et al. Monoacylglycerol lipase (MAGL) as a promising therapeutic target[J]. Biochem Pharmacol, 2018, 157: 18-32. |
| [18] |
NOMURA D K, LOMBARDI D P, CHANG J W, et al. Monoacylglycerol lipase exerts dual control over endocannabinoid and fatty acid pathways to support prostate cancer[J]. Chem Biol, 2011, 18(7): 846-856. |
| [19] |
HU W R, LIAN Y F, PENG L X, et al. Monoacylglycerol lipase promotes metastases in nasopharyngeal carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(7): 3704-3713. |
| [20] |
BABA Y, FUNAKOSHI T, MORI M, et al. Expression of monoacylglycerol lipase as a marker of tumour invasion and progression in malignant melanoma[J]. J Eur Acad Dermatol Venereol, 2017, 31(12): 2038-2045. |
| [21] |
NOMURA D K, LONG J Z, NIESSEN S, et al. Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis[J]. Cell, 2010, 140(1): 49-61. |
| [22] |
ZHANG Y, DU W W, CHEN Z L, et al. Upregulation of PD-L1 by SPP1 mediates macrophage polarization and facilitates immune escape in lung adenocarcinoma[J]. Exp Cell Res, 2017, 359(2): 449-457. |
| [23] |
WU J Y, HUANG T W, HSIEH Y T, et al. Cancer-derived succinate promotes macrophage polarization and cancer metastasis via succinate receptor[J]. Mol Cell, 2020, 77(2): 213-227. e5. |
| [24] |
XU F, CUI W Q, WEI Y, et al. Astragaloside Ⅳ inhibits lung cancer progression and metastasis by modulating macrophage polarization through AMPK signaling[J]. J Exp Clin Cancer Res, 2018, 37(1): 207. |




