2. 730000 兰州,兰州大学:基础医学院病理教研室
2. Department of Pathology, School of Basic Medicine, Lanzhou University, Lanzhou, Gansu Province, 730000, China
由肠易激综合征(irritable bowel syndrome,IBS)导致的慢性功能性内脏痛严重影响患者生活,该病迁延难愈,容易反复发作。研究报道该病是一种慢性消化系统胃肠功能紊乱疾病,主要以腹痛、腹胀、排便习惯和粪便性状改变等为主要症状表现[1]。现有基础与临床研究数据显示[2]遗传、环境、胃肠动力异常、内分泌紊乱、免疫功能降低、内脏高敏感等因素均在该病的病情进展中发挥重要作用。卓冰帆等[3]临床研究报道改善IBS患者脑-肠轴失调的状态,能明显缓解患者的腹痛以及腹部不适的临床症状,但是并未阐述其中的作用机制。GIUMMARRA等[4]指出脊髓组织作为连接脑-肠轴重要的神经中枢系统,在腹腔或胸腔内脏器官疼痛中发挥重要作用。国内外大量的研究数据显示[5]细胞外信号调节蛋白激酶1(extraeellular signal regulated kinase1,ERK1)-环磷腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element binding protein,CREB)信号在疼痛的发生、进展、持续或修复、消失的病程中发挥重要作用。SUN等[6]研究显示在炎性内脏痛大鼠模型中抑制ERK1/CREB信号的磷酸化,能明显减轻实验动物的疼痛行为。右美托咪定是临床上常用的一种α2-肾上腺素能受体激动剂,具有良好的镇静、镇痛和器官保护的效用。研究显示[7]右美托咪定能通过减少谷氨酸等分子的释放,下调中枢组织中炎性因子的释放以及中间神经细胞的极化,抑制痛觉的传输。但是有关右美托咪定在IBS中的报道较少。本研究通过构建IBS大鼠模型,从脊髓组织中ERK1和CREB的表达入手,探讨右美托咪定对IBS痛觉传导的作用机制,希望为IBS的临床用药提供新的线索。
1 材料与方法 1.1 实验动物、主要试剂及仪器 1.1.1 实验动物40只SPF级足月雄性SD新生大鼠,体质量6~8 g,购自中国农业科学院兰州兽医研究所[动物的生产许可证号:SCXK(甘):2020-0002];在兰州大学动物实验中心SPF级动物房、温度20~25 ℃、自由摄食饮水、昼夜自然光线条件下喂养。本研究研究已获取本院动物护理与使用委员会的审核与批准。
1.1.2 主要试剂CREB的pc DNA3.1-CREB(pc)以及其阴性对象pc DNA3.1-CREB-NC由兰州百源基因技术有限公司提供;盐酸右美托咪定注射液(dexmedetomidine,Dex,2 mL:0.2 mg,国药准字H20183219) 购自扬子江药业集团有限公司;HE染色试剂盒、Western blot试剂盒购自美国Roche公司;苯巴比妥钠购自北京索莱宝有限公司;多聚甲醛溶液购自上海碧云天有限公司;兔抗大鼠p-ERK1、p-CREB抗体购自美国cell signaling公司。
1.1.3 主要仪器生物荧光显微镜(日本NIKON公司),电镜(日本JEOL公司),动物相关手术器械包(张家港大都医疗器械有限公司),超薄切片机(美国Thermo公司),凝胶电泳仪(美国Bio-Rad公司),组织研磨机(科勒尔仪器有限公司)。
1.2 慢性功能性内脏痛大鼠模型的构建以及动物的分组处理大鼠进行适应性喂养后,按随机数字表法分为正常组(不做任何处理)、模型组、右美托咪定(Dexmedetomidine,Dex)组、Dex+pc组(n=10)。模型组、Dex组、Dex+pc组大鼠参照GRABAUSKAS等[8]的方法在出生第8~21天内,清醒状态复制慢性功能性内脏痛大鼠模型:将润滑过的自制球囊插入肛门约2 cm深,以医用微小注射器给气囊充气0.25 mL,维持1 min后放气并将气囊取出,2 h后再次重复上述操作1次。结束刺激后新生大鼠常规喂养,直至大鼠生长至8周龄时,测定大鼠的腹壁撤退反射评分(abdominal withdrawal reflex,AWR)和痛阈。AWR、痛阈测定值与正常组大鼠差异显著则视为造模成功。
造模成功后,从第8周后,Dex组大鼠每日腹腔注射5 μg/kg的盐酸右美托咪定注射液和100 nmol/L的pc DNA3.1-CREB-NC,Dex+pc组大鼠每日腹腔注射5 μg/kg的盐酸右美托咪定注射液和100 nmol/L的pc DNA3.1-CREB[9],正常组、模型组从第8周后腹腔注射等剂量生理盐水和100 nmol/L pc DNA3.1-CREB-NC,连续给药14 d。
1.3 大鼠AWR的测定将大鼠禁食12 h后,乙醚气体吸入麻醉,将气囊自肛门插入与2 cm,将大鼠放置在20 cm×10 cm×10 cm的透明容器中,待大鼠清醒后连接自制扩张气球囊(colorectal dilatation,CRD)和血压计(用以调节压力)后,给予CRD(分20、40、60、80 mmHg 4个等级)刺激,每次的CRD刺激维持20 s,刺激间隔时长为5 min,每个压力等级重复3次。评分标准[10]:0分,动物未出现明显的行为改变;1分,动物抬头但腹部肌肉未有收缩症状记;2分,动物腹肌轻微收缩,但未抬起;3分,动物腹肌强烈收缩以及腹肌抬起,但无骨盆抬起;4分,动物身体抬起,骨盆抬离桌面,腹部呈弓状。
1.4 大鼠痛阈值的测定前期准备工作同1.3,CRD刺激从15 mmHg开始,以5 mmHg为压力增加梯度,每次刺激维持20 s,每2次刺激间隔时长为5 min,当动物的AWR评分达到3分时的压力值为大鼠的痛阈值[11]。
1.5 各组大鼠结肠和脊髓组织的损伤病理情况上述实验完成后,处死大鼠,无菌剥离大鼠的结肠及脊髓组织,多聚甲醛固定,脱水,透明,包埋,制成厚度在3~5 μm的冠状石蜡切片,HE染色,显微镜下观察并采集图片。
1.6 各组大鼠脊髓组织的超微结构的变化取各组大鼠的脊髓组织,按实验要求进行固定、冲洗、脱水、浸透、包埋、切片,室温下铀、铅双重染色,电镜观察。
1.7 各组大鼠脊髓组织的细胞凋亡取各组大鼠的脊髓组织,按TUNEL染色试剂盒要求进行预处理、抗原修复、封闭、标记、避光染色、脱水、中性树胶封片、镜检、视野中出现绿色荧光的细胞为凋亡细胞[12],细胞的凋亡率等于TUNEL阳性细胞数与总细胞的比值。
1.8 各组大鼠脊髓组织中ERK1和CREB的mRNA的表达取各组大鼠的脊髓组织,Trizol试剂提取样本中的总RNA,根据反转录试剂盒要求操作,将RNA反转录为cDNA,实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)进行扩增,采用2-ΔΔCt表示基因mRNA的相对表达量[13],以GAPDH作为参照,反应引物序列如下:GAPDH的mRNA正义链:5′-CCCGGGTTTCAGAGACAACTTC-3′,反义链:5′-TCCACATGCTTTATTCCAGCAATC-3′;ERK1的mRNA正义链:5′-CATGAGAGCCCTCACACTCCT-3′,反义链:5′-CACCTTTGCTGGACTCTGCAC-3′;CREB的mRNA正义链:5′-TCACAGGTACAGGGATGAGGACAC-3′,反义链:5′-CAAAGCACAGCAATGTCCTGAAG-3′。
1.9 各组大鼠脊髓组织中p-ERK1、p-CREB的表达取各组大鼠的脊髓组织,在4 ℃裂解液中放置30 min,离心,并将上清液稀释,常规方法提取样本中的总蛋白,以50 μg样品进行上样,电泳后,转膜,封闭,加入一抗(1 ∶1 000),二抗(1 ∶5 000)稀释后,室温孵育后,显色30 min,以GAPDH为参照[14],分析目标蛋白的灰度值。
1.10 统计学分析实验所得数据采用SPSS 16.0软件进行统计分析,采用Graphpad 8.0进行作图,对于IL-1β、TNF-α基因表达水平等符合正态分布的数据采用x±s表示,多组间比较采用单因素分析,两两比较采用t检验,P < 0.05视为有统计学意义。
2 结果 2.1 各组大鼠在实验的行为观察以及体质量的监测情况实验过程中正常组大鼠精神状态良好、反应机警、皮毛顺滑有光泽、排泄规律、大便性状未见明显异常、饮水与进食量递增、体质量增加较快。模型组大鼠精神状态欠佳、反应迟钝、喜欢扎堆和舔舐腹部、活动量明显下降、易激怒、皮毛暗淡无光、耳廓色淡、排泄不规律、肛周总是有稀便附着、食欲不振、饮食量及体质量增加不明显。Dex组大鼠的精神状态明显改善、大鼠的皮毛柔顺度明显好转、舔舐腹部次数明显下降、肛周附着情况明显缓解。与Dex组大鼠比较,Dex+pc组大鼠精神状态明显降低、皮毛暗淡杂乱、舔舐腹部次数增加、肛周附着物明显增多。
体质量监测结果显示:正常组大鼠在1~10周中的体质量稳步升高,增长曲线无明显异常;模型组、Dex组、Dex+pc组大鼠在1~8周的体质量增长缓慢下降,趋势一致。但在第8周药物干预后,Dex组、Dex+pc组大鼠的体质量增长速度明显升高,仍不及正常组。并且与Dex组大鼠比较,Dex+pc组大鼠的体质量体质量增长速度明显下降,仍高于模型组(图 1)。
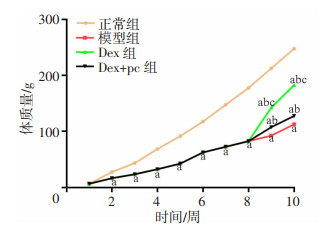
|
| a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较;c:P < 0.05,与Dex组比较 图 1 各组大鼠体质量的比较(n=10,x±s) |
2.2 各组大鼠AWR的比较
在20、40、60、80 mmHg压力等级下:与正常组大鼠比较,模型组、Dex组、Dex+pc组大鼠的AWR值明显升高(P < 0.05);与模型组大鼠比较,Dex组、Dex+pc组大鼠的AWR值明显降低(P < 0.05);与Dex组大鼠比较,Dex+pc组大鼠的AWR值明显升高(P < 0.05),见图 2。
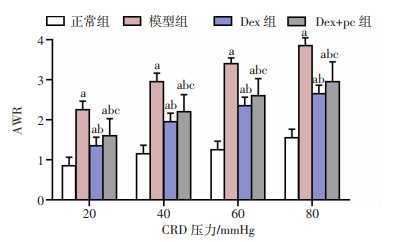
|
| a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较;c:P < 0.05,与Dex组比较 图 2 各组大鼠AWR的比较(n=10,x±s) |
2.3 各组大鼠痛阈值的比较
与正常组大鼠比较,模型组、Dex组、Dex+pc组大鼠的痛阈值明显下降(P < 0.05);与模型组大鼠比较,Dex组、Dex+pc组大鼠的痛阈值明显升高(P < 0.05);与Dex组大鼠比较,Dex+pc组大鼠的痛阈值明显下降(P < 0.05),见图 3。
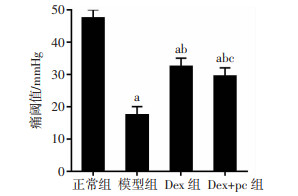
|
| a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较;c:P < 0.05,与Dex组比较 图 3 各组大鼠痛阈值的比较(n=10,x±s) |
2.4 各组大鼠的结肠损伤病理比较
HE染色观察:正常组大鼠结肠组织的绒毛排列整齐,结构完整,黏膜结构清晰可辨,肌层薄厚均匀;模型组大鼠的结肠组织绒毛排列紊乱,缺失严重,肌层明显变薄;Dex组大鼠的结肠组织,绒毛排列趋于正常,黏膜下肌层均有增厚的趋势。4组大鼠的结肠组织均未出现结缔增生以及间质水肿,Dex+pc组大鼠的结肠组织损伤较模型组缓解,但缓解程度不如Dex组,见图 4。
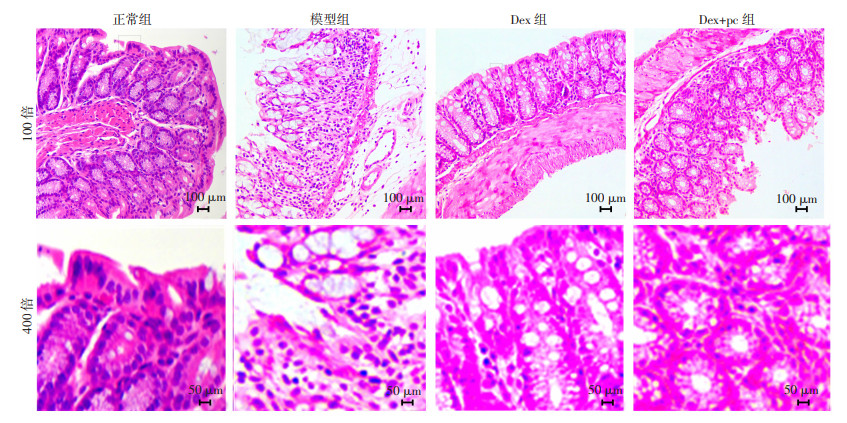
|
| 图 4 各组大鼠结肠组织病理学观察结果 |
2.5 各组大鼠的脊髓损伤病理比较
HE染色观察:正常组大鼠脊髓组织细胞排列整齐,结构完整,神经元细胞数量丰富;模型组大鼠的脊髓损伤明显,空泡样变性严重,神经元细胞大量坏死,灰质和白质的界限不清晰;Dex组大鼠的脊髓形态趋于正常,坏死区域以及凋亡细胞数量明显减少;Dex+pc组大鼠的脊髓组织损伤较模型组明显减轻,但仍能看到一定程度的炎性介质浸润,见图 5。
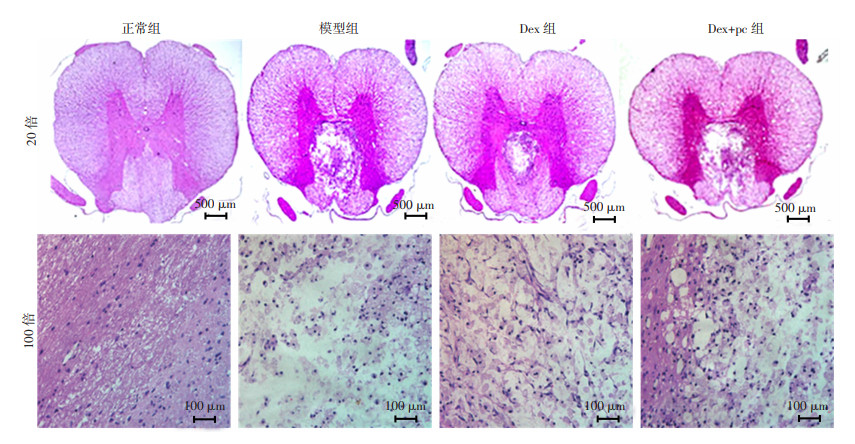
|
| 图 5 各组大鼠脊髓组织病理学观察结果 |
2.6 各组大鼠的脊髓组织的超微结构损伤
透射电镜观察显示:正常组大鼠的脊髓组织细胞超微结构完整,髓鞘和轴突结构清晰可辨,背角神经元细胞数量以及性态稳定;模型组大鼠脊髓组织的髓鞘以及轴突结构损伤明显,线粒体空泡样变性严重,核质界限不明,细胞核呈现出明显的聚集和固缩现象,背角神经元细胞数量锐减,变性严重;Dex组大鼠的脊髓组织细胞超微结构损伤明显缓解,染色质固缩明显减轻,线粒体的性状趋于正常,背角神经元细胞数量有所回升;Dex+pc组大鼠的脊髓组织的超微结构损伤较模型组明显减轻,但仍能看到一定程度变性的线粒体,见图 6。
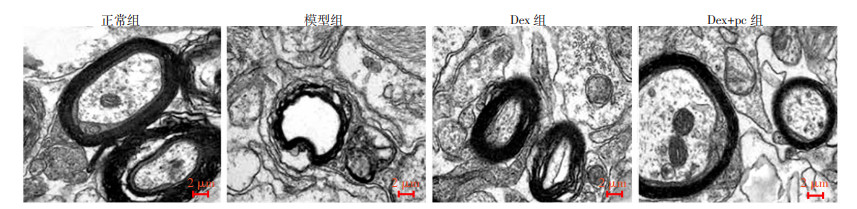
|
| 图 6 大鼠脊髓组织损伤的超微结构观察 |
2.7 各组大鼠的脊髓组织的细胞凋亡
TUNEL结果显示:与正常组大鼠比较,模型组、Dex组、Dex+pc组大鼠的脊髓组织的细胞凋亡率明显升高(P < 0.05);与模型组大鼠比较,Dex组、Dex+pc组大鼠的脊髓组织的细胞凋亡率明显下降(P < 0.05);与Dex组大鼠比较,Dex+pc组大鼠的脊髓组织的细胞凋亡率明显升高(P < 0.05),见图 7。
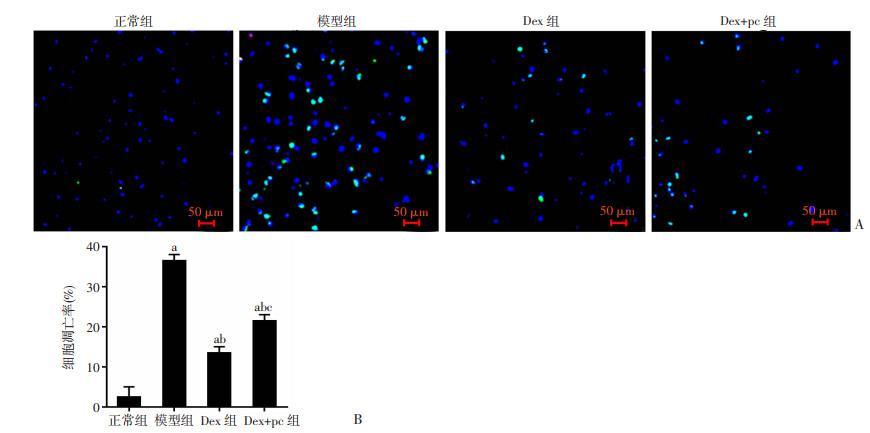
|
| A:TUNEL观察大鼠脊髓组织的细胞凋亡;B:定量分析(n=10,x±s) a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较;c:P < 0.05,与Dex组比较 图 7 大鼠脊髓组织的细胞凋亡结果 |
2.8 各组大鼠脊髓组织中ERK1和CREB的mRNA的表达
RT-qPCR结果显示:与正常组比较,模型组、Dex组、Dex+pc组大鼠的脊髓组织中ERK1和CREB的mRNA的表达明显升高(P < 0.05);与模型组比较,Dex组、Dex+pc组大鼠的脊髓组织中ERK1和CREB的mRNA的表达明显降低(P < 0.05);与Dex组大鼠比较,Dex+pc组大鼠的脊髓组织中ERK1和CREB的mRNA的表达明显升高(P < 0.05),见图 8。
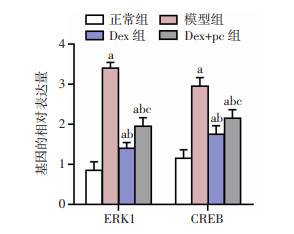
|
| a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较;c:P < 0.05,与Dex组比较 图 8 大鼠的脊髓组织中ERK1和CREB的mRNA的表达(n=10,x±s) |
2.9 各组大鼠脊髓组织中p-ERK1、p-CREB的表达
Western blot检测显示:与正常组比较,模型组、Dex组、Dex+pc组大鼠的脊髓组织中p-ERK1、p-CREB的表达明显升高(P < 0.05);与模型组比较,Dex组、Dex+pc组大鼠的脊髓组织中p-ERK1、p-CREB表达明显降低(P < 0.05);与Dex组大鼠比较,Dex+pc组大鼠的脊髓组织中ERK1和CREB的表达明显升高(P < 0.05),见图 9。

|
| a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较;c:P < 0.05,与Dex组比较 图 9 Western blot检测各组大鼠的脊髓组织中p-ERK1、p-CREB的表达(A)及定量分析(B) (n=10,x±s) |
3 讨论
流行病学研究显示,随着人们物质以及精神生活水平的提高,IBS的发病率呈现出逐年升高的趋势,该病发病机制较为复杂,尚未完全揭示其分子机制,临床上尚缺乏使所有患者免于疾病困扰的特效药,只能以相关药物控制患者腹痛和腹泻等临床症状的进展[15]。随着外科微创手术与消化内镜诊疗技术的发展,很多消化道疾病乃至肿瘤通过腹腔镜、消化内镜进行诊断与治疗,内脏伤害性刺激与内脏痛有效干预,也是迫切问题之一[16]。
3.1 Dex能明显减轻结肠组织和脊髓组织的病理损伤缓解肠易激综合征内脏痛的痛阈值作为新型的镇痛、镇静药物,Dex具有良好的中枢神经系统保护作用,在多种疾病中能起到较为明显的缓解疼痛的作用[17]。邢曼玉等[18]研究显示Dex能明显缓解腹腔镜手术患者的术后疼痛。吴秀霞等[19]研究显示Dex定能明显降低机械锁足反应阈,调控脊髓中Ras相关的C3肉毒素底物1(ras-related C3 botulinumtoxin substrate,Rac 1)信号的转导,阻断大鼠神经性病理性痛的病情进展。脊髓组织,尤其是脊髓后角中分布着较为丰富的α2-肾上腺素能受体,外源性补充的Dex能激活这些分子,在病理条件状态下发挥优良的止痛、催眠镇静效用,保护器官与组织以及抑制交感神经的作用[20]。秦燕等[21]研究显示在脊髓缺血再灌注损伤大鼠模型中,Dex能明显降低损伤区域的氧化应激反应,抑制大鼠中枢神经元的凋亡,从而发挥中枢神经的保护作用。本研究中模型组大鼠造模后出现明显的肠易激综合征,临床症状如精神状态欠佳,反应迟钝,喜欢扎堆和舔舐腹部等,说明大鼠IBS模型造模成功,经药物干预后,Dex组结果显示大鼠精神状态明显改善,临床症状趋于好转,大鼠AWR值和痛阈值测定结果显示Dex组大鼠的AWR及痛阈值均有明显改善,提示Dex对IBS大鼠有良好的镇痛效果。Dex组大鼠结肠和脊髓的病理结果显示Dex对结肠组织和脊髓组织良好的器官保护作用,说明Dex可缓解模型动物结肠和脊髓组织的组织病理损伤,减轻其脊髓组织的超微结构损伤,下调脊髓组织的细胞的凋亡,升高大鼠的AWR和痛阈值。
3.2 Dex通过抑制ERK1和CREB的磷酸化来干预疾病进展深入阐明药物的作用靶点,不仅有助于准确的掌控药物的作用途径,更有助于深层次的揭示疾病的分子发展机制。国内外的众多研究学者一致认为ERK1和CREB的磷酸化在与疼痛相关的疾病中发挥重要的调控作用[22]。研究显示当ERK在生理兴奋性递质的作用下发生磷酸化(p-ERK1),携带信号发生核移位,将胞外信号传至胞核,激活下游的CREB的表达,并推动CREB转化为具有促存活转录因子(p-CREB),积极调控相关基因的转录、剪接与翻译[23-24],完成对神经元细胞的凋亡、增殖、兴奋以及发育等过程的干预。TORRES-PÉREZ等[25]研究结果显示在大鼠足爪局部烫伤模型中,抑制烧伤区域中ERK1/CREB通路的磷酸化,能明显改善实验动物的疼痛程度。本研究中模型组结果显示,p-ERK1、p-CREB的表达升高,ERK1/CREB通路的磷酸化程度升高,信号转导增强,大鼠结肠和脊髓组织损伤加重,痛感增高;经Dex干预后,p-ERK1、p-CREB的表达下降,ERK1/CREB通路的磷酸化程度减弱,大鼠结肠和脊髓组织损伤明显改善,痛感降低,并以pc DNA3.1-CREB做挽救实验,Dex+pc组结果显示,pc DNA3.1-CREB能部分逆转Dex对疾病的干预作用,说明药物可能通过抑制ERK1和CREB的磷酸化来发挥作用。
综上所述,右美托咪定能抑制慢性功能性内脏痛大鼠脊髓组织的细胞凋亡,可能通过抑制ERK1和CREB的磷酸化来发挥结肠和脊髓组织的保护作用,但是将右美托咪定用于肠易激综合征临床的治疗中,还需考虑患者的体质以及自身疾病进展的特殊性。
| [1] |
LACYB E, PIMENTEL M, BRENNER D M, et al. ACG clinical guideline: management of irritable bowel syndrome[J]. Am J Gastroenterol, 2021, 116(1): 17-44. |
| [2] |
AZIZ I, SIMRÉN M. The overlap between irritable bowel syndrome and organic gastrointestinal diseases[J]. Lancet Gastroenterol Hepatol, 2021, 6(2): 139-148. |
| [3] |
卓冰帆, 张彦卿, 宁晓燕. 痛泻要方合四君子汤加减对腹泻型肠易激综合征患者脑肠肽的影响[J]. 南京中医药大学学报, 2019, 35(1): 25-28. ZHUO B F, ZHANG Y Q, NING X Y. Effect of Tongxie Yao Fang combined with sijunzi decoction on brain-gut peptide in irritable bowel syndrome patients with diarrhea type[J]. J Nanjing Univ Tradit Chin Med, 2019, 35(1): 25-28. |
| [4] |
GIUMMARRAM J, SIMPSON P, GABBE B J. Pain, anxiety, and depression in the first two years following transport-related major trauma: a population-based, prospective registry cohort study[J]. Pain Med, 2020, 21(2): 291-307. |
| [5] |
KIM Y, KWONS Y, JUNG H S, et al. Amitriptyline inhibits the MAPK/ERK and CREB pathways and proinflammatory cytokines through A3AR activation in rat neuropathic pain models[J]. Korean J Anesthesiol, 2019, 72(1): 60-67. |
| [6] |
SUN L, ZHOU J J, SUN C H. MicroRNA-211-5p enhances analgesic effect of dexmedetomidine on inflammatory visceral pain in rats by suppressing ERK signaling[J]. J Mol Neurosci, 2019, 68(1): 19-28. |
| [7] |
马莉, 冷玉芳, 张梦婕, 等. 右美托咪定两种给药方法在急性腹膜炎小鼠局部组织的抗炎镇痛作用中的比较[J]. 临床麻醉学杂志, 2020, 36(3): 284-288. MA L, LENG Y F, ZHANG M J, et al. Comparison of anti-inflammatory and analgesic effects of dexmedetomidine in local tissues of mice with acute peritonitis[J]. J Clin Anesthesiol, 2020, 36(3): 284-288. |
| [8] |
GRABAUSKAS G, WU X Y, GAO J, et al. Prostaglandin E2, produced by mast cells in colon tissues from patients with irritable bowel syndrome, contributes to visceral hypersensitivity in mice[J]. Gastroenterology, 2020, 158(8): 2195-2207. |
| [9] |
姚俊鹏, 赵妍, 陈颖, 等. 电针对腹泻型肠易激综合征大鼠肠上皮黏膜屏障功能的影响[J]. 针刺研究, 2020, 45(5): 357-362. YAO J P, ZHAO Y, CHEN Y, et al. Effect of electroacupuncture on intestinal epithelial mucosal barrier function in rats with diarrhea-predominant irritable bowel syndrome[J]. Acupunct Res, 2020, 45(5): 357-362. |
| [10] |
PARISIO C, LUCARINI E, MICHELI L, et al. Extra virgin olive oil and related by-products (Olea europaea L.) as natural sources of phenolic compounds for abdominal pain relief in gastrointestinal disorders in rats[J]. Food Funct, 2020, 11(12): 10423-10435. |
| [11] |
LUCARINI E, COPPI E, MICHELI L, et al. Acute visceral pain relief mediated by A3AR agonists in rats: involvement of N-type voltage-gated calcium channels[J]. Pain, 2020, 161(9): 2179-2190. |
| [12] |
LI W C, YAO S P, LI H R, et al. Curcumin promotes functional recovery and inhibits neuronal apoptosis after spinal cord injury through the modulation of autophagy[J]. J Spinal Cord Med, 2021, 44(1): 37-45. |
| [13] |
李丹丹, 宋丹丹, 韩楠, 等. Ca2+-CaMKⅡ-CREB信号通路在U50488H减轻CPB致大鼠围术期神经认知障碍中的作用[J]. 中华麻醉学杂志, 2020, 40(2): 160-163. LI D D, SONG D D, HAN N, et al. Role of Ca2+-CaMKⅡ-CREB signaling pathway in U50488H-induced reduction of CPB-caused perioperative neurocognitive disorders in rats[J]. Chin J Anesthesiol, 2020, 40(2): 160-163. |
| [14] |
SONGY F, PEI L X, CHEN L, et al. Electroacupuncture relieves irritable bowel syndrome by regulating IL-18 and gut microbial dysbiosis in a trinitrobenzene sulfonic acid-induced post-inflammatory animal model[J]. Am J Chin Med, 2020, 48(1): 77-90. |
| [15] |
ROBERTS A, GRAFTON G, POWELLA D, et al. CSTI-300 (SMP-100); a novel 5-HT3 receptor partial agonist with potential to treat patients with irritable bowel syndrome or carcinoid syndrome[J]. J Pharmacol Exp Ther, 2020, 373(1): 122-134. |
| [16] |
CHUNGH G, MIN Y W, LEE C S, et al. Effects of novel probiotics in a murine model of irritable bowel syndrome[J]. Korean J Gastroenterol, 2020, 75(3): 141-146. |
| [17] |
LIU Y T, LIU W, WANG X Q, et al. Dexmedetomidine relieves acute inflammatory visceral pain in rats through the ERK pathway, toll-like receptor signaling, and TRPV1 channel[J]. J Mol Neurosci, 2018, 66(2): 279-290. |
| [18] |
邢曼玉, 梁霞, 郭曲练, 等. 右美托咪定联合局麻药腹腔滴注缓解腹腔镜手术术后疼痛的Meta分析[J]. 临床麻醉学杂志, 2020, 36(4): 364-370. XING M Y, LIANG X, GUO Q L, et al. Intraperitoneal instillation of dexmedetomidine plus local anesthetic relieves the postoperative pain in laparoscopic surgery: a meta-analysis[J]. J Clin Anesthesiol, 2020, 36(4): 364-370. |
| [19] |
吴秀霞, 幸芳, 卢锡华. 脊髓Rac1信号通路在右美托咪定减轻大鼠神经病理性痛中的作用[J]. 中华麻醉学杂志, 2020, 40(9): 1101-1104. WU X X, XING F, LU X H. Role of spinal Rac1 signaling pathway in dexmedetomidine-induced reduction of neuropathic pain in rats[J]. Chin J Anesthesiol, 2020, 40(9): 1101-1104. |
| [20] |
ŞENGEL N, KÖKSAL Z, DURSUN A D, et al. Effects of dexmedetomidine administered through different routes on kidney tissue in rats with spinal cord ischaemia-reperfusion injury[J]. Drug Des Devel Ther, 2022, 16: 2229-2239. |
| [21] |
秦燕, 杨光. 基于CXCR4-FAK信号通路观察鞘内注射右美托咪定改善大鼠脊髓缺血再灌注损伤后神经运动功能[J]. 中国比较医学杂志, 2020, 30(4): 77-85. QIN Y, YANG G. Intrathecal injection of dexmedetomidine improves neuromotor function in rats with spinal cord ischemia-reperfusion injury based on the CXCR4-FAK signaling pathway[J]. Chin J Comp Med, 2020, 30(4): 77-85. |
| [22] |
刘志军, 姜云峰, 胡兵伟. 探讨鞘内注射siRNA-P300通过cAMP-PKA-CREB通路对神经病理性痛大鼠镇痛效果的影响[J]. 重庆医学, 2019, 48(18): 3071-3076. LIU Z J, JIANG Y F, HU B W. Effect of intrathecal injection of siRNA-P300 on analgesia effect in rats with neuropathic pain through cAMP-PKA-CREB pathway[J]. Chongqing Med, 2019, 48(18): 3071-3076. |
| [23] |
SHAO S, XIA H, HU M, et al. Isotalatizidine, a C19-diterpenoid alkaloid, attenuates chronic neuropathic pain through stimulating ERK/CREB signaling pathway-mediated microglial dynorphin A expression[J]. J Neuroinflam, 2020, 17(1): 13. |
| [24] |
JIANG N, WANG H X, LV J W, et al. Dammarane sapogenins attenuates stress-induced anxiety-like behaviors by upregulating ERK/CREB/BDNF pathways[J]. Phytother Res, 2020, 34(10): 2721-2729. |
| [25] |
TORRES-PÉREZ J V, ADAMEK P, PALECEK J, et al. The NAv1.7 blocker protoxin Ⅱ reduces burn injury-induced spinal nociceptive processing[J]. J Mol Med, 2018, 96(1): 75-84. |




