2. 400010 重庆, 重庆医科大学附属第二医院麻醉科;
3. 400037 重庆, 陆军军医大学(第三军医大学)第二附属医院麻醉科
2. Department of Anesthesiology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010;
3. Department of Anesthesiology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
术中唤醒开颅手术(awake craniotomy, AC)是治疗脑功能区病变的主要术式。术中唤醒期主要依靠头皮神经阻滞(scalp nerve block, SNB)发挥镇痛作用[1]。处于唤醒期的患者需要维持适当的清醒状态来配合医生完成脑功能区定位,又需要恰当的麻醉来消除术中的血流动力学改变、疼痛、恶心呕吐、恐惧等不良事件[2-3]。因此与常规神经外科手术相比,AC对SNB的要求更高。若患者存在解剖结构改变、神经走形异常等情况时,传统体表定位SNB会因阻滞点定位不准而影响麻醉效果[4]。进针偏移可能会损伤局部神经,甚至误穿入血管引起药物中毒、诱发癫痫、呼吸心跳骤停等不良事件[5]。相关研究指出,超声引导可有效提高神经阻滞的精准度,减少并发症的发生[6-7]。超声引导下头皮神经阻滞(ultrasound-guided scalp nerve block, US-guided SNB)已用于神经外科手术,通过超声引导对神经、血管精确定位来提高SNB的精准度,从而有效发挥稳定血流动力学、减少并发症的作用[8]。然而,目前关于该技术的研究主要集中在无需唤醒的神经外科手术中[9],鲜有利用US-guided SNB减少AC术中神经阻滞并发症的报道。考虑到AC对SNB的要求更高,本研究计划采用回顾性队列研究,以需要行AC治疗的脑功能病变患者为研究对象,系统分析US-guided SNB应用于AC中的效果,以评估其应用价值。
1 资料与方法 1.1 研究对象本研究回顾性分析了2016年1月至2022年1月在重庆医科大学附属第一医院及陆军军医大学第二附属医院神经外科接受手术治疗的脑功能区病变患者的病历资料。患者纳入标准:①择期行AC治疗的脑功能区病变患者; ②首次接受手术治疗; ③年龄≥18岁; ④美国麻醉医师协会全身状态(American Society Anesthesiology Physical Status, ASA-PS)分级Ⅱ至Ⅲ级[10]。排除标准:①有周围神经病变; ②有阿片类药物或局部麻醉药过敏史; ③有药物依赖和酗酒史; ④临床资料不完整者。最终纳入患者82例,均为脑功能区占位,其中重庆医科大学附属第一医院14例,陆军军医大学第二附属医院68例。重庆医科大学附属第一医院于2020年2月起开展US-guided SNB以代替传统体表定位SNB,陆军军医大学第二附属医院于2019年11月起行US-guided SNB代替传统方法。因此82例患者中,39例接受US-guided SNB,纳入观察组(重庆医科大学附属第一医院8例,陆军军医大学第二附属医院31例),43例接受体表定位SNB,纳入对照组(重庆医科大学附属第一医院6例,陆军军医大学第二附属医院37例,图 1),两组患者医院占比近似,差异无统计学意义(χ2=0.621,P=0.430)。本研究获重庆医科大学附属第一医院(2022-K310)以及陆军军医大学第二附属医院(2022-研第294-01)伦理委员会批准。
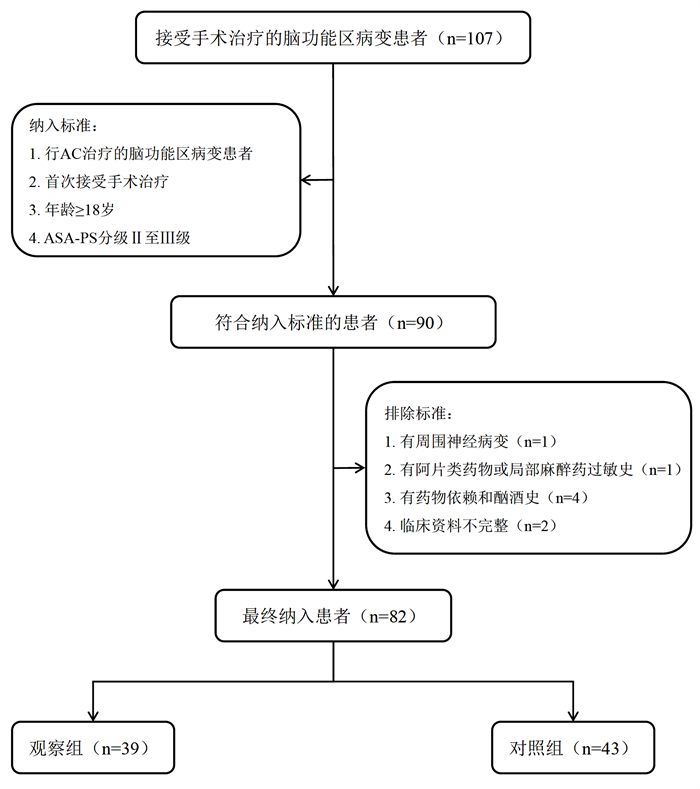
|
| 图 1 研究对象纳入及分组的流程图 |
1.2 资料收集
记录患者的一般资料,包括性别、年龄、体质指数(body mass index, BMI)、ASA-PS分级。手术相关指标包括手术时长、术中唤醒时长、唤醒期每个指令下连续报数量、唤醒后每小时体动次数、术中失血量,术中盐酸尼卡地平、丙泊酚、瑞芬太尼、盐酸右美托咪定和枸橼酸舒芬太尼的用量。分别记录入室时(T0)、切皮完成时(T1)、唤醒时(T2)、唤醒后10 min(T3)、唤醒后20 min(T4)的平均动脉压(mean arterial pressure, MAP)和心率(heart rate, HR)。记录术后48 h内并发症情况,如发热、恶心呕吐、头晕、呼吸抑制、头部皮下血肿、刀口皮肤感染。
1.3 手术和麻醉患者入室前做好术中唤醒宣教,入室后建立静脉通道,监测生命体征,麻醉以静脉麻醉为基础联合SNB。麻醉前用药:盐酸戊乙奎醚(锦州奥鸿药业有限责任公司)0.02 mg/kg肌注减少腺体分泌,麻醉诱导:咪达唑仑(江苏恩华药业股份有限公司)0.1~0.15 mg/kg、丙泊酚(重庆医科大学附属第一医院:Corden Pharma S.P.A,陆军军医大学第二附属医院:西安力邦制药有限公司)2~2.5 mg/kg、笨磺顺阿曲库铵(南京健友生化制药股份有限公司)0.15~0.3 mg/kg、枸橼酸舒芬太尼(人福医药)0.5~5 ug/kg顺序静脉给药。给氧去氮5 min后插入喉罩行呼吸机控制通气,术中动态调节呼吸参数,保证呼气末二氧化碳分压(end-tidal pressure of carbon dioxide, PETCO2)于30~35 mmHg范围内。在麻醉诱导完成之后,上头钉前完成SNB。麻醉维持:术中调整丙泊酚4~12 mg·kg-1·h-1、瑞芬太尼(人福医药)0.02~0.2 ug·kg-1·min-1、盐酸右美托咪定(扬子江药业集团有限公司) 0.2~0.4 ug·kg-1·h-1维持麻醉,按需给予枸橼酸舒芬太尼镇痛、笨磺顺阿曲库铵松弛肌肉。术中持续应用脑电双频指数(bispectral index, BIS)监测患者麻醉深度,开颅过程维持BIS于40~60。唤醒期:患者唤醒前30 min停用笨磺顺阿曲库铵、丙泊酚,仅以瑞芬太尼、盐酸右美托咪定维持镇痛、镇静,维持BIS于80以上,静脉给予盐酸托烷司琼(重庆医科大学附属第一医院:西南药业股份有限公司,陆军军医大学第二附属医院:齐鲁制药有限公司)2 mg止吐,待病人呼吸及意识恢复,拔出喉罩,患者配合医生完成脑功能区定位。完成脑功能区定位标记后继续前方案全凭静脉麻醉,BIS回至40~60,手术者切除病灶并完成关颅缝皮。手术完成后,取下头架即刻加用笨磺顺式阿曲库铵0.15~0.3 mg/kg,丙泊酚2~2.5 mg/kg,行气管插管,将病人护送入麻醉后监护室(postanesthesia care unite, PACU),等待麻醉后复苏。
1.4 SNB两组配制相同的阻滞药物:0.66%的利多卡因(遂成药业股份有限公司)与0.33%的罗哌卡因(AstraZeneca AB)混合液。对照组麻醉医师根据患者骨性结构及体表标志定位阻滞点,并注入阻滞药物(图 2)。US-guided SNB组麻醉医师在超声引导下定位阻滞点并注药(图 3),具体操作如下:
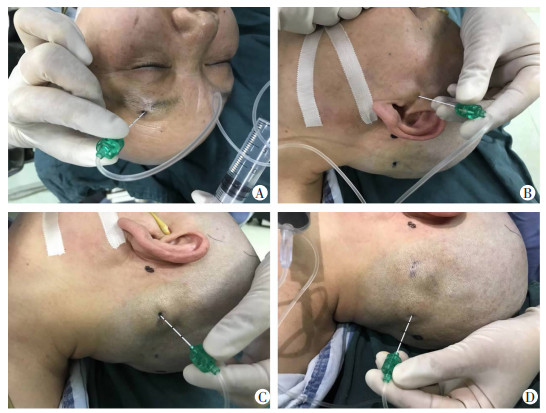
|
| A:眶上神经、滑车上神经阻滞;B:耳颞神经阻滞;C:枕小神经阻滞;D:枕大神经阻滞 图 2 体表定位SNB |
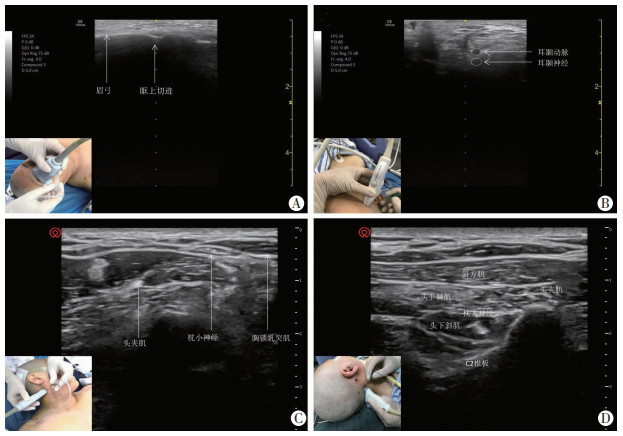
|
| A:眶上神经、滑车上神经阻滞;B:耳颞神经阻滞;C:枕小神经阻滞;D:枕大神经阻滞 图 3 超声引导SNB |
① 眶上神经、滑车上神经:患者仰卧位。对照组于眶上缘触及眶上切迹,指向眶上切迹进针,针尖稍偏向鼻内侧,抵至眉弓上缘骨膜,回抽无血后注入2 mL局麻药,阻滞眶上神经与滑车上神经(图 2A)。观察组选择高频线阵探头,深度2 cm,超声下找到眶上切迹,平面外入路进针,进针方向稍偏向鼻内侧,注射局麻药2 mL,局麻药沿眉弓骨皮质扩散并包绕眶上切迹阻滞眶上神经,同时,局麻药会向眶上切迹内侧鼻根扩散,阻滞滑车上神经(图 3A)。
② 耳颞神经:患者仰卧位,头部转向对侧。对照组于耳屏水平距耳屏1.5 cm处避开动脉垂直进针抵至骨膜,回抽无血注入麻药3 mL(图 2B)。观察组将探头横置于颧弓上方,于耳屏前颧弓根部上方1 cm处找到颞浅动脉搏动,采用平面外技术由上向下进针,于颞浅动脉深面注入局麻药3 mL,避免穿刺针扎入颞浅动脉(图 3B)。
③ 枕小神经、枕大神经:患者仰卧位,头转向对侧。对照组枕骨隆突与乳突连线外侧1/3处垂直进针抵至颅骨膜,注入5 mL局麻药阻滞枕小神经(图 2C),然后内侧1/3处垂直进针抵至颅骨膜,注入5 mL局麻药阻滞枕大神经(图 2D)。观察组超声探头置于胸锁乳突肌中上1/3处,将穿刺针置于胸锁乳突肌和头夹肌之间的筋膜层,枕小神经表现为低回声椭圆形结构,注入5 mL局麻药包绕枕小神经完成阻滞(图 3C)。高频线阵探头与棘突垂直放置探及枕外隆凸,平行下移探头定位C2棘突,探头向前平移定位头下斜肌,于C2椎板定位头半棘肌,斜放探头呈外上内下与头下斜肌长轴平行,探头下端对准C2棘突,枕大神经于此处浅出走形于头下斜肌和头半棘肌之间,由外向内进针到该筋膜层,注入5 mL局麻药,阻滞枕大神经(图 3D)。
1.5 统计学分析使用SPSS 22.0统计学分析软件对数据进行分析。计量资料利用Kolmogorov-Smirnov法检验是否符合正态分布,正态分布资料以x±s表示,组间比较采用独立样本t检验,多时点数据采用重复测量分析,非正态分布资料以中位数(四分位区间)表示,组间比较采用Mann-Whitney U秩和检验。计数资料以例(%)表示,采用χ2检验比较。P < 0.05时认为差异有统计学意义。
2 结果 2.1 患者一般资料对比观察组(n=39)和对照组(n=43)患者的一般资料发现,两组患者性别组成、年龄、BMI及ASA-PS分级的差异均无统计学意义(P > 0.05),详见表 1。
| 组别 | 性别 (男/女) |
年龄/岁 | BMI/kg·m-2 | ASA-PS (Ⅱ级/Ⅲ级) |
| 对照组 | 24/19 | 48.02±16.44 | 22.98±3.55 | 23/20 |
| 观察组 | 19/20 | 50.51±16.49 | 22.10±3.66 | 22/17 |
| t/χ2 | 0.413 | 0.684 | 1.098 | 0.071 |
| P | 0.521 | 0.496 | 0.275 | 0.791 |
2.2 患者手术指标
表 2比较了观察组和对照组患者的手术相关指标。观察组患者的术中唤醒时间、唤醒期体动次数均明显少于对照组,差异有统计学意义(均P < 0.05)。与对照组比较,观察组患者盐酸尼卡地平、瑞芬太尼、盐酸右美托咪定、枸橼酸舒芬太尼用量亦明显减少,差异有统计学意义(均P < 0.05)。两组患者手术时间、术中失血量、唤醒期每个指令下连续报数、丙泊酚用量差异无统计学意义。
| 分组 | 手术时间/min | 术中唤醒时间/min | 失血量/mL | 唤醒期每个指令下连续报数/个 | 体动次数/次·h-1 | 盐酸尼卡地平/mg | 丙泊酚/mg | 瑞芬太尼/mg | 盐酸右美托咪定/mg | 枸橼酸舒芬太尼/ug |
| 对照组 | 175.12±39.21 | 11.24±3.03 | 488.32±230.64 | 10.41±2.73 | 6.74±3.63 | 1.27±0.39 | 303.91±36.03 | 1.44±0.51 | 1.53±0.48 | 27.43±3.81 |
| 观察组 | 170.43±45.52 | 6.53±1.84 | 469.21±221.73 | 9.93±3.24 | 4.92±2.61 | 0.97±0.27 | 312.63±44.22 | 1.08±0.35 | 1.30±0.33 | 22.42±2.63 |
| t | 0.501 | 8.398 | 0.382 | 0.739 | 2.591 | 3.856 | 0.981 | 3.737 | 2.622 | 6.786 |
| P | 0.617 | < 0.001 | 0.703 | 0.462 | 0.011 | < 0.001 | 0.330 | < 0.001 | 0.011 | < 0.001 |
2.3 血流动力学指标
在T0~T4时间点分别记录两组患者HR及MAP的数据,并绘制HR、MAP随时间变化的趋势图。如图 4所示,两组患者HR均于T1之后呈逐渐上升趋势,其中对照组患者HR上升更明显;观察组患者MAP在T1~T2逐渐上升,后呈下降趋势,而对照组患者T1~T3呈上升趋势,T4期有所回降,均明显高于观察组。组内比较发现,观察组和对照组HR、MAP在T1~T4均呈上升趋势,差异有统计学意义(均P < 0.001)。组间比较发现,T2~T4对照组患者HR、MAP均显著高于观察组,差异有统计学意义(均P < 0.001)。交互作用的分析显示,SNB方法的不同与HR和MAP均存在交互作用,差异有统计学意义(HR:F=2.688,P=0.033;MAP:F=3.905,P=0.004),详见表 3。
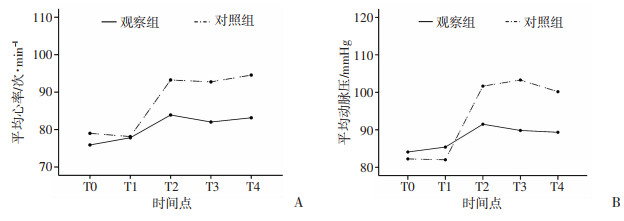
|
| A:HR变化趋势;B:MAP变化趋势 图 4 观察组与对照组患者HR、MAP随时间变化 |
| 项目 | 组别 | T0 | T1 | T2 | T3 | T4 | 组内比较 | 组间比较 | 交互作用 | |||
| F | P | F | P | F | P | |||||||
| HR/次·min-1 | 对照组 | 79.00±14.53 | 78.14±15.02 | 93.26±14.88 | 92.74±16.30 | 94.56±14.95 | 11.121 | < 0.001 | 35.978 | < 0.001 | 2.688 | 0.033 |
| 观察组 | 75.90±13.61 | 77.82±15.26 | 83.90±15.55 | 82.03±15.87 | 83.15±15.71 | |||||||
| MAP/mmHg | 对照组 | 82.23±10.90 | 82.00±15.74 | 101.65±17.11 | 103.28±16.09 | 100.16±15.77 | 13.99 | < 0.001 | 43.286 | < 0.001 | 3.905 | 0.004 |
| 观察组 | 84.08±11.27 | 85.38±10.82 | 91.49±11.81 | 89.82±12.67 | 89.33±13.50 | |||||||
2.4 术后并发症
术后48 h内两组均有部分患者出现发热、恶心呕吐、头晕的症状,但两组差异无统计学意义,详见表 4。两组患者均无呼吸抑制、头部皮下血肿、刀口皮肤感染的情况。
| 组别 | n | 发热 | 恶心呕吐 | 头晕 | 呼吸抑制 | 头部皮下血肿 | 刀口皮肤感染 |
| 对照组 | 43 | 5 (11.63%) | 6 (13.95%) | 2 (4.65%) | 0 | 0 | 0 |
| 观察组 | 39 | 4 (10.26%) | 5 (12.82%) | 2 (5.13%) | 0 | 0 | 0 |
| χ2 | 0.039 | 0.023 | 0.010 | - | - | - | |
| P | 0.843 | 0.880 | 0.920 | - | - | - |
3 讨论
AC手术较常规开颅手术对SNB的精准度要求更高。传统体表定位SNB虽已成为开颅手术主要的局部镇痛方法,但仍存在定位不准导致麻醉效果不佳甚至引发不良事件的不足之处,故临床一直在探索提高SNB精准度的方法。US-guided SNB已被证实可有效提高SNB的精准度,但目前关于该技术应用在AC术中的报道较少。本研究以行AC治疗的脑功能病变患者为研究对象,发现US-guided SNB技术可有效缩短AC手术的术中唤醒时间,具有更好的稳定血压、心率的作用,且可减少术中降压药、镇静镇痛药的用量。这证明US-guided SNB技术可有效改善SNB的麻醉效果。
本研究结果发现,与对照组体表定位法相比,接受US-guided SNB患者所需的术中唤醒时间短,唤醒期体动次数显著减少。这主要是由于超声引导能够可视化定位头部神经,准确识别针尖和靶神经之间的关系。从而提高了头部神经阻滞的精准度,保证了唤醒期的有效局部镇痛,提高患者的配合度。最终缩短了唤醒所需时间。US-guided SNB组患者术中所需瑞芬太尼、盐酸右美拖咪定、枸橼酸舒芬太尼的剂量亦显著低于对照组。这同样得益于超声引导下的精准麻醉,优化了颅脑局部的镇痛效果,减少了全身麻醉所需镇静镇痛药的用量。
AC术中血流动力学波动的主要影响因素包括术中切皮、钻颅骨、刺激脑组织等,这会激发机体应激反应,引起血压、心率波动[11-12]。另外如术中刺激到三叉神经亦会引起三叉神经-心脏反射,从而引起心率改变[13]。US-guided SNB可实现头部神经的精准阻滞,起到进一步稳定血流动力学的作用。本研究中接受US-guided SNB的患者术中HR、MAP波动及降压药盐酸尼卡地平用量均显著低于行体表定位SNB的患者。这与刘鸽等[14]以及LIU等[15]的研究近似,他们同样提出,US-guided SNB在幕上肿瘤切除术以及中耳显微手术中稳定血流动力学的效果显著。这主要得利于US-guided SNB能确保麻醉药物准确注入并包绕头部神经,从而有效阻断头部神经的感觉传导、减轻术中疼痛刺激引起的应激反应。此外US-guided SNB能够减少静脉麻醉药的用量、缩短唤醒时间,这降低了麻醉药物以及唤醒时间对血流动力学的影响。
US-guided SNB既可提供实时可视化的目标神经定位,又能动态监测局部麻醉药的扩散,有效提高了SNB的成功率和安全性。US-guided SNB虽然对设备要求不高,但对操作者的专业性要求较高,使其在临床麻醉中的开展受到了一定限制。这就要求麻醉医师不断拓展超声相关的专业知识和操作技能,才能更好地促进US-guided SNB技术在临床AC手术中的推广。本研究为回顾性队列研究,除不可避免的选择偏移外,与应激反应相关的神经内分泌指标、脑神经功能相关指标、患者术后疼痛评估等资料无法获得。因此无法评估US-guided SNB对脑功能、神经功能、术后疼痛等相关情况的影响。本研究下一步的工作除逐步开展脑功能、神经功能相关的研究外,亦会关注US-guided SNB对患者术后疼痛、并发症等的影响,为US-guided SNB技术的临床推广提供更有力的理论依据。
综上所述,US-guided SNB技术具有提升AC手术唤醒期手术质量、减少术中全身麻醉药用量、稳定血流动力学的作用,可有效提高AC患者唤醒期麻醉的安全性和准确性。
| [1] |
KULIKOV A, LUBNIN A. Anesthesia for awake craniotomy[J]. Curr Opin Anaesthesiol, 2018, 31(5): 506-510. |
| [2] |
FONTAINE D, ALMAIRAC F. Pain during awake craniotomy for brain tumor resection. Incidence, causes, consequences and management[J]. Neurochirurgie, 2017, 63(3): 204-207. |
| [3] |
POTTERS J W, KLIMEK M. Local anesthetics for brain tumor resection: current perspectives[J]. Local Reg Anesth, 2018, 11: 1-8. |
| [4] |
NANAYAKKARA D, MANAWARATNE R, SAMPATH H, et al. Supraorbital nerve exits: positional variations and localization relative to surgical landmarks[J]. Anat Cell Biol, 2018, 51(1): 19-24. |
| [5] |
CHOWDHURY T, BARON K, CAPPELLANI R B. Severe bradycardia during scalp nerve block in patient undergoing awake craniotomy[J]. Saudi J Anaesth, 2013, 7(3): 356-357. |
| [6] |
CHIN K J, CHAN V. Ultrasound-guided peripheral nerve blockade[J]. Curr Opin Anaesthesiol, 2008, 21(5): 624-631. |
| [7] |
RE M, BLANCO J, GÓMEZ DE SEGURA I A. Ultrasound-guided nerve block anesthesia[J]. Vet Clin North Am Food Anim Pract, 2016, 32(1): 133-147. |
| [8] |
ZETLAOUI P J, GAUTHIER E, BENHAMOU D. Ultrasound-guided scalp nerve blocks for neurosurgery: a narrative review[J]. Anaesth Crit Care Pain Med, 2020, 39(6): 876-882. |
| [9] |
程芳, 林华赋, 萧燕萍, 等. 超声引导头部神经阻滞在幕上肿瘤切除术中的应用[J]. 医学综述, 2020, 26(10): 2026-2030. CHENG F, LIN H F, XIAO Y P, et al. Application of ultrasound-guided head nerve block in supratentorial tumor resection[J]. Med Recapitul, 2020, 26(10): 2026-2030. |
| [10] |
HORVATH B, KLOESEL B, TODD M M, et al. The evolution, current value, and future of the American society of anesthesiologists physical status classification system[J]. Anesthesiology, 2021, 135(5): 904-919. |
| [11] |
SOLERA RUIZ I, UÑA OREJÓN R, VALERO I, et al. Awake craniotomy. Considerations in special situations[J]. Rev Esp Anestesiol Reanim, 2013, 60(7): 392-398. |
| [12] |
CHAKI T, SUGINO S, JANICKI P K, et al. Efficacy and safety of a lidocaine and ropivacaine mixture for scalp nerve block and local infiltration anesthesia in patients undergoing awake craniotomy[J]. J Neurosurg Anesthesiol, 2016, 28(1): 1-5. |
| [13] |
SAHU A, KOHT A H. Unusual manifestations of the trigeminocardiac reflex during awake craniotomy: a case report and review of the literature[J]. A A Pract, 2021, 15(8): e01508. |
| [14] |
刘鸽, 赖峻松, 李敏, 等. 幕上肿瘤切除术中超声引导头部神经阻滞对患者认知功能和睡眠质量的影响分析[J]. 中国医学创新, 2021, 18(23): 14-18. LIU G, LAI J S, LI M, et al. Effect of ultrasound-guided cranial nerve block on cognitive function and sleep quality in supratentorial tumor resection[J]. Med Innov China, 2021, 18(23): 14-18. |
| [15] |
LIU J, YUAN K, ZHOU H, et al. A randomized controlled trial evaluating the hemodynamic impact of ultrasound-guided great auricular nerve block in middle ear microsurgery[J]. BMC Anesthesiol, 2020, 20(1): 234. |




