2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系军队流行病学教研室;
3. 400032 重庆,沙坪坝区双碑社区卫生服务中心;
4. 401120 重庆,重庆医科大学附属第三医院心血管疾病中心
2. Department of Epidemiology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Shuangbei Community Health Service Center of Shapingba District, Chongqing, 400032;
4. Cardiovascular Disease Center, the Third Affiliated Hospital of Chongqing Medical University, Chongqing, 401120, China
2型糖尿病是一个日益严重的全球健康问题,影响着全球约4.63亿成年人[1]。2015-2017年中华医学会内分泌学分会在全国31个省进行的糖尿病流行病学调查显示,我国18岁及以上人群糖尿病患病率为11.2%[2]。
近年来,血糖波动是2型糖尿病研究的热点之一,血糖波动即血糖变异性(glycemic variability, GV)是指血糖在一定时间内于高峰和低谷之间变化的非稳定状况,主要包括短期和长期血糖波动,是评价血糖控制质量的主要考虑指标[3]。有研究表明,血糖波动会加剧微血管、大血管的并发症,对糖尿病患者微血管和大血管并发症以及全因死亡率有较高的预测价值[4-5]。无论是代表短期还是长期的血糖变异性,都与糖尿病大血管和微血管并发症、低血糖、死亡率和其他不良临床结局的风险增加有关[6]。临床上通常利用包括日内和日间血糖变异性的短期变异性,以及基于糖化血红蛋白(HbA1c)、空腹血糖(FPG)、自我检测血糖(self- monitoring of blood glucose, SMBG)和连续血糖监测(continuous glucose monitoring, CGM)的长期变异性来评估血糖波动。
尽管近年来评估血糖波动的手段和参数越来越丰富,但大多参数仅关注短期血糖波动的幅度,不能体现在较长时间尺度上的规律[7-8]。纵向轨迹可以描述某一事物发展状态随时间变化的长期过程。组基轨迹模型(group-based trajectory modelling,GBTM)是一种以发展轨迹组为单位将人群聚类的方法,可以识别总体中具有差异的发展轨迹[9-10]。通过GBTM将糖尿病患者血糖水平长期波动的趋势可视化,更好地体现出血糖水平随着时间的变化规律。
改善血糖波动异常是2型糖尿病患者血糖管理的目标之一,本研究通过GBTM来识别社区随访管理的糖尿病患者不同空腹血糖波动轨迹,探索血糖波动轨迹的影响因素,为社区糖尿病患者血糖控制、预防不良结局提供依据。
1 资料与方法 1.1 研究对象选取2012年1月至2019年12月在重庆市沙坪坝区双碑社区卫生服务中心建立居民健康档案并纳入社区随访管理的2型糖尿病患者。排除标准:①基线资料缺失;②诊断2型糖尿病后3年内每年血糖随访少于2次。本研究通过陆军军医大学伦理委员会批准(批件号:2021第25-02)。
1.2 研究方法采用回顾性队列研究设计。2型糖尿病患者在社区卫生服务中心建立居民档案,并加入社区随访管理时为研究基线,基线资料包括基本信息、生活方式和体检信息,通过社区卫生服务中心的慢性病管理系统调取,具体包括:①人口学信息:如性别、年龄、是否工作、婚姻状况、医保类型。②个人健康状况及家族病史:如腰围、体质指数(BMI)、心电图等。其中,男性腰围≥85 cm,女性腰围≥80 cm定义为中心型肥胖,BMI≥24 kg/m2定义为超重。③生活方式:吸烟状况、饮酒状况、锻炼频率及服药依从性等。社区卫生服务中心工作人员按照《国家基本公共卫生服务规范第3版》随访管理评估要求,对确诊的2型糖尿病患者,每年提供4次免费空腹血糖检测和随访,血糖检测为患者在空腹8~12 h状态下,采指尖静脉血运用血糖检测仪测定空腹血糖。终点事件为诊断2型糖尿病后3年空腹血糖的动态变化。
1.3 统计学分析符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,非正态分布的计量资料以M(P25, P75)表示,组间比较采用秩和检验,计数资料以例数(%)表示,采用χ2检验或Fisher确切概率法比较。
假设人群中存在着有限个不同发展形态的潜在轨迹样式,各潜变量轨迹组的研究群体随时间(如年龄)的延伸具有同质的纵向发展模式[11],组基轨迹模型(GBTM)可以用来探索总体中包含多少个发展趋势不同的亚组,并确定各亚组的发展轨迹。本研究采用GBTM构建糖尿病患者空腹血糖水平的变化轨迹,将糖尿病患者分成各个亚组。GBTM组数一般为1~5组,每组轨迹遍历1~3阶多项式方程,最终模型的拟合效果采用以下指标进行评估[12]:①贝叶斯信息准则(Bayesian information criterion,BIC):BIC值越接近0,表示模型拟合越好;②平均验后分组概率(average posterior probability,AvePP),该指标反映了根据轨迹分组后的亚组内成员与该轨迹的符合程度,通常>0.7为可接受的标准;③每组成员数:各组成员数≥5%。本研究使用糖尿病确诊后每年随访中的前2次空腹血糖数据,共3年6次,采用组基轨迹模型构建并绘制轨迹分析图。并采用多重插补法对缺失数据进行处理。
运用无序多分类Logistic回归分析各个轨迹亚组的相关因素。所有统计检验均为双侧检验,P < 0.05为差异有统计学意义。本研究采用SPSS 25.0和Stata 15.0统计软件进行数据分析。
2 结果 2.1 一般情况本研究纳入769名2型糖尿病患者,男性365人(47.5%),女性404人(52.5%),65岁及以上有314人(40.8%),大部分患者文化程度为初中及以下,有一半以上患者同时患有高血压。见表 1。
| 变量 | 例数(%) | 变量 | 例数(%) | |
| 性别 | 合并症 | |||
| 男 | 365(47.5) | 高血压 | 424(55.1) | |
| 女 | 404(52.5) | 其他合并症 | 55(7.2) | |
| 年龄 | 中心型肥胖 | 488(63.5) | ||
| 超重 | 494(64.2) | |||
| < 65岁 | 455(59.2) | 锻炼频率 | ||
| ≥65岁 | 314(40.8) | 每天锻炼 | 466(60.6) | |
| 文化程度 | 偶尔或不锻炼 | 303(39.4) | ||
| 初中及以下 | 565(73.5) | 吸烟状况 | ||
| 高中及以上 | 204(26.5) | 不吸烟 | 574(74.6) | |
| 是否工作 | 吸烟或已戒烟 | 195(25.4) | ||
| 有工作 | 587(76.3) | 饮酒状况 | ||
| 无工作 | 182(23.7) | 不饮酒 | 583(75.8) | |
| 饮酒或已戒酒 | 186(24.2) | |||
| 婚姻状况 | 心电图 | |||
| 已婚 | 657(85.4) | 正常 | 533(69.3) | |
| 其他 | 112(14.6) | 异常 | 236(30.7) | |
| 医保类型 | 服药依从性 | |||
| 城镇职工 | 581(75.6) | 规律 | 538(70.0) | |
| 其他 | 188(24.4) | 间断 | 84(10.9) | |
| 未服药 | 147(19.1) |
2.2 构建空腹血糖变化轨迹模型
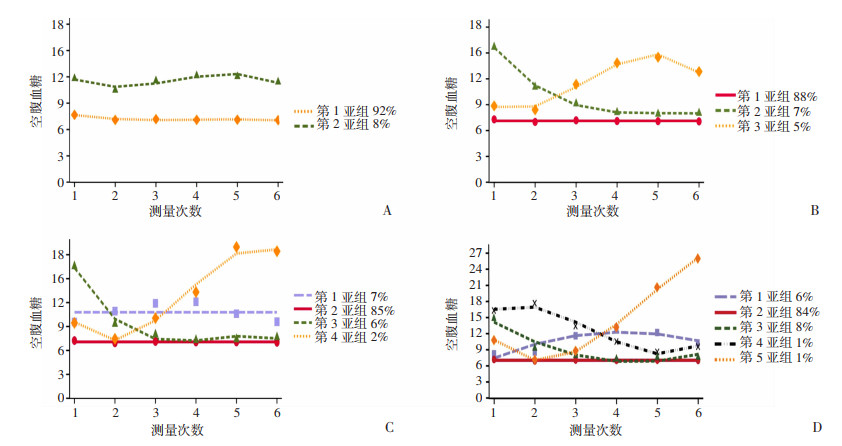
对社区2型糖尿病患者空腹血糖变化经过多次轨迹拟合,模型拟合完成后,根据模型拟合评价指标和轨迹模型图选择最优的模型。图 1为拟合的糖尿病患者空腹血糖不同轨迹图,一共拟合了4个模型,分别为2~ 5个亚组。
|
| A: Model 1,分为2个亚组;B: Model 2,分为3个亚组;C: Model 3,分为4个亚组;D: Model 4,分为5个亚组;横坐标1~6分别代表诊断糖尿病后第1年第1次随访、第1年第2次随访、第2年第1次随访、第2年第2次随访、第3年第1次随访、第3年第2次随访 图 1 糖尿病患者空腹血糖轨迹模型曲线图 |
根据最优模型评估指标BIC接近0、AvePP>0.7以及每组成员数百分比≥5%[12],确定最优模型为Model 2(图 1B),亚组数量为3组(表 2)。第1个亚组占总人数的88%,该组患者空腹血糖呈现出空腹血糖水平较低、变化幅度小、整体平稳的趋势,将该组命名为低水平平稳组。第2亚组占总人数的7%,该组空腹血糖呈现出由高水平下降至低水平,随后维持稳定的趋势,将该亚组命名为高水平下降组。第3亚组占总人数的5%,空腹血糖呈现初期在低水平稳定,随后快速上升至高水平,后略有下降的趋势,将该亚组命名为中水平上升组。
| 模型 | BIC | AvePP | ||||
| 亚组1 | 亚组2 | 亚组3 | 亚组4 | 亚组5 | ||
| Model 1 | -10 614.57 | 0.99 | 0.93 | |||
| Model 2 | -10 366.76 | 0.99 | 0.93 | 0.96 | ||
| Model 3 | -10 284.21 | 0.87 | 0.99 | 0.94 | 0.97 | |
| Model 4 | -10 180.51 | 0.94 | 0.98 | 0.90 | 0.99 | 0.99 |
| Model 1~Model 4分别表示将人群划分为2~5组时的模型;BIC为贝叶斯信息准则,值越接近0,表示模型拟合越好;AvePP为平均验后分组概率,通常>0.7为可接受的标准 | ||||||
2.3 空腹血糖变化轨迹模型亚组基线特征比较
根据GBTM轨迹拟合结果,将社区糖尿病患者分为低水平平稳组、高水平下降组和中水平上升组,并比较3组之间的基线特征。3组比较结果显示,既往高血压史、锻炼频率、饮酒状况和服药依从性在3组的分布存在统计学差异(P < 0.05),其余因素在3组间的分布均不存在统计学差异。与低水平平稳组相比,高水平下降组和中水平上升组有既往高血压史(38.6%、47.4% vs 57.0%)、每天锻炼(45.6%、50.0% vs 62.5%)、不饮酒(61.4%、71.1% vs 78.5%)的比例更低。低水平平稳组未服药(20.9%)比例高于其余2组,高水平下降组规律服药(86.0%)比例较其余两组更高,中水平上升组间断服药(42.1%)比例较高(表 3)。
| 变量 | 低水平平稳组(n=674) | 高水平下降组(n=57) | 中水平上升组(n=38) | P |
| 男性 | 311(46.1) | 34(59.6) | 20(52.6) | 0.118 |
| 年龄 | 0.381 | |||
| < 65岁 | 393(58.3) | 36(63.2) | 26(68.4) | |
| ≥65岁 | 281(41.7) | 21(36.8) | 12(31.6) | |
| 文化程度 | 0.230 | |||
| 初中及以下 | 492(73.0) | 47(82.5) | 26(68.4) | |
| 高中及以上 | 182(27.0) | 10(17.5) | 12(31.6) | |
| 是否工作 | 0.833 | |||
| 有工作 | 514(76.3) | 45(78.9) | 28(73.7) | |
| 无工作 | 160(23.7) | 12(21.1) | 10(26.3) | |
| 婚姻状况 | 0.243 | |||
| 已婚 | 575(85.3) | 52(91.2) | 30(78.9) | |
| 其他 | 99(14.7) | 5(8.3) | 8(21.1) | |
| 医保类型 | 0.076 | |||
| 城镇职工医保 | 518(76.9) | 37(64.9) | 26(68.4) | |
| 其他医保类型 | 156(23.1) | 20(35.1) | 12(31.6) | |
| 既往高血压史 | 384(57.0) | 22(38.6) | 18(47.4) | 0.017 |
| 中心型肥胖 | 433(64.2) | 34(59.6) | 21(55.3) | 0.441 |
| 超重 | 437(64.8) | 37(64.9) | 20(52.6) | 0.310 |
| 锻炼频率 | 0.017 | |||
| 每天锻炼 | 421(62.5) | 26(45.6) | 19(50.0) | |
| 偶尔或不锻炼 | 253(37.5) | 31(54.4) | 19(50.0) | |
| 吸烟状况 | 0.094 | |||
| 不吸烟 | 511(75.8) | 36(63.3) | 27(71.1) | |
| 吸烟或已戒烟 | 163(24.2) | 21(36.8) | 11(28.9) | |
| 饮酒状况 | 0.009 | |||
| 不饮酒 | 529(78.5) | 35(61.4) | 27(71.1) | |
| 饮酒或已戒酒 | 145(21.5) | 22(38.6) | 11(28.9) | |
| 心电图情况 | 0.387 | |||
| 正常 | 468(69.4) | 36(63.2) | 29(76.3) | |
| 异常 | 206(30.6) | 21(36.8) | 9(23.7) | |
| 服药依从性 | 0.001 | |||
| 规律 | 471(69.9) | 49(86.0) | 18(47.4) | |
| 间断 | 62(9.2) | 6(10.5) | 16(42.1) | |
| 未服药 | 141(20.9) | 2(3.5) | 4(10.5) |
2.4 空腹血糖轨迹相关因素的Logistic回归分析
以糖尿病患者空腹血糖变化轨迹分组作为因变量,将单因素分析中有统计学意义的变量进一步纳入多因素Logistic回归分析。分析结果显示(表 4),以低水平平稳组为对照,有高血压病史、未服药的患者被归为高水平下降组的可能性较低,即这部分患者的血糖从高水平逐渐下降的可能性较低,OR值(95%CI)分别为0.50(0.28~0.90)和0.13(0.03~0.56),偶尔或不锻炼、饮酒或已戒酒的患者更倾向于被归为高水平下降组,即血糖更易呈现从高水平逐渐下降的波动趋势,OR值(95%CI)分别为2.02(1.15~3.55)和2.32(1.16~4.63)。与规律服药的糖尿病患者相比,间断服药的糖尿病患者更倾向被归为中水平上升组,即出现血糖水平从中水平上升趋势的风险较高,OR值(95%CI)为6.02(2.86~12.66)。
| 因素 | 高水平下降组a | 中水平上升组a | |||
| OR(95%CI) | P | OR(95%CI) | P | ||
| 性别 | |||||
| 女 | 参照组 | 参照组 | |||
| 男 | 0.95(0.48~1.88) | 0.888 | 1.06(0.47~2.39) | 0.896 | |
| 年龄 | |||||
| < 65岁 | 参照组 | 参照组 | |||
| ≥65岁 | 1.00(0.55~1.80) | 0.990 | 0.83(0.40~1.75) | 0.631 | |
| 高血压史 | |||||
| 否 | 参照组 | 参照组 | |||
| 是 | 0.50(0.28~0.90) | 0.021 | 0.84(0.42~1.68) | 0.617 | |
| 锻炼频率 | |||||
| 每天锻炼 | 参照组 | 参照组 | |||
| 偶尔或不锻炼 | 2.02(1.15~3.55) | 0.014 | 1.39(0.70~2.75) | 0.353 | |
| 饮酒状况 | |||||
| 不饮酒 | 参照组 | 参照组 | |||
| 饮酒或已戒酒 | 2.32(1.16~4.63) | 0.017 | 1.33(0.55~3.19) | 0.525 | |
| 服药依从性 | |||||
| 规律 | 参照组 | 参照组 | |||
| 间断 | 0.73(0.29~1.81) | 0.494 | 6.02(2.86~12.66) | < 0.001 | |
| 未服药 | 0.13(0.03~0.56) | 0.006 | 0.72(0.24~2.20) | 0.568 | |
| a:对照为低水平平稳组 | |||||
3 讨论
血糖波动与卒中、心肌梗死和全因死亡率的风险呈剂量反应关系[13],且与心血管疾病的风险呈显著正相关[14]。高血糖变异性与低血糖风险增加[15]、心理健康障碍及生活质量降低[16]和2型糖尿病患者死亡率增加相关[17-18]。目前大多关于血糖长期波动的研究所使用的手段及参数不能体现血糖水平随时间的变化趋势,且有关血糖波动影响因素的研究并不多,本研究采用模型构建来描述血糖的变化规律性,反映血糖波动特征,并探讨波动的影响因素。
本研究结果显示,运用GBTM可以将社区2型糖尿病人群按照空腹血糖水平分为3组,即低水平平稳组、高水平下降组和中水平上升组。以低水平平稳组为对照,有高血压史、未服药的2型糖尿病患者被归为高水平下降组的可能性较低,即基线血糖水平高且不易改善,血糖水平从高水平逐渐下降的可能性较低。而偶尔或不锻炼、饮酒或已戒酒的糖尿病患者更倾向于被归为高水平下降组,即基线血糖水平高,但血糖水平从高水平逐渐下降的可能性较大。有相关研究表明,糖尿病伴高血压患者的血压水平不佳(2级高血压及以上)为糖尿病足病伴高血压患者血糖控制的主要影响因素[19],高血压患者碳水化合物代谢紊乱较无高血压的人群来说更为常见[20-21],即高血压患者血糖调节能力更差,这意味着有高血压史的2型糖尿病患者空腹血糖控制难度更大,血糖要控制到正常水平较无高血压的糖尿病患者更难,这与本研究相符。
3.1 生活方式与血糖的关联《国家基层糖尿病防治管理手册(2022)》表明糖尿病是由遗传和环境因素共同作用所导致的复杂性疾病,其中糖尿病可干预的危险因素主要包括糖尿病前期、代谢综合征、不健康饮食、身体活动不足、吸烟等[22]。美国糖尿病协会的声明表示体力活动可以增强胰岛素作用效果、降低空腹血糖,更好地达到血糖控制目标[23],LUMB[24]表示在2型糖尿病中,无论是有氧运动还是阻力运动都改善了血糖控制,与血糖下降有关。目前公认体育运动对2型糖尿病的血糖控制有益[25],且各国糖尿病治疗指南均建议糖尿病患者进行体育锻炼,每个糖尿病患者均应定期参加体育锻炼,以实现最佳的血糖控制,FRANCESCONI等[26]的研究表明运动有助于降低胰岛素抵抗,提高胰岛素分泌来改善血糖,耐力和力量训练都能从根本上改善胰岛素抵抗,建议成年男性和女性每周至少进行150 min中等强度的有氧运动。有研究结果显示,在社区开展包括加强体育锻炼、戒烟、减少酒精摄入量等生活方式干预能有效降低空腹血糖水平[27-28],目前共识认为个人生活方式如吸烟、饮酒、运动、饮食及肥胖与2型糖尿病发生有关,ZHANG等[29]的研究表明采用健康的生活方式与明显降低2型糖尿病风险相关,糖尿病管理应鼓励人们避免吸烟和酗酒、健康饮食和增加体育活动水平,许多2型糖尿病病例可以通过改变生活方式(包括保持健康体质量、健康饮食、不吸烟以及适量饮酒等在内)来预防[1]。本研究显示基线为偶尔或不锻炼、饮酒或已戒酒的糖尿病患者更倾向于被归为高水平下降组,即该组患者基线时空腹血糖大多处于高水平状态(>15 mmol/L),是低水平平稳组(7~8 mmol/L)的2倍多,这与大部分研究结果相符。至于该组患者为何更易呈现高水平逐渐下降的波动趋势,可能的原因是所研究的因素均为基线所收集的资料,身体活动不足、饮酒为糖尿病可干预的危险因素,该组患者在社区医师的健康管理下,采取增加锻炼、限酒等改善生活方式的控制血糖的措施,因此更容易呈现出高水平下降的波动趋势。
3.2 服药依从性与血糖的关联KOHNERT等[30]在未使用胰岛素治疗的2型糖尿病患者中证实口服降糖药及餐后β细胞功能与血糖变异性独立相关,降糖药物的使用能够使糖尿病患者血糖控制更好,PAGKALOS[31]表明胰岛素和口服降糖药物是降低高血糖水平最有效的疗法,KOUFAKIS等[32]的研究表明在因高血糖的住院患者中,口服降糖药有效控制血糖水平的疗效与胰岛素相当,且有良好的安全性和耐受性,以上研究均表明口服降糖药能够很好地控制血糖。而对于血糖水平较低的患者,间断服药是出现血糖由低水平升高至高水平波动的独立危险因素。有文献阐明更高的药物使用依从性与血糖控制有关[33],赵茜等[34]的研究也表明提高药物使用依从性有助于提高2型糖尿病患者空腹血糖的控制水平。血糖控制水平越差,基础血糖水平较低的糖尿病患者出现血糖波动的风险越高。本研究进一步验证上述研究结果,与规律服药的糖尿病患者相比,间断服药的糖尿病患者更倾向于被归为中水平上升组,即血糖水平呈现从中水平上升趋势的风险较高,可见提高服药依从性、减少间断服药,可以维持血糖在较低水平的稳定性,避免出现不良的血糖波动趋势。
本研究还存在一定的局限性,只选择了重庆市一个社区纳入慢性病管理的糖尿病患者,研究的代表性有限,且样本量不够大,血糖波动组人数较少,后续拟纳入多个社区人群扩大样本量进一步验证研究结果。此外,对于社区2型糖尿病患者只收集到基线的生活方式状态,未观察到患者在研究过程中生活方式的改变,这种改变对于糖尿病患者血糖控制有着较为重要的影响,后续可以增加对生活方式改善相关资料的收集,进一步研究锻炼、饮酒等生活方式对血糖波动的影响。另外,利用组基轨迹模型对糖尿病患者血糖波动特征进行识别分组,可以使糖尿病患者血糖波动可视化,能够更好地描述血糖波动的特征,但GBTM在纵向数据的研究中忽略了相同轨迹内的个体变异性,以及根据后验概率在进行分组时存在一定的不确定性[10],这可能对研究结果产生一定的影响。
综上,本研究以社区2型糖尿病患者空腹血糖为基础,运用GBTM构建轨迹模型并探讨其相关影响因素。结果表明社区2型糖尿病患者空腹血糖轨迹呈现不同的动态变化特征,高血压史、服药依从性、锻炼频率和饮酒可能是患者出现不同血糖波动轨迹的相关影响因素,这为更有效地控制社区2型糖尿病患者的血糖提供了理论依据。
| [1] |
ZHENG Y, LEY S H, HU F B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications[J]. Nat Rev Endocrinol, 2018, 14(2): 88-98. |
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志, 2021, 41(5): 482-548. Chinese Diabetes Society of Chinese Medical Association. Guideline for the prevention and treatment of type 2 diabetes mellitus in China (2020 edition)[J]. Int J Endocrinol Metab, 2021, 41(5): 482-548. |
| [3] |
RODBARD D. Glucose variability: a review of clinical applications and research developments[J]. Diabetes Technol Ther, 2018, 20(S2): S25-S215. |
| [4] |
YOON J E, SUNWOO J S, KIM J S, et al. Poststroke glycemic variability increased recurrent cardiovascular events in diabetic patients[J]. J Diabetes Complications, 2017, 31(2): 390-394. |
| [5] |
CARODSO C L, LEITE N C, MORAM C M, et al. Long-term visit-to-visit glycemic variability as predictor of micro-and macrovascular complications in patients with type 2 diabetes: the Rio de Janeiro Type 2 Diabetes Cohort Study[J]. Cardiovasc Diabetol, 2018, 17(1): 33. |
| [6] |
ZHOU Z, SUN B, HUANG S Q, et al. Glycemic variability: adverse clinical outcomes and how to improve it?[J]. Cardio-vasc Diabetol, 2020, 19(1): 102. |
| [7] |
MARTINEZ M, SANTAMARINA J, PAVESI A, et al. Glycemic variability and cardiovascular disease in patients with type 2 diabetes[J]. BMJ Open Diabetes Res Care, 2021, 9(1): e002032. |
| [8] |
倪佳英, 马晓静, 周健. 血糖波动异常与糖尿病并发症的研究进展[J]. 中华糖尿病杂志, 2022, 14(04): 388-392. NI J Y, MA X J, ZHOU J. Research progress of abnormal glycemic variability and diabetic complications[J]. Chin J Diabetes Mellit, 2022, 14(4): 388-392. |
| [9] |
NAGIN D S, ODGERS C L. Group-based trajectory modeling in clinical research[J]. Annu Rev Clin Psychol, 2010, 6: 109-138. |
| [10] |
张晨旭, 谢峰, 林振, 等. 基于组轨迹模型及其研究进展[J]. 中国卫生统计, 2020, 37(6): 946-949. ZHANG C X, XIE F, LIN Z, et al. Group trajectory model and its research progress[J]. Chin J Health Stat, 2020, 37(6): 946-949. |
| [11] |
冯国双, 于石成, 刘世炜. 轨迹分析模型在追踪数据分析中的应用[J]. 中国预防医学杂志, 2014, 15(3): 292-295. FENG G S, YU S C, LIU S W. Application of trajectory analysis model in tracking data analysis[J]. Chin Prev Med, 2014, 15(3): 292-295. |
| [12] |
Lennon H, Kelly S, Sperrin M, et al. Framework to construct and interpret latent class trajectory modelling[J]. BMJ Open, 2018, 8(7): e020683. |
| [13] |
LEE D Y, HAN K, PARK S, et al. Glucose variability and the risks of stroke, myocardial infarction, and all-cause mortality in individuals with diabetes: retrospective cohort study[J]. Cardiovasc Diabetol, 2020, 19(1): 144. |
| [14] |
SHEN Y, ZHOU J, SHI L Z, et al. Association between visit-to-visit HbA1c variability and the risk of cardiovascular disease in patients with type 2 diabetes[J]. Diabetes Obes Metab, 2021, 23(1): 125-135. |
| [15] |
QU Y M, JACOBER S J, ZHANG Q Y, et al. Rate of hypo-glycemia in insulin-treated patients with type 2 diabetes can be predicted from glycemic variability data[J]. Diabetes Technol Ther, 2012, 14(11): 1008-1012. |
| [16] |
PENCKOFER S, QUINN L, BYRN M, et al. Does glycemic variability impact mood and quality of life?[J]. Diabetes Technol Ther, 2012, 14(4): 303-310. |
| [17] |
HIRAKAWA Y, ARIMA H, ZOUNGAS S, et al. Impact of visit-to-visit glycemic variability on the risks of macrovascular and microvascular events and all-cause mortality in type 2 diabetes: the ADVANCE trial[J]. Diabetes Care, 2014, 37(8): 2359-2365. |
| [18] |
KAZE A D, SANTHANAM P, ERQOU S, et al. Long-term variability of glycemic markers and risk of all-cause mortality in type 2 diabetes: the Look AHEAD study[J]. BMJ Open Diabetes Res Care, 2020, 8(2): e001753. |
| [19] |
娄海飞, 张丽华, 赵月, 等. 糖尿病足病伴高血压患者血糖控制的影响因素[J]. 中华高血压杂志, 2022, 30(3): 287-289. LOU H F, ZHANG L H, ZHAO Y, et al. Influencing factors of blood glucose control in patients with diabetic foot disease and hypertension[J]. Chin J Hypertens, 2022, 30(3): 287-289. |
| [20] |
PERREAULT L, PAN Q, ARODA V R, et al. Exploring residual risk for diabetes and microvascular disease in the Diabetes Prevention Program Outcomes Study (DPPOS)[J]. Diabet Med, 2017, 34(12): 1747-1755. |
| [21] |
WEI G S, COADY S A, GOFF D C, J r, et al. Blood pressure and the risk of developing diabetes in African Americans and whites: ARIC, CARDIA, and the Framingham heart study[J]. Diabetes Care, 2011, 34(4): 873-879. |
| [22] |
中华医学会糖尿病学分会, 国家基层糖尿病防治管理办公室. 国家基层糖尿病防治管理手册(2022)[J]. 中华内科杂志, 2022, 61(7): 717-748. Chinese Diabetes Society of Chinese Medical Associntion, National Office for Primary Diabetes Care. National handbook for the prevention and control of diabetes in prim ary care (2022)[J]. Chin J Intern Med, 2022, 61(7): 717-748. |
| [23] |
COLBERG S R, SIGAL R J, YARDLEY J E, et al. Physical activity/exercise and diabetes: a position statement of the American diabetes association[J]. Diabetes Care, 2016, 39(11): 2065-2079. |
| [24] |
LUMB A. Diabetes and exercise[J]. Clin Med (Lond), 2014, 14(6): 673-676. |
| [25] |
MELMER A, KEMPF P, LAIMER M. The role of physical exercise in obesity and diabetes[J]. Praxis (Bern 1994), 2018, 107(17/18): 971-976. |
| [26] |
FRANCESCONI C, NIEBAUER J, HABERP, et al. Life-style: physical activity and training as prevetion and therapy of type 2 diabetes mellitus (Update 2019)[J]. Wien Klin Wochenschr, 2019, 131(Suppl 1): 61-66. |
| [27] |
KNOWLER W C, BARRETT-CONNOR E, FOWLER S E, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin[J]. N Engl J Med, 2002, 346(6): 393-403. |
| [28] |
LIN A H, ZHANG G R, LIU Z T, et al. Community-based lifestyle intervention for reducing blood pressure and glucose among middle-aged and older adults in China: a pilot study[J]. Int J Environ Res Public Health, 2014, 11(11): 11645-11663. |
| [29] |
ZHANG Y, PAN X F, CHEN J, et al. Combined lifestyle factors and risk of incident type 2 diabetes and prognosis among individuals with type 2 diabetes: a systematic review and meta-analysis of prospective cohort studies[J]. Diabetologia, 2020, 63(1): 21-33. |
| [30] |
KOHNERT K D, AUGSTEIN P, ZANDER E, et al. Glycemic variability correlates strongly with postprandial beta-cell dysfunction in a segment of type 2 diabetic patients using oral hypoglycemic agents[J]. Diabetes Care, 2009, 32(6): 1058-1062. |
| [31] |
PAGKALOS E M. Combinations of insulin and oral hypoglycemic agents in diabetes mellitus type 2[J]. Diabetes Res Clin Pract, 2011, 93: S100-S101. |
| [32] |
KOUFAKIS T, MUSTAFA O G, ZEBEKAKIS P, et al. Oral antidiabetes agents for the management of inpatient hyper-glycaemia: so far, yet so close[J]. Diabet Med, 2020, 37(9): 1418-1426. |
| [33] |
CAPOCCIA K, ODEGARD P S, LETASSY N. Medication adherence with diabetes medication[J]. Diabetes Educ, 2016, 42(1): 34-71. |
| [34] |
赵茜, 郭雅丽, 许琪, 等. 格列齐特药物治疗下2型糖尿病患者血糖控制水平影响因素研究[J]. 中国慢性病预防与控制, 2012, 20(3): 314-316. ZHAO Q, GUO Y L, XU Q, et al. The influential factors of fasting blood glucose in patients of type 2 diabetes mellitus with gliclazide treatment[J]. Chin J Prev Control Chronic Dis, 2012, 20(3): 314-316. |




