随着老龄化的加剧,瓣膜性心脏病(valvular heart disease,VHD)的患病率在世界范围内均逐渐升高[1-2]。其中,钙化性主动脉瓣疾病(calcific aortic valve disease,CAVD)是最常见的瓣膜性心脏病之一,每年有超过1 000万患者,且大部分都是老年人群[3]。CAVD早期通常无明显症状,但随着瓣叶的逐渐增厚、钙化以及主动脉开口狭窄的愈发严重而出现血流动力学异常、心力衰竭等并最终导致死亡。近年来,越来越多的证据表明,CAVD并非是一种被动性的退化性疾病,其进展与血脂异常、炎症反应等复杂因素紧密相关[4-6]。但是具体的发病机制目前尚未完全阐明,暂无有效的药物可以预防和治疗,换瓣手术是唯一的有效治疗手段。因此,寻找CAVD发生发展过程中适合的药物干预靶点是当前急需解决的问题[7]。
镁离子是人体重要的阳离子,大部分储存于细胞内,仅有少部分在细胞外。镁离子是多种酶促反应的重要辅酶因子,参与了多项生理活动,与许多疾病的发生发展密切相关。近年来,有临床研究发现低镁血症与血管钙化和心血管疾病有关[8-9]。随着研究的深入,发现镁离子可以起到抗血管钙化的作用,但是其与瓣膜钙化间的联系研究较少[10]。因此,本研究通过观察镁离子对体外诱导瓣膜间质细胞成骨分化的作用,试图明确镁离子在瓣膜钙化病程中所扮演的角色,为瓣膜钙化的治疗提供新的思路。
1 材料与方法 1.1 材料 1.1.1 猪瓣膜来源选取4月龄家猪(上海五丰食品有限公司),体质量约50 kg,获取主动脉瓣膜组织后,立即置放入含1%青-链霉素的预冷无菌磷酸盐缓冲液(PBS)中,置于冰盒迅速返回实验室进行细胞的分离与培养。
1.1.2 试剂与仪器DMEM培养基、胎牛血清(FBS)、e酶、Ⅱ型胶原均购于美国Gibco公司;PBS缓冲液购于上海博蕴公司;SDS裂解液、BCA蛋白浓度测定试剂盒购于上海碧云天生物公司;PAGE蛋白上样量缓冲液、PAGE凝胶制备试剂盒购于上海雅酶生物医药科技有限公司,α-SMA购于Proteintech公司;Vimentin、CD31购于Abcam公司;OPN、RUNX2、ERK、P-ERK、AKT、P-AKT抗体均购于CST公司;兔抗、鼠抗购于武汉谷歌生物科技有限公司;DAPI染色液购于博士德生物工程有限公司,茜素红S染液购于索莱宝公司。多功能台式离心机购于德国Eppendorf公司;流式细胞仪购自美国BD公司;蛋白印记相关仪器购于Bio-Rad公司;电子显微镜购于德国Olympus公司。
1.2 方法 1.2.1 原代猪主动脉瓣间质细胞(aortic valve interstitial cells,AVICs)的分离与培养在超净台中取出猪主动脉瓣膜,在含1%青-链霉素的预冷无菌PBS中漂洗至上清呈澄清状态,用医用无菌棉签轻拭瓣膜表面,每3片瓣膜组织放于一个无菌EP管中,加入Ⅱ型胶原1 mL,37 ℃恒温摇床消化15 min。取出瓣膜后用PBS涮洗3 min/3次,加入1 mL Ⅱ型胶原,将用眼科剪将瓣膜组织剪碎至糊状,37 ℃恒温摇床消化90 min。将EP管中所有内容物用直径200目的滤网过滤,收集滤出物并离心。弃上清后用10%DMEM将沉淀吹打均匀后接种在10 cm大皿中,及时观察细胞状态和形态,24 h后更换新鲜培养基。
取对数期生长的细胞,4%多聚甲醛固定后使用0.2% Triton X-100通透细胞15 min,山羊血清封闭细胞30 min;加入一抗工作液4 ℃孵育过夜,次日取出清洗后荧光二抗室温避光孵育30 min;孵育完毕后加入DAPI染液3 min,清洗后即可于荧光显微镜下观察拍照。取对数生长期的细胞,计数后重悬,使每管细胞量为1×107/mL,加入5 μL一抗工作液,混匀后4 ℃孵育30 min;清洗2遍后用100 μL PBS缓冲液重悬,加入荧光二抗4 ℃避光孵育30 min,清洗后1 h内使用流式细胞仪进行检测。
1.2.2 AVICs的成骨分化诱导配置成骨诱导培养基(osteogenic induction medium,OIM),5 mL双蒸水中加入25 mg抗坏血酸、200 μL诺和灵和156 mg NaH2PO4-7H2O,过滤后取5 mL加入500 mL含5%FBS和1%双抗的DMEM中,即配置成功。取3~7代AVICs接种于6孔板,细胞密度控制在50%左右,待细胞贴壁后加入OIM培养7 d。
1.2.3 Western blot检测镁对成骨标志物以及相关信号通路表达的影响将细胞分为空白对照组(Blank组)、成骨诱导培养基组(OIM组)和镁处理组(浓度为1、2、3 mmol/L MgSO4溶液)。各组细胞处理完成后弃上清,PBS清洗细胞3遍,置于冰盒中后加入SDS细胞裂解液30 min,刮取后收集并进行超声破碎处理。BCA法测各组蛋白浓度后配置样品,煮沸20 min后上样,恒压60V 30 min、120V 60 min进行电泳。电泳结束后切胶,恒流270 mA、90 min将蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,TBST缓冲液洗膜后加入配制好的一抗,4 ℃过夜。次日TBST缓冲液清洗后加入相应二抗,室温孵育1 h,清洗后加入化学发光液进行曝光显影。采用Image J软件分析条带灰度值。
1.2.4 茜素红染色检测镁对钙盐沉积的影响取3~7代AVICs接种于12孔板内,细胞密度控制在50%左右,待细胞贴壁后按照实验分组干预7 d,弃上清,PBS清洗3遍,4%多聚甲醛室温孵育30 min以固定细胞。PBS清洗3遍后加入茜素红S染液,约5 min观察钙盐呈现较深的橙红色时移除染液,并用无水乙醇清洗,观察染色结果并拍照。
1.3 统计学方法采用GraphPad Prism软件和SPSS 26.0软件进行数据处理。计量资料用x±s表示。组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 原代AVICs的形态及表型鉴定将3~7代AVICs接种于6孔板,待细胞贴壁后可在镜下观察到细胞呈梭形、纺锤形或不规则多角形,均匀分布,单层生长。使用细胞免疫荧光染色的方法对AVICs进行鉴定(图 1、2),几乎所有的细胞均表达间叶源性细胞标志物波形蛋白(Vimentin);表达成纤维细胞和平滑肌细胞标志物α-平滑肌肌动蛋白(α-SMA)的细胞较少;视野内几乎未见内皮细胞标志物CD31阳性的细胞。流式细胞术检测到AVICs的Vimentin表达率为96.4%;低表达α-SMA,表达率约为13.06%;不表达CD31,表达率约为0.08%(阳性率 < 5%)。因此,所分离出的细胞几乎都为间质细胞,且是处于静止型的VICs,纯度较为理想,无明显的瓣膜内皮细胞污染。
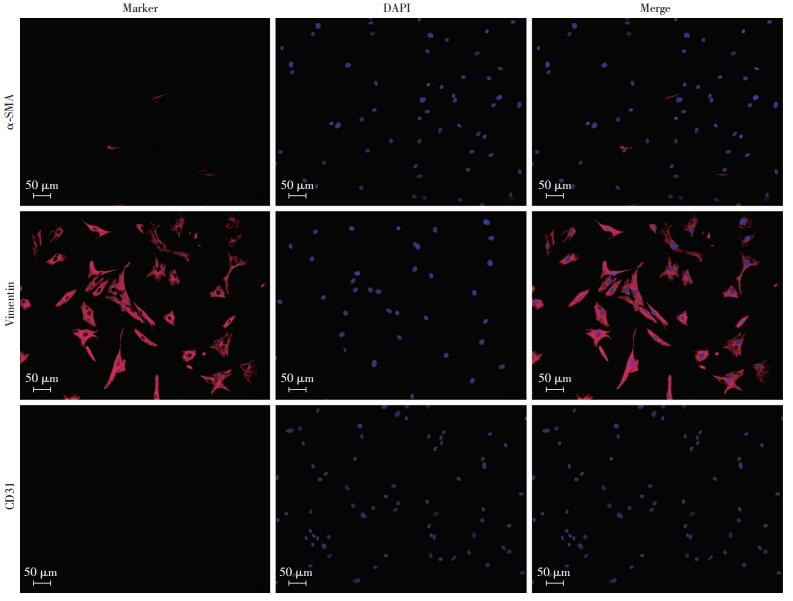
|
| 图 1 免疫荧光染色鉴定原代AVICs表面标志物 |
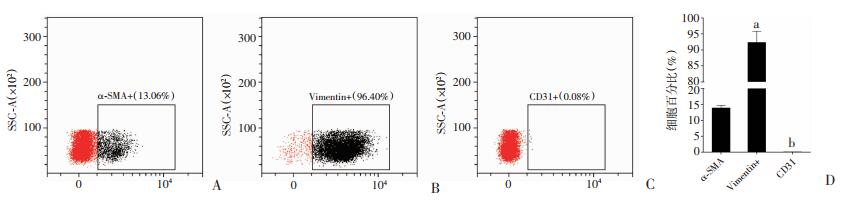
|
| A:流式细胞术检测原代AVICs α-SMA的表达;B:流式细胞术检测原代AVICs Vimentin的表达;C:流式细胞术检测原代AVICs CD31的表达;D:表面标志物相对表达量(n=3,x±s) a:P<0.01,与α-SMA组比较;b:P<0.01,与Vimentin组比较 图 2 流式细胞术鉴定原代AVICs表面标志物 |
2.2 镁离子抑制OIM诱导的AVICs成骨样细胞表型转分化
各组细胞干预7 d后提取总蛋白,Western blot结果显示:OIM组成骨标志物RUNX2以及OPN表达量显著高于Blank组(P < 0.01);与OIM组相比,镁处理组可显著降低RUNX2以及OPN的表达量(P < 0.01),尤其是镁离子浓度3 mmol/L时更为明显,见图 3。
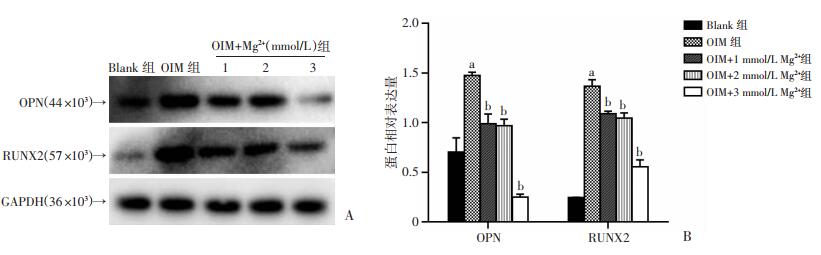
|
| A: 成骨分化免疫印记;B:蛋白相对表达量(n=3,x±s) a:P<0.01,与Blank组比较;b:P<0.01,与OIM组比较 图 3 Western blot检测各处理组AVICs成骨细胞表型转分化标志物表达量 |
2.3 镁离子抑制OIM诱导的AVICs成骨分化能力
茜素红染色结果可见:OIM组较Blank组钙盐沉积显著增多;镁处理组虽然仍有少量钙结节存在,但相比较于OIM组,钙盐沉积明显减少,见图 4。
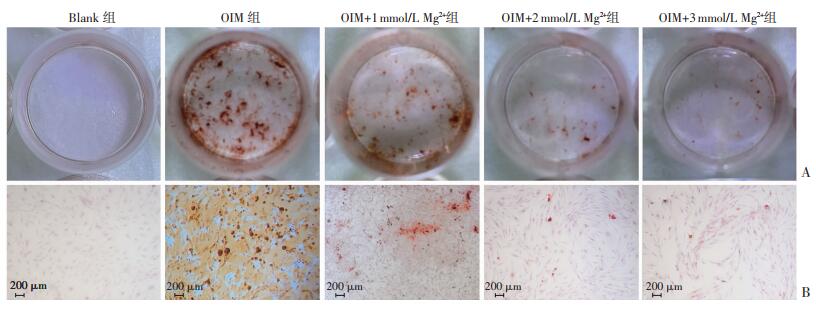
|
| A:各处理组钙盐沉积大体观察;B: 各处理组钙盐沉积镜下观察 图 4 茜素红染色观察镁离子抑制OIM诱导的AVICs成骨分化能力 |
2.4 参与镁抑制钙化培养基诱导的AVICs成骨分化的信号通路
根据上述结果选取OIM+3 mmol/L Mg2+组,Western blot结果显示(图 5),磷酸化的AKT在OIM中被显著激活(P < 0.01),OIM+3 mmol/L Mg2+则使磷酸化失活(P < 0.01),而各组总AKT基本保持稳定。ERK信号通路也是同样的表达情况。因此推测,高浓度的镁可能通过抑制OIM诱导的AKT和ERK激活来减缓成骨分化。
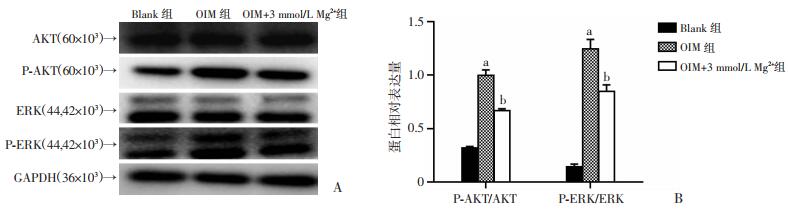
|
| A:PI3K/AKT和MAPK/ERK1/2信号通路免疫印记;B:P-AKT/AKT和P-ERK/ERK蛋白相对表达量(n=3,x±s) a:P < 0.01,与Blank组比较;b:P < 0.01,与OIM组比较 图 5 Western blot检测PI3K/AKT和MAPK/ERK1/2信号通路对镁抑制钙化的调节 |
3 讨论
近年CAVD已被逐渐认为是一种涉及炎症、脂质沉积等多种过程的主动性疾病,是类似于骨发育等多因素综合调控的病理过程。心脏瓣膜主要由覆盖在瓣膜表面的内皮细胞、贯穿瓣膜整层结构的间质细胞以及间质细胞分泌的胶原蛋白、弹性纤维等细胞外基质成分共同组成[11-12]。其中,间质细胞是瓣膜中数量最多的细胞成分,具有多种表型分化潜能。由于正常的人源VICs很难获取,AVICs与人类同源性相对较高,来源广泛易获取,所以自行分离培养原代AVICs进行实验研究[13]。为了探讨镁与AVICs成骨分化之间的关系,本实验首先通过OIM诱导AVICs成骨分化,Western blot结果显示OPN和RUNX2表达增加,表明成功建立了体外AVICs成骨分化模型。
正常情况下,静止的VICs表现成纤维细胞样表型,当受到异常血流、机械应力或其他损伤刺激时,VICs会活化成肌成纤维细胞样表型[14]。活化的VICs收缩性能增强,α-SMA表达增加,产生胶原的能力也大大增强,在完成组织修复后即恢复为静止型,或者直接发生凋亡以维持组织平衡稳态[15-16]。若刺激因素继续存在,VICs有可能通过Wnt/β-catenin、MAPK/ERK、Notch等多条通路上调RUNX2、OPN等多种成骨细胞相关因子的表达,并向成骨细胞样表型转分化,导致瓣膜组织增厚变硬,最终发生钙化[17-18]。
Mg2+作为人体必需的阳离子,有多项重要的生理功能,对血管内皮细胞和平滑肌细胞均有一定的调节作用,因此与血管钙化之间的关系备受关注[19]。Mg2+和Ca2+是共价二价阳离子,Mg2+具有Ca2+的理化性质,可作为生理性钙拮抗剂,钙镁平衡对钙化的发生发展具有重要影响[20]。近年研究发现,镁可以通过影响钙磷代谢、炎症反应、脂质沉积和成骨分化等过程对血管钙化起到抑制作用,但与瓣膜钙化之间的相关研究甚少[21-23]。本实验发现在OIM处理的AVICs中加入Mg2+后,OPN和RUNX2的蛋白表达量显著降低,尤其是高浓度镁处理组效果尤为明显。茜素红染色结果发现,镁处理组的钙结节数量变少且体积变小,更加验证了Mg2+可以减轻体外OIM诱导的AVICs钙化发生。
大量研究证明,PI3K/AKT和MAPK/ERK1/2信号通路活化后磷酸化水平升高,在多种细胞的成骨分化过程中均起着至关重要的作用,且高镁在一定程度上参与PI3K/AKT和MAPK/ERK1/2信号通路的调节[24-26]。为了阐明镁对AVICs成骨分化保护作用的潜在机制,本研究进一步对各个处理组的PI3K/AKT和MAPK/ERK1/2磷酸化水平进行检测。Western blot结果显示,高镁能显著降低OIM诱导的AKT和ERK1/2磷酸化,因此推测镁能够通过调节PI3K/AKT和MAPK/ERK1/2信号通路参与抑制钙化的进展。
综上所述,镁可以抑制体外OIM诱导的AVICs钙化,其可能是通过调节PI3K/AKT和MAPK/ERK1/2信号通路抑制AVICs成骨细胞表型转分化进而抑制钙化的发生发展。但本研究仅从体外实验方面进行了探究,缺乏体内实验,接下来拟通过动物实验进行体内验证,为CAVD的临床防治提供新靶点。
| [1] |
VIRANI S S, ALONSO A, APARICIO H J, et al. Heart disease and stroke statistics—2021 update: a report from the American Heart Association[J]. Circulation, 2021, 143(8): e254-e743. |
| [2] |
CHEN Y F, FU G F, LIANG F, et al. Symptoms, hope, self-management behaviors, and quality of life among Chinese preoperative patient with symptomatic valvular heart diseases[J]. J Transcult Nurs, 2020, 31(3): 284-293. |
| [3] |
YADGIR S, JOHNSON C O, ABOYANS V, et al. Global, regional, and national burden of calcific aortic valve and degenerative mitral valve diseases, 1990-2017[J]. Circulation, 2020, 141(21): 1670-1680. |
| [4] |
HU J H, LEI H, LIU L L, et al. Lipoprotein(a), a lethal player in calcific aortic valve disease[J]. Front Cell Dev Biol, 2022, 10: 812368. |
| [5] |
SHEN J L, ZHAO M, ZHANG C X, et al. IL-1β in atherosclerotic vascular calcification: from bench to bedside[J]. Int J Biol Sci, 2021, 17(15): 4353-4364. |
| [6] |
KOSSAR A P, ANSELMO W, GRAU J B, et al. Circulating and tissue matricellular RNA and protein expression in calcific aortic valve disease[J]. Physiol Genomics, 2020, 52(4): 191-199. |
| [7] |
HE C M, TANG H, MEI Z J, et al. Human interstitial cellular model in therapeutics of heart valve calcification[J]. Amino Acids, 2017, 49(12): 1981-1997. |
| [8] |
MARY A, ISSA H, BOULLIER A, et al. P905Association of ionized serum magnesium with progression of aortic valve calcification[J]. Eur Heart J, 2019, 40(Supplement_1): ehz747.0501. |
| [9] |
MASSIMETTI C, CARDELLO P, BRESCIA F, et al. Association between low serum magnesium levels and the extent of abdominal aortic calcification in renal transplant recipients[J]. G Ital Nefrol, 2020, 37(1): 2020-vol1. |
| [10] |
MASSY Z A, DRVEKE T B. Magnesium and cardiovascular complications of chronic kidney disease[J]. Nat Rev Nephrol, 2015, 11(7): 432-442. |
| [11] |
DI VITO A, DONATO A, PRESTA I, et al. Extracellular matrix in calcific aortic valve disease: architecture, dynamic and perspectives[J]. Int J Mol Sci, 2021, 22(2): 913. |
| [12] |
KODIGEPALLI K M, THATCHER K, WEST T, et al. Biology and biomechanics of the heart valve extracellular matrix[J]. J Cardiovasc Dev Dis, 2020, 7(4): 57. |
| [13] |
吴昊, 蔡洋, 李芹, 等. 猪心脏瓣膜间质细胞培养方法的改进[J]. 中华实用诊断与治疗杂志, 2018, 32(11): 1041-1043. WU H, CAI Y, LI Q, et al. Improvement of culture method of porcine heart valve interstitial cells[J]. J Chin Pract Diagn Ther, 2018, 32(11): 1041-1043. |
| [14] |
KOSTYUNIN A E, YUZHALIN A E, OVCHARENKO E A, et al. Development of calcific aortic valve disease: do we know enough for new clinical trials?[J]. J Mol Cell Cardiol, 2019, 132: 189-209. |
| [15] |
RUTKOVSKIY A, MALASHICHEVA A, SULLIVAN G, et al. Valve interstitial cells: the key to understanding the pathophysiology of heart valve calcification[J]. J Am Heart Assoc, 2017, 6(9): e006339. |
| [16] |
BLAKE R R, MARKBY G R, CULSHAW G J, et al. Survival of activated myofibroblasts in canine myxomatous mitral valve disease and the role of apoptosis[J]. Res Vet Sci, 2020, 128: 99-106. |
| [17] |
HU X J, WU W C H, DONG N G, et al. Role of TGF-β1 signaling in heart valve calcification induced by abnormal mechanical stimulation in a tissue engineering model[J]. Curr Med Sci, 2018, 38(5): 765-775. |
| [18] |
BOGDANOVA M, KOSTINA A, ZIHLAVNIKOVA ENAYATI K, et al. Inflammation and mechanical stress stimulate osteogenic differentiation of human aortic valve interstitial cells[J]. Front Physiol, 2018, 9: 1635. |
| [19] |
SAKAGUCHI Y, HAMANO T, OBI Y, et al. A randomized trial of magnesium oxide and oral carbon adsorbent for coronary artery calcification in predialysis CKD[J]. J Am Soc Nephrol, 2019, 30(6): 1073-1085. |
| [20] |
WU L L, LUTHRINGER B J C, FEYERABEND F, et al. Effects of extracellular magnesium on the differentiation and function of human osteoclasts[J]. Acta Biomater, 2014, 10(6): 2843-2854. |
| [21] |
MONTES DE OCA A, GUERRERO F, MARTINEZ-MORENO J M, et al. Magnesium inhibits Wnt/β-catenin activity and reverses the osteogenic transformation of vascular smooth muscle cells[J]. PLoS One, 2014, 9(2): e89525. |
| [22] |
CHEN X L, DODD G, THOMAS S, et al. Activation of Nrf2/ARE pathway protects endothelial cells from oxidant injury and inhibits inflammatory gene expression[J]. Am J Physiol Heart Circ Physiol, 2006, 290(5): H1862-H1870. |
| [23] |
ZAKKAR M, VAN DER HEIDEN K, LUONG L A, et al. Activation of Nrf2 in endothelial cells protects arteries from exhibiting a proinflammatory state[J]. Arterioscler Thromb Vasc Biol, 2009, 29(11): 1851-1857. |
| [24] |
ZHOU T W, WANG Y J, LIU M, et al. Curcumin inhibits calcification of human aortic valve interstitial cells by interfering NF-κB, AKT, and ERK pathways[J]. Phytother Res, 2020, 34(8): 2074-2081. |
| [25] |
YUE J J, JIN S Z, GU S Z, et al. High concentration magnesium inhibits extracellular matrix calcification and protects articular cartilage via Erk/autophagy pathway[J]. J Cell Physiol, 2019, 234(12): 23190-23201. |
| [26] |
YANG Q F, ZHANG P, LIU T, et al. Magnesium isoglycyrrhizinate ameliorates radiation-induced pulmonary fibrosis by inhibiting fibroblast differentiation via the p38MAPK/Akt/Nox4 pathway[J]. Biomed Pharmacother, 2019, 115: 108955. |




