丙泊酚是一种临床常见的静脉全身麻醉药,广泛用于儿童麻醉的诱导、维持和ICU镇静,对未成熟脑的神经毒性尚无统一定论[1]。低氧血症是围术期常见的并发症[2],低血压、病理性分流等均可引起低氧血症。此外,麻醉药物不同程度的扩血管及呼吸抑制效应,可使麻醉期间肺泡/通气血流比例失调,如果处理不当,可导致低氧血症。脑组织耗氧量巨大,是对低氧损伤的主要敏感器官。本课题组前期研究发现:空气或低氧条件下,丙泊酚多次暴露会导致未成熟SD大鼠认知功能障碍[3-5],但其机制尚不明确。
铁死亡(ferroptosis)是一种铁依赖性的新型程序性细胞死亡,其特征为铁超载和脂质过氧化致细胞膜破坏[6]。近年来,越来越多的研究表明铁死亡与各种神经系统疾病的病理生理机制相关[7]。海马是中枢神经系统神经元高度集中的部位,在学习、记忆等认知功能方面发挥重要作用[8]。据报道,异氟醚通过诱导C57/BL6小鼠海马神经元铁死亡,导致神经毒性和学习记忆功能障碍[9]。但目前缺乏铁死亡是否参与低氧复合丙泊酚致未成熟SD大鼠海马神经元损伤的相关研究。因此,在课题组前期研究的基础上,本研究采用低氧复合丙泊酚模型,从铁死亡角度探讨低氧复合丙泊酚对未成熟SD大鼠海马神经元的影响及机制,以期为临床防治围术期并发症提供实验依据。
1 材料与方法 1.1 药品与主要试剂丙泊酚注射液(意大利阿斯利康,批号:1708109,规格:20 mL/100 mg);脂肪乳注射液(四川科伦,批号:F18020309,规格:250 mL);Iron检测试剂盒(美国Abcam);丙二醛(MDA)测定试剂盒(南京建成);Anti-TFRC(北京Bioss);兔源β-Actin抗体(武汉ABclonal);山羊抗兔Ⅱ抗(北京中杉金桥)。
1.2 实验动物取7日龄健康SD大鼠168只(体质量15.59±1.13 g), 雌雄各半,均由重庆医科大学动物实验中心提供,动物实验合格证号:SYXK(渝)2017—0012。SD大鼠均饲养于重庆医科大学附属儿童医院动物实验中心,母乳喂养,昼夜交替,环境温度20~25 ℃,湿度60%~70%。
1.2.1 动物分组按照随机数表法将7日龄SD大鼠分为6组,每组28只:脂肪乳氧气组(CO)、脂肪乳空气组(CA)、脂肪乳低氧组(CH)、丙泊酚氧气组(PO)、丙泊酚空气组(PA)以及丙泊酚低氧组(PH)。
1.2.2 干预措施丙泊酚组及脂肪乳组分别腹腔注射丙泊酚50 mg/kg、脂肪乳5 mL/kg,1次/d,连续7 d。每次腹腔注射完毕后将其分别放于氧浓度为50%、21%、18%的暖箱(38 ℃)中,待翻正反射恢复后,立即放回常氧环境中由母鼠继续喂养。
1.2.3 取材和标本制备干预第7日,注射完毕后24 h,断头法处死并取脑组织。各组随机选取3只大鼠,取其单侧海马CA1区1 mm3组织置于2.5%戊二醛电镜液中固定用以透射电镜观察。其余大鼠于冰上迅速剥离双侧海马组织,-80 ℃冻存,用于相关指标检测。
1.3 方法 1.3.1 呼吸频率和血氧饱和度监测每次给药后,用婴幼儿血氧饱和度探头环绕于未成熟SD大鼠的腹部,监护仪监测呼吸频率(RR)和血氧饱和度(SpO2)。
1.3.2 透射电镜观察海马神经元内线粒体形态改变取出电镜液固定的海马组织块,1%锇酸避光固定,室温脱水,渗透包埋,切片染色,透射电镜观察海马神经元细胞内线粒体形态。
1.3.3 检测海马组织中Fe2+、MDA含量分别取各组海马组织按照试剂盒说明书操作检测Fe2+、MDA含量。
1.3.4 Western blot检测铁死亡相关分子蛋白表达水平分别取各组海马组织,加入裂解液,冰上裂解,提取蛋白原液,BCA法测定蛋白浓度后制备蛋白样品,煮沸变性。取20 μg蛋白样品进行SDS-PAGE凝胶电泳,PVDF膜湿转,5%脱脂奶粉摇床封闭100 min。4 ℃摇床孵育一抗过夜:TFRC(1 ∶1 000)、β-actin(1 ∶50 000)。次日TBST洗膜后室温摇床孵育二抗(1 ∶20 000)100 min。ECL化学发光法显影,Bio-Rad凝胶图像分析系统扫描并清晰成像。显影结果经Image Lab软件进行定量分析。目的蛋白与内参β-actin灰度值的比值作为目的蛋白表达量。
1.4 统计学分析采用SPSS 20.0进行统计分析,使用GraphPad Prism 9.0进行绘图。计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD法,P<0.05为差异具有统计学意义。
2 结果 2.1 各组未成熟SD大鼠呼吸频率(RR)和血氧饱和度(SpO2)比较与相应的脂肪乳组比较,PA组、PH组RR和SpO2均明显下降(P<0.01),PO组仅RR明显降低(P<0.01),而SpO2无显著差异;与PO组比较,PA组、PH组SpO2明显下降(P<0.01),而RR差异无统计学意义。见表 1。
| 组别 | RR(次/min) | SpO2(%) |
| CO组 | 138±5 | 98.9±0.9 |
| CA组 | 137±4 | 98.7±0.8 |
| CH组 | 139±4 | 96.1±1.3 |
| PO组 | 38±5a | 97.9±0.9 |
| PA组 | 38±5a | 80.3±3.1ab |
| PH组 | 39±4a | 69.6±3.7ab |
| a: P<0.01,与相应的脂肪乳组比较;b: P<0.01,与PO组比较 | ||
2.2 低氧复合丙泊酚对未成熟SD大鼠海马神经元内线粒体形态的影响
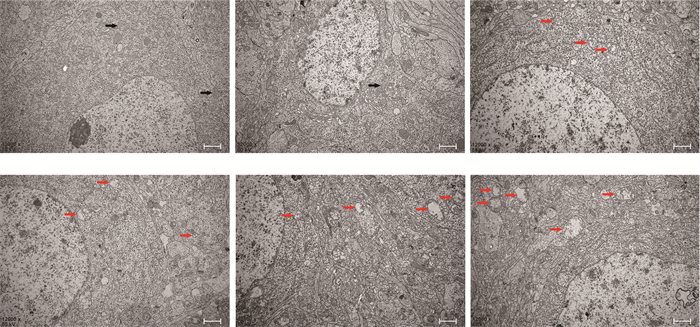
透射电镜结果显示:PA组、PH组海马神经元内线粒体普遍肿胀,线粒体嵴溶解、消失;CH组、PO组仅部分线粒体肿胀、嵴减少;而CO组、CA组海马神经元内线粒体形态相对正常,见图 1。
|
| 黑色箭头示正常线粒体;红色箭头示肿胀线粒体 图 1 透射电镜观察各组大鼠海马神经元内线粒体形态 |
2.3 低氧复合丙泊酚对各组未成熟SD大鼠海马组织Fe2+、MDA水平的影响
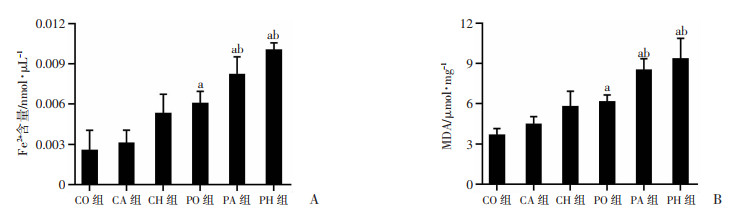
生化法检测结果显示:与相应的脂肪乳组比较,各丙泊酚组Fe2+含量、MDA水平均明显升高(均P<0.01);与PO组比较,PA组、PH组Fe2+含量、MDA水平均升高(均P<0.05),见图 2。
|
|
a: P<0.01,与相应的脂肪乳组比较;b: P<0.05,与PO组比较 A: 各组大鼠海马组织中Fe2+水平;B: 各组大鼠海马组织中MDA水平 图 2 低氧复合丙泊酚对Fe2+、MDA水平的影响(x±s, n=4) |
2.4 低氧复合丙泊酚对各组未成熟SD大鼠海马组织铁死亡相关蛋白表达水平的影响
通过Western blot检测TFRC表达水平,结果显示:与相应的脂肪乳组比较,各丙泊酚组TFRC表达上调(P<0.05);与PO组比较,PA组、PH组TFRC表达上调(P<0.05),见图 3。

|
|
a: P<0.05,与相应的脂肪乳组比较;b: P<0.05,与PO组比较 A: Western blot检测各组大鼠海马组织TFRC蛋白表达;B: 各组TFRC蛋白相对表达量(x±s, n=3) 图 3 低氧复合丙泊酚对各组海马组织TFRC蛋白表达的影响 |
3 讨论 3.1 丙泊酚麻醉与低氧
丙泊酚作为儿童麻醉中常用的静脉麻醉药和镇静药,对婴幼儿大脑发育的影响引起了人们的广泛关注。有研究表明,即使亚麻醉剂量的丙泊酚也可对幼鼠大脑皮层、壳核和尾核的神经元结构产生影响[10-12]。我们在临床工作中观察到,丙泊酚可引起呼吸抑制从而影响患儿的氧合状态[13]。若合并低血压、病理性分流、俯卧位手术体位等而未及时处理,则可导致低氧血症,从而影响患者预后。本研究结果显示,与相应的脂肪乳组比较,各丙泊酚组的RR均明显下降,这与临床上所观察到的丙泊酚呼吸抑制现象一致。此外,与PO组比较,PA组和PH组SpO2降低,提示丙泊酚麻醉的未成熟SD大鼠暴露于低氧或空气中时会出现缺氧,给予氧气后可提高血氧饱和度,对缺氧状况有所改善。
3.2 氧化-抗氧化失衡与铁死亡本课题组前期通过体内外研究发现:低氧复合丙泊酚可导致新生SD大鼠海马神经细胞损伤和发育期认知功能障碍[5, 14],且在低氧环境下丙泊酚致神经生长因子诱导PC12细胞分化的神经细胞时活性氧(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)水平升高,初步证实其机制与氧化应激损伤有关[15]。大脑富含不饱和脂肪酸和铁,并缺乏有效的血液和淋巴回流系统,故抗氧化能力相对较差。随着氧化-抗氧化失衡的发生,脑组织受到脂质过氧化损伤,从而引起神经细胞功能障碍[16]。脑神经细胞线粒体对神经元的发育、生长及功能实现起着重要作用,同时也是对低氧敏感的细胞器[17]。本研究发现:PA组、PH组海马神经元内线粒体普遍肿胀,线粒体嵴溶解、消失;CH组、PO组仅部分线粒体肿胀、嵴减少;而CO组、CA组海马神经元内线粒体形态相对正常。由此推断在麻醉状态下,氧气可以保护未成熟SD大鼠海马神经元线粒体。在轻度低氧时期,脑血管的代偿作用能在一定程度上使脑功能保持正常水平,但是随着低氧的加重,就会破坏大脑兴奋与抑制过程的平衡关系,从而使神经细胞内各细胞器受损[18]。
铁死亡是铁依赖性脂质过氧化为特征的细胞死亡方式。铁是所有细胞和有机体新陈代谢过程中所必需的微量营养元素。据报道,铁超载可导致神经毒性和严重的认知功能障碍[19]。生理状态下,人体中的铁以Fe3+形式存在;应激状态下,Fe3+被细胞膜上的转铁蛋白受体1(transferrin receptor 1, TFR1)内吞入胞,并还原为Fe2+,Fe2+蓄积于胞内时,可通过芬顿反应促进脂质过氧化,生成MDA等,进而导致神经细胞铁死亡[16]。本研究发现:在空气或低氧条件下,丙泊酚致未成熟SD大鼠海马组织内Fe2+和MDA含量升高,TFRC蛋白表达水平上调,提示未成熟SD大鼠海马神经元受损与活跃的脂质过氧化相关,且Fe2+参与了该过程。因此,我们认为在空气或低氧条件下,丙泊酚可通过铁死亡途径对未成熟SD大鼠海马神经元产生损伤。但有研究认为丙泊酚可通过抑制ALOX15(arachidonate lipoxygenase 15)磷酸化,减少Erastin诱导的HT22细胞脂质过氧化和ROS堆积,并减少Fe2+蓄积,从而减轻铁死亡[20],这与我们的研究结果不同。我们认为可能与体内外实验的差异、用药剂量、研究方法,尤其是低氧因素密切相关。值得注意的是,本研究的PO组可以解释我们的研究结果与其他研究之间的相似之处,进一步表明氧气在丙泊酚麻醉下对未成熟SD大鼠海马神经元中的保护作用。
3.3 本研究的局限性我们通过构建SD大鼠低氧复合丙泊酚模型,旨在研究在低氧或空气状态下,丙泊酚对未成熟SD大鼠海马神经元的损伤,呼吁临床医生警惕麻醉药物对未成熟脑产生的副作用。但本研究也存在一定的局限性,尚缺乏对丙泊酚作用机制更深入的探究。有研究表明,低氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)可通过介导线粒体能量代谢途径参与丙泊酚调控RCC4细胞的增殖和凋亡[21],提示丙泊酚与线粒体能量代谢密切相关,这也与本研究中观察海马神经元内线粒体超微结构发生改变的结果相似。但低氧复合丙泊酚具体如何影响线粒体能量代谢需要进一步的研究。
综上所述,本研究结果表明低氧因素增加丙泊酚对未成熟SD大鼠海马神经元的损伤,其机制与海马组织铁死亡相关。麻醉药物的临床应用要注意对未成熟脑的保护,抑制铁死亡途径或可为减轻麻醉致未成熟脑损伤提供新的思路及研究方向。
| [1] |
CHIDAMBARAN V, COSTANDI A, D'MELLO A. Propofol: a review of its role in pediatric anesthesia and sedation[J]. CNS Drugs, 2015, 29(7): 543-563. |
| [2] |
VAN SCHAIK E P C, BLANKMAN P, VAN KLEI W A, et al. Hypoxemia during procedural sedation in adult patients: a retrospective observational study[J]. Can J Anaesth, 2021, 68(9): 1349-1357. |
| [3] |
张敬, 于晴, 刘阳, 等. 丙泊酚合并低氧通过p38通路损伤未成熟大鼠的认知功能[J]. 南方医科大学学报, 2018, 38(11): 1294-1299. ZHANG J, YU Q, LIU Y, et al. Propofol combined with hypoxia induces cognitive dysfunction in immature rats via p38 pathway[J]. J South Med Univ, 2018, 38(11): 1294-1299. |
| [4] |
于晴, 刘阳, 孙茫, 等. 低氧因素对丙泊酚麻醉新生大鼠认知功能的影响[J]. 中国临床药理学杂志, 2018, 34(14): 1678-1681. YU Q, LIU Y, SUN M, et al. Effect of hypoxic factors on cognitive function in propofol-anesthetized neonatal rats[J]. Chin J Clin Pharmacol, 2018, 34(14): 1678-1681. |
| [5] |
SUN M, YUAN R X, LIU H, et al. The effects of repeated propofol anesthesia on spatial memory and long-term potentiation in infant rats under hypoxic conditions[J]. Genes Dis, 2020, 7(2): 245-252. |
| [6] |
TANG D L, CHEN X, KANG R, et al. Ferroptosis: molecular mechanisms and health implications[J]. Cell Res, 2021, 31(2): 107-125. |
| [7] |
LI J, CAO F, YIN H L, et al. Ferroptosis: past, present and future[J]. Cell Death Dis, 2020, 11(2): 88. |
| [8] |
BLISS T V P, COLLINGRIDGE G L. A synaptic model of memory: long-term potentiation in the hippocampus[J]. Nature, 1993, 361(6407): 31-39. |
| [9] |
LIU P F, YUAN J, FENG Y T, et al. Ferroptosis contributes to isoflurane-induced neurotoxicity and learning and memory impairment[J]. Cell Death Discov, 2021, 7(1): 72. |
| [10] |
KAHRAMAN S, ZUP S L, MCCARTHY M M, et al. GABAergic mechanism of propofol toxicity in immature neurons[J]. J Neurosurg Anesthesiol, 2008, 20(4): 233-240. |
| [11] |
HUANG J, JING S, CHEN X, et al. Propofol administration during early postnatal life suppresses hippocampal neurogenesis[J]. Mol Neurobiol, 2016, 53(2): 1031-1044. |
| [12] |
CATTANO D, YOUNG C, STRAIKO M M, et al. Subanesthetic doses of propofol induce neuroapoptosis in the infant mouse brain[J]. Anesth Analg, 2008, 106(6): 1712-1714. |
| [13] |
LEE T L. Pharmacology of propofol[J]. Ann Acad Med Singap, 1991, 20(1): 61-65. |
| [14] |
TU S F, WANG X Y, YANG F, et al. Propofol induces neuronal apoptosis in infant rat brain under hypoxic conditions[J]. Brain Res Bull, 2011, 86(1/2): 29-35. |
| [15] |
孙茫, 沈炼桔, 刘阳, 等. 低氧环境下丙泊酚可增加PC12细胞的凋亡[J]. 南方医科大学学报, 2017, 37(2): 216-220. SUN M, SHEN L J, LIU Y, et al. Effect of propofol on apoptosis of PC12 cells under hypoxic condition and the mechanism[J]. J South Med Univ, 2017, 37(2): 216-220. |
| [16] |
胡淼, 门运政, 陈蕾, 等. 右美托咪定通过抑制铁死亡发挥对小鼠脑缺血再灌注损伤的保护作用[J]. 中南大学学报(医学版), 2022, 47(5): 600-609. HU M, MEN Y Z, CHEN L, et al. Dexmedetomidine exerts its protective effect on cerebral ischemia reperfusion injury in mice by inhibiting ferroptosis[J]. J Central South Univ Med Sci, 2022, 47(5): 600-609. |
| [17] |
董小铷, 张向楠, 李丹, 等. 红景天苷对低压低氧诱发大鼠脑损伤的保护作用[J]. 细胞与分子免疫学杂志, 2015, 31(10): 1327-1331. DONG X R, ZHANG X N, LI D, et al. Protective effect of salidroside against high altitude hypoxia-induced brain injury in rats[J]. Chin J Cell Mol Immunol, 2015, 31(10): 1327-1331. |
| [18] |
阮俊勇, 雷涛, 董旭, 等. 急性低压低氧环境对脑功能及其结构影响的研究进展[J]. 中华物理医学与康复杂志, 2020, 42(9): 858-860. RUAN J Y, LEI T, DONG X, et al. Research progress on the effects of acute hypothermia and hypoxia on brain function and structure[J]. Chin J Phys Med Rehabil, 2020, 42(9): 858-860. |
| [19] |
MASALDAN S, BUSH A I, DEVOS D, et al. Striking while the iron is hot: iron metabolism and ferroptosis in neurodegeneration[J]. Free Radic Biol Med, 2019, 133: 221-233. |
| [20] |
XUAN W T, LU X Y, YANG Z Y, et al. Propofol protects against erastin-induced ferroptosis in HT-22 cells[J]. J Mol Neurosci, 2022, 72(9): 1797-1808. |
| [21] |
李正民, 张玉明, 张振, 等. HIF-1介导的线粒体能量代谢参与丙泊酚调控肾透明细胞癌细胞增殖及凋亡[J]. 国际肿瘤学杂志, 2019, 46(12): 711-717. LI Z M, ZHANG Y M, ZHANG Z, et al. Mitochondrial energy metabolism mediated via HIF-1 involves the proliferation and apoptosis of renal clear cell carcinoma cells regulated by propofol[J]. J Int Oncol, 2019, 46(12): 711-717. |




