2. 730000 兰州,甘肃省人民医院普外科;
3. 730050 兰州,西宁联勤保障中心药品仪器监督检验站
2. Department of General Surgery, Gansu Provincial Hospital, Lanzhou, Gansu Province, 730000;
3. Institute for Drug and Instrument Control of Xining Joint logistics Support Center, Lanzhou, Gansu Province, 730050, China
顺铂(cis-Dichlorobis(ethylenediamine)platinum,DDP)的抗肿瘤治疗过程中,顺铂进入机体后大部分与血浆蛋白结合,最后经过肾脏排泄[1]。由于顺铂在肾脏中聚集程度很高,因此对肾脏产生很大的毒性。顺铂对肾脏组织细胞中肾近端小管细胞损伤最大,肾小管的损伤最终导致肾脏结构和功能紊乱,严重时会导致肾衰竭甚至患者死亡[2]。顺铂在肾脏中主要引起肾近端小管细胞发生凋亡和坏死,主要表现为细胞基因组DNA损伤、细胞器功能障碍等[3]。顺铂给患者带来了极大的痛苦,目前针对顺铂的肾毒性尚没有很好的缓解办法。氨磷汀是临床上常用来缓解顺铂肾毒性的药物,然而氨磷汀缓解顺铂对肾近端小管细胞损伤作用机制尚不明确[4]。因此阐明氨磷汀缓解顺铂肾毒性的分子机制有着十分重要的意义。
本研究主要探讨氨磷汀增强肾近端小管细胞抵抗顺铂毒性的分子机制,初步研究发现PKM2在其中起了重要作用。PKM2是丙酮酸激酶家族成员之一,是细胞糖酵解过程中的关键酶,催化磷酸烯醇式丙酮酸生成丙酮酸[5]。PKM2主要分布在大脑和肝脏等组织中,其主要通过形成四聚体和二聚体来发挥生物学功能[6]。除了在糖酵解过程中发挥作用外,PKM2也能够从胞浆转移到细胞核,并以二聚体的形式协同多种转录因子共同调节基因的表达,从而激活多条信号通路,发挥细胞生物学功能[7-8]。除此之外,PKM2能够磷酸化激活转录因子,进而影响其转录活性[9]。例如PKM2可以磷酸化STAT3的第705位的酪氨酸,进一步促进丝裂原活化蛋白激酶激酶5(MAPKK5/MEK5)的转录,从而促进肿瘤细胞的生长[10]。另外一项研究表明,PKM2通过磷酸化ATF3增强肠癌患者对吉西他滨耐药[11]。PKM2可使AKT1S1发生磷酸化,促进其与14-3-3蛋白的结合,激活mTORC I信号通路,促进肿瘤生长和抵抗凋亡[12]。本研究旨在探讨氨磷汀诱导的PKM2对肾近端小管细胞抵抗顺铂诱导的凋亡作用,以期为临床缓解顺铂的肾毒性提供新的理论依据。
1 材料与方法 1.1 试剂氨磷汀(化学名2-(3-氨基丙胺基)-乙硫醇磷酸酯)和顺铂(化学名顺式-二氯二氨合铂)购自美国MedChemExpress公司,DMSO购自德国Merck公司;胰蛋白酶消化液购自美国ThermoFisher Scientific公司;PKM2抗体购自英国Abcam公司;Cleaved-caspase3、Cleaved-PARP、Actin抗体购自美国Cell Signaling Technology公司;TRIzolTM试剂购自美国ThermoFisher Scientific公司,RT-PCR试剂盒购自美国MedChemExpress公司;PKM2的siRNA和对照siRNA购自美国Santa Cruz公司。
1.2 细胞培养人原代肾近端小管上皮细胞(品牌LONZA,购自北京泽平科技有限公司)和HK-2细胞系(购自上海中科院细胞库)置于含10%胎牛血清(Gbico公司,美国)的DMEM/F12培养基中,培养条件为:37 ℃、5%CO2、饱和湿度的细胞培养箱中,所有细胞经检测无支原体污染。
1.3 细胞活力检测对数生长期细胞用胰蛋白酶消化,通过计数板计数,按照每孔200 μL细胞悬液含10 000个细胞的密度接种于96孔板中,细胞在培养箱中培养至少8 h,待细胞完全贴壁后,每孔加指定浓度的顺铂(溶解于蒸馏水中,存储浓度1 mg/mL)和氨磷汀(溶解于蒸馏水中,存储浓度100 mg/mL),然后细胞继续培养48 h。按照CCK-8检测试剂盒说明书步骤完成细胞增殖检测。实验流程如下:在培养的第44小时加入CCK-8溶液20 μL,放入培养箱中继续培养4 h,然后在酶联检测仪上检测450 nm波长下每孔的光密度值D(450),按下列公式求出细胞活力。细胞活力(cell viability)=[实验组D(450)-空白对照组D(450)]/[对照组D(450)-空白对照组D(450)] [13]。
1.4 荧光定量PCR对数生长期细胞用胰蛋白酶消化,通过计数板计数,按照每孔2 mL细胞悬液含50万个细胞的密度接种于6孔板中,细胞在培养箱中培养至少8 h,待细胞完全贴壁后,每孔加指定浓度的顺铂和氨磷汀,继续培养48 h。清除培养液后,用PBS清洗细胞3次,用TRIzol试剂提取总RNA。定量RNA浓度,按照制造商的说明及逆转录试剂盒操作步骤将获取的总RNA反转录成cDNA。通过荧光定量PCR检测PKM2的mRNA表达,Actn基因作为内参基因。按照SYBR Green PCR试剂盒试验步骤在CFX ConnectTM实时系统上检测基因的表达,并根据2-△△Ct算法计算倍数变化。
| 基因 | 序列(5′→3′) |
| PKM2 | 正义链5′-ATGTCGAAGCCCCATAGTGAA-3′ 反义链5′-TGGGTGGTGAATCAATGTCCA-3′ |
| Actin | 正义链5′-CATGTACGTTGCTATCCAGGC-3′ 反义链5′-CTCCTTAATGTCACGCACGAT-3′ |
1.5 小RNA干扰和质粒转染
对数生长期细胞用胰蛋白酶消化,通过计数板计数,按照每孔2 mL细胞悬液含50万个细胞的密度接种于6孔板中,细胞在培养箱中培养至少8 h,待细胞完全贴壁后。用无血清的培养液置换培养液,孵育2 h。Lipo3000混合PKM2的小RNA干扰和对照小RNA干扰(small interfere RNA,siRNA),在室温静置0.5 h,加入每个孔,使siRNA的终浓度是50 nmol/L,继续培养8 h。去除含Lipo3000和siRNA的培养液,加入新鲜的含血清的培养液继续培养48 h,完成细胞活力实验和蛋白免疫印迹实验。质粒转染步骤同上,6孔板每个孔转染2 μg的pcDNA3.0-OE (over expression) PKM2质粒和pcDNA3.0对照质粒。
1.6 流式细胞术检测细胞凋亡对数生长期的HK-2细胞,经过顺铂和氨磷汀处理48 h后,用无EDTA的胰蛋白酶消化和收集细胞。将1 × 105个细胞重悬于200 μL Binding Buffer中,加入4 μL 0.5 mg/mL PI和2 μL Annexin V-FITC溶液,避光室温孵育15 min,用流式细胞仪(Beckman)进行荧光检测。(Annexin V-FITC和PI都用激发波长488 nm,Annexin V-FITC发射光为520 nm,发射光为617 nm)。
1.7 分析PKM2基因在肾脏各组织细胞中的表达通过在线软件tabula-muris (https://tabula-muris.ds.czbiohub.org/),分析数据库中肾脏组织各细胞亚群PKM2的表达。参数选择Method: droplet,Tissue: kidney, Gene: PKM2。
1.8 蛋白免疫印迹实验收集单层贴壁细胞,利用RIPA(radio immunoprecipitation assay)裂解液(含有蛋白酶抑制剂)提取总蛋白,98 ℃变性蛋白10 min,完成SDS-PAGE电泳,每个电泳孔上样量为40~60 μg蛋白质。电泳完成后,PAGE胶上的蛋白通过电转至PVDF膜上。用5%牛血清白蛋白在室温封闭PVDF膜1 h,然后TBST清洗3次,在4 ℃条件下孵育相应的抗体(抗体稀释比例均为1 ∶1 000),10 h后用TBST清洗3次。最后在室温孵育二抗1 h(抗体稀释比例为1 ∶5 000), 用TBST清洗3次,显色。
1.9 统计学分析实验数据均采用SPSS 20.0软件进行统计学分析,所有实验独立重复3次,计量资料采用x±s表示,数据的比较分析采取Student’t检验分析,P<0.05为差异有统计学意义。
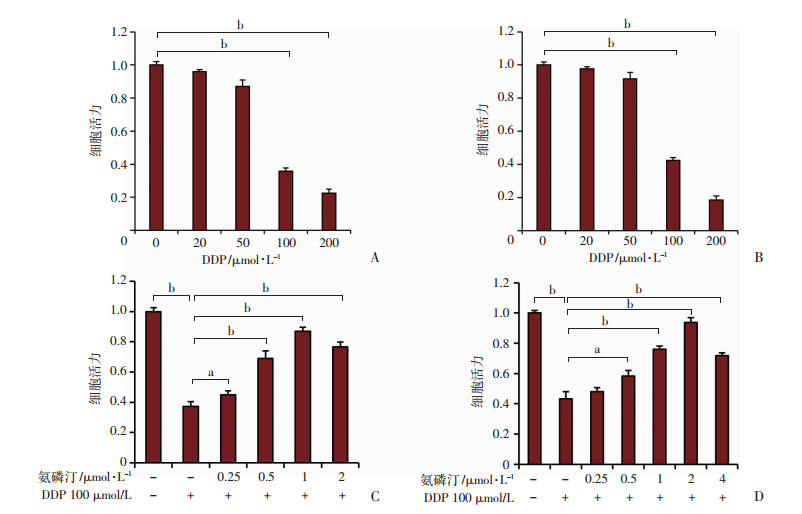
2 结果 2.1 氨磷汀增强肾近端小管上皮细胞抵抗顺铂毒性为检测氨磷汀是否能够增强肾近端小管上皮细胞抵抗顺铂毒性,首先检测了不同浓度的DDP对HK-2细胞和原代肾近端小管上皮细胞的毒性。结果如图 1A、B所示,随着顺铂浓度的增加,两种细胞的细胞活力依次下降, 且顺铂浓度100 μmol/L以上对这两种细胞都有显著的细胞毒性。分别在HK-2细胞和原代肾近端小管上皮细胞加入氨磷汀和顺铂后48 h,结果如图 1C、D所示,100 μmol/L的顺铂能够显著抑制HK-2细胞和原代肾近端小管上皮细胞的活力,在同时存在顺铂和氨磷汀的情况下,细胞活力明显升高,表明氨磷汀能够阻止顺铂对HK-2细胞和原代肾近端小管上皮细胞的毒性。同时结果也表明两种细胞抵抗顺铂毒性的能力,随着氨磷汀药物浓度的增加而增强。
|
|
a: P<0.05;b: P<0.001 A、B:CCK-8法检测顺铂处理的HK-2(A)和原代肾近端小管上皮细胞(B)的细胞活力;C、D:CCK-8法检测氨磷汀和顺铂联合处理的HK-2(C)和原代肾近端小管上皮细胞(D)的细胞活力 图 1 氨磷汀和顺铂处理HK-2和原代肾近端小管上皮细胞的细胞活力 |
2.2 PKM2在肾近端小管上皮细胞中低表达
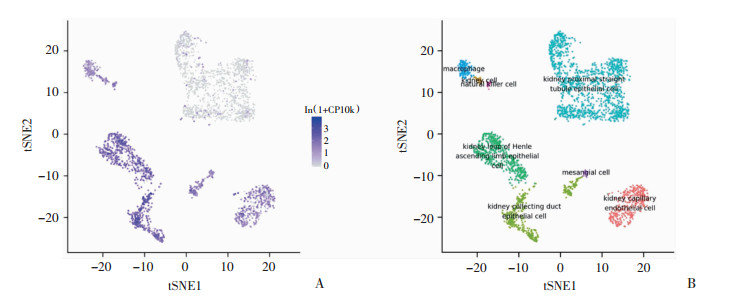
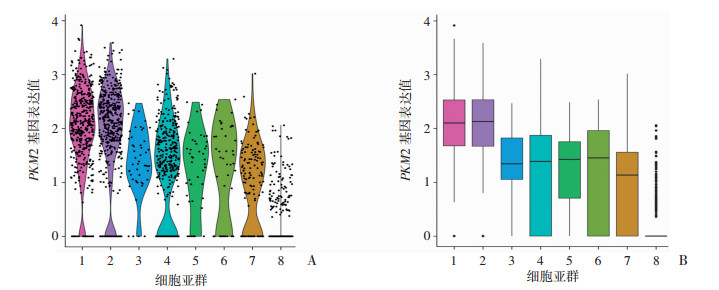
通过Tabula在线数据库分析PKM2基因在肾脏组织各细胞亚群中的表达水平,结构如图 2所示,PKM2基因在肾近端小管上皮细胞中表达水平最低。而在肾集合管上皮细胞中表达相对最高。通过分析PKM2基因在肾脏组织各细胞亚群中的相对表达值,如图 3所示,PKM2在肾集合管上皮细胞和肾Henle袢细段小管上皮细胞中表达值最高,而在肾近端小管上皮细胞中表达值最低。
|
| A:PKM2基因在各亚群细胞中的表达;B:肾脏组织各亚群细胞的分类 图 2 单细胞测序结果分析PKM2基因在肾脏组织各细胞亚群中的表达水平 |
|
|
1:肾集合管上皮细胞;2:肾Henle袢细段小管上皮细胞;3:肾系膜细胞;4:肾毛细管内皮细胞;5:足细胞;6:白细胞;7:巨噬细胞;8:肾近端小管上皮细胞 A:PKM2基因在各亚群细胞中的表达小提琴统计图;B:PKM2基因在各亚群细胞中的表达箱形统计图 图 3 PKM2基因在肾脏组织各细胞亚群中的相对表达值 |
2.3 氨磷汀诱导HK-2细胞PKM2基因表达
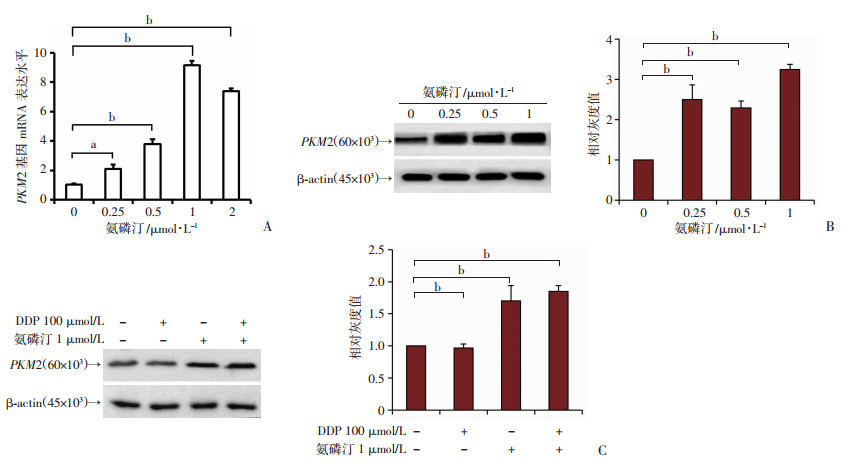
在氨磷汀处理的HK-2细胞中,随着氨磷汀药物浓度的增加,PKM2基因的mRNA水平也显著增加(图 4A)。在蛋白表达水平,随着氨磷汀药物浓度的增加,PKM2基因蛋白表达显著增加(图 4B)。检测顺铂和氨磷汀单独处理和联合处理对PKM2蛋白表达的影响,如图 4C所示,顺铂处理不能明显改变PKM2的表达,而顺铂联合氨磷汀处理后,PKM2蛋白的表达显著上升。
|
|
a: P<0.05;b: P<0.001 A:RT-PCR法检测HK-2细胞PKM2基因表达;B、C:免疫印迹法检测氨磷汀和顺铂单独或联合处理的HK2细胞的PKM2蛋白表达 图 4 氨磷汀和顺铂处理对HK-2细胞中PKM2基因表达的影响 |
2.4 干扰PKM2基因表达降低氨磷汀对HK-2细胞顺铂毒性的保护作用
为进一步证明PKM2的表达促进了氨磷汀对HK-2细胞顺铂毒性的保护作用,利用siRNA技术敲低HK-2细胞中PKM2基因的表达,检测细胞活力。如图 5A所示, 在HK-2细胞中转染PKM2基因的siRNA,发现PKM2基因的蛋白表达显著降低。在转染了PKM2基因siRNA的HK-2细胞中,用顺铂和氨磷汀处理48 h,结果如图 5B所示,在对照组中氨磷汀能够显著增强细胞抵抗顺铂的毒性,而在干扰PKM2表达后,氨磷汀阻止顺铂对HK-2细胞的毒性作用显著降低。以上结果表明,氨磷汀增强肾近端小管上皮细胞抵抗顺铂毒性与PKM2基因的表达显著相关。另外在HK2细胞中通过转染PKM2过表达质粒过表达PKM2,用顺铂处理细胞48 h,结果表明,过表达PKM2能够显著缓解顺铂对HK-2细胞活力的抑制(图 5C、D)。
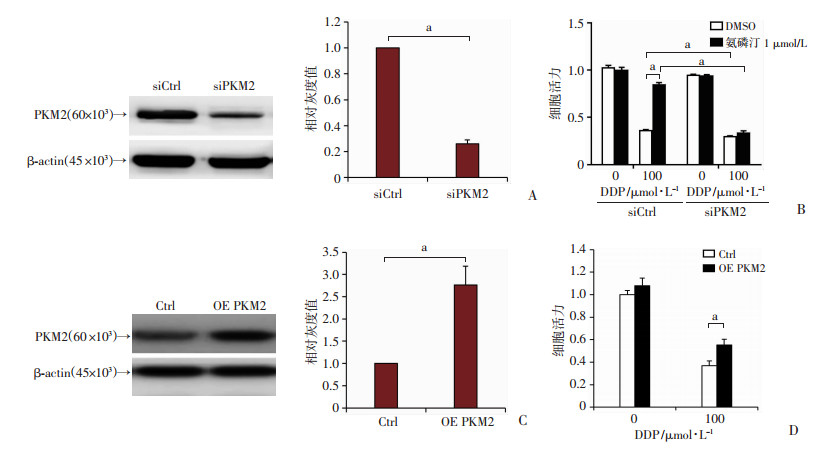
|
|
a:P<0.001 A、C:免疫印迹法检测PKM2过表达和敲低HK-2细胞的PKM2基因表达;B、D:CCK-8法检测氨磷汀和顺铂处理的PKM2过表达、敲低和对照HK-2细胞的细胞活力水平 图 5 氨磷汀和顺铂处理PKM2过表达、敲低和对照HK-2细胞的细胞活力水平 |
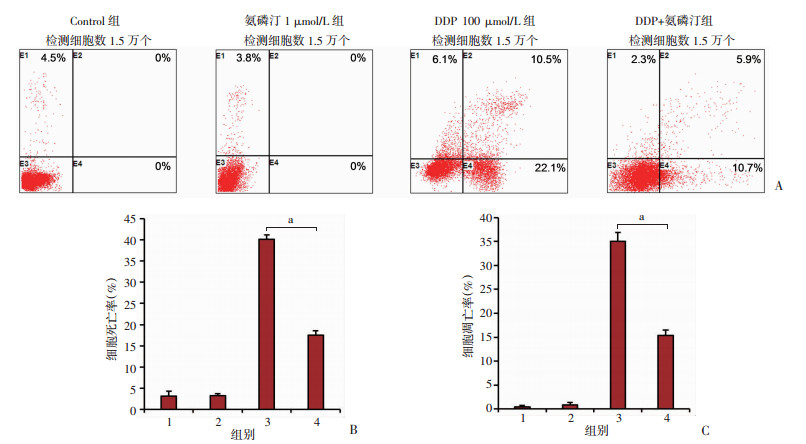
2.5 氨磷汀阻止顺铂诱导的HK-2细胞凋亡
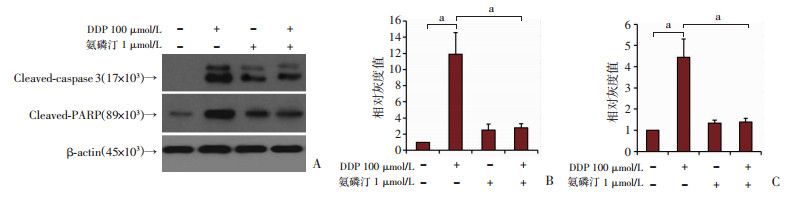
细胞活力的降低主要由于细胞凋亡的发生,为此,在进一步的实验中验证氨磷汀增强肾近端小管上皮细胞抵抗顺铂毒性与细胞凋亡的相关性。在HK-2细胞中,用氨磷汀和顺铂处理48 h,如图 6A所示,100 μmol/L的顺铂诱导细胞的凋亡率是32.6%,而在氨磷汀和顺铂联合处理组,细胞的凋亡率降低到16.6%。图 6B、C的结果也表明氨磷汀能够显著降低顺铂诱导的HK-2细胞凋亡比例。细胞凋亡标志蛋白Cleaved-caspase3(剪切型caspase3)和Cleaved-PARP(剪切型PARP)蛋白检测。结果如图 7所示,顺铂能够显著诱导这两个标志蛋白表达的增加,而在同时存在氨磷汀情况下,顺铂诱导的Cleaved-caspase3和Cleaved-PARP蛋白表达被显著抑制。由此表明氨磷汀能够阻止顺铂诱导的HK-2细胞凋亡。
|
|
1:Control组;2:氨磷汀1 μmol/L组;3:DDP 100 μmol/L组;4:DDP+氨磷汀组;a:P<0.001 A:PI和Annexin-V双染流式图;B:总的细胞死亡比例统计图;C:总的细胞凋亡比例统计图 图 6 流式细胞术检测氨磷汀和顺铂处理的HK-2细胞死亡和凋亡 |
|
|
a:P<0.001 A:蛋白表达结果;B:Cleaved-caspase3相对表达量;C:Cleaved-PARP相对表达量 图 7 氨磷汀和顺铂处理的HK-2细胞中Cleaved-caspase3和Cleaved-PARP蛋白的表达 |
3 讨论
顺铂是临床上最常见的抗肿瘤化疗药,在各种实体瘤中治疗效果十分显著,如前列腺癌、卵巢癌、小细胞肺癌、头颈部癌、睾丸癌和子宫颈癌[14-15]。然而顺铂有显著的肾毒性以及对其他组织的毒性,其临床应用受到一定的限制[16]。在所有接受顺铂治疗的肿瘤患者中,有25%~40%的患者发生急性肾损伤。顺铂诱导的肾脏损伤主要发生在近端肾小管。低浓度顺铂诱导近端肾小管上皮细胞凋亡,而高浓度顺铂诱导近端肾小管上皮细胞坏死[17]。因此阐明顺铂诱导近端肾小管上皮细胞死亡的机制对于开发药物用于临床上治疗急性肾损伤有着十分重要的意义。
氨磷汀为正常细胞保护剂,临床上主要用于各种癌症的辅助治疗。氨磷汀可明显减轻化疗药物所产生的肾脏、骨髓、心脏、耳及神经系统的毒性,而不降低化疗药物的药效[18]。本研究发现氨磷汀通过上调PKM2表达抑制了顺铂诱导的肾近端小管上皮细胞凋亡。PKM2即M2型丙酮酸激酶,是细胞糖酵解过程中的一个限速酶。研究发现高表达PKM2促进细胞抵抗凋亡,分子机制的研究表明,PKM2抑制细胞凋亡主要通过结合线粒体上的抗凋亡蛋白Bcl-2,增强Bcl-2蛋白的稳定性,进而抑制线粒体细胞色素C的释放,从而阻止细胞凋亡[19]。已有报道表明顺铂能够诱导线粒体细胞色素C的释放,从而激活caspase9触发细胞通过线粒体凋亡途径而凋亡[17]。这些发现说明在肾小管上皮细胞中,氨磷汀可能通过上调PKM2表达稳定线粒体上的抗凋亡蛋白Bcl-2,进而抑制线粒体细胞色素C的释放,从而阻止顺铂诱导的肾小管上皮细胞凋亡。本研究发现相对于其他肾脏组织细胞,PKM2在肾近端小管上皮细胞中显著低表达,这表明肾近端小管上皮细胞可能相对于其他肾脏组织细胞对化疗药更敏感。事实上,以前的研究发现顺铂诱导肾损伤主要是诱导肾近端小管上皮细胞死亡,而对其他细胞的损伤相对较小。这些证据表明PKM2能够保护肾脏组织细胞抵抗顺铂毒性。本研究发现氨磷汀能够上调肾近端小管上皮细胞PKM2的mRNA及蛋白的表达。已有研究表明,PKM2的转录水平受c-myc和HIF-α等转录因子的调节[20]。而c-myc和HIF-α表达受上游PI3K/AKT信号通路的调节[21]。由此我们推测氨磷汀可能通过激活PI3K/AKT信号通路上调c-myc和HIF-α等的表达,从而诱导PKM2的表达。总之,本研究表明PKM2是介导肾近端小管上皮细胞抵抗顺铂损伤的关键基因,提示在临床上能够上调PKM2表达的药物都有潜在缓解顺铂导致的急性肾损伤的作用。
| [1] |
ZHANG J, YE Z W, TEW K D, et al. Cisplatin chemotherapy and renal function[J]. Adv Cancer Res, 2021, 152: 305-327. |
| [2] |
GUPTA S, PORTALES-CASTILLO I, DAHER A, et al. Conventional chemotherapy nephrotoxicity[J]. Adv Chronic Kidney Dis, 2021, 28(5): 402-414. |
| [3] |
MAPUSKAR K A, STEINBACH E J, ZAHER A, et al. Mitochondrial superoxide dismutase in cisplatin-induced kidney injury[J]. Antioxidants (Basel), 2021, 10(9): 1329. |
| [4] |
LIU Y H, LI K, TIAN H Q. Renoprotective effects of a new free radical scavenger, XH-003, against cisplatin-induced nephrotoxicity[J]. Oxid Med Cell Longev, 2020, 2020: 9820168. |
| [5] |
GUPTA V, BAMEZAI R N. Human pyruvate kinase M2: a multifunctional protein[J]. Protein Sci, 2010, 19(11): 2031-2044. |
| [6] |
ISRAELSEN W J, DAYTON T L, DAVIDSON S M, et al. PKM2 isoform-specific deletion reveals a differential requirement for pyruvate kinase in tumor cells[J]. Cell, 2013, 155(2): 397-409. |
| [7] |
ASHIZAWA K, WILLINGHAM M C, LIANG C M, et al. In vivo regulation of monomer-tetramer conversion of pyruvate kinase subtype M2 by glucose is mediated via fructose 1, 6-bisphosphate[J]. J Biol Chem, 1991, 266(25): 16842-16846. |
| [8] |
HU H, TU W Z, CHEN Y G, et al. The combination of PKM2 overexpression and M2 macrophages infiltration confers a poor prognosis for PDAC patients[J]. J Cancer, 2020, 11(8): 2022-2031. |
| [9] |
LUO W B, SEMENZA G L. Emerging roles of PKM2 in cell metabolism and cancer progression[J]. Trends Endocrinol Metab, 2012, 23(11): 560-566. |
| [10] |
GAO X L, WANG H Z, YANG J J, et al. Pyruvate kinase M2 regulates gene transcription by acting as a protein kinase[J]. Mol Cell, 2012, 45(5): 598-609. |
| [11] |
RISCAL R, SCHREPFER E, ARENA G, et al. Chromatin-bound MDM2 regulates serine metabolism and redox homeostasis independently of p53[J]. Mol Cell, 2016, 62(6): 890-902. |
| [12] |
CHRISTOFK H R, VANDER HEIDEN M G, HARRIS M H, et al. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth[J]. Nature, 2008, 452(7184): 230-233. |
| [13] |
赖丽梨, 靳焕, 段华英, 等. 巨噬细胞增强宫颈癌细胞对SN-38的抗性[J]. 华南师范大学学报(自然科学版), 2021, 53(1): 63-69. LAI L L, JIN H, DUAN H Y, et al. Macrophage's promotion of cervical cancer cell resistance to SN-38[J]. J South China Norm Univ Nat Sci Ed, 2021, 53(1): 63-69. |
| [14] |
CHEN Y B, SONG Y C, MI Y J, et al. microRNA-499a promotes the progression and chemoresistance of cervical cancer cells by targeting SOX6[J]. Apoptosis, 2020, 25(3/4): 205-216. |
| [15] |
WANG S, ZOU Z, LUO X, et al. LRH1 enhances cell resistance to chemotherapy by transcriptionally activating MDC1 expression and attenuating DNA damage in human breast cancer[J]. Oncogene, 2018, 37(24): 3243-3259. |
| [16] |
TANG Q, WANG X R, JIN H, et al. Cisplatin-induced ototoxicity: Updates on molecular mechanisms and otoprotective strategies[J]. Eur J Pharm Biopharm, 2021, 163: 60-71. |
| [17] |
SANCHO-MARTÍNEZ S M, PIEDRAFITA F J, CANNATA-ANDÍA J B, et al. Necrotic concentrations of cisplatin activate the apoptotic machinery but inhibit effector caspases and interfere with the execution of apoptosis[J]. Toxicol Sci, 2011, 122(1): 73-85. |
| [18] |
LIESENFELD L F, WAGNER B, HILLEBRECHT H C, et al. HIPEC-induced acute kidney injury: a retrospective clinical study and preclinical model[J]. Ann Surg Oncol, 2022, 29(1): 139-151. |
| [19] |
LIANG J, CAO R X, WANG X J, et al. Mitochondrial PKM2 regulates oxidative stress-induced apoptosis by stabilizing Bcl2[J]. Cell Res, 2017, 27(3): 329-351. |
| [20] |
WONG N, OJO D, YAN J, et al. PKM2 contributes to cancer metabolism[J]. Cancer Lett, 2015, 356(2 Pt A): 184-191. |
| [21] |
ZHANG H F, WU C S, ALSHAREEF A, et al. The PI3K/AKT/c-MYC axis promotes the acquisition of cancer stem-like features in esophageal squamous cell carcinoma[J]. Stem Cells, 2016, 34(8): 2040-2051. |




