2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院神经外科
2. Department of neurosurgery, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
原发性肝癌是世界范围内最常见的恶性肿瘤之一。肝脏恶性肿瘤的R0切除受未来残肝体积(future liver remnant volume, FLRV)的限制,FLRV不足常是外科切除的禁忌。我国肝癌患者大多数伴有不同程度的肝硬化,这与没有肝硬化基础的肝癌患者相比,行肝肿瘤切除手术要求保留更多的FLRV。而大部分患者发现时肿瘤体积大,FLRV不足,因此这部分患者往往无手术切除机会,预后差,是肝胆外科学者面临的科学问题。
联合肝脏分隔和门静脉结扎二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)为该部分患者带来根治性手术机会。该术式主要应用于FLRV不足[正常肝脏质地,FLRV/TLV(全肝体积,total liver volume)<30%,肝纤维化FLRV/TLV<40%被认为是FLRV不足]的肝癌患者[1]。将患者肝肿瘤切除手术分两期进行,一期手术将病侧肝脏与保留侧正常肝脏分割,同时病侧肝脏门静脉进行结扎,一段时间后待健侧肝脏代偿性增生FLRV达到可切除标准后再行二期手术切除病侧肝肿瘤。目前ALPPS临床技术已较成熟,相关研究也较好的阐明了促进剩余肝脏增生的机制。但ALPPS手术有一定的二期手术未完成率,而影响二期手术进行的原因目前未见明确的研究分析报道。本研究纳入2013年10月至2021年12月期间连续行ALPPS治疗的肝脏肿瘤患者的临床资料。收集统计患者未行二期手术的临床原因,分析影响二期手术进行的危险因素。现报道如下。
1 资料与方法 1.1 临床资料本研究采用横断面研究方法,纳入2013年10月至2021年12月期间我院行ALPPS手术治疗的肝脏肿瘤患者,共62例。纳入标准:①主要诊断为肝脏肿瘤;②手术方式为ALPPS;③FLRV不足(FLRV百分比即FLRV占标准肝体积百分比:肝硬化<40%,非肝硬化<30%)。排除行ALPPS但FLRV百分比>40%的肝脏肿瘤患者。共62例。收集统计患者未行二期手术的临床原因,分析比较患者的性别、年龄、肝硬化、乙肝情况、肿瘤直径、临床分期、Child-Pugh评分和肝脏分隔方式等基线特征、一期术前术后肝功能(转氨酶、胆红素和白蛋白水平)、一期术后FLRV增长情况、一期术后肿瘤情况、一期和二期手术的间隔时间、住院天数和术后并发症等临床资料。本研究通过陆军军医大学第一附属医院伦理委员会审查(KY2021069)。
1.2 研究方法 1.2.1 患者所有患者在接受ALPPS术前排除可能存在的远处转移,通过肝体积测算(Amira, Visage Imaging, Australia)计算FLRV。患者Child-Pugh分级A-B级,未接受术前全身化疗。
1.2.2 外科手术开腹ALPPS和腹腔镜ALPPS一期步骤:患者全身麻醉后,行右侧肋缘下切口进腹或者腹腔镜方式探查整个腹腔以排除肿瘤播种。评估肝脏质地,仔细检查门静脉系统以确定是否存在肝外侧支循环或门体分流。超声检查残余肝脏以排除可能存在的病灶,评估门静脉血流方向。显露肝门后,分离出门静脉右支并加以结扎(图 1A,a)。前入路法沿中肝静脉右侧1 cm进行肝脏分割,完全离断肝脏,直至显露肝后下腔静脉前壁。中肝静脉结扎或保存(图 1A,b~c)。
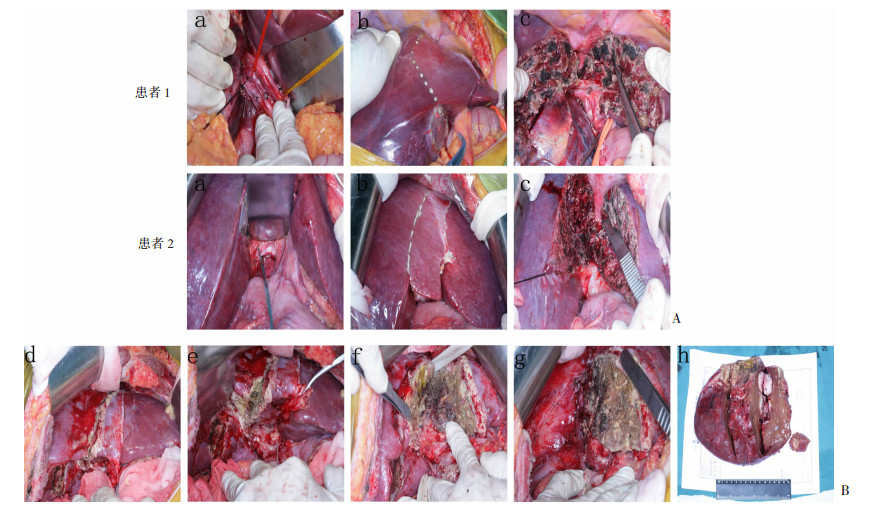
|
| A:两例患者一期手术过程图片 a:游离肝门,门静脉右支结扎,b:肝脏表面画出预切除线,c:沿预切除线离断肝脏实质,行肝脏分割;B:二期手术过程图片 d:开腹后游离粘连,显示肝脏分割线,e~f:分离肝脏分割断面的粘连,g:切除肿瘤后显示肝脏断面,h:切除肿瘤剖面大体观察 图 1 开腹ALPPS一期和二期手术过程术中典型图片 |
射频辅助ALPPS(radiofrequency assisted ALPPS, RALPPS)一期步骤:取右上腹肋缘下切口入腹,超声探查肝脏及肿瘤情况。不游离肝脏,切除胆囊后解剖出右肝动脉、门静脉右支及右肝管。结扎门静脉右支(图 2A,a)。用射频装置(Habib 4X,RITA 4401L,AngioDynamics Inc,USA)沿预切割线烧灼,直达弹性束带的前壁,以在病一健侧肝叶间建立1条无血带(图 2A,b~d)。射频消融后行术中超声检查以确定两侧肝叶间无血液循环。于右肝动脉、右肝管及肝后隧道留置可吸收线(0 PDS)作为标记,肝门部及烧灼线表面放置防粘连膜后,关闭腹腔。
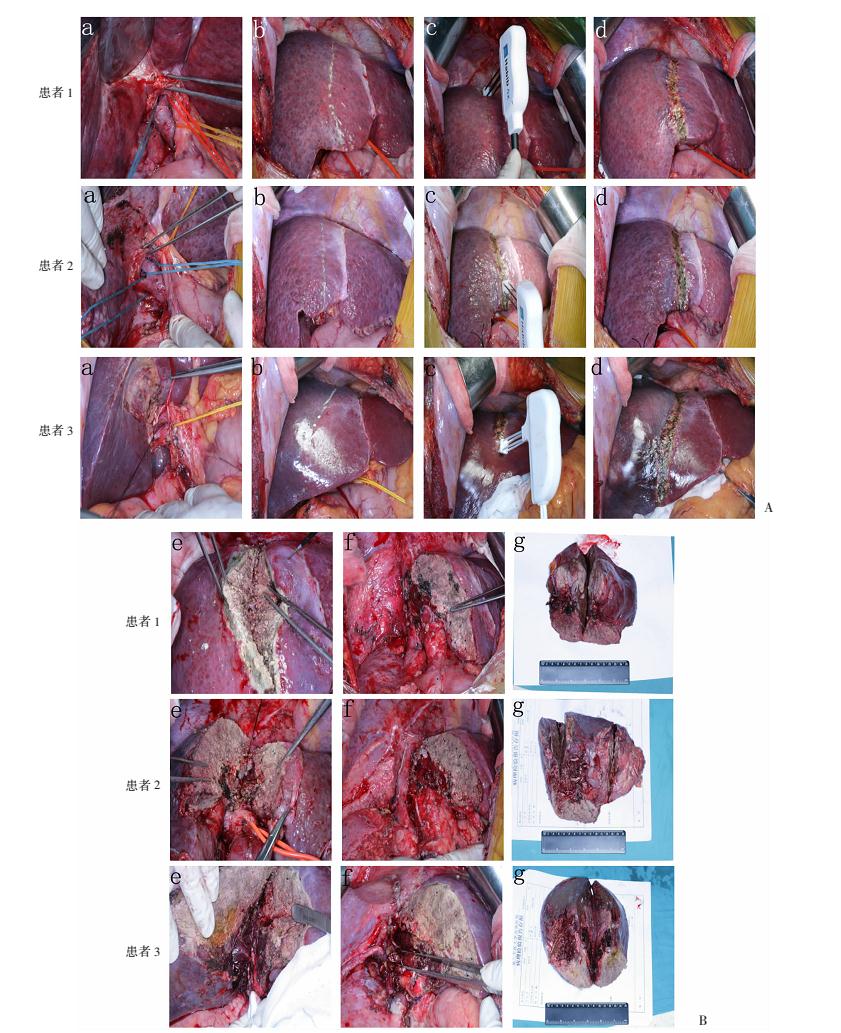
|
| A: 代表每例患者一期手术过程图片;B:代表每例患者二期手术过程图片 a:游离肝门,门静脉右支结扎,b:肝脏表面画出预切除线,c:沿预切除线行射频消融凝固肝脏实质,d:建立的消融带;e:开腹后沿消融带离断肝脏实质,f:切除肿瘤后显示肝脏断面,g:切除肿瘤剖面大体观 图 2 RALPPS一期和二期手术过程术中典型图片 |
ALPPS一期术后,每7~10 d进行CT扫描以监测FLRV的再生情况。一旦FLRV达到安全水平,即进行ALPPS二期手术。简要步骤如下:从原切口进腹,仔细分离粘连,循预置在右侧肝蒂的标记,解剖出肝门部结构,离断右肝蒂; 对于开腹或者腹腔镜ALPPS,游离出右肝静脉并切断缝扎,切除病肝(图 1B,d~h);对于射频辅助ALPPS,离断左右肝相连的肝脏组织直至下腔静脉表面,再游离出右肝静脉并切断缝扎,切除病灶,残肝创面妥善止血(图 2B,e~g)。
1.2.3 术后管理和随访根据Clavien-Dindo分类法记录并分析并发症[2],根据“50-50”标准定义肝切除术后肝功能衰竭[3]。记录患者的术后住院时间、术后1天肝功能主要指标[主要包括谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、白蛋白和总胆红素(total bilirubin, TBIL)],术后并发症情况(主要有肺部感染、出血、腹腔积液、胸腔积液等)。
1.3 统计学方法本研究采用R 4.0.3统计软件处理数据。计量资料使用Shapiro-Wilk正态性检验判定正态性,如果符合正态分布,采用x±s表示,两组比较采用独立样本t检验;如果不符合正态分布,采用中位数(四分位数)表示,两组比较采用Wilcoxon检验。计数资料采用例数(%)表示,两组比较采用χ2检验或Fisher确切概率法。影响二期手术进行的危险因素的多因素分析采用二元Logistic回归分析。P<0.05认为差异有统计学意义。
2 结果 2.1 一般临床资料共62例患者行ALPPS手术进行治疗。其中男性54例,女性8例。平均年龄(49.1±10.4)岁。开腹ALPPS 9例,RALPPS 29例,腹腔镜ALPPS 24例。45例患者成功行第二期手术,其一期和二期手术平均间隔等待时间为21(17, 28)d。17例患者未行二期手术,其中开腹ALPPS组2例,RALPPS组11例,腹腔镜ALPPS组4例。
62例患者中有55例原发性肝癌(hepatocellular carcinoma, HCC),4例肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC),2例转移性肝癌,1例上皮样血管内皮瘤。乙肝表面抗原阳性患者51例。40例患者有不同程度的肝硬化。肿瘤最大直径平均为(9.6±4.1)cm。13例患者伴有门静脉癌栓形成。58例患者巴塞罗那分期为B~C期。肿瘤均位于肝脏右叶,肿瘤侵犯肝段数目平均为3 (2, 4)个。一期术前ICG R15测值平均为4.0%(3.0%, 7.0%),一期术前FLRV百分比为29.0%(25.0%, 33.0%),60例患者一期术前肝功能Child-Pugh分级为A级,2例为B级(7分)。具体见表 1。
| 项目 | 总体(n=62) | 未行二期手术组(n=17) | 二期手术组(n=45) | 统计值 | P |
| 性别 | 0.35 | 0.556 | |||
| 女 | 8(12.9) | 1(5.9) | 7(15.6) | ||
| 男 | 54(87.1) | 16(94.1) | 38(84.4) | ||
| 年龄/岁 | 49.1±10.4 | 49.9±7.7 | 48.8±11.3 | 0.45 | 0.658 |
| 肿瘤侵犯肝段数目/个 | 3(2, 4) | 4(2, 4) | 2(2, 4) | 0.71 | 0.480 |
| 肿瘤最大直径/cm | 9.6±4.1 | 11.3±3.9 | 9.0±4.0 | 2.09 | 0.041 |
| 门静脉癌栓 | 7.58 | 0.006 | |||
| 无 | 49(79.0) | 9(52.9) | 40(88.9) | ||
| 有 | 13(21.0) | 8(47.1) | 5(11.1) | ||
| 肝硬化程度 | 1.46 | 0.227 | |||
| 无 | 22(35.5) | 4(23.5) | 18(40.0) | ||
| 有 | 40(64.5) | 13(76.5) | 27(60.0) | ||
| 临床巴塞罗那分期 | 4.65 | 0.098 | |||
| A | 4(6.5) | 0 | 4(8.9) | ||
| B | 37(59.7) | 8(47.1) | 29(64.4) | ||
| C | 21(33.9) | 9(52.9) | 12(26.7) | ||
| 乙型肝炎表面抗原 | 0.15 | 0.701 | |||
| 阳性 | 51(82.3) | 15(88.2) | 36(80.0) | ||
| 阴性 | 11(17.7) | 2(11.8) | 9(20.0) | ||
| 一期术前肝功能评分/分 | - | 0.219 | |||
| 5 | 47(75.8) | 11(64.7) | 36(80.0) | ||
| 6 | 13(21.0) | 6(35.3) | 7(15.6) | ||
| 7 | 2(3.2) | 0 | 2(4.4) | ||
| 一期术前ICG(%) | 4.0(3.0, 7.0) | 6.0(3.0, 11.0) | 4.0(3.0, 5.0) | 1.36 | 0.174 |
| 一期术前剩余肝体积比(%) | 29.0(25.0, 33.0) | 27.0(25.0, 32.0) | 29.0(24.0, 34.0) | -0.73 | 0.468 |
| 一期手术时长/分 | 242.4±63.5 | 219.8±66.4 | 251.0±60.9 | -1.75 | 0.085 |
| 一期手术方式 | 3.13 | 0.209 | |||
| 开腹ALPPS | 9(14.5) | 2(11.8) | 7(15.6) | ||
| RALPPS | 29(46.8) | 11(64.7) | 18(40.0) | ||
| 腹腔镜ALPPS | 24(38.7) | 4(23.5) | 20(44.4) | ||
| 一期术中失血量/mL | 200.0(112.5, 337.5) | 200.0(100.0, 400.0) | 200.0 (200.0, 300.0) | -0.04 | 0.968 |
| 患者总住院天数/d | 42.0(24.0, 52.2) | 35.0 (24.0, 63.0) | 43.0 (30.0, 48.0) | 0.19 | 0.850 |
| 肿瘤类型 | - | - | |||
| 右肝上皮样血管内皮瘤 | 1(1.6) | 0 | 1(2.2) | ||
| 右肝内胆管细胞癌 | 4(6.4) | 0 | 4(8.9) | ||
| 原发性肝癌 | 55(88.7) | 16(94.1) | 39(86.7) | ||
| 右肝转移癌 | 2(3.3) | 1(5.9) | 1(2.2) |
2.2 患者手术结局
二期手术总体失败率为27.4%(17/62),ALPPS组二期失败率为22.2%(2/9),RALPPS组二期失败率为37.9%(11/29),腹腔镜ALPPS组二期失败率为16.7%(4/24),RALPPS组二期手术失败率最高。
结果显示肿瘤最大直径和门静脉癌栓形成在二期手术组和未行二期手术组患者中差异具有统计学意义(P<0.05)。年龄、性别和肝硬化程度等指标差异无统计学意义,具体见表 1。
2.3 患者术后肝功能指标的比较所有患者一期术前和一期术后肝功能情况见表 2,结果提示二期手术组和未行二期手术组患者的一期术前白蛋白和总胆红素水平、一期术后谷草转氨酶和总胆红素水平差异具有统计学意义(均P<0.05)。
| 指标 | 未行二期手术组(n=17) | 二期手术组(n=45) | 统计值 | P |
| 术前谷丙转氨酶/IU·L-1 | 56.0 (34.0, 64.9) | 40.0 (27.9, 61.5) | 0.96 | 0.336 |
| 术前谷草转氨酶/IU·L-1 | 60.0 (39.0, 83.2) | 41.0 (31.4, 67.0) | 1.75 | 0.080 |
| 术前白蛋白/g·L-1 | 38.7±3.1 | 41.4±4.3 | -2.33 | 0.023 |
| 术前总胆红素/μmol·L-1 | 20.3(16.6, 27.9) | 14.6(11.4, 20.2) | 2.64 | 0.008 |
| 术后谷丙转氨酶/IU·L-1 | 567.0 (322.0, 879.0) | 395.0 (296.2, 598.4) | 1.70 | 0.090 |
| 术后谷草转氨酶/IU·L-1 | 743.0 (489.3, 1 069.8) | 505.0 (284.2, 707.0) | 2.53 | 0.011 |
| 术后白蛋白/g·L-1 | 31.0±5.5 | 32.7±4.0 | -1.31 | 0.195 |
| 术后总胆红素/μmol·L-1 | 26.7(17.4, 37.5) | 18.8(13.1, 24.9) | 2.21 | 0.027 |
2.4 患者术后并发症的比较
我们统计了ALPPS患者一期术后并发症发生的情况。结果显示肺部炎症、胸水、腹水为常见并发症。其中一期术后腹水两组患者差异具有统计学意义(P<0.05)。见表 3。
| 项目 | 未行二期手术组(n=17) | 二期手术组(n=45) | 统计值 | P |
| 肺部感染 | - | 0.324 | ||
| 无 | 9(52.9) | 20(44.4) | ||
| 有 | 8(47.1) | 25(55.6) | ||
| 腹腔感染 | - | 0.328 | ||
| 无 | 17(100.0) | 43(95.6) | ||
| 有 | 0 | 2(4.4) | ||
| 胸水 | - | 0.465 | ||
| 无 | 4(23.5) | 8(17.8) | ||
| 有 | 13(76.5) | 37(82.2) | ||
| 腹水 | - | 0.038 | ||
| 无 | 2(11.8) | 14(31.1) | ||
| 有 | 15(88.2) | 31(68.9) | ||
| 出血 | - | 0.274 | ||
| 无 | 16(94.1) | 45(100.0) | ||
| 有 | 1(5.9) | 0 | ||
| 死亡 | - | 0.274 | ||
| 无 | 16(94.1) | 45(100.0) | ||
| 有 | 1(5.9) | 0 | ||
| 发热 | - | 0.566 | ||
| 无 | 16(94.1) | 40(88.9) | ||
| 有 | 1(5.9) | 5(11.1) |
我们进一步统计分析了严重并发症发生情况,结果显示未行二期手术组患者发生Ⅲ级及以上并发症11例,二期手术组患者仅有4例发生Ⅲ级及以上并发症,两组患者Ⅲ级及以上并发症发生率差异具有显著统计学意义(P<0.001)。见表 4。
| 指标 | 未行二期手术组(n=17) | 二期手术组(n=45) | 统计值 | P |
| 并发症等级 | 18.027 | <0.001 | ||
| <Ⅲ级 | 6(35.3) | 41(91.1) | ||
| ≥Ⅲ级 | 11(64.7) | 4(8.9) | ||
| 注:根据Clavien-Dindo grade进行分级 | ||||
2.5 一期术后未能行二期手术的原因及影响因素分析
我们进一步分析一期术后未能行二期手术的主要临床结局原因,结果显示主要临床因素为肝脏未明显增生、FLRV不足、肝脏功能和肝脏储备功能差、并发症发生和肿瘤进展。具体见表 5。
| 病例 | 一期手术方式 | 未行二期手术原因 |
| 1 | 开腹ALPPS | ICG R15持续高(27%),顽固性胸腹水,C级肝功能 |
| 2 | 开腹ALPPS | FLRV不足 |
| 3 | RALPPS | ICG R15持续高(16.8%),FLRV 34%(术后1月余),B级肝功能 |
| 4 | RALPPS | 门静脉主干、右支癌栓形成,左肝转移灶 |
| 5 | RALPPS | 失访 |
| 6 | RALPPS | 胆红素持续高,300 μmol/L以上, C级肝功能 |
| 7 | RALPPS | ICG R15持续高(17.3%),FLRV不足,腹水,C级肝功能 |
| 8 | RALPPS | C级肝功能 |
| 9 | RALPPS | ICG R15持续高(21.3%),FLRV不足 |
| 10 | RALPPS | 死亡 |
| 11 | RALPPS | ICG R15持续高(17%),回肠末端出血,肝右叶病灶增大,左肝多发转移灶 |
| 12 | RALPPS | 右侧胸腔大量积液、大量腹水,凝血功能差 |
| 13 | RALPPS | 剖腹探查发现肝内多发转移 |
| 14 | 腹腔镜ALPPS | 多器官功能衰竭,自动出院 |
| 15 | 腹腔镜ALPPS | FLRV不足 |
| 16 | 腹腔镜ALPPS | 门静脉主干血栓,海绵样变,FLRV不足 |
| 17 | 腹腔镜ALPPS(中转开腹) | FLRV不足,腹水,左肝内叶转移病灶 |
上述因素是临床结局,这些临床结局决定患者无法行二期手术。因此我们进一步分析了影响二期手术进行的危险因素,我们将肿瘤最大直径、癌栓形成、一期术前白蛋白、一期术前总胆红素水平和并发症等级进行二元Logistic回归分析,结果显示肿瘤直径、癌栓形成和并发症的等级是影响二期手术能否进行的独立影响因素(均P<0.05)。见表 6。
| 危险因素 | B | SE | Z | P | OR(95%CI) |
| 肿瘤最大直径 | -0.29 | 0.14 | -2.16 | 0.031 | 0.75(0.57~0.97) |
| 癌栓形成 | -1.94 | 0.96 | -2.02 | 0.044 | 0.14(0.02~0.95) |
| 一期术前白蛋白水平 | -0.01 | 0.12 | -0.10 | 0.922 | 0.99(0.78~1.25) |
| 一期术前总胆红素水平 | -0.05 | 0.05 | -0.84 | 0.399 | 0.96(0.86~1.06) |
| 并发症等级(<Ⅲ级/≥Ⅲ级) | -3.65 | 1.21 | -3.01 | 0.003 | 0.03(0~0.28) |
3 讨论
ALPPS手术可在短期内诱导剩余肝脏显著增生[4]。SCHADDE等[5]多中心临床研究结果显示ALPPS手术一期术后7 d内FLRV可增加80%。ALPPS手术肿瘤根治切除率高达90%~100%[6],让因FLRV不足而无法行常规同期根治性切除的肝癌患者有了治愈的希望,能够提高进展期原发性和继发性肝癌的可切除率,显著改善病人生存。文献报道ALPPS术后的长期生存率明显优于TACE,与常规同期肝癌切除术后的长期生存率相似,认为ALPPS是选择性无法同期切除的肝癌患者的可行治疗方案[4, 7]。
由于ALPPS手术过程本身涉及两期手术,因此存在一期术后因为各种原因导致二期手术有可能不能完成。目前文献报道ALPPS二期手术完成率和R0切除率分别达97%和91%[8]。但该综述总结的文献大多数是国外文献,病种为直肠癌肝转移,因此二期手术完成率较高,且有国外指南已将ALPPS术式列入直肠癌肝转移的手术治疗。国内文献报道肝癌ALPPS二期手术完成率约为66.7%[9]。但是从我们中心结果来看,ALPPS二期手术完成率和R0切除率分别达72.6% (45/62)和100%。
剩余肝脏增生到足够体积是ALPPS二期手术能够进行的主要因素之一。文献指出肝脏分隔方式、采用腹腔镜、肝硬化和新辅助化疗为可能影响ALPPS一期术后剩余肝脏增生的临床因素,但需大样本或前瞻性研究进一步明确[10]。此外,增加残余肝脏血供是促进ALPPS一期术后剩余肝脏增生的关键因素[11]。在基础研究方面,研究指出骨髓来源肝血窦内皮祖细胞参与ALPPS术后肝脏的快速再生[12]。
肿瘤进展是影响ALPPS二期手术成功进行的另外一个因素。但其实ALPPS一期术后剩余肝脏快速急剧增生可以避免过长的手术间隔时间导致肿瘤进展而失去二期手术机会,手术时间间隔长的主要因素之一也就是剩余肝脏增生不足,没有达到肝切除的条件而无法实施二期手术,进而肿瘤有可能发生发展。因为ALPPS一期手术没有切除肿瘤,而是行门静脉结扎,因此与TACE原理一样,缺血缺氧环境有可能促进肿瘤发生进展。因此一期术后肿瘤出现肝内转移,特别是预留侧肝脏的转移是影响二期手术进行的临床因素。
并发症的发生也是影响ALPPS二期手术成功进行的一个因素。ALPPS一期术后常见并发症为肺部炎症、胸水[13]。我们结果显示未行二期手术组患者发生腹水的比例高于二期手术组患者,差异具有统计学意义。此外,未行二期手术组患者一期术后发生Ⅲ级及以上并发症的比例也高于二期手术组患者,差异具有显著统计学意义。因此,严重并发症的发生可能是导致二期手术不能进行的临床原因。本研究发现未能成功行二期手术的直接临床原因为肝脏未明显增生,肝储备功能差,严重并发症发生和肿瘤进展。进一步多因素分析结果显示肿瘤直径、癌栓形成和并发症的等级是影响二期手术能否进行的独立影响因素。
在肝脏分隔方式方面,有文献指出由于RALPPS一、二期手术间隔等待时间较长,因此不建议肝癌患者采用RALPPS手术[14]。我们结果也提示未能行二期手术的患者主要集中在RALPPS组。射频消融肝实质建立隔离带时能刺激肝细胞再生,但是建立消融隔离带时消融肝脏的时间短,刺激肝细胞增生的持续作用时间也短,此外,该方式没有完全阻断肝实质间血液侧支循环,无法使门静脉血完全供给剩余肝脏。因此RALPPS一期术后出现肝脏增生不明显的原因可能是射频消融刺激肝细胞增生的效果无法代偿肝实质没有完全分割阻断门静脉侧支循环带来的不良影响,因此部分患者,特别是肝硬化很重的患者肝脏增生能力较差。因此我们对于ALPPS一期术后肝脏增生不明显的患者可以采用经皮穿刺多次补救性射频消融刺激残余肝脏增生[15]。因为射频消融能够活化成纤维细胞和巨噬细胞,能够诱导肝细胞增殖[16],另一方面,射频消融可增加循环IL-6[17-18],IL-10[17]以及TNF-α[18]的水平,而这些因子可明显刺激肝脏增生。此外,RALPPS术后可见肝组织库普弗细胞浸润,且库普弗细胞缺失会显著抑制细胞因子表达并延迟肝再生[18]。目前RALPPS治疗边缘不可切除的肝癌是安全可行的[19-20],但可能需要选择合适的患者。
随着ALPPS技术的发展,一期手术方式越来越微创化,诞生了很多改良式ALPPS技术,具有代表性的有RALPPS、TACE联合选择性门静脉栓塞[21],经皮微波或射频消融肝实质分隔联合门静脉栓塞[22]。这些微创的一期手术在肝癌分步肝切除中应用越来越广泛,但是还需大样本、长期随访的结果进一步证实其安全性和有效性。我们认为ALPPS手术在不可同期一步切除的肝癌患者的治疗中可能发挥越来越大的作用,而且一期手术使用微创的方法可能会改善预后,降低并发症发生率。
志谢 感谢陆军军医大学第一附属医院肝胆外科季渝军提供肝体积测算服务| [1] |
CLAVIEN P A, PETROWSKY H, DEOLIVEIRA M L, et al. Strategies for safer liver surgery and partial liver transplantation[J]. N Engl J Med, 2007, 356(15): 1545-1559. |
| [2] |
KATAYAMA H, KUROKAWA Y, NAKAMURA K, et al. Extended Clavien-Dindo classification of surgical complications: Japan Clinical Oncology Group postoperative complications criteria[J]. Surg Today, 2016, 46(6): 668-685. |
| [3] |
KAMBAKAMBA P, STOCKER D, REINER C S, et al. Liver kinetic growth rate predicts postoperative liver failure after ALPPS[J]. HPB (Oxford), 2016, 18(10): 800-805. |
| [4] |
WANG Z, PENG Y F, HU J W, et al. Associating liver partition and portal vein ligation for staged hepatectomy for unresectable hepatitis B virus-related hepatocellular carcinoma: a single center study of 45 patients[J]. Ann Surg, 2020, 271(3): 534-541. |
| [5] |
SCHADDE E, RAPTIS D A, SCHNITZBAUER A A, et al. Prediction of mortality after ALPPS stage-1: an analysis of 320 patients from the international ALPPS registry[J]. Ann Surg, 2015, 262(5): 780-785. |
| [6] |
SCHADDE E, ARDILES V, ROBLES-CAMPOS R, et al. Early survival and safety of ALPPS: first report of the International ALPPS Registry[J]. Ann Surg, 2014, 260(5): 829-836. |
| [7] |
DENG Z F, JIN Z R, QIN Y H, et al. Efficacy of the association liver partition and portal vein ligation for staged hepatectomy for the treatment of solitary huge hepatocellular carcinoma: a retrospective single-center study[J]. World J Surg Oncol, 2021, 19(1): 95. |
| [8] |
SCHADDE E, SCHNITZBAUER A A, TSCHUOR C, et al. Systematic review and meta-analysis of feasibility, safety, and efficacy of a novel procedure: associating liver partition and portal vein ligation for staged hepatectomy[J]. Ann Surg Oncol, 2015, 22(9): 3109-3120. |
| [9] |
吴心强, 陈亚进. 肝硬化肝再生的研究进展[J]. 中华消化外科杂志, 2017, 16(2): 210-214. WU X Q, CHEN Y J. Research progress in liver regeneration of cirrhosis[J]. Chin J Dig Surg, 2017, 16(2): 210-214. |
| [10] |
林为东, 莫经刚. ALPPS促进剩余肝脏快速增生机制及相关因素研究进展[J]. 中国普通外科杂志, 2017, 26(8): 1065-1070. LIN W D, MO J G. Mechanisms of ALPPS promoting rapid hypertrophy of future liver remnant and relevant factors: recentadvances[J]. Chin J Gen Surg, 2017, 26(8): 1065-1070. |
| [11] |
金望迅, 王兵, 黄灵, 等. 影响二步肝切除术肝脏再生的主要因素研究[J]. 中华全科医学, 2019, 17(6): 927-931, 1032. JIN W X, WANG B, HUANG L, et al. A retrospective study on the key factors that influence the liver regeneration after the stage-1 associating liver partition and portal ligation for staged hepatectomy[J]. Chin J Gen Pract, 2019, 17(6): 927-931, 1032. |
| [12] |
黄粲宸, 黄民, 肖乐, 等. ALPPS一期术后刺激残肝再生及其相关因素的研究[J]. 第三军医大学学报, 2018, 40(13): 1198-1204. HUANG C C, HUANG M, XIAO L, et al. Liver regeneration and related factors after first step of ALPPS surgery in SD rats[J]. J Third Mil Med Univ, 2018, 40(13): 1198-1204. |
| [13] |
曹永, 揭彬, 郑树国, 等. 26例肝癌行ALPPS围手术期并发症的观察分析[J]. 第三军医大学学报, 2019, 41(15): 1491-1496. CAO Y, JIE B, ZHENG S G, et al. Clinical analysis of perioperative complications of 26 cases of liver cancer after ALPPS[J]. J Third Mil Med Univ, 2019, 41(15): 1491-1496. |
| [14] |
ZHANG J W, HUANG H C, BIAN J, et al. Safety, feasibility, and efficacy of associating liver partition and portal vein ligation for staged hepatectomy in treating hepatocellular carcinoma: a systematic review[J]. Ann Transl Med, 2020, 8(19): 1246. |
| [15] |
王强, 闫军, 冯晓彬, 等. 补救性射频消融或门静脉栓塞术联合射频辅助肝脏分隔和门静脉结扎的二步肝切除术治疗肝硬化肝癌[J]. 中华消化外科杂志, 2016, 15(5): 455-460. WANG Q, YAN J, FENG X B, et al. Remedial radiofrequency ablation or portal vein embolization combined with radiofrequency ablation-assistant associating liver partition and portal vein ligation for staged hepatectomy in the treatment of patients with hepatocellular carcinoma with cirrho[J]. Chin J Dig Surg, 2016, 15(5): 455-460. |
| [16] |
ROZENBLUM N, ZEIRA E, BULVIK B, et al. Radio-frequency ablation: inflammatory changes in the periablative zone can induce global organ effects, including liver regeneration[J]. Radiology, 2015, 276(2): 416-425. |
| [17] |
ERINJERI J P, THOMAS C T, SAMOILIA A, et al. Image-guided thermal ablation of tumors increases the plasma level of interleukin-6 and interleukin-10[J]. J Vasc Interv Radiol, 2013, 24(8): 1105-1112. |
| [18] |
ZHANG W K, ZHU X W, TANG Y, et al. Kupffer cells depletion alters cytokine expression and delays liver regeneration after Radio-frequency-assisted Liver Partition with Portal Vein Ligation[J]. Mol Immunol, 2022, 144: 71-77. |
| [19] |
GALL T M, SODERGREN M H, FRAMPTON A E, et al. Radio-frequency-assisted Liver Partition with Portal vein ligation (RALPP) for liver regeneration[J]. Ann Surg, 2015, 261(2): e45-e46. |
| [20] |
WANG Q, YAN J, FENG X B, et al. Safety and efficacy of radiofrequency-assisted ALPPS (RALPPS) in patients with cirrhosis-related hepatocellular carcinoma[J]. Int J Hyperthermia, 2017, 33(7): 846-852. |
| [21] |
陈耿, 张琳, 周毅, 等. 联合同期超选择性肝动脉栓塞和门静脉栓塞的二步肝切除术治疗合并肝硬化的原发性肝癌[J]. 中华肝胆外科杂志, 2019, 25(4): 249-253. CHEN G, ZHANG L, ZHOU Y, et al. Simultaneous super-selective hepatic arterial and portal vein embolization for stagedhepatectomy in patients with hepatocellular carcinoma and cirrhosis[J]. Chin J Hepatobil Surg, 2019, 25(4): 249-253. |
| [22] |
张远标, 洪德飞, 黄东胜, 等. 经皮微波或射频消融肝实质分隔联合门静脉栓塞计划性肝切除术治疗肝硬化肝癌[J]. 中华消化外科杂志, 2016, 15(5): 510-514. ZHANG Y B, HONG D F, HUANG D S, et al. Percutaneous microwave or radiofrequency ablation liver partition and portal vein embolization for planned hepatectomy[J]. Chin J Dig Surg, 2016, 15(5): 510-514. |




