原发性肝癌是最常见的恶性肿瘤之一,其中肝细胞癌(hepatocellular carcinoma,HCC)占主体。HCC是全球第六大最常见的癌症,也是癌症死亡的第四大原因[1]。由于大多数HCC恶性程度高,进展迅速,传统的手术、放疗、化疗等治疗手段效果较差,因此急需寻找新的治疗方法提高患者的生存期和生存质量。
近年来,过继细胞免疫治疗(adoptive cell transfer therapy, ACT)作为一种新的肿瘤免疫疗法备受关注[2]。ACT是将大量免疫细胞在体外培养和扩增后再注入体内以使癌症消退的一种免疫疗法。ACT通常使用具有抗肿瘤活性的天然宿主T细胞、基因工程化T细胞受体或嵌合抗原受体(chimeric antigen receptor, CAR)修饰而成的T细胞,其中嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T)能够特异性靶向清除肿瘤细胞,近年来已成为研究热点。
CAR的结构主要由细胞外抗原结合区、铰链区、跨膜区和一个或多个细胞内信号区组成[3]。近30年来,CAR已发展出5代,第二代在临床上应用最多,第三代到第五代目前还在研究阶段[4]。CAR-T在临床治疗血液恶性肿瘤中取得了显著的疗效,尤其是以CD19为靶点的CAR-T研究已被大量报道[5],越来越多的学者开始进一步研究CAR-T治疗实体瘤,其中针对肝癌的临床前研究已取得了部分进展,目前研究CAR-T治疗肝癌的靶点主要聚焦在磷脂酰肌醇蛋白聚糖3(Glypican-3,GPC3)[6]、黏蛋白1(mucin-1)[7]、甲胎蛋白(alpha fetal protein, AFP)[8-9]上。
上皮细胞黏附分子(epithelial cellular adhesion molecule, EpCAM)是一种跨膜糖蛋白,在多种癌组织中高表达,如肝癌、结肠癌等[10-11],目前将EpCAM作为CAR-T治疗肝癌靶点的研究尚未见大量报道。本研究将针对EpCAM肿瘤抗原的第三代嵌合抗原受体基因[scFv (anti-EpCAM)-CD28-4-1BB-CD3ζ],通过慢病毒载体转染到T淋巴细胞获得EpCAM-CAR-T细胞,然后评价CAR-T细胞在体外抗肝癌效果。该实验为靶向EpCAM的CAR-T细胞治疗肝癌的体内实验及临床应用奠定了实验基础。
1 材料与方法 1.1 主要试剂及仪器编码靶向EpCAM的CAR基因的慢病毒由四川大学生物治疗国家重点实验室提供;SK-hep1购自中国武汉普诺赛生命科技有限公司;hep-G2、HuH7和BEL-7402均购自中国上海抚生实业有限公司;DMEM培养基、胎牛血清和胰蛋白酶均购自美国Gibco公司;X-VIVO培养基购自美国Lonza公司;青-链霉素购自美国Mediatech公司;Ficoll淋巴细胞分离液购自美国Sigma-Aldrich公司;重组人白细胞介素-2(rhIL-2)购自美国BD公司;抗人CD3/抗CD28磁珠购自美国Invitrogen公司;抗人CD3抗体、抗人CD8抗体、抗人CD4流式实验抗体购自美国Biolegend公司;PE标记的抗人EpCAM流式抗体购自美国Biolegend公司;PE标记的山羊抗鼠F(ab’)2流式抗体购自美国Jackson ImmunoResearch公司;IFN-γ ELISA试剂盒、TNF-α ELISA试剂盒购自美国BioLegend公司;乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒购自中国南京建成生物研究所公司。细胞计数板购自美国Count star公司;孔板、培养皿、培养瓶购自美国CORNING公司;15、50 mL离心管购自美国BD公司。摇床购自中国天呈公司,电子数字天平购自中国普力斯特公司,超纯水系统购自美国Millipore公司,-80 ℃超低温冰箱购自美国Thermo公司,生物安全柜购自美国Thermo公司,普通冰箱购自中国Haier公司,实时荧光定量PCR仪购自美国Bio-Rad公司,生物显微镜购自德国Leica公司,CO2细胞培养箱购自美国Thermo公司,普通离心机购自美国Thermo Scientific公司,超速离心机购自Beckmann公司,高速离心机购自美国Thermo Scientific,恒温水浴箱购自美国PolyScience,酶标仪购自美国Bio-Rad公司,FACSCelesta流式细胞仪购自美国BD公司。
1.2 细胞培养4种人肝癌细胞SK-hep1、hep-G2、HuH7、BEL-7402用含5%胎牛血清、1%青-链霉素的DMEM高糖完全培养基培养,当细胞生长至80%~90%时,用0.25% 胰蛋白酶消化并传代,置于37 ℃、5% CO2恒温培养箱中培养,细胞均为贴壁细胞。
从外周静脉血提取出的人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)用含有2.5% AB型人血清、100 U/mL IL-2的X-VIVO完全培养基培养,置于37 ℃、5% CO2恒温培养箱中培养,该种细胞为悬浮细胞。
1.3 流式细胞术检测EpCAM在肝癌细胞表面的表达为了检测EpCAM在各肝癌细胞表面的表达情况,收集1×106个肝癌细胞,用PBS缓冲液洗涤3次。第3次洗涤后,用200 μL PBS缓冲液重悬细胞。在试管中加入1 μL PE荧光偶联EpCAM抗体,4 ℃避光孵育染色30 min。孵育结束后,用PBS缓冲液洗涤2次,用100 μL PBS缓冲液重悬细胞,流式细胞术检测并分析。
1.4 人外周血单个核细胞的分离和提取从重庆医科大学附属第一医院消化内科征集一位健康志愿者,取12 mL健康志愿者的外周静脉血入肝素抗凝管。先在15 mL离心管中加入6 mL淋巴细胞分离液,再贴壁加入6 mL血液,在32 ℃、1 000×g、离心加减速度均为2的条件下离心30 min。离心后可见其分为4层,将白膜层即单个核细胞层(peripheral blood mononuclear cells, PBMCs)吸入至50 mL离心管中。加入20 mL X-VIVO培养基清洗,300×g离心10 min后弃上清液,加入20 mL红细胞裂解缓冲液,裂解2 min后300×g离心5 min。离心后弃上清,加入20 mL X-VIVO培养基清洗,300×g离心5 min后弃上清,并用含有抗人CD3 /CD28抗体磁珠的X-VIVO完全培养基(磁珠∶细胞=1 ∶1)进行活化、培养传代。本研究经本院伦理委员会审批通过。
1.5 靶向EpCAM的CAR-T细胞的制备用含有靶向EpCAM-CAR基因的慢病毒转染T细胞,从而制备出CAR-T细胞。先加1 mL纤维连接蛋白(50 ug/mL)即RetroNectin于6孔板中,4 ℃封口过夜。弃液后用2% BSA溶液封闭30 min,用PBS缓冲液洗涤2次。每孔加入0.5 mL X-VIVO培养基,然后加入含靶向EpCAM-CAR基因的慢病毒,1 000×g、32 ℃条件下离心2 h。加入2×106个T淋巴细胞,300×g离心10 min。最后将6孔板放入培养箱进行培养,以便进行后续分析。
1.6 流式细胞术检测T细胞表面CAR的表达为了检测EpCAM-CAR在T细胞表面的表达情况,在慢病毒转染T细胞48~72 h,使用间接染色法进行荧光染色。先分别收集1×106个CAR-T细胞,用PBS缓冲液洗涤3次。第3次洗涤后,用200 μL PBS缓冲液重悬细胞。加入4 μL生物素偶联F(ab’)2抗体,4 ℃下孵育30 min。用PBS缓冲液洗涤2次,弃上清液后用200 μL PBS缓冲液重悬细胞。加入4 μL PE标记链霉亲和素,4 ℃避光孵育30 min。用PBS缓冲液洗涤2次,弃上清液后用100 μL PBS缓冲液重悬细胞,以流式细胞术进行检测分析, 未转染的普通T细胞作为对照组,检测CAR-T实验组的CAR表达情况。
1.7 LDH释放实验检测EpCAM-CAR-T细胞杀伤能力靶细胞SK-hep1、hep-G2、HuH7和BEL-7402经细胞培养、充分生长后被收集起来,300×g离心5 min洗涤去除胎牛血清和培养基等,添加新鲜基础培养基于离心沉淀中,调整细胞数为1×105/mL。收集效应细胞CAR-T和活化T细胞,300×g离心5 min洗涤去除人血清和细胞因子等,添加新鲜基础培养基于离心沉淀中,调整细胞数为2×105/mL。将效应细胞、靶细胞分别加96孔板中(200 μL/孔),效应细胞∶靶细胞=2 ∶1、1 ∶1。细胞放入CO2培养箱,培养6 h。于孵育结束前1 h,在靶细胞最大LDH释放孔中加入20 μL lysis裂解液充分裂解细胞。孵育结束后300×g离心5 min,转移上清液至新的96孔板中以备LDH释放实验。按照试剂说明书要求设置培养基背景孔、靶细胞自发LDH释放孔、效应细胞自发LDH释放孔、靶细胞最大LDH释放孔、每种实验孔均设3个复孔。按照说明书要求加入样本、LDH试剂,最后加入终止液后,通过酶标仪测定吸光度值[D(450)]。根据公式计算效应细胞杀伤能力(溶细胞率)。
溶细胞率=(实验组D值-效应细胞自发释放孔D值-靶细胞自发释放孔D值)/(靶细胞最大释放孔D值-靶细胞自发释放孔D值)× 100%
1.8 酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)法检测IFN-γ、TNF-α的浓度靶细胞即肝癌细胞与效应细胞即未转染的T细胞或CAR-T细胞,以不同比例(1 ∶5/1 ∶10)加入96孔板中,每组设3个复孔,放入37 ℃、5% CO2培养箱中共培养,每孔肝癌细胞数为1×104个。20 h后,离心收集上清液,使用ELISA试剂盒分别测定IFN-γ和TNF-α浓度。在酶标仪上测定各孔450、570 nm处的吸光度值。根据标准品浓度与D值的曲线关系,计算出IFN-γ和TNF-α的浓度。
1.9 流式细胞术检测T细胞表面CD3/4/8的表达CAR-T细胞培养10 d后,收集1×106个细胞,用PBS缓冲液洗涤3次。第3次洗涤后,用200 μL PBS缓冲液重悬细胞。相继加入1 μL APC-A750荧光偶联CD3抗体、1 μL FITC荧光偶联CD4抗体和1 μL PE荧光偶联CD8抗体,4 ℃避光孵育染色30 min。染色后,用PBS缓冲液洗涤2次,100 μL PBS缓冲液重悬细胞,并以流式细胞仪检测分析。
1.10 统计学分析所有统计分析使用SPSS 25.0和GraphPad Prism 8.0软件进行。细胞因子浓度数据、溶细胞率等定量数据均用x±s表示,用独立样本t检验分析两组样本的均数。P<0.05认为差异具有统计学意义。
2 结果 2.1 EpCAM在人肝癌细胞系中的表达采用流式细胞术检测4种人肝癌细胞表面EpCAM抗原的表达。SK-hep1、hep-G2、HuH7和BEL-7402细胞中EpCAM的表达率分别为0.25%(几乎不表达)、99.46%、91.15%和99.33%(图 1)。
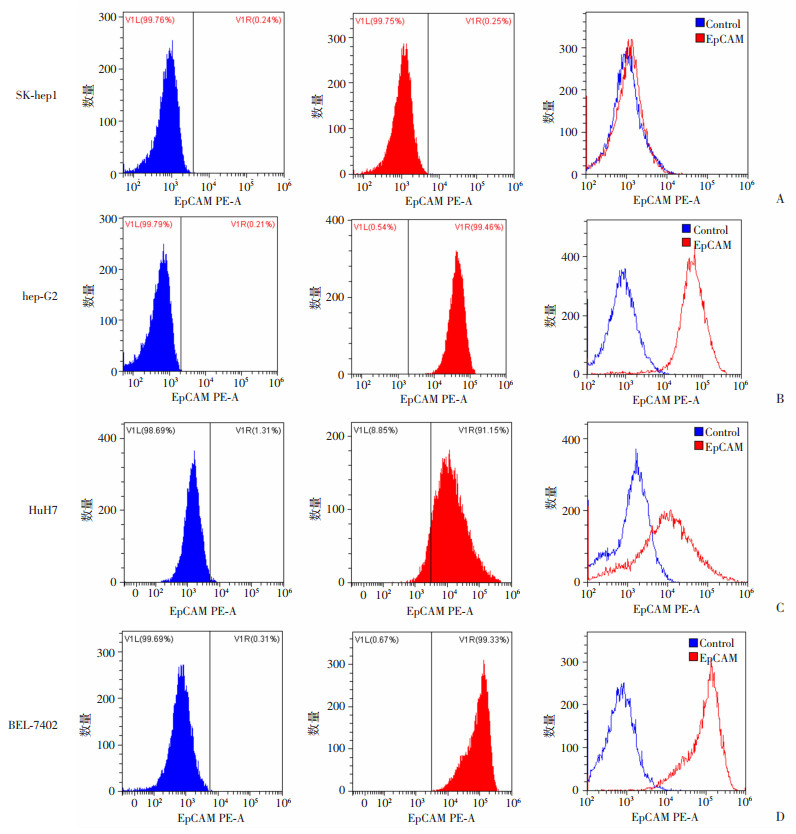
|
| A~D:分别为SK-hep1、hep-G2、HuH7和BEL-7402肝癌细胞 图 1 流式细胞术检测4种人肝癌细胞系表面EpCAM抗原的表达 |
2.2 转染后T细胞表面CAR的表达
采用编码靶向EpCAM-CAR的慢病毒转染T细胞来构建CAR-T细胞。慢病毒转染T细胞48~72 h后,流式细胞术检测转染效率,其中Control组代表未转染的T细胞组,CAR-T组为慢病毒转染的T细胞组。结果显示,高达43.21%的T细胞表面表达了CAR分子(图 2,M2值),表明成功构建了稳定高表达的靶向EpCAM的CAR-T细胞。
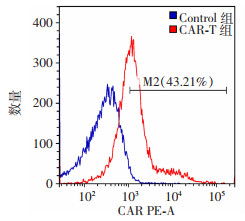
|
| 图 2 流式细胞术检测T细胞表面CAR的表达 |
2.3 CAR-T细胞的体外杀伤能力
乳酸脱氢酶(LDH)在胞质内含量丰富,正常时并不能通过细胞膜,在细胞受损或死亡时才释放到细胞外,此时培养基中LDH的活性与受损或死亡细胞数量成正比。LDH释放实验结果显示:以未转染T细胞与SK-hep1肝癌细胞共培养组为对照组,与对照组相比,在效靶比(E ∶T)为2 ∶1时,EpCAM-CAR-T细胞分别与3种EpCAM阳性细胞即hep-G2、HuH7和BEL-7402肝癌细胞共培养时有更多量的LDH释放(P<0.01,图 3)。
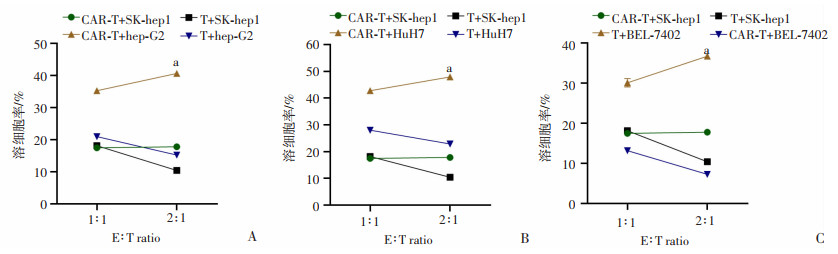
|
|
SK-hep1:EpCAM阴性肝癌细胞;a: P<0.01,与对照组比较 A:LDH释放实验测定两种效应细胞与SK-hep1、hep-G2分别共培养后的释放情况;B:LDH释放实验测定两种效应细胞与SK-hep1、HuH7分别共培养后的释放情况;C:LDH释放实验测定两种效应细胞分别与SK-hep1、BEL-7402分别共培养后的释放情况 图 3 LDH释放实验检测CAR-T细胞直接杀伤能力 |
T细胞要发挥抗肿瘤作用,除了与靶细胞特异性结合直接杀伤靶细胞外,还同时释放大量的细胞因子,如IFN-γ、TNF-α等,最终扩大和增强免疫应答。本课题通过检测共培养的细胞因子浓度水平,能侧面印证CAR-T细胞对肝癌细胞的杀伤能力。
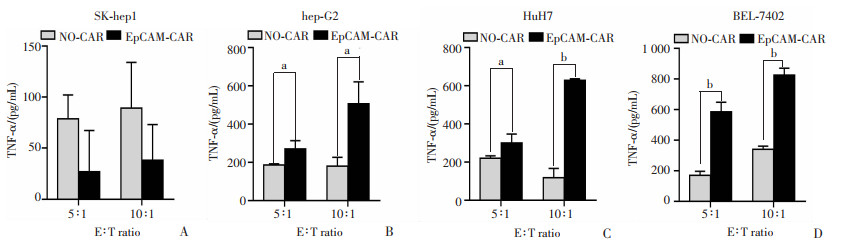
ELISA分别检测共培养细胞上清液中的细胞因子IFN-γ和TNF-α,以未转染T细胞与肝癌细胞共培养组为对照组。结果显示:与对照组相比,3种EpCAM阳性靶细胞株即hep-G2、HuH7和BEL-7402诱导靶向EpCAM-CAR-T细胞释放出更多的IFN-γ和TNF-α(P<0.05, P<0.01, 图 4、5)。而对于EpCAM阴性的SK-hep1肿瘤细胞,EpCAM-CAR-T实验组和对照组之间IFN-γ和TNF-α的浓度没有显著的差异。此外,细胞因子水平随着E ∶T比值的增加而增加(图 4、5)。
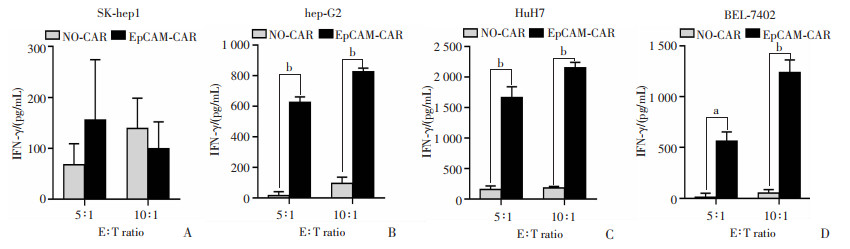
|
|
NO-CAR:未转染的T细胞对照组;EpCAM-CAR:CAR-T实验组;a: P<0.05,b: P<0.01 A~D:分别为SK-hep1、hep-G2、HuH7和BEL-7402与2种效应细胞分别共培养后效应细胞分泌的IFN-γ水平 图 4 ELISA实验测定共培养后细胞因子IFN-γ释放水平 |
|
|
NO-CAR:未转染的T细胞对照组;EpCAM-CAR:CAR-T实验组;a: P<0.05,b: P<0.01 A~D:分别为SK-hep1、hep-G2、HuH7和BEL-7402与2种效应细胞分别共培养后效应细胞分泌的TNF-α水平 图 5 ELISA实验测定共培养后细胞因子TNF-α释放水平 |
2.4 CAR-T细胞的表型
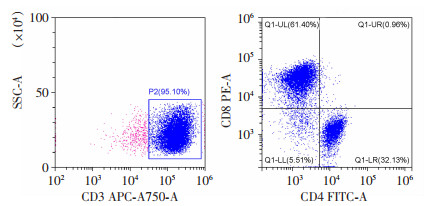
通过流式细胞仪检测激活CAR-T细胞的表型,高达95.10%的PBMCs为CD3阳性,说明均是人T淋巴细胞,其中CD8+T细胞占61.40%、CD4+T细胞占32.13%(图 6)。该结果表明在刺激扩增后的靶向EpCAM的CAR-T细胞中,CD8+的T细胞明显多于CD4+的T细胞,其具有更强的杀伤能力。
|
| 图 6 流式细胞术检测EpCAM -CAR-T细胞的表型 |
3 讨论
T细胞是肿瘤细胞的天敌,在抗肿瘤的免疫反应中发挥重要作用。基于CAR-T细胞的过继细胞免疫治疗可以预防肿瘤的复发和进展[12]。CAR-T疗法已经成为一种非常有前途的ACT。与传统的ACT相比,CAR-T治疗有以下优点:①它具有一定的抗原特异性;②CAR-T细胞不依赖于MHC,直接识别肿瘤细胞[13]。
目前,靶向CD19的CAR -T是临床实践中研究最广泛的,实体瘤的CAR-T治疗也在进一步研究中,研究的实体肿瘤靶点包括人表皮生长因子受体2 (human epidermal growth factor receptor-2, HER2)[14]、双唾液酸神经节苷脂(disialoganglioside, GD2)[15]、间皮素(mesothelin)[16]、甲胎蛋白等。
肝癌是一种恶性程度很高的实体瘤,进展快,预后差,目前CAR-T细胞治疗肝癌的研究相对较少,本课题选择EpCAM抗原作为CAR-T治疗肝癌靶点。既往研究表明,EpCAM在肝癌、食管癌、胃癌、结直肠癌、卵巢癌、前列腺癌等组织中过表达,而在正常组织中基本不表达。循环肿瘤细胞和播散性肿瘤细胞被确定为潜在的转移诱导细胞[17],而EpCAM是其标记物,此外EpCAM还是肿瘤干细胞的标记物。EpCAM在化疗耐药肿瘤患者中可能升高或降低表达[18]。
3.1 4种肝癌细胞系唯有SK-hep1基本不表达靶抗原EpCAM本研究采用流式细胞术检测了4种肝癌组织中EpCAM的表达。结果显示EpCAM在hep-G2、HuH7和BEL-7402中高表达,而SK-hep1基本不表达。靶向EpCAM的CAR-T细胞(即EpCAM-CAR-T)能够识别肿瘤表面抗原EpCAM,从而更有效地杀伤肿瘤细胞。
3.2 通过慢病毒转染成功制备高表达CAR的CAR-T为了实现CAR在T细胞上的稳定表达,既往研究发现重组人纤维连接蛋白(RetroNectin)可以增强慢病毒感染T细胞的效率。在本研究中,Retronectin法被用来更有效地将编码CAR的慢病毒转染到T细胞中,慢病毒转染T细胞48~72 h后,用流式细胞仪检测转染效率。结果表明,CAR在转染的T细胞表面的表达率高达43.21%。
3.3 EpCAM-CAR-T相对普通T细胞具备更强的杀伤能力T细胞是通过直接破坏靶细胞膜而将靶细胞杀伤,同时释放细胞因子增强免疫效应,所以T细胞杀伤靶细胞后,从靶细胞中释放出的LDH程度能直观地代表T细胞的直接杀伤能力,而从T细胞释放出的细胞因子的量也能一定程度上代表其杀伤能力。两种体外杀伤实验里,LDH释放实验表明EpCAM-CAR-T对EpCAM阳性肝癌细胞比对EpCAM阴性肝癌细胞具有更强的直接杀伤能力,而且细胞因子释放实验表明EpCAM-CAR-T在肿瘤表面抗原EpCAM刺激下,对比普通T细胞,其可以释放更多量的细胞因子,包括IFN-γ、TNF-α,激活和维持T细胞抗肿瘤活性,发挥更强的杀伤效应。
综上所述,本研究通过含有靶向EpCAM-CAR基因的慢病毒转染普通T细胞,成功构建了稳定高表达EpCAM-CAR的CAR-T细胞。在体外实验中,EpCAM-CAR-T对EpCAM阳性肝癌细胞的杀伤能力强于其对EpCAM阴性肝癌细胞的杀伤能力,本研究为进一步开展EpCAM-CAR-T细胞治疗肝癌的临床研究奠定了一定的实验基础。本研究尚存在不足之处,比如进一步做体内动物实验验证CAR-T在动物体内抗肝癌能力。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ROSENBERG S, RESTIFO N. Adoptive cell transfer as personalized immunotherapy for human cancer[J]. Science, 2015, 348(6230): 62-68. DOI:10.1126/science.aaa4967 |
| [3] |
DOMINGUEZ G. The CART gene: structure and regulation[J]. Peptides, 2006, 27(8): 1913-1918. DOI:10.1016/j.peptides.2006.01.025 |
| [4] |
JENSEN M C, RIDDELL S R. Design and implementation of adoptive therapy with chimeric antigen receptor-modified T cells[J]. Immunol Rev, 2014, 257(1): 127-144. DOI:10.1111/imr.12139 |
| [5] |
MAUS M V. CD19 CAR T cells for adults with relapsed or refractory acute lymphoblastic leukaemia[J]. Lancet, 2021, 398(10299): 466-467. DOI:10.1016/S0140-6736(21)01289-7 |
| [6] |
SHI D H, SHI Y P, KASEB A O, et al. Chimeric antigen receptor-glypican-3 T-cell therapy for advanced hepatocellular carcinoma: results of phase Ⅰ trials[J]. Clin Cancer Res, 2020, 26(15): 3979-3989. DOI:10.1158/1078-0432.CCR-19-3259 |
| [7] |
马宜冬, 王真, 巩睿智, 等. 靶向黏蛋白1嵌合抗原受体修饰的Jurkat T细胞特异杀伤肝癌细胞[J]. 第二军医大学学报, 2014, 35(11): 1177-1182. MA Y D, WANG Z, GONG R Z, et al. Specific cytotoxicity of MUC1 chimeric antigen receptor-engineered Jurkat T cells against hepatocellular carcinoma[J]. Acad J Second Mil Med Univ, 2014, 35(11): 1177-1182. DOI:10.3724/SP.J.1008.2014.01177 |
| [8] |
LIU H, XU Y Y, XIANG J Y, et al. Targeting alpha-fetoprotein (AFP)-MHC complex with CAR T-cell therapy for liver cancer[J]. Clin Cancer Res, 2017, 23(2): 478-488. DOI:10.1158/1078-0432.CCR-16-1203 |
| [9] |
SUN L H, GUO H, JIANG R Y, et al. Engineered cytotoxic T lymphocytes with AFP-specific TCR gene for adoptive immunotherapy in hepatocellular carcinoma[J]. Tumor Biol, 2016, 37(1): 799-806. DOI:10.1007/s13277-015-3845-9 |
| [10] |
GIRES O, PAN M, SCHINKE H, et al. Expression and function of epithelial cell adhesion molecule EpCAM: where are we after 40 years?[J]. Cancer Metastasis Rev, 2020, 39(3): 969-987. DOI:10.1007/s10555-020-09898-3 |
| [11] |
ASAKURA N, NAKAMURA N, MUROI A, et al. Expression of cancer stem cell markers EpCAM and CD90 is correlated with anti- and pro-oncogenic EphA2 signaling in hepatocellular carcinoma[J]. Int J Mol Sci, 2021, 22(16): 8652. DOI:10.3390/ijms22168652 |
| [12] |
ZHANG R Y, ZHANG Z, LIU Z K, et al. Adoptive cell transfer therapy for hepatocellular carcinoma[J]. Front Med, 2019, 13(1): 3-11. DOI:10.1007/s11684-019-0684-x |
| [13] |
BUJAK J K, PINGWARA R, NELSON M H, et al. Adoptive cell transfer: new perspective treatment in veterinary oncology[J]. Acta Vet Scand, 2018, 60(1): 60. DOI:10.1186/s13028-018-0414-4 |
| [14] |
BUDI H S, AHMAD F N, ACHMAD H, et al. Human epidermal growth factor receptor 2 (HER2)-specific chimeric antigen receptor (CAR) for tumor immunotherapy; recent progress[J]. Stem Cell Res Ther, 2022, 13(1): 40. DOI:10.1186/s13287-022-02719-0 |
| [15] |
PULE M A, SAVOLDO B, MYERS G D, et al. Virus-specific T cells engineered to coexpress tumor-specific receptors: persistence and antitumor activity in individuals with neuroblastoma[J]. Nat Med, 2008, 14(11): 1264-1270. DOI:10.1038/nm.1882 |
| [16] |
TOKATLIAN T, ASUELIME G E, MOCK J Y, et al. Mesothelin-specific CAR-T cell therapy that incorporates an HLA-gated safety mechanism selectively kills tumor cells[J]. J Immunother Cancer, 2022, 10(1): e003826. DOI:10.1136/jitc-2021-003826 |
| [17] |
GIRES O, STOECKLEIN N H. Dynamic EpCAM expression on circulating and disseminating tumor cells: causes and consequences[J]. Cell Mol Life Sci, 2014, 71(22): 4393-4402. DOI:10.1007/s00018-014-1693-1 |
| [18] |
BROWN T C, SANKPAL N V, GILLANDERS W E. Functional implications of the dynamic regulation of EpCAM during epithelial-to-mesenchymal transition[J]. Biomolecules, 2021, 11(7): 956. DOI:10.3390/biom11070956 |




