肝细胞癌(hepatocellular carcinoma, HCC)在因癌致死的癌症中排名第2,每年会造成大约788 000人病死,其主要由乙肝病毒感染,酒精性肝硬化等引起[1]。近年来,肝癌已经成为我国因癌致死的主要癌症之一,严重影响着人民的健康。肝癌患者确诊时往往处于中晚期并大多伴有肝内外的转移,因而其预后非常差。目前最常用的检测主要是通过影像学的手段和检测甲胎蛋白,有效的治疗手段和检测指标仍然十分有限,尤其是早期的诊断和治疗。转移是导致癌症患者死亡的主要原因之一[2-3],因此,阐明肝癌的侵袭和转移机制,寻找一种有效的抑制侵袭和转移的手段具有重要意义。
白介素35(interleukin 35, IL35)是一种新发现IL12家族的细胞因子,其由EB病毒诱导基因3(epstein barr virus-induced gene3, Ebi3)和白细胞介素12α(interleukin 12 alpha, IL12α)组成[4]。IL35主要与IL12Rβ2和gp130两个受体联接而发挥作用。研究表明,IL35在肝癌中高表达,且与患者肝癌的复发风险呈正相关[5]。在肝癌细胞HepG2中过表达IL35能够通过抑制基质金属蛋白酶2(MMP2)和MMP9表达来抑制肝癌细胞的侵袭和迁移。此外,IL35在其他多种癌症中均有其发挥抑癌作用的报道,例如IL35在结直肠癌中高表达且与疾病的发展和预后密切相关[7],IL35高表达于胰腺癌患者中且是加重胰腺癌进展的主要因素之一[8],IL35通过调控Treg细胞功能加强急性髓性白血病的免疫逃逸[9]。
自噬是一种维持细胞内环境稳定的程序性死亡,主要是通过将需要降解的细胞器和衰老的蛋白输送到溶酶体进行自我消化降解,从而实现细胞器更新和内环境稳态[10]。自噬囊泡是贯穿整个自噬过程的一种重要现象,通过形成自噬体和自噬溶酶体发挥不同作用而达到重复利用的生物学作用。自噬在肝癌中发挥着双刃剑的作用,已有研究表明前列腺素A能够通过诱导自噬发挥抑制肝癌的作用[11]。抑制自噬会导致肝癌组织中p62的聚集而加速肝脏肿瘤的进展[12]。Beciln1是酵母自噬基因Atg6的同源基因,其与LC3B、p62具有协同反映自噬流强弱的作用。研究表明,Beclin1的降低与肝细胞癌的进展密切相关[13]。因此,在肝细胞癌中诱导自噬将是一种可行的抑制肝细胞癌生长的手段,且目前IL35在肝细胞癌中与自噬关系尚不明确。
本研究以肝癌细胞为对象,探讨IL35对肝癌细胞株自噬的影响,进而探讨其通过调节自噬达到抑制HCC的目的。旨在进一步揭示IL35在HCC中发挥的作用。
1 材料与方法 1.1 材料人肝癌和癌旁组织来源于重庆医科大学附属第一医院手术切除患者的标本。人正常肝细胞株HL7702和HCC细胞株Hep3B、Huh7、SMMC7721、Bel7402、SK-Hep-1由本课题组和四川大学华西医院肝胆外科实验室长期保存。DMEM高糖培养基和胎牛血清购自以色列BI公司;胰酶消化液购自上海碧云天公司;CCK-8试剂盒购自美国Bimake公司;细胞冻存液购自中国新赛美公司;细胞裂解液购自碧云天公司;蛋白酶抑制剂cocktail购自美国bimake公司;SDS-PAGE凝胶试剂盒购自上海碧云天公司;Ebi3抗体,IL12α抗体购自中国immunoway公司,GAPDH抗体,E-cadherin、N-cadherin和Vimentin抗体V购自上海Abways公司;山羊抗兔辣根过氧化物酶标记的二抗购自北京中杉金桥公司;基质胶和Transwell小室购自康宁公司;IL35低表达慢病毒购自上海汉恒生物科技公司。
1.2 方法 1.2.1 细胞培养人正常肝细胞系LO2和4株HCC细胞系(Huh7、Hep3B、SMMC7721及Bel7402)培养于含10% 胎牛血清的DMEM高糖培养基中,并在37 ℃,含5%CO2的细胞孵育箱中生长。当细胞密度达到90%左右时对细胞进行传代处理。传代时丢弃旧培养基,使用1 mL预热PBS缓冲液清洗2次,吸除PBS缓冲液后加入1 mL预热0.25%胰酶细胞消化液,并放入细胞孵育箱中消化1~2 min,消化完成后轻拍瓶壁使细胞脱落,加入1 mL完全培养基终止消化,将细胞混悬液移至15 mL离心管中,使用离心机以1 000 r/min离心5 min,离心结束后弃去上清,加入3 mL完全培养基,轻轻吹打混匀,根据实验需要按照1 ∶2或1 ∶3传代。
1.2.2 细胞慢病毒转染构建低表达人IL35的重组慢病毒载体和空载体。Hep3B细胞在5 mg/mL聚丙烯存在的情况下被慢病毒转染,转染复数(MOI)为10~100。24 h后,将含有病毒的培养基替换为新鲜的含有10%胎牛血清的DMEM高糖培养基。转染72 h后,通过使用2 μg/mL嘌呤霉素选择细胞以建立具有稳定低表达IL 35的细胞系。
1.2.3 Western blot检测收集肝组织和各细胞株,然后进行蛋白质提取。通过SDS-PAGE分离后,蛋白质被转移到PVDF膜上。将膜在QuickBlockTM封闭缓冲液(碧云天,中国)在室温封闭20 min。将前述一抗与膜在4 ℃下反应过夜,然后将膜与山羊抗兔二抗在室温下孵育1 h。将膜用TBST洗涤3次, 每次5 min。用增强的化学发光(ECL)试剂盒(Merck Millipore,德国)在Vilber Fusion FX7 Spectra仪器上(Fusion,FX7,法国)检测蛋白条带。ImageJ软件定量蛋白质表达。
1.2.4 透射电镜观察自噬体形成将Hep3B肝癌细胞接种在6孔板中,取对数期的细胞,0.25%胰酶消化肝细胞,并在4 ℃下用4%戊二醛固定2 h。然后,将细胞在4 ℃下固定在1%四氧化锇中2 h,用过滤的乙酸铀酰染色,并在分级的乙醇和丙酮系列中脱水。然后,我们在乙氧基树脂中渗透,包埋和聚合样品。制备半薄(0.5 μm)和超薄(60 nm)切片,并用乙酸铀酰和柠檬酸铅染色。用2.5%戊二醛和1%四氧化溶液固定,后用1%四氧化锇固定,在越来越多的醇中脱水并包埋在乙氧基树脂中。用Hitachi H-7500型透射电子显微镜(日立,日本东京)对切片进行可视化。使用Gatan-780系统获取图像。
1.2.5 CCK-8检测细胞增殖根据制造商的规程,使用CCK-8细胞增殖测定法测量细胞活力。将细胞以2×104/孔的密度播种到含有100 μL完整DMEM高糖培养基的96孔板中24 h。检测转染慢病毒的Hep3B细胞。除去上清液,并将细胞在含有20 μL CCK-8溶液的DMEM高糖培养基中于37 ℃和5%CO2孵育2 h。酶标仪在450 nm波长下测量光密度值D(450)。细胞存活率=[实验组D(450)值-空白组D(450)值]/[对照组D(450)值-空白组D(450)值]×100%。
1.2.6 平板克隆实验取对数期各组细胞,0.25%胰酶消化制成单细胞悬液,以500/孔的密度重新接种到6板上,随后充分摇动并培养2周,以使单个细胞长成肉眼可见的细胞团。PBS洗涤细胞2次,4%多聚甲醛室温固定15 min;弃去多聚甲醛,PBS洗涤2次。然后用3.7%的甲醇和0.1%的结晶紫染色室温染色30 min。
1.2.7 Transwell实验为了评估细胞迁移或侵袭能力,分别使用填充了和没有填充基质胶的(BD biosciences,Franklin Lakes,NJ)的transwell小室。取各组对数期细胞,0.25%胰酶消化制备单细胞悬液,将细胞在上室中与无血清培养基一起孵育。同时,将含有10%FBS的DMEM放入下室。将细胞在37 ℃下孵育24 h,并通过棉签小心地清除未侵袭的细胞。同时,用95%甲醇固定位于膜下侧的侵入细胞,并在室温下用结晶紫染色30 min。使用卡尔·蔡司显微镜系统随机拍摄5张图像。对5个随机视野进行计数统计。
1.3 统计学分析使用GraphPad Prism8.0版进行统计分析。采用x±s表示统计结果。t检验用于分析2组之间的正态分布数据。单因素方差分析(ANOVA)比较3组或更多组之间的差异。癌旁和肝癌组织之间的差异使用χ2检验。P < 0.05被认为差异具有统计学意义。
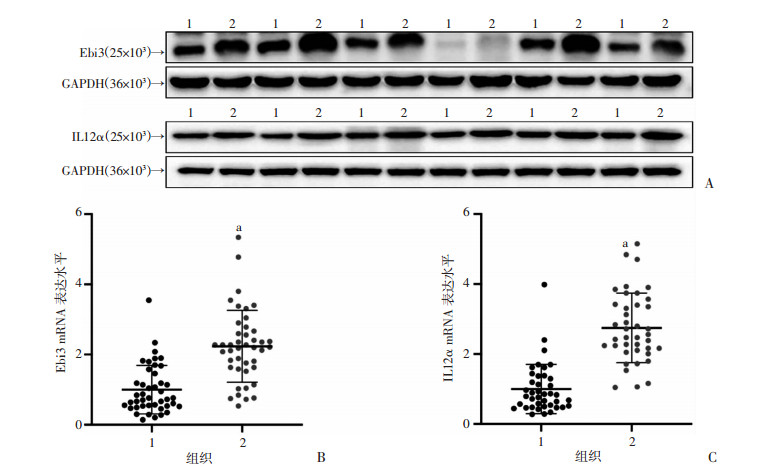
2 结果 2.1 IL35在肝癌组织中表达高于癌旁组织采用RT-qPCR和Western blot技术检测40对癌旁和肝癌组织中IL35在转录和蛋白水平的表达。结果表明,IL35在肝癌组织中的表达明显高于癌旁组织,差异具有统计学意义(P < 0.01, 图 1)。
|
|
1:癌旁组织;2:HCC组织; a: P < 0.01, 与癌旁组织比较 A: Western blot检测IL35表达;B: qRT-PCR检测Ebi3 mRNA表达;C:qRT-PCR检测IL12α mRNA表达 图 1 IL35在肝脏癌旁和HCC组织中的表达情况 |
2.2 IL35的表达与40位患者临床数据之间的相互关系
根据RT-qPCR和Western blot结果,将40例HCC患者分为高表达(n=28)和低表达(n=12)两组,以研究IL35表达与HCC患者临床特征之间的相关性。在患者的年龄,性别,肿瘤直径,肝硬化,组织分化,血清甲胎蛋白水平,HBV,BCLC分级和肿瘤转移等这些特征中,我们发现血管侵犯与IL35的高表达有关(P < 0.05,表 1)。
| 临床特征 | 病例数 | ||
| 高表达(n=28) | 高表达(n=21) | P | |
| 年龄/岁 | > 0.999 9 | ||
| < 60 | 20 | 8 | |
| ≥60 | 8 | 4 | |
| 性别 | 0.676 7 | ||
| 男 | 23 | 9 | |
| 女 | 5 | 3 | |
| 肿瘤大小/cm | 0.489 8 | ||
| ≤5 | 18 | 6 | |
| > 5 | 10 | 6 | |
| 肝硬化 | 0.395 5 | ||
| 有 | 21 | 11 | |
| 无 | 7 | 1 | |
| 甲胎蛋白(AFP)/ng·mL-1 | 0.715 9 | ||
| > 400 | 10 | 3 | |
| ≥400 | 18 | 9 | |
| HBsAg | > 0.999 9 | ||
| 阳性 | 21 | 11 | |
| 阴性 | 3 | 1 | |
| 血管侵犯 | |||
| 有 | 25 | 5 | |
| 无 | 3 | 7 | |
2.3 IL35在肝癌细胞株中的表达水平
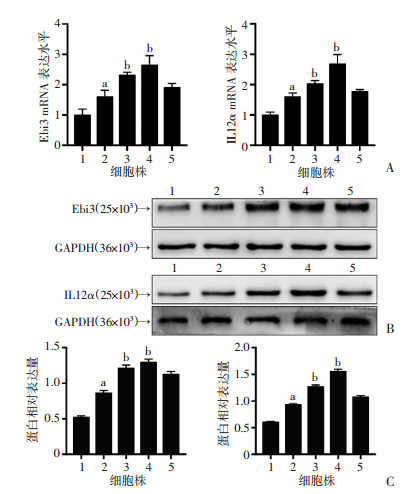
采用RT-qPCR和Western blot技术检测IL35在正常肝细胞和肝癌细胞株的表达水平。结果显示,与HL7702细胞相比,IL35在Hep3B、Huh7、SMMC7721、Bel7402中的蛋白表达均上调,而且在Hep3B细胞中的表达最高,差异具有统计学意义(P < 0.01, 图 2)。基于以上研究结果,选择Hep3B细胞作为后续的研究对象进行研究。
|
|
1:HL7702细胞株;2:SMMC7721细胞株;3:Huh7细胞株;4:Hep3B细胞株;5:Bel7402细胞株;a: P < 0.05, b: P < 0.01, 与HL7702细胞比较 A: qRT-PCR检测IL35在人正常肝细胞和HCC细胞株中的mRNA表达;B:Western blot检测IL35在人正常肝细胞和HCC细胞株中的蛋白表达;C:半定量分析IL35的蛋白表达水平 图 2 IL35在肝细胞及HCC细胞中的表达 |
2.4 慢病毒转染稳定低表达IL35的稳定细胞株
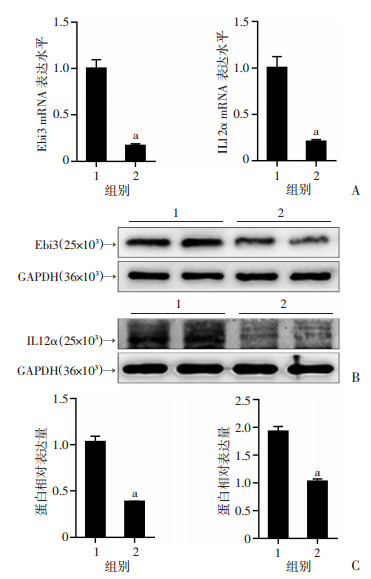
采用下调IL35的慢病毒转染Hep3B细胞,用以构建稳定低表达IL35的细胞株。采用RT-qPCR和Western blot技术分别从转录和蛋白水平检测慢病毒的转染效率。结果表明,与sh-NC组相比,sh-IL35组中IL35的表达水平明显降低,差异具有统计学意义(P < 0.01, 图 3)。表明低表达IL35的稳定细胞株构建成功,可以用于后续实验研究。
|
|
1:NC-shRNA;2:IL35-shRNA;a: P < 0.01, 与NC-shRNA组比较 A:qRT-PCR检测;B:Western blot检测;C:半定量分析 图 3 慢病毒下调IL35效率验证 |
2.5 下调IL35诱导Hep3B细胞自噬
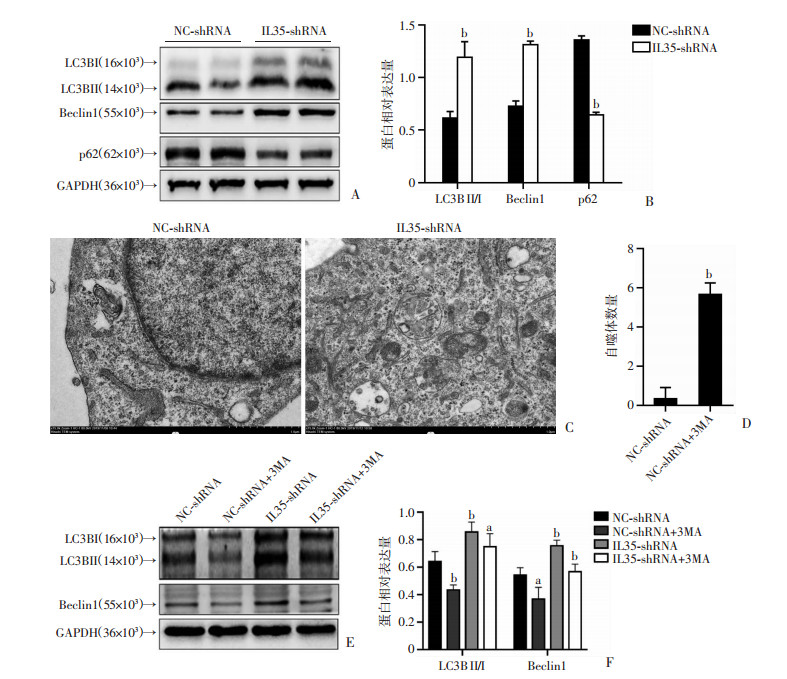
以经慢病毒转染后的Hep3B细胞为研究对象,Western blot检测自噬相关蛋白LC3B、Beclin1和p62的蛋白水平。结果表明,与NC-shRNA组相比,IL35-shRNA组的LC3BII/I的比值增加,Beclin1蛋白水平也同时增加,p62蛋白水平降低(P < 0.01, 图 4A、B)。透射电子显微镜结果显示,与NC-shRNA组相比,IL35-shRNA组的自噬小体形成数量明显高于NC-shRNA,差异具有统计学意义(P < 0.01, 图 4C、D)。为了验证下调IL35确实能够诱导自噬,应用自噬抑制剂3-MA (2 μmol/L) [14]处理细胞,发现IL35-shRNA联合3-MA组中LC3BII和Beclin1的蛋白水平高于NC-shRNA联合3-MA组,差异具有统计学意义(P < 0.01, 图 4E、F)。以上结果表明,下调IL35能够有效诱导Hep3B肝癌细胞发生自噬。
|
|
a: P < 0.05, b: P < 0.01, 与NC-shRNA组比较 A:Western blot检测下调IL35对肝癌细胞Hep3B自噬相关蛋白表达的影响;B:半定量分析自噬相关蛋白的表达;C:透射电镜观察下调IL35后肝细胞Hep3B自噬小体的形成;D:自噬小体数量的定量分析;E: Western blot检测自噬相关蛋白的表达;F: 半定量分析自噬相关蛋白的表达 图 4 下调IL35诱导Hep3B细胞发生自噬 |
2.6 下调IL35能有效抑制Hep3B细胞增殖
为探索下调IL35对Hep3B肝癌细胞增殖的影响,采用CCK-8和集落形成实验分别进行探讨。结果表明,在Hep3B细胞中,IL35-shRNA组的细胞克隆形成明显减少,细胞生长受抑(P < 0.01, 图 5A、B)。此外,与NC-shRNA组相比,IL35-shRNA组中的细胞增殖受到明显抑制,差异具有统计学意义(P < 0.01, 图 5C)。以上结果表明,下调IL35能够有效抑制Hep3B细胞增殖。
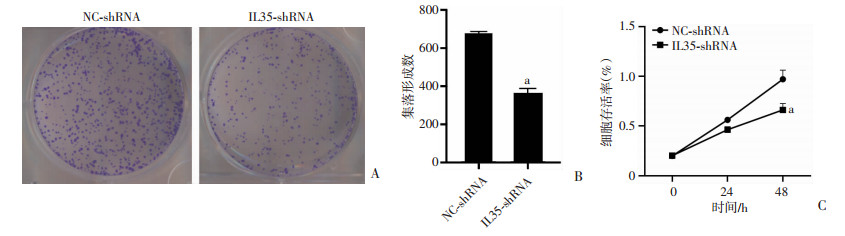
|
|
a: P < 0.01, 与NC-shRNA组相比较 A:克隆形成实验检测下调IL35对肝癌细胞Hep3B克隆形成的影响;B:定量分析克隆形成;C:CCK-8法检测下调IL35对肝细胞Hep3B细胞增殖的影响 图 5 下调IL35对肝癌细胞Hep3B增殖的影响 |
2.7 下调IL35能有效抑制Hep3B的侵袭和转移
本研究中临床资料表明,IL35在肝癌组织中的高表达,与肿瘤的转移有着一定的统计学关联。因此,我们进一步对转染了下调IL35慢病毒的HCC细胞Hep3B的转移和侵袭特性进行了初步探讨。Western blot结果表明,与NC-shRNA组相比,IL35-shRNA组中E-cadherin的表达上调,N-cadherin、Vimentin的表达下调,差异具有统计学意义(P < 0.01,图 6A、B)。此外,Transwell实验结果显示,与NC-shRNA组相比,IL35- shRNA组能有效减少HCC细胞Hep3B的迁移和侵袭的细胞数量,差异具有统计学意义(P < 0.01,图 6C、D)。
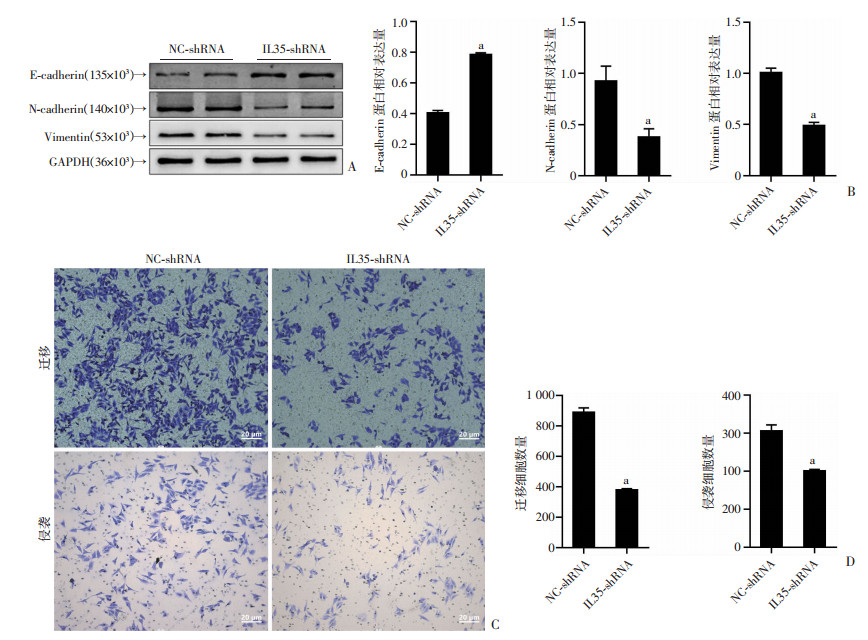
|
|
a: P < 0.01, 与NC-shRNA组比较 A:Western blot检测下调IL35对肝癌细胞Hep3B上皮间质转化的相关蛋白表达的影响;B:半定量分析上皮间之转化相关蛋白的表达;C:Transwell实验检测下调IL35对肝癌细胞Hep3B迁移和侵袭的影响;D:定量分析迁移和侵袭细胞的数量 图 6 下调IL35对Hep3B细胞上皮间质转化行为的影响 |
3 讨论
肝癌作为严重威胁人类健康的一大恶性疾病,具有早期诊断困难,治疗效果差和预后不佳等特点。细胞因子已经被证实具有调节肿瘤微环境,在肿瘤的发生和发展中起着“双刃剑”的作用,IL35作为IL12家族中的一员,最新研究表明其能够有效调控肿瘤微环境、炎症反应和免疫反应的细胞因子,其潜在的应用价值有待进一步的挖掘发现[15-16]。IL35在多种肿瘤患者或肿瘤细胞中的表达均被证实是上调的,与相应的肿瘤生物学特性密切相关,比如在喉鳞状细胞癌[17]、甲状腺癌[18]和HCC等[19]。虽然IL35与肝癌的研究已获得一定的成果,但IL35在HCC中与自噬的关系目前尚未明确,因此本研究从自噬着手,通过探讨IL35在肝癌组织和细胞中的表达,通过下调IL35来观察其对自噬的影响,并以此为基础探讨下调IL35对Hep3B肝癌细胞增殖,迁移和侵袭的影响。本研究证实了IL35在肝癌组织和肝癌细胞中的表达水平均上调,而Hep3B细胞IL35表达最高,这与之前的研究结果一致[6]。基于此,我们成功构建了能稳定低表达IL35的HCC细胞株Hep3B用于后续研究。低表达IL35能够有效抑制HCC细胞Hep3B的增殖,初步表明下调IL35能发挥抑制HCC细胞Hep3B增殖的作用。这一结果也表明IL35可能作为一个新的肝癌治疗靶点,值得进行进一步的深入研究。
自噬作为一种细胞保护机制,起到维持细胞内环境稳态的作用,但自噬在肝癌细胞中的调节作用却十分复杂,一方面自噬可以通过抑制炎症刺激相关的肝癌细胞的进展,但另一方面自噬可以抑制缺氧条件下活性氧的产生,减少肝癌细胞的凋亡。LC3BⅡ是自噬的经典标志物,常被用来反应自噬的活性程度,其主要被Atg7激活而裂解为LC3BⅠ,而后通过与磷脂酰乙醇胺的反应形成共轭连接[20]。研究表明,自噬在HCC既能被诱导,也能被抑制,例如一氧化氮能通过抑制自噬诱导凋亡发挥调控HCC的作用[21],槲皮素能通过部分激活自噬诱导凋亡发挥抑制小鼠HCC的作用[22], 此外,本课题组的前期研究结果发现,IL37能通过诱导HCC细胞自噬和凋亡而发挥抑制HCC的作用[23]。本研究用稳定低表达IL35的肝癌细胞Hep3B进行研究,采用Western blot检测自噬相关蛋白LC3B、Beclin1和p62的表达情况,结果表明,下调IL35后,LC3BⅡ/Ⅰ比值增加,Beclin1蛋白表达上调,但p62蛋白表达却降低。为了进一步证实下调IL35能够诱导Hep3B细胞发生自噬,我们还通过应用自噬抑制剂3-MA来佐证。结果表明,IL35-shRNA联合3-MA组中LC3BⅡ、Beclin1的表达高于NC-shRNA联合3-MA组中LC3BⅡ、Beclin1的蛋白表达。透射电子显微镜的结果也表明,下调IL35后,Hep3B细胞中自噬体数量明显高于空载组。然而IL35在肝癌中与自噬的确切机制目前尚未得知,需要进一步的研究加以探讨。
上皮间质转化(epithelial-mesenchymal transition, EMT), 被认为是癌细胞早期转移的重要特征,其主要通过赋予癌细胞更具有侵袭性的特征而被广泛研究[24], 在体外研究中通常通过观察E-cadherin、N-cadherin和Vimentin等指标加以反应。细胞因子发挥调控肿瘤的作用多种多样,调控上皮间质转化也是被研究的热门课题之一[25],且肿瘤的侵袭和迁移特性是影响患者生存和预后的一大因素。在本研究中,我们通过研究40对肝癌患者的IL35表达和临床资料的相关性发现,HCC的转移和IL35存在密切的关系。但目前关于IL35和HCC的侵袭和迁移的研究尚不清楚。在本研究中,Western blot结果表明,下调IL35能够有效升高E-cadherin蛋白表达,降低N-cadherin和Vimentin的蛋白表达。Transwell实验也进一步在体外证实下调IL35能够有效抑制Hep3B细胞发生侵袭和迁移,进而抑制HCC。
综上所述,在HCC细胞Hep3B中,下调IL35能够有效抑制Hep3B细胞的增殖,并通过抑制其迁移和侵袭发挥调控HCC的作用,而这一过程可能与低表达IL35激活的细胞自噬有关,但其确切的分子机制仍不明确,需要进一步的研究加以证实。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA A Cancer J Clin, 2015, 65(1): 5-29. |
| [2] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA A Cancer J Clin, 2016, 66(2): 115-132. |
| [3] |
GRANDHI M S, KIM A K, RONNEKLEIV-KELLY S M, et al. Hepatocellular carcinoma: from diagnosis to treatment[J]. Surg Oncol, 2016, 25(2): 74-85. |
| [4] |
SAWANT D V, HAMILTON K, VIGNALI D A A. Interleukin-35: expanding its job profile[J]. J Interferon Cytokine Res, 2015, 35(7): 499-512. |
| [5] |
FU Y P, YI Y, CAI X Y, et al. Overexpression of interleukin-35 associates with hepatocellular carcinoma aggressiveness and recurrence after curative resection[J]. Br J Cancer, 2016, 114(7): 767-776. |
| [6] |
LONG J, GUO H Y, CUI S C, et al. IL-35 expression in hepatocellular carcinoma cells is associated with tumor progression[J]. Oncotarget, 2016, 7(29): 45678-45686. |
| [7] |
LIANG Y F, CHEN Q Q, DU W J, et al. Epstein-Barr virus-induced gene 3 (EBI3) blocking leads to induce antitumor cytotoxic T lymphocyte response and suppress tumor growth in colorectal cancer by bidirectional reciprocal-regulation STAT3 signaling pathway[J]. Mediators Inflamm, 2016, 2016: 3214105. |
| [8] |
HUANG C B, LI N, LI Z X, et al. Tumour-derived interleukin 35 promotes pancreatic ductal adenocarcinoma cell extravasation and metastasis by inducing ICAM1 expression[J]. Nat Commun, 2017, 8: 14035. |
| [9] |
TAO Q S, PAN Y, WANG Y P, et al. Regulatory T cells-derived IL-35 promotes the growth of adult acute myeloid leukemia blasts[J]. Int J Cancer, 2015, 137(10): 2384-2393. |
| [10] |
LEVINE B, KROEMER G. Biological functions of autophagy genes: a disease perspective[J]. Cell, 2019, 176(1/2): 11-42. |
| [11] |
LUO M J, LIU Y F, LIU N N, et al. Proscillaridin A inhibits hepatocellular carcinoma progression through inducing mitochondrial damage and autophagy[J]. Acta Biochim Biophys Sin (Shanghai), 2021, 53(1): 19-28. |
| [12] |
TAKAMURA A, KOMATSU M, HARA T, et al. Autophagy-deficient mice develop multiple liver tumors[J]. Genes Dev, 2011, 25(8): 795-800. |
| [13] |
OSMAN N A A, ABD EL-REHIM D M, KAMAL I M. Defective Beclin-1 and elevated hypoxia-inducible factor (HIF)-1α expression are closely linked to tumorigenesis, differentiation, and progression of hepatocellular carcinoma[J]. Tumor Biol, 2015, 36(6): 4293-4299. |
| [14] |
LI L, LIU J D, GAO G D, et al. Puerarin 6″-O-xyloside suppressed HCC via regulating proliferation, stemness, and apoptosis with inhibited PI3K/AKT/mTOR[J]. Cancer Med, 2020, 9(17): 6399-6410. |
| [15] |
WANG R X, YU C R, DAMBUZA I M, et al. Interleukin-35 induces regulatory B cells that suppress autoimmune disease[J]. Nat Med, 2014, 20(6): 633-641. |
| [16] |
HAO S N, CHEN X, WANG F, et al. Breast cancer cell-derived IL-35 promotes tumor progression via induction of IL-35-producing induced regulatory T cells[J]. Carcinogenesis, 2018, 39(12): 1488-1496. |
| [17] |
WU W, JIANG H, LI Y, et al. IL-35 expression is increased in laryngeal squamous cell carcinoma and in the peripheral blood of patients[J]. Oncol Lett, 2017, 13(5): 3303-3308. |
| [18] |
康海岩, 杨庭显, 张磊. 甲状腺癌患者Gal-3、IL-17、IL-35、anti-TgAb的变化及期意义[J]. 西北国防医学杂志, 2017, 38(8): 505-508. KANG H Y, YANG T X, ZHANG L. Significance of serum Gal-3, IL-17, IL-35 and anti-TgAb in patients with thyroid carcinoma[J]. Med J Natl Defend Forces Northwest China, 2017, 38(8): 505-508. |
| [19] |
刘若时, 李慧, 吴继周, 等. IL-35、IL-22与广西肝癌家族聚集性的相关性研究[J]. 广西医科大学学报, 2018, 35(2): 170-173. LIU R S, LI H, WU J Z, et al. The relationship between IL-35, IL-22 and familial aggregation of hepatocellular carcinoma in Guangxi[J]. J Guangxi Med Univ, 2018, 35(2): 170-173. |
| [20] |
ROSSITER H, KÖNIG U, BARRESI C, et al. Epidermal keratinocytes form a functional skin barrier in the absence of Atg7 dependent autophagy[J]. J Dermatol Sci, 2013, 71(1): 67-75. |
| [21] |
ZHANG X G, JIN L, TIAN Z, et al. Nitric oxide inhibits autophagy and promotes apoptosis in hepatocellular carcinoma[J]. Cancer Sci, 2019, 110(3): 1054-1063. |
| [22] |
JI Y, LI L, MA Y X, et al. Quercetin inhibits growth of hepatocellular carcinoma by apoptosis induction in part via autophagy stimulation in mice[J]. J Nutr Biochem, 2019, 69: 108-119. |
| [23] |
LI T T, ZHU D, MOU T, et al. IL-37 induces autophagy in hepatocellular carcinoma cells by inhibiting the PI3K/AKT/mTOR pathway[J]. Mol Immunol, 2017, 87: 132-140. |
| [24] |
NIETO M A, HUANG R Y J, JACKSON R A, et al. Emt: 2016[J]. Cell, 2016, 166(1): 21-45. |
| [25] |
DONG Y Y, WU Z F, HE M Y, et al. ADAM9 mediates the interleukin-6-induced Epithelial-Mesenchymal transition and metastasis through ROS production in hepatoma cells[J]. Cancer Lett, 2018, 421: 1-14. |




