2. 400042 重庆,陆军特色医学中心神经外科
2. Department of Neurosurgery, Army Medical Center of PLA, Chongqing, 400042, China
胶质母细胞瘤(glioblastoma, GB)是成人中枢神经系统最常见、最具侵袭性的恶性肿瘤,经标准治疗方案(stupp方案)治疗后,超过一半患者于术后7~10个月出现复发,中位生存期为14~16个月[1]。GB术后高复发率已成为影响患者生存预后的重要因素之一。研究证实,瘤周水肿带包含复杂的瘤周异常血管形成及肿瘤细胞浸润,因术前常规磁共振成像(magnetic resonance imaging, MRI)和术中黄荧光均难以识别,瘤周浸润的肿瘤细胞完整切除困难。研究表明,术后残余肿瘤细胞多位于切除腔2 cm范围内,易导致肿瘤复发,约80%复发性GB发生于此空间内,但也存在远距复发等空间模式[2-4]。目前,多数研究以复发灶距术腔距离是否>2 cm将空间复发模式分为原位复发与非原位复发,其中非原位复发包括远距离复发、室管膜下播散和软脑膜播散[5]。不同空间复发模式对GB患者术后进展及预后存在影响[6-8]。
MRI是颅内肿瘤首选影像学检查方法。因GB内部异质性较大,不同患者的影像学表现也存在差异[9]。磁共振表观扩散系数(apparent diffusion coefficient,ADC)图像能通过水分子表观扩散来反映肿瘤细胞的密度、瘤周浸润等信息,可直观反映组织间差异及病理变化,与病理结果具有较好的一致性。结合灰度直方图特征分析等图像处理手段能提供超出视觉范围的肿瘤微观结构的定量信息,反映肿瘤不同区域的异质性[10-13]。本研究以术前MRI瘤周2 cm水肿带ADC图像为基础,采用Mazda软件,实现对瘤周水肿区的分割及特征提取,探讨ADC灰度直方图参数对GB患者术后不同空间复发模式的预测价值,为临床术前手术切除范围、术后放疗靶区勾画及复发GB患者的临床管理提供依据。
1 对象与方法 1.1 研究对象经陆军特色医学中心伦理委员会批准[医研伦理(2022)第281号],采用病例-对照研究设计方案,收集陆军特色医学中心神经外科2012-2021年接受标准治疗(stupp方案)的156例GB患者(根据2021年WHO中枢神经系统肿瘤分类[14])的临床与影像资料,经二次病理证实或脑胶质瘤治疗反应评估标准(modified criteria for radiographic response assessment in glioblastoma,mRANO)[15]证实,复发性GB患者92例。对复发性GB患者采用以下纳入、排除标准。纳入标准:①年龄>18岁,术前未接受过任何形式的治疗且无其他脑内疾病;②术前、术后临床资料与MRI资料完整;③肿瘤病灶均位于幕上,且有明确瘤周水肿;④术后3~6个月规律随访且随访时间>6个月。排除标准:①术后未规律放化疗治疗患者;②术后出现严重并发症患者;③MRI图像质量差,不能进行图像分析。最终纳入复发性GB患者50例。
1.2 仪器与方法采用3.0 T MR扫描仪(德国Siemens Magnetom Verio公司)进行术前及随访MRI图像采集。磁共振常规成像序列包括轴位及矢状位T1加权成像(T1-weighted imaging,T1WI)、轴位T2加权成像(T2-weighted imaging,T2WI)、液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列和增强序列。功能成像包括弥散加权成像(diffusion-weighted imaging,DWI)和灌注加权成像(perfusion weighted imaging,PWI)扫描。对比剂选用钆类对比剂(钆喷酸葡胺,北京北陆药业),肘静脉穿刺后团注,剂量为0.2 mL/kg,速率为3 mL/s。各序列主要参数见表 1。
| 成像序列 | 重复时间/ms | 回波时间/ms | 层厚/mm | 层距/mm | 矩阵 | 视野/mm |
| T1WI | 268 | 2.7 | 3.0 | 1.0 | 320×320 | 230×230 |
| T2WI | 3 800 | 96 | 3.0 | 1.0 | 320×320 | 230×230 |
| FLAIR | 6 500 | 102 | 3.0 | 1.0 | 320×320 | 230×230 |
| T1C+ | 268 | 2.7 | 3.0 | 1.0 | 320×320 | 230×230 |
| DWI | 5 800 | 95 | 3.0 | 1.0 | 320×320 | 230×230 |
| PWI | 1 500 | 30 | 5.0 | 1.0 | 320×320 | 230×230 |
1.3 患者随访及复发模式分析
GB患者术后72 h内行CT或MRI检查,定期3~6个月行MRI复查。肿瘤复发主要依据mRANO标准,并记录患者第一次手术与复发的时间间隔,即为无进展生存期(progression-free survival,PFS)。从第一次手术到死亡或最后一次随访的时间为总生存期(overall survival, OS)。随访截止时间为2022年6月。
对复发空间模式的判定以复发灶距术腔距离是否>2 cm为参考标准,分为原位复发与非原位复发(图 1),非原位复发包括远距离复发、室管膜下播散和软脑膜播散。空间复发模式的判定由两名高年资神经影像医师独立进行,意见有分歧时通过协商达成一致。
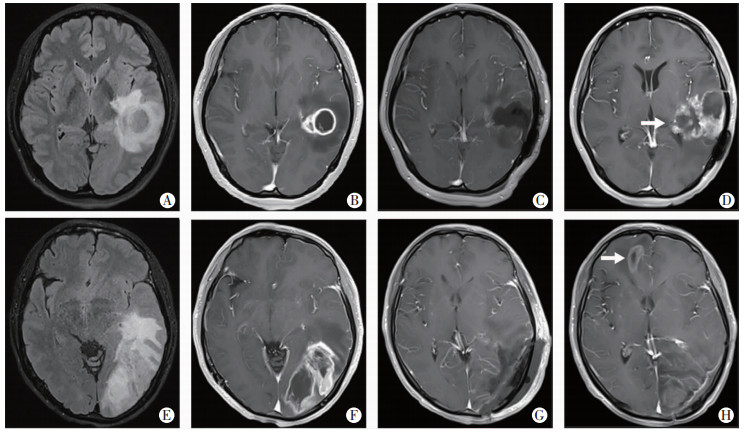
|
| A~D:左侧颞叶GB原位复发患者MRI表现(女,30岁);A:术前FLAIR图像(示病灶呈混杂信号,瘤周见环形水肿带);B:术前增强图像(示病灶呈环形强化);C:术后72 h内增强图像(示肿瘤全切,术腔未见异常强化影);D:术后12个月复查增强图像箭头:示肿瘤复发,主要位于术腔周围;E~H:左侧颞枕叶GB非原位复发患者MRI表现(男,52岁);E:术前FLAIR图像(示瘤周大片状水肿带);F:术前增强图像(示病灶呈不均匀环形强化);G:术后72 h内增强图像(示肿瘤全切,术腔未见异常强化影);H:术后3个月复查增强图像箭头:示复发病灶位于右侧额叶 图 1 原位与非原位复发组示例患者MRI图像 |
1.4 ADC灰度直方图分析
选取术前轴位MRI增强图像上肿瘤强化最大层面对应的ADC图像,采用Mazda软件在ADC图像上沿瘤周水肿带2 cm范围内边缘勾画感兴趣区(region of interest,ROI)并填充(图 2)。对ROI勾画并特征提取的观测者自身和观测者间一致性检验由2名医生独立完成。由第1名医生勾画ROI并提取特征,1周后再次勾画ROI并提取特征,用于观测者自身一致性评估;第2名医生完成1次ROI勾画用于观测者间一致性评估。软件生成灰度直方图,计算平均值、方差、偏度、峰度、第1百分位数、第10百分位数、第50百分位数、第90百分位数、第99百分位数,共9个特征参数。
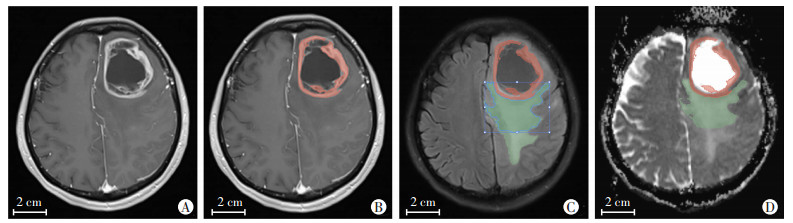
|
| A:术前轴位MRI增强图像上肿瘤强化范围最大层面;B:肿瘤强化边缘(红色区域);C:FLAIR图像肿瘤瘤周水肿带范围绿色区域:示瘤周水肿带范围蓝框区域:示用测量工具划定的瘤周2 cm水肿带;D:ADC图像肿瘤瘤周2 cm水肿带范围绿色区域:最终ROI勾画 图 2 瘤周水肿带ROI选取示意图 |
1.5 统计学分析
采用SPSS 21.0软件进行统计分析。年龄等计量资料符合正态分布者以x±s表示,两组间比较采用独立样本t检验;不符合正态分布者以M(P25,P75)表示,两组间比较采用Mann-Whitney U 检验。性别、肿瘤原发部位等计数资料采用例数(%)表示,采用χ2检验。以P < 0.05为差异有统计学意义。组间相关系数(intraclass correlation coefficients,ICC)用于评价特征提取时观测者自身及观测者间一致性,ICC>0.75的特征参数纳入研究。生存分析应用Kaplan-Meier法,生存时间的差异应用log-rank法进行单因素分析。对差异有统计学意义的直方图参数建立ROC曲线并获得AUC,确定最佳临界值及其对应的敏感度、特异度。多因素Logistic回归分析对有统计学意义的直方图参数进行建模,原位复发组与非原位复组被列为分类响应变量,再通过ROC曲线评估模型效能。
2 结果 2.1 一般临床资料50例复发性IDH野生型GB患者中,原位复发组有患者28例,其中男性20例,年龄为(50.1±11.8)岁,中位PFS为6.6个月,中位OS为15.4个月。肿瘤原发部位局限单叶生长16例(额叶4例,顶叶2例,颞叶9例,枕叶1例),跨叶生长12例;非原位复发组有患者22例(远距离复发16例,室管膜下播散1例,软脑膜播散5例),其中男性11例,年龄为(51.9±13.5)岁,中位PFS为4.6个月,中位OS为12.4个月。肿瘤原发部位局限单叶生长13例(额叶7例,顶叶3例,颞叶3例),跨叶生长9例。在原位、非原位复发组两组间性别、年龄、手术方式、术前KPS评分、肿瘤原发部位差异均无统计学意义(表 2)。生存分析结果显示,PFS(log-rank χ2=4.325,P=0.038)、OS(log-rank χ2=4.022,P=0.045)在两组间差异有统计学意义(P < 0.05,图 3)。
| 临床指标 | 原位复发 (n=28) |
非原位复发 (n=22) |
t/χ2 | P |
| 年龄/岁 | 50.1±11.8 | 51.9±13.5 | 0.493 | 0.624 |
| 性别 | 2.401 | 0.121 | ||
| 男性 | 20(71.4) | 11(50.0) | ||
| 女性 | 8(28.6) | 11(50.0) | ||
| 手术方式 | 0.012 | 0.912 | ||
| 全切 | 22(78.6) | 17(77.3) | ||
| 次全切 | 6(21.4) | 5(22.7) | ||
| 术前KPS评分 | 0.062 | 0.804 | ||
| ≥70分 | 20(71.4) | 15(68.2) | ||
| < 70分 | 8(28.6) | 7(31.8) | ||
| 肿瘤原发部位 | 0.019 | 0.890 | ||
| 单叶生长 | 16(57.1) | 13(59.1) | ||
| 跨叶生长 | 12(42.9) | 9(40.9) |
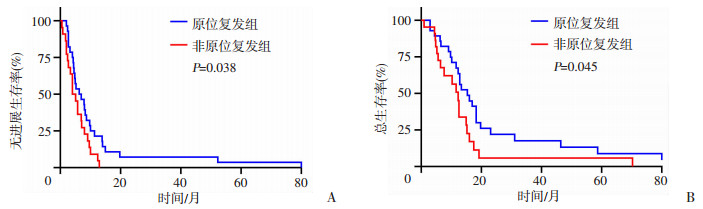
|
| 图 3 GB不同空间复发模式的Kaplan-Meier生存曲线 |
2.2 两种不同空间复发模式的灰度直方图参数比较
ADC灰度直方图(横坐标代表ROI内不同灰度值,纵坐标代表体素在各灰度值的频率)见图 4。除偏度外,其余各特征参数在观测者自身及观测者间具有较好的一致性(表 3)。各特征参数定量分析结果见表 4。在9个特征参数中,方差、峰度、第90百分位数3个参数在两组间差异有统计学意义(P < 0.05)。方差表示图像灰度分布的离散程度,原位复发组方差为(727.70±239.45),非原位复发组为(480.31±209.22),在直方图上原位复发组灰度频数分布更为离散。峰度值表示图形分布尖锐或平坦度,原位复发组峰度为-0.26(-0.54,-0.06),其均值为负(-0.31±0.31),直方图图形为平坦峰;非原位复发组峰度为-0.05(-0.34,1.27),其均值为正(0.59±1.39),图形分布为尖顶峰。第90百分位数表示低于该百分位数点的体素分布占比,直方图显示原位复发组体素在该范围分布更广。
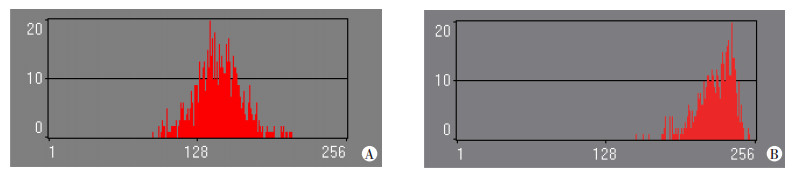
|
| 图 4 原位(A)和非原位(B)复发示例患者感兴趣区ADC灰度直方图 |
| 测量参数 | 观测者间ICC指数 | 观测者内ICC指数 |
| 平均值 | 0.933(0.882~0.962) | 0.970(0.948~0.983) |
| 方差 | 0.962(0.933~0.979) | 0.917(0.858~0.952) |
| 偏度 | 0.586(0.278~0.764) | 0.785(0.650~0.872) |
| 峰度 | 0.771(0.599~0.870) | 0.890(0.814~0.936) |
| 第1百分位数 | 0.855(0.745~0.917) | 0.865(0.773~0.921) |
| 第10百分位数 | 0.906(0.835~0.947) | 0.927(0.876~0.958) |
| 第50百分位数 | 0.926(0.869~0.958) | 0.971(0.950~0.984) |
| 第90百分位数 | 0.962(0.933~0.978) | 0.971(0.949~0.983) |
| 第99百分位数 | 0.926(0.869~0.958) | 0.906(0.840~0.945) |
| 参数 | 原位复发组(n=28) | 非原位复发组(n=22) | t/Z | P |
| 平均值 | 159.26±15.52 | 149.21±26.50 | -1.677 | 0.100 |
| 方差 | 727.70±239.45 | 480.31±209.22 | -3.830 | <0.001 |
| 偏度 | -0.36±0.35 | -0.35±0.59 | 0.103 | 0.919 |
| 峰度 | -0.26(-0.54,-0.06) | -0.05(-0.34,1.27) | -2.072 | 0.038 |
| 第1百分位数 | 95.39±16.29 | 94.36±19.80 | -0.202 | 0.841 |
| 第10百分位数 | 122.43±17.186 | 121.45±25.11 | -0.163 | 0.872 |
| 第50百分位数 | 161.54±16.80 | 150.23±27.80 | -1.682 | 0.102 |
| 第90百分位数 | 192.11±15.93 | 175.36±27.85 | -2.515 | 0.015 |
| 第99百分位数 | 203.00(197.00, 222.75) | 190.00(174.50, 224.75) | -1.877 | 0.061 |
其余6个特征参数(平均值、偏度、第1百分位数、第10百分位数、第50百分位数、第99百分位数)两组间差异无统计学意义。
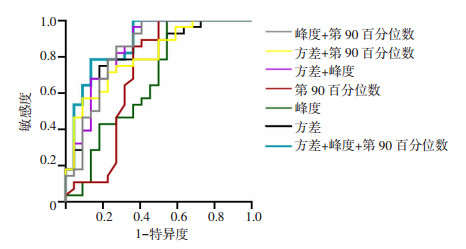
2.3 灰度直方图参数ROC曲线及多因素Logistic回归分析ROC曲线分别分析方差、峰度、第90百分位数3个特征参数在原位与非原位复发组间的诊断效能(图 5)。当方差为606.10时,其对应的敏感度和特异度分别为75.00%、81.82%;当峰度为3.62时,其对应的敏感度和特异度分别为100.00%、45.45%;当第90百分位数为168.50时,其对应的敏感度和特异度分别为100.00%、50.00%。上述3个参数中,方差的AUC最大(AUC=0.804),具有最佳诊断效能。基于方差、峰度、第90百分位数3个参数两两或3个联合构建的4种多因素Logistic回归模型,ROC分析结果表明4种模型在原位与非原位复发组间差异均有统计学意义(P < 0.05),以方差、峰度、第90百分数3个参数联合构建的Logistic回归模型的诊断效能最佳,AUC为0.878,诊断敏感度为78.57%,特异度为86.36%(表 5)。
|
| 图 5 原位与非原位复发组间灰度直方图有统计学意义的参数及多参数联合ROC曲线分析 |
| 参数 | AUC | 敏感度(%) | 特异度(%) | 约登指数 | 阳性似然比 | 阴性似然比 | 阳性预测值(%) | 阴性预测值(%) |
| 方差 | 0.804 | 75.00 | 81.82 | 0.568 | 4.13 | 0.31 | 84.00 | 72.00 |
| 峰度 | 0.627 | 100.00 | 45.45 | 0.455 | 1.83 | 70.00 | 100.00 | |
| 第90百分位数 | 0.703 | 100.00 | 50.00 | 0.500 | 2.00 | 71.79 | 100.00 | |
| 方差+峰度 | 0.846 | 96.43 | 63.64 | 0.601 | 2.65 | 0.06 | 77.14 | 93.33 |
| 方差+第90百分位数 | 0.804 | 71.43 | 77.27 | 0.487 | 3.14 | 0.37 | 80.00 | 68.00 |
| 峰度+第90百分位数 | 0.836 | 100.00 | 59.09 | 0.591 | 2.44 | 75.68 | 100.00 | |
| 方差+峰度+第90百分位数 | 0.878 | 78.57 | 86.36 | 0.649 | 5.76 | 0.25 | 88.00 | 75.00 |
3 讨论
本研究发现,GB复发存在不同空间模式,且不同空间复发模式的GB患者生存预后存在差异。术前磁共振ADC直方图特征参数有助于预测GB术后空间复发模式。
既往研究发现,非原位复发组GB术后进展较快、预后更差。本研究中,原位复发组PFS、OS均长于非原位复发组(中位PFS:6.6 vs 4.6个月;中位OS:15.4 vs 12.4个月;P < 0.05),该结果与JIANG等[7]报道结果一致。部分研究认为,根治性手术切除仅有利于GB术后局部复发的控制,因远处浸润的肿瘤细胞一般密度较低[7-8],术前MRI难以发现,这可能是GB非原位复发患者预后较差的原因之一。
GB恶性程度高,侵袭性强,已证实瘤周水肿浸润的肿瘤细胞密度呈由瘤体向外周递减的阶梯式分布[16-17],且80%的GB复发于瘤周水肿带区2 cm范围内,其异质性对GB空间复发模式存在影响[3-4, 18-19]。本研究通过术前瘤周2 cm水肿带ADC灰度直方图提取相关参数定量分析,可视化体素空间分布规律,其中方差、峰度、第90百分位数在两组空间复发模式间差异有统计学意义,3个参数分别反映了体素空间分布的离散度、平坦度及分布范围[20],客观反映肿瘤细胞的扩散异质性。
灰度直方图分析结果显示,原位复发组峰度均值为负,非原位复发组为正,原位复发组方差及第90百分位数均大于非原位复发组,提示原位复发组瘤周水肿带ADC图像信号分布离散、紊乱,而非原位复发组信号分布较为均匀、集中。3个参数的差异反映两组GB瘤周水肿带空间异质性不同,以原位复发组瘤周水肿带异质性更大。这可能与原位复发GB瘤周水肿带复杂的微血管环境及肿瘤细胞沿白质纤维束异常浸润有关[21]。FERRACCI等[22]研究发现,肿瘤细胞沿短U型纤维浸润并伴瘤周异常血管形成是原位复发的主要机制,通过联络、联合、投射纤维进行远距扩散,且不伴瘤周异常血管形成是非原位复发的主要机制。刘水源等[23]研究发现,原位复发者瘤周水肿轻,但肿瘤细胞主要聚集在瘤体附近,非原位复发者瘤周水肿重,肿瘤细胞向远处呈弥散均匀分布,此分布特点也可能是造成ADC图像信号分布差异的原因之一。考虑到单参数分析的局限性,本研究联合有统计学意义的灰度直方图参数构建Logistic回归模型可进一步提高诊断效能,其中以方差、峰度、第90百分位数联合构建的模型诊断效能最佳。
综上所述,GB术前MRI瘤周2 cm水肿带ADC灰度直方图可作为评估胶质瘤术后不同空间复发模式的影像学标记,为临床制订更优的治疗方案提供了量化依据,有潜在的应用前景。但本研究尚存在以下不足:①本研究作为病例-对照研究,研究样本数量有限,特别是非原位复发模式组的样本量小,可能存在选择性偏倚,下一步将在多中心大样本量的研究中进一步验证。②选取单一层面图像勾画感兴趣区可能会导致数据采集不均衡、不全面。下一步将在全体素特征参数的研究中进一步优化。
| [1] |
MCKINNON C, NANDHABALAN M, MURRAY S A, et al. Glioblastoma: clinical presentation, diagnosis, and management[J]. Br Med J, 2021, 374: n1560. |
| [2] |
QIU J, DENG K X, WANG P, et al. Application of diffusion kurtosis imaging to the study of edema in solid and peritumoral areas of glioma[J]. Magn Reson Imaging, 2022, 86: 10-16. |
| [3] |
KHALAFALLAH A M, RAKOVEC M, BETTEGOWDA C, et al. A crowdsourced consensus on supratotal resection versus gross total resection for anatomically distinct primary glioblastoma[J]. Neurosurgery, 2021, 89(4): 712-719. |
| [4] |
CANTIDIO F S, GIL G O B, QUEIROZ I N, et al. Glioblastoma—treatment and obstacles[J]. Rep Pract Oncol Radiother, 2022, 27(4): 744-753. |
| [5] |
刘毛毛, 贺业新. MRI预测高级别胶质瘤术后复发模式的研究进展[J]. 磁共振成像, 2021, 12(12): 99-101. LIU M M, HE Y X. Research progress of magnetic resonance imaging in predicting postoperative recurrence patterns of high-grade gliomas[J]. Chin J Magn Reson Imaging, 2021, 12(12): 99-101. |
| [6] |
PIPER R J, SENTHIL K K, YAN J L, et al. Neuroimaging classification of progression patterns in glioblastoma: a system- atic review[J]. J Neurooncol, 2018, 139(1): 77-88. |
| [7] |
JIANG H H, YU K F, LI M X, et al. Classification of progression patterns in glioblastoma: analysis of predictive factors and clinical implications[J]. Front Oncol, 2020, 10: 590648. |
| [8] |
TOH C H, LIAU C T, WEI K C, et al. Baseline multicentric tumors, distant recurrences and leptomeningeal dissemination predict poor survival in patients with recurrent glioblastomas receiving bevacizumab[J]. J Neurooncol, 2019, 142(1): 149-159. |
| [9] |
周波, 童海鹏, 陈晓, 等. 多模态MRI评价胶质母细胞瘤中组织因子表达水平的价值[J]. 第三军医大学学报, 2020, 42(3): 307-313. ZHOU B, TONG H P, CHEN X, et al. Value of multimodal MRI in evaluation of tissue factor expression in glioblastoma[J]. J Third Mil Med Univ, 2020, 42(3): 307-313. |
| [10] |
LEWIS M A, GANESHAN B, BARNES A, et al. Filtration-histogram based magnetic resonance texture analysis (MRTA) for glioma IDH and 1p19q genotyping[J]. Eur J Radiol, 2019, 113: 116-123. |
| [11] |
GAO A K, ZHANG H T, YAN X, et al. Whole-tumor histo- gram analysis of multiple diffusion metrics for glioma genotyping[J]. Radiology, 2022, 302(3): 652-661. |
| [12] |
ZHANG H W, LYU G W, HE W J, et al. Differential diagnosis of central lymphoma and high-grade glioma: dynamic contrast-enhanced histogram[J]. Acta Radiol, 2020, 61(9): 1221-1227. |
| [13] |
HU Y, CHEN Y, WANG J, et al. Non-invasive estimation of glioma IDH1 mutation and VEGF expression by histogram analysis of dynamic contrast-enhanced MRI[J]. Front Oncol, 2020, 10: 593102. |
| [14] |
LOUIS D N, PERRY A, WESSELING P, et al. The 2021 WHO classification of tumors of the central nervous system: a summary[J]. Neuro Oncol, 2021, 23(8): 1231-1251. |
| [15] |
ELLINGSON B M, WEN P Y, CLOUGHESY T F. Modified criteria for radiographic response assessment in glioblastoma clinical trials[J]. Neurotherapeutics, 2017, 14(2): 307-320. |
| [16] |
BLYSTAD I, WARNTJES J B M, SMEDBY Ö, et al. Quantitative MRI for analysis of peritumoral edema in malignant gliomas[J]. PLoS One, 2017, 12(5): e0177135. |
| [17] |
VELÁSQUEZ C, MANSOURI S, MORA C, et al. Mole cular and clinical insights into the invasive capacity of glioblastoma cells[J]. J Oncol, 2019, 2019: 1740763. |
| [18] |
TU Z W, XIONG H F, QIU Y, et al. Limited recurrence distance of glioblastoma under modern radiotherapy era[J]. BMC Cancer, 2021, 21(1): 720. |
| [19] |
AUER T A, KERN M, FEHRENBACH U, et al. T2 mapping of the peritumoral infiltration zone of glioblastoma and anaplastic astrocytoma[J]. Neuroradiol J, 2021, 34(5): 392-400. |
| [20] |
王佳, 胡春洪, 王希明. 基于ADC灰度直方图分析鉴别颅内孤立性纤维瘤/血管外皮瘤和血管型脑膜瘤[J]. 放射学实践, 2020, 35(2): 154-158. WANG J, HU C H, WANG X M. ADC-based gray histogram analysis for differentiating between solitary fibrous tumor/hemangiopericytoma and hemangioma meningioma[J]. Radiol Pract, 2020, 35(2): 154-158. |
| [21] |
STADLBAUER A, KINFE T M, EYVPOGLU I, et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans[J]. Clin Cancer Res, 2021, 27(6): 1641-1649. |
| [22] |
FERRACCI F X, MICHAUD K, DUFFAU H. The landscape of postsurgical recurrence patterns in diffuse low-grade gliomas[J]. Crit Rev Oncol, 2019, 138: 148-155. |
| [23] |
刘水源, 刘盛泽, 林志雄, 等. 初诊脑胶质瘤MRI影像上的PTBE特征对全切术后肿瘤复发部位趋向及形态的影响[J]. 国际医药卫生导报, 2017, 23(19): 2967-2969, 2974. LIU S Y, LIU S Z, LIN Z X, et al. Influence of features of peritumoral brain edema in MRI of brain glioma on recurrence sites and morphology after total resection[J]. Int Med Health Guid News, 2017, 23(19): 2967-2969, 2974. |




