炎症性肠病(inflammatory bowel disease,IBD)是一组病因尚不明确的肠道慢性非特异性炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。在过去的十年里,全球(特别是亚洲和非洲)IBD患者数量正在增加,因此IBD已经成为一个世界性的公共卫生问题[1]。IBD的损害和症状是不同的,CD可以扩散到整个胃肠道,患者可能会出现腹痛、腹泻、体质量减轻和发热;而溃疡性结肠炎一般只影响结直肠,一般症状为结直肠出血、频繁排便、里急后重和下腹痛[2]。UC与使用PD-L1抑制剂后所出现的免疫介导性肠炎(immune-mediated colitis,IMC)在临床和内镜下表现以及组织病理学表型上均具有极高的相似性,若不结合用药史常难以区分[3]。程序性死亡受体-1(programmed cell death protein 1,PD-1)是一种表达在多种免疫细胞的免疫球蛋白基因超家族成员,PD-L1作为其配体,与PD-1结合后抑制活化的CD4+和CD8+效应T细胞的增殖,在黏膜对共生菌和食物抗原的耐受中起着重要作用[4-5]。目前的研究证明,UC的发病与肠黏膜的免疫平衡被打破存在着重要联系,其中调节性T细胞与辅助T17细胞(Treg/Th17细胞)的失衡起着至关重要的作用[6],而肠黏膜的免疫平衡与PD-1/PD-L1通路密切相关[7-8],这提示我们PD-L1可能在UC的发病机制中也扮演着重要的角色。
但PD-L1在UC患者肠黏膜的表达情况仍存在争议,有研究[9-10]表明PD-L1在UC患者肠黏膜中上调明显,也有研究者认为PD-L1在UC患者与正常人之间表达并无差异[11]。因此本研究首先检测PD-L1在UC患者结肠黏膜中的表达水平,并建造了DSS肠炎的小鼠模型,对小鼠进行腹腔内注射PD-L1-Fc蛋白后观察相应指标的变化,初步探究PD-L1在实验性结肠炎动物模型的表达情况及其可能作用,为探讨UC的发病机制及其潜在的治疗方法提供新的思路。
1 材料与方法 1.1 UC标本来源收集2022年1-9月于陆军军医大学第一附属医院消化内科肠镜室就诊的18~64岁的UC患者结肠组织标本29例,同期收集非UC患者结肠组织标本22例(取自病变最明显处),病例诊断符合2018年《炎症性肠病诊断与治疗的共识意见》,疾病活动性的评估采用改良梅奥(Mayo)评分(评分方式见表 1)。20例UC患者及12例非UC患者标本制成病理切片,15例UC和10例非UC患者标本提取mRNA,其中3例UC患者及1例非UC患者组织标本同时制作了病理切片也提取了mRNA,研究方案经陆军军医大学第一附属医院伦理委员会审核批准[批件号: (A)KY202261],研究对象对标本采集均知情同意。
| 评分项目 | 0分 | 1分 | 2分 | 3分 |
| 排便次数 | 正常 | 比正常增加1~2次/d | 比正常增加3~4次/d | 比正常增加5次/d或以上 |
| 便血 | 未见出血 | 不到一半时间出现便中混血 | 大部分时间便中混血 | 一直存在出血 |
| 内镜发现 | 正常或无活动性病变 | 轻度病变(红斑、血管纹理减少、轻度易脆) | 中度病变(明显红斑、血管纹理缺乏、易脆、糜烂) | 重度病变(自发性出血,溃疡形成) |
| 医师总体评价 | 正常 | 轻度病情 | 中度病情 | 重度病情 |
1.2 实验动物及分组
8~10周龄C57BL/6雄性小鼠24只,SPF级,体质量23~26 g,购自成都药康生物科技有限公司,动物生产许可证号:SCXK(川)2020-034。动物饲养于陆军军医大学复合伤研究所动物房,使用许可证号:SYXK(渝)2017-0002,恒温恒湿,自由饮水摄食,适应性饲养1周后开始实验。将24只小鼠分为:①空白对照组(n=4),自由摄食水。②PD-L1-Fc组(n=4),自由摄食水后第3天腹腔注射PD-L1-Fc蛋白(1 mg/mL)40 μg/只。③DSS组(n=8),2.5%DSS溶液自由饮用7 d换正常饮用水。④DSS+PD-L1-Fc组(n=8),2.5%DSS溶液自由饮用7 d换正常饮水,第3天腹腔注射PD-L1-Fc蛋白(1 mg/mL)40 μg/只。
1.3 小鼠结肠镜检查实验取材当天上午禁食6 h后使用高分辨率的小鼠视频内窥镜系统(Karl STORZ,Tuttlingen,德国)对实验小鼠进行结肠镜检查。用1.5%~2.0%的异氟醚麻醉小鼠,然后用空气充气以显示近端结肠3 cm。根据以下参数对结肠炎的严重程度进行盲法评分(分):结肠半透明0~3,肠壁上附着纤维蛋白0~3,黏膜颗粒状0~3,血管形态0~3;粪便特征:正常至腹泻0~3,管腔内有血液0~3,最高得分为18[12]。
1.4 动物标本采集及处理每日观察记录小鼠体质量、大便性状、血便情况,进行疾病活动指数(disease activity index,DAI)评分,评分标准为:体质量下降率(0~1%:0分,>1%~5%:1分,6%~10%:2分,11%~18%:3分,>18%:4分)、粪便黏稠度(正常0分,软1分,黏液便2分,稀便3分,稀水样便4分)及粪便潜血(阴性0分,浅蓝1分,蓝色2分,深蓝3分,肉眼血便4分)。PD-L1-Fc组于腹腔注射PD-L1-Fc蛋白后36 h取材,其余组在给予DSS后8~10 d取材,取材前脱颈椎处死;分离结肠组织,测量结肠长度。剪取部分结肠组织(肠道两端)迅速放入液氮中冷冻,-80 ℃冰箱保存备用,其余部分固定于含Zinc的EP管内。
1.5 主要试剂RT-qPCR试剂:RNAiso Plus,PrimeScript RT reagent Kit with gDNA Eraser,TB Green Premix Ex TaqⅡ (TaKaRa),引物详见表 2。免疫组化试剂:鼠抗人PD- L1单克隆抗体(66248-1-Ig武汉三鹰生物技术有限公司);山羊抗鼠二抗、山羊抗兔二抗/DAB显色试剂盒(购于北京中杉金桥生物技术有限公司);Western blot试剂:PD-L1单克隆抗体(66248-1-Ig)、GAPDH-HRP单克隆抗体(HRP-60004)购于武汉三鹰生物技术有限公司,兔抗人TNF-α多克隆抗体(BS6000)购于巴傲得生物科技有限公司,电泳凝胶试剂盒、电泳液购自上海雅酶生物医药公司;DSS购于MP Biomedical公司。
| 基因 | 上游引物 | 下游引物 |
| Human PD-L1 | 5'-CTGCACTTTTAGGAGATTAGATC-3' | 5'-CTACACCAAGGCATAATAAGATG-3' |
| Human TGFβ1 | 5'-AGCTGTACCAGAAATACAGCA-3' | 5'-ATAACCACTCTGGCGAGTC-3' |
| Human IL-6 | 5'-GGAGACTTGCCTGGTGAAA-3' | 5'-CTGGCTTGTTCCTCACTACTC-3' |
| Human IL-1β | 5'-CCTGTGGCCTTGGGCCTCAA-3' | 5'-GGTGCTGATGTACCAGTTGGG-3' |
| Human IL17a | 5'-GAGGACAAGAACTTCCCCCG-3' | 5'-ACGTTCCCATCAGCGTTGAT-3' |
| Human GAPDH | 5'-GTGAAGGTCGGAGTCAACG-3' | 5'-TGAGGTCAATGAAGGGGTC-3' |
| Mouse IL-1β | 5'-CCTCGTGCTGTCGGACCCATA-3' | 5'-CAGGCTTGTGCTCTGCTTGTGA-3' |
| Mouse IL-6 | 5'-TAGTCCTTCCTACCCCAATTTCC-3' | 5'-TTGGTCCTTAGCCACTCCTTC-3' |
| Mouse IL-22 | 5'-ATGAGTTTTTCCCTTATGGGGAC-3' | 5'-GCTGGAAGTTGGACACCTCAA-3' |
| Mouse Foxp3 | 5'-TGAACTCCTCCCTGCTCCTCCT-3' | 5'-CCTAATGCCTCCCAGAGCCCAT-3' |
| Mouse IL-17a | 5'-CACCTCACACGAGGCACAAGTG-3' | 5'-TCAGCAGCAGCAACAGCATCAG-3' |
| Mouse GAPDH | 5'-CAGTGGCAAAGTGGAGATTGTTG-3' | 5'-TCGCTCCTGGAAGATGGTGAT-3' |
1.6 方法 1.6.1 免疫组化
检测患者及DSS小鼠肠黏膜PD-L1表达:肠组织标本制成3 μm连续切片。切片常规脱蜡、水化、抗原修复、阻断、封闭后加入PD-L1鼠抗人单克隆抗体(工作浓度1 ∶1 000) 4 ℃孵育过夜,孵育二抗后DAB显色。结果判定:在非肿瘤细胞中,光学显微镜下见细胞质/细胞膜染色为阳性细胞[13]。在双盲条件下,由2名医师在80倍视野下随机选取5个清晰无折叠的视野,计数阳性细胞数。
1.6.2 RT-qPCR检测患者肠黏膜PD-L1及促炎因子IL-1β、IL-6、IL-17a,抗炎因子IL-22、TGF-β1的mRNA水平,检测小鼠肠组织促炎因子IL-1β、IL-6、IL-17a,抗炎因子IL-22及Foxp3的mRNA水平,将收集到的结肠组织提取总RNA,RT-PCR检测PD-L1及相关细胞因子的表达情况。mRNA的相对水平以对应标本的GAPDH作为内参,采用2-ΔΔCt计算。
1.6.3 Western blot检测将速冻的肠道组织充分研磨后提取肠道总蛋白,蛋白样品在SDS-PAGE凝胶进行电泳分离,随后转印至PVDF膜,用5%脱脂奶粉于室温摇床封闭1 h,加入配置好的一抗PD-L1(1 ∶5 000),TNF-α(1 ∶1 000)于4 ℃摇床孵育过夜,洗净后加入配置好的二抗于4 ℃摇床孵育2 h,使用VILBER显色仪显色成像并测量灰度值。
1.7 统计学分析采用GraphPad Prism 8.0统计软件进行数据分析;计量资料以x±s表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用t检验,组间关联采用Pearson相关性分析;以 P < 0.05为差异有统计学意义。
2 结果 2.1 患者的一般情况及病情评分共29名UC患者及22例非UC患者(对照组)的病例资料被纳入研究,病例组性别构成和年龄与相应对照组间差异无统计学意义(P>0.05,表 3)。
| 变量 | 对照组(n=22) | UC(n=29) |
| 年龄 | ||
| < 18~40岁 | 11(50) | 14(48) |
| >40岁 | 11(50) | 15(52) |
| 性别 | ||
| 男性 | 14(63.6) | 17(58.6) |
| 女性 | 8(36.4) | 12(41.4) |
| 病情分度 | ||
| 轻度活动 | 0 | 6(15) |
| 中度活动 | 0 | 16(65) |
| 重度活动 | 0 | 7(20) |
| 缓解期 | 0 | 0 |
2.2 免疫组化明确PD-L1在UC患者结肠黏膜表达情况
HE染色示UC患者结肠黏膜内大量淋巴、浆细胞浸润,可见腺体分支、隐窝缩短等慢性损伤性改变,免疫组化结果显示,UC患者结肠黏膜可见大量胞膜或胞质呈棕黄色和黄色的PD-L1阳性细胞,较对照组着色细胞数明显增多(P < 0.000 1),着色部位多位于固有层,且以淋巴小结处表达升高最为显著(图 1)。UC组患者Mayo评分与PD-L1的表达量存在正相关趋势。
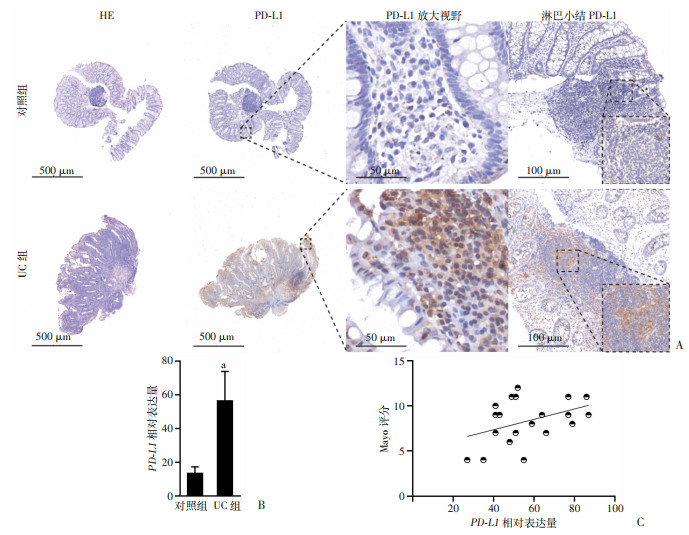
|
| A:免疫组化染色检测PD-L1表达量;B:PD-L1相对表达量 a: P < 0.000 1,与对照组比较;C:Pearson相关性分析统计UC患者Mayo评分与PD-L1表达量的关系 图 1 PD-L1在UC组与对照组患者结肠黏膜表达情况比较(对照组n=12,UC组n=20,x±s) |
2.3 UC患者肠黏膜mRNA水平PD-L1及炎症因子IL-6、IL-1β、IL-17a、IL-22、TGF-β1表达情况
RT-qPCR结果表明,相较对照组而言,UC结肠黏膜PD-L1仍有不同程度的升高(P < 0.05,图 2A),促炎因子IL-6、IL-1β、IL-17a升高(P < 0.05),而抗炎因子IL-22、TGF-β1同样升高(P < 0.05,图 2B~2F),其中仅TGF-β1与PD-L1的表达呈正相关(P < 0.05,图 2G)。

|
| a:P < 0.05,与对照组比较 A:PD-L1 mRNA;B:IL-6 mRNA;C:IL-1β mRNA;D:IL-17a mRNA;E:IL-22 mRNA;F:TGF-β1 mRNA;G:Pearson相关性分析统计TGF-β1与PD-L1表达量的关系(r=0.87,P < 0.001) 图 2 UC组及对照组结肠黏膜PD-L1、IL-6、IL-1β、IL-17a、IL-22、TGF-β1 mRNA表达水平比较(对照组n=11,UC组n=15,x±s) |
2.4 DSS诱导的小鼠结肠炎模型中PD-L1表达情况
Western blot示DSS组小鼠结肠黏膜中PD-L1表达较空白对照组明显升高(P < 0.05,图 3A、B),免疫组化也有相同现象(P < 0.05),且以组织损伤严重部位着色最显著(图 3C)。
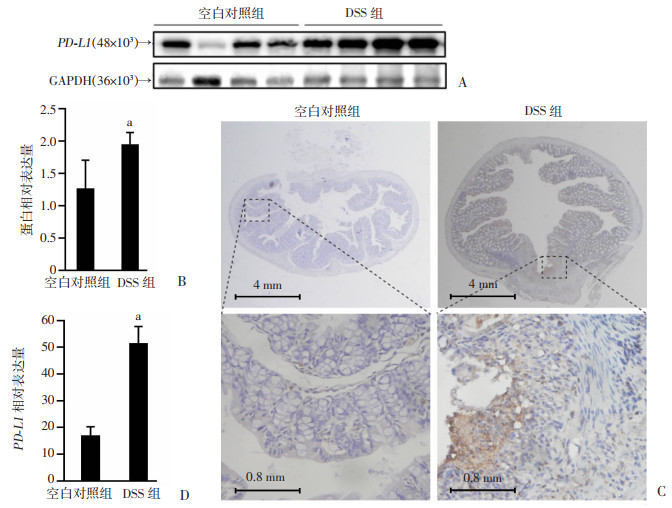
|
| a: P < 0.05,与空白对照组比较 A:Western blot检测PD-L1表达量;B:PD-L1蛋白相对表达水平;C:免疫组化检测PD-L1表达情况;D:PD-L1表达定量分析 图 3 空白对照组与DSS组小鼠结肠PD-L1表达水平比较(n=4,x±s) |
2.5 PD-L1-Fc蛋白对小鼠的全身状况及肠道表型影响
腹腔注射PD-L1-Fc蛋白后,DSS+PD-L1-Fc组小鼠的体质量下降率(图 4A,P < 0.05)、DAI评分(图 4B,P < 0.05)及结肠长度(图 4D,P < 0.05)较DSS组均显著改善。肠镜显示DSS+PD-L1-Fc组小鼠肠黏膜相对DSS组更加光滑,纤维蛋白覆着及溃疡更少见,肠镜评分更低(图 4G、H,P < 0.05)。HE染色可以观察到DSS组小鼠的结肠黏膜明显受损,隐窝结构破坏,深大溃疡形成,黏膜下层有大量炎性细胞浸润,而DSS+PD-L1-Fc组小鼠受损程度较DSS组小鼠明显减轻,病理评分更低(图 4E、F,P < 0.05)。
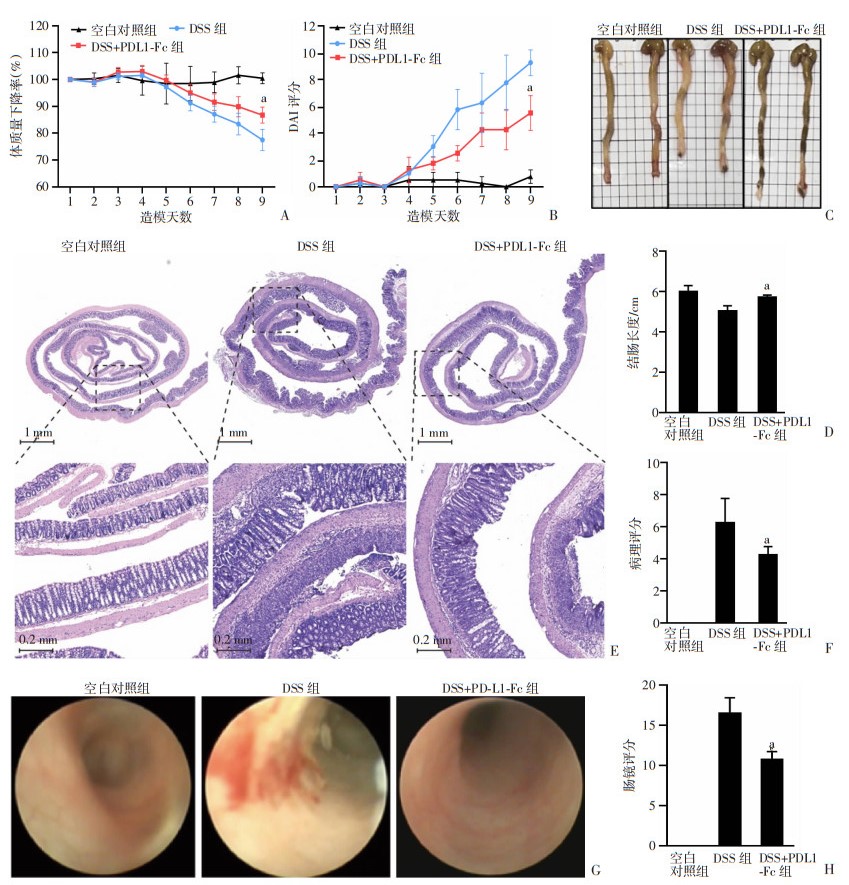
|
| a: P < 0.05,与DSS组比较 A:体质量变化率;B:DAI评分;C、D:结肠长度比较及统计;E、F:结肠HE染色及病理评分;G、H:肠镜观察结果及内镜评分 图 4 PDL1-Fc蛋白对各组小鼠的全身状况及肠道表型影响(n=4,x±s) |
2.6 PD-L1-Fc蛋白对小鼠结肠炎症因子的影响
Western blot显示DSS组小鼠结肠TNF-a、PD-L1的表达量较空白对照组上调(P < 0.05),治疗后DSS+PD-L1-Fc组小鼠PD-L1及TNF-a的表达量较DSS组有下降趋势(图 5A~C)。RT-qPCR结果表明腹腔注射PD-L1-Fc蛋白后下调IL-17a、IL-6的mRNA水平(P < 0.05),IL-1β也呈下降趋势,同时上调了Foxp3、IL-22的mRNA水平(P < 0.05)。

|
| 1:空白对照组;2:PD-L1-Fc组;3:DSS组;4:DSS+PD-L1-Fc组; a: P < 0.05,与空白对照组比较;b:P < 0.05,与DSS组比较 A:Western blot检测PD-L1及TNF-α的变化;B:PD-L1;C:TNF-α;D:IL-6 mRNA;E:IL-1β mRNA;F:IL-17a mRNA;G:Fxop3 mRNA;H:IL-22 mRNA 图 5 PD-L1-Fc蛋白对小鼠结肠炎症因子的影响(n=3,x±s) |
3 讨论 3.1 PD-L1及炎症因子在UC患者结肠黏膜中表达升高
本实验证明了无论是mRNA还是蛋白水平,UC患者肠上皮PD-L1的表达均明显高于对照组。近年来部分结肠癌患者也被报道了PD-L1的高表达[14],UC在病程发展中也可能会出现癌变,那么PD-L1在UC患者肠上皮的上调会不会与癌变存在相关性?1篇纳入31 287例UC的Meta分析显示,亚洲地区UC合并结直肠癌的患病率约0.85%,随着病程延长,10年的累计风险约0.02%,20年的累计风险约4.81%[15],另一项来自澳洲的研究也显示了相似的发病率,同时他们还发现接受过肠切除术的UC患者患结肠癌的概率会明显升高[16]。而我们收集的UC患者最长病程不超过10年,且均未接受过肠切除术,肠道活检部位都未发现明显肿瘤细胞。遗憾的是本实验UC患者的Mayo评分与PD-L1的表达量不存在显著相关性,提示我们PD-L1的表达量或许无法作为一种病情提示指标。本实验中,TGF-β1作为一种可促进Treg细胞分化的因子,也是Treg细胞分泌的抗炎因子,可激活细胞内转导途径并促进肠道稳态,在我们的实验结果中显著升高,并且与PD-L1呈正相关。有研究表明其在活动性UC患者肠黏膜及血清的表达上调[17],且TGF-β1可上调PD-L1/PD-L2信号治疗DSS结肠炎[18]。因此我们推测在UC患者肠黏膜中PD-L1和TGF-β1诱导Treg细胞的产生,起到自身的适应性保护作用,但其上调不足以对抗原有的免疫及炎症破坏,其具体机制还需要进一步的实验证明。
3.2 PD-L1在DSS肠炎小鼠结肠表达升高且对DSS肠炎有治疗作用DSS肠炎模型类似于人类UC,是一种常用的动物结肠炎模型[19]。我们在DSS肠炎小鼠结肠中验证了PD-L1同样高表达,但关于PD-L1及其受体PD-1在小鼠结肠炎模型中的作用的报道仍有争议。有研究者指出,抑制PD-1对TNBS诱导的结肠炎具有保护作用[20];CURIEL等[21]证明阻断PD-L1可加重结肠炎模型小鼠的肠道炎症,而SONG等[22]进一步证明PD-L1可治疗两种不同造模方式的实验性结肠炎。本实验我们采取了腹腔注射PD-L1-Fc的方式治疗DSS结肠炎,治疗后小鼠结肠挛缩减轻,病理评分及肠道内镜评分均降低。在单独给予PD-L1-Fc蛋白后小鼠结肠PD-L1的表达上调,提示成功高表达肠组织PD-L1,但在给予PD-L1-Fc蛋白治疗DSS肠炎后小鼠结肠中PD-L1的表达反而下降,我们推测这是一种负反馈机制引起的PD-L1蛋白下调。
3.3 PD-L1-Fc可能通过调节Treg/Th17细胞平衡影响炎症因子变化减轻炎症目前认为控制UC肠道局部炎症反应的关键点之一就是诱导肠道黏膜免疫耐受,调节Treg/Th17细胞的平衡[23-24]。Foxp3与IL-17a分别是Treg细胞与Th17细胞的标志性因子,使用PD-L1-Fc治疗后,小鼠结肠Foxp3表达升高,而IL-17a表达下降。这提示我们PD-L1可能通过下调Th17细胞,上调Treg细胞从而维持免疫稳态平衡进一步治疗DSS肠炎。FRANCISCO等[25]证明PD-L1可促进原始CD4+T细胞向Treg细胞分化,结肠Treg细胞表达Foxp3是预防结肠炎的组织学征象所必需的[26-28],Foxp3可通过抑制RORγt抑制IL-17a mRNA转录,从而抑制Th17细胞的分化及功能[29]。目前的研究认为Th17细胞在IBD的发生发展过程中主要起到促炎作用,其机制可能为IL-17促进炎症因子的释放,增强黏膜免疫反应,与其他炎症因子产生协同作用进而增强炎症反应等有关[30]。其中IL-6已被证实可与TGF-β1等促进Th17细胞分化[31-33],即使没有IL-6,IL-1β也可与IL-23协同诱导致病性Th17细胞分化[34]。而TNF-α则可以通过激活Caspase-3凋亡途径增加肠上皮细胞凋亡和损伤来引起黏膜炎症[35]。我们观察到了IL-6、TNFα、IL-1β的下调,虽然部分下调缺乏统计学意义,但这种下降趋势提示了我们PD-L1可以通过抑制促炎因子进一步控制炎症。另外值得一提的是我们观察到了DSS组小鼠肠道IL-22的上调,IL-22已被证实在IBD患者血液和肠道中高表达[36],可诱导抗菌肽产生而促进抗菌免疫,并通过增加上皮细胞增殖和存活在组织修复中发挥重要作用[37],已有研究表明Th17细胞可诱导先天性淋巴细胞产生IL-22而调节肠上皮细胞的脂质代谢稳态[38],我们或许可以推测DSS肠炎模型中,PD-L1可上调Th17细胞由以上通路诱导IL-22产生从而保护结肠上皮细胞,近来钟超团队[39]发现PD-1缺乏的小鼠淋巴组织诱导细胞所产生的IL-22也随之减少最终加重小鼠结肠炎,这也进一步证明了我们的观点。
综上所述,我们从mRNA和蛋白水平证明了PD-L1在UC患者肠黏膜组织的上调,并且验证了PD-L1-Fc蛋白对DSS结肠炎模型的治疗作用,提示PD-L1的高表达或可调节Treg/Th17细胞的稳态平衡并影响炎症因子的变化而减轻DSS诱导的结肠炎,但作为免疫检查点,全身高表达PD-L1可能造成肿瘤细胞的免疫逃逸,因此靶向结肠定点释放PD-L1应当是未来治疗UC的潜在新方向。
| [1] |
NG S C, SHI H Y, HAMIDI N, et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies[J]. Lancet, 2017, 390(10114): 2769-2778. |
| [2] |
SUN M, HE C, CONG Y, et al. Regulatory immune cells in regulation of intestinal inflammatory response to microbiota[J]. Mucosal Immunol, 2015, 8(5): 969-978. |
| [3] |
SIAKAVELLAS S I, BAMIAS G. Checkpoint inhibitor colitis: a new model of inflammatory bowel disease?[J]. Curr Opin Gastroenterol, 2018, 34(6): 377-383. |
| [4] |
FREEMAN G J, LONG A J, IWAI Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J]. J Exp Med, 2000, 192(7): 1027-1034. |
| [5] |
PINCHUK I V. PD-1 ligand expression by human colonic myofibroblasts/fibroblasts regulates CD4+ T-cell activity[J]. Gastroenterology, 2008, 135(4): 1228-1237. |
| [6] |
WU W, SUN M M, ZHANG H P, et al. Prolactin mediates psychological stress-induced dysfunction of regulatory T cells to facilitate intestinal inflammation[J]. Gut, 2014, 63(12): 1883-1892. |
| [7] |
KEIR M E, BUTTE M J, FREEMAN G J, et al. PD-1 and its ligands in tolerance and immunity[J]. Annu Rev Immunol, 2008, 26: 677-704. |
| [8] |
CHULKINA M, BESWICK E J, PINCHUK I V. Role of PD-L1 in gut mucosa tolerance and chronic inflammation[J]. Int J Mol Sci, 2020, 21(23): 9165. |
| [9] |
CASSOL C A, OWEN D, KENDRA K, et al. Programmed cell death-1 (PD-1) and programmed death-ligand 1 (PD-L1) expression in PD-1 inhibitor-associated colitis and its mimics[J]. Histopathology, 2020, 77(2): 240-249. |
| [10] |
NGUYEN J, FINKELMAN B S, ESCOBAR D, et al. Overexpression of programmed death ligand 1 in refractory inflammatory bowel disease[J]. Hum Pathol, 2022, 126: 19-27. |
| [11] |
NAKAZAWA A, DOTAN I, BRIMNES J, et al. The expression and function of costimulatory molecules B7H and B7-H1 on colonic epithelial cells[J]. Gastroenterology, 2004, 126(5): 1347-1357. |
| [12] |
LIU Y J, TANG B, WANG F C, et al. Parthenolide ameliorates colon inflammation through regulating Treg/Th17 balance in a gut microbiota-dependent manner[J]. Theranostics, 2020, 10(12): 5225-5241. |
| [13] |
AKHTAR M, RASHID S, AL-BOZOM I A. PD-L1 immunostaining: what pathologists need to know[J]. Diagn Pathol, 2021, 16(1): 94. |
| [14] |
YANG Z Y, WU G C, ZHANG X, et al. Current progress and future perspectives of neoadjuvant anti-PD-1/PD-L1 therapy for colorectal cancer[J]. Front Immunol, 2022, 13: 1001444. |
| [15] |
BOPANNA S, ANANTHAKRISHNAN A N, KEDIA S, et al. Risk of colorectal cancer in Asian patients with ulcerative colitis: a systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2017, 2(4): 269-276. |
| [16] |
SELINGER C P, ANDREWS J M, TITMAN A, et al. Long-term follow-up reveals low incidence of colorectal cancer, but frequent need for resection, among Australian patients with inflammatory bowel disease[J]. Clin Gastroenterol Hepatol, 2014, 12(4): 644-650. |
| [17] |
SCHULER C, FOTI F, PERREN L, et al. Deletion of Smad7 ameliorates intestinal inflammation and contributes to fibrosis[J]. Inflamm Bowel Dis, 2022, izac221: ibd. |
| [18] |
GARO L P, AJAY A K, FUJIWARA M, et al. Smad7 controls immunoregulatory PDL2/1-PD1 signaling in intestinal inflammation and autoimmunity[J]. Cell Rep, 2019, 28(13): 3353-3366. |
| [19] |
EICHELE D D, KHARBANDA K K. Dextran sodium sulfate colitis murine model: an indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis[J]. World J Gastroenterol, 2017, 23(33): 6016-6029. |
| [20] |
XU H M, ZHOU Y L, XU J, et al. Inhibition of PD-1 protects against TNBS-induced colitis via alteration of enteric microbiota[J]. Biomed Res Int, 2021, 2021: 4192451. |
| [21] |
CURIEL T J, WEI S, DONG H D, et al. Blockade of B7-H1 improves myeloid dendritic cell-mediated antitumor immunity[J]. Nat Med, 2003, 9(5): 562-567. |
| [22] |
SONG M Y, HONG C P, PARK S J, et al. Protective effects of Fc-fused PD-L1 on two different animal models of colitis[J]. Gut, 2015, 64(2): 260-271. |
| [23] |
CHASSAING B, KUMAR M, BAKER M T, et al. Mammalian gut immunity[J]. Biomed J, 2014, 37(5): 246-258. |
| [24] |
YAMADA A, ARAKAKI R, SAITO M, et al. Role of regulatory T cell in the pathogenesis of inflammatory bowel disease[J]. World J Gastroenterol, 2016, 22(7): 2195-2205. |
| [25] |
FRANCISCO L M, SALINAS V H, BROWN K E, et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells[J]. J Exp Med, 2009, 206(13): 3015-3029. |
| [26] |
VAN DER VEEKEN J, CAMPBELL C, PRITYKIN Y, et al. Genetic tracing reveals transcription factor Foxp3-dependent and Foxp3-independent functionality of peripherally induced Treg cells[J]. Immunity, 2022, 55(7): 1173-1184. |
| [27] |
HARRISON O J, SRINIVASAN N, POTT J, et al. Epithelial-derived IL-18 regulates Th17 cell differentiation and Foxp3+ Treg cell function in the intestine[J]. Mucosal Immunol, 2015, 8(6): 1226-1236. |
| [28] |
JIANG Z Q, WU C. Reciprocal interactions between regulatory T cells and intestinal epithelial cells[J]. Front Immunol, 2022, 13: 951339. |
| [29] |
KONKEL J E, ZHANG D F, ZANVIT P, et al. Transforming growth factor-β signaling in regulatory T cells controls T helper-17 cells and tissue-specific immune responses[J]. Immunity, 2017, 46(4): 660-674. |
| [30] |
CAO H, DIAO J, LIU H, et al. The pathogenicity and synergistic action of Th1 and Th17 cells in inflammatory bowel diseases[J]. Inflamm Bowel Dis, 2022, 2022S. |
| [31] |
ALIYU M, ZOHORA F T, ANKA A U, et al. Interleukin-6 cytokine: an overview of the immune regulation, immune dysregulation, and therapeutic approach[J]. Int Immuno-pharmacol, 2022, 111: 109130. |
| [32] |
YASUDA K, TAKEUCHI Y, HIROTA K. The pathogenicity of Th17 cells in autoimmune diseases[J]. Semin Immunopathol, 2019, 41(3): 283-297. |
| [33] |
LEE J Y, HALL J A, KROEHLING L, et al. Serum amyloid A proteins induce pathogenic Th17 cells and promote inflammatory disease[J]. Cell, 2020, 180(1): 79-91. |
| [34] |
WU B, ZHANG S, GUO Z L, et al. The TGF-β superfamily cytokine activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation[J]. Immunity, 2021, 54(2): 308-323. |
| [35] |
ALFEN J S, LARGHI P, FACCIOTTI F, et al. Intestinal IFN-γ-producing type 1 regulatory T cells coexpress CCR5 and programmed cell death protein 1 and downregulate IL-10 in the inflamed guts of patients with inflammatory bowel disease[J]. J Allergy Clin Immunol, 2018, 142(5): 1537-1547. |
| [36] |
BRAND S, BEIGEL F, OLSZAK T, et al. IL-22 is increased in active Crohn's disease and promotes proinflammatory gene expression and intestinal epithelial cell migration[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 290(4): G827-G838. |
| [37] |
HUBER S, GAGLIANI N, ZENEWICZ L A, et al. IL-22BP is regulated by the inflammasome and modulates tumorigenesis in the intestine[J]. Nature, 2012, 491(7423): 259-263. |
| [38] |
MAO K R, BAPTISTA A P, TAMOUTOUNOUR S, et al. Innate and adaptive lymphocytes sequentially shape the gut microbiota and lipid metabolism[J]. Nature, 2018, 554(7691): 255-259. |
| [39] |
WU D, HU L N, HAN M W, et al. PD-1 signaling facilitates activation of lymphoid tissue inducer cells by restraining fatty acid oxidation[J]. Nat Metab, 2022, 4(7): 867-882. |




