2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院组织胚胎学教研室
2. Department of Histology and Embryology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
我国老年人群数目急剧增加,视神经老化慢性退行性病变时刻威胁着老年人群视功能[1]。髓鞘是由成熟少突胶质细胞(oligodendrocyte,OLs)的突起反复包绕轴突形成。随着髓鞘研究的不断深入,它不仅能够绝缘轴突,保证动作电位的快速传导,同时也能为轴突提供能量,维持轴突的正常功能。但髓鞘在视神经老化慢性退行性病变中的改变还尚不清楚。
氯马斯汀是第一代抗组胺剂,与组胺竞争结合H1受体来缓解过敏反应的症状[2]。近期研究发现氯马斯汀还具有毒蕈碱1型受体(muscarinic receptor 1, M1R)阻断作用[3]。M1R是一种负向调控少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)分化成熟的细胞膜受体,特异性敲除OPCs中的M1R可以增加小鼠的髓鞘形成[4]。通过高通量筛选发现,氯马斯汀在离体培养体系中促进OPCs分化和髓鞘形成的能力比甲状腺激素等其他药物更强[5]。目前,氯马斯汀治疗多发性硬化的二期临床试验结果提示氯马斯汀在多发性硬化神经退行性病变中能促进髓鞘再生[3]。然而氯马斯汀促进髓鞘再生的确切机制还并未研究清楚。因此,本研究探讨小鼠老化过程中视神经髓鞘的改变,及促髓鞘形成药物氯马斯汀对小鼠老化过程中视觉传导功能的影响,为氯马斯汀改善视神经老化慢性退行性病变提供依据。
1 材料与方法 1.1 实验动物C57 BL/6小鼠购自陆军军医大学实验动物中心。Cspg4-CreERt; mT/mG小鼠由Cspg4-CreERt小鼠(Jackson实验室, 货号: 008538)与mT/mG小鼠(Jackson实验室, 货号: 007676)杂交获得[6];Cspg4-CreERt; Tau-mGFP小鼠由Cspg4 -CreERt小鼠与Tau-mGFP小鼠(The Jackson Laboratory, 货号: 021162)杂交获得[6]。雄性和雌性小鼠无偏差用于所有实验。实验设计、实验过程及动物处死方法,经过陆军军医大学实验动物福利伦理审查委员会审核,符合动物伦理和动物福利要求。实验动物生产许可证号为SCXK(渝)20170002,使用许可证号为SYXK(渝)20170002。
1.2 药品及试剂氯马斯汀(SelleckChem, 货号: S1847)、NG2兔单克隆抗体(Millipore, 货号: MAB5320)、CC1小鼠单克隆抗体(Millipore, 货号: OP80-100UG)、驴抗兔(二抗)抗体(Life technologies, 货号: A32795)、驴抗小鼠(二抗)抗体(Life technologies, 货号: A31571)、他莫昔芬(SigmaAldrich, 货号: T5648)。
1.3 实验设计与分组利用4月龄、8月龄和13月龄的野生型小鼠,结合免疫荧光染色和蛋白定量评估小鼠老化过程中视神经OPCs、OLs改变;结合闪光视觉诱发电位(flash visual evoked potential,fVEP)实验评估小鼠老化过程中视觉传导功能改变。
利用4月龄和13月龄的Cspg4-CreERt;mT/mG报告基因小鼠,结合免疫荧光染色评估小鼠老化过程中视神经新生髓鞘数量变化。
利用13月龄的Cspg4-CreERt; Tau-mGFP报告基因小鼠,按照随机数字表法分为对照组和氯马斯汀治疗组。对照组予以空白溶剂,氯马斯汀治疗组予以氯马斯汀治疗1个月,评估氯马斯汀对小鼠老化过程中视神经新生髓鞘的作用。
利用13月龄的野生型小鼠,按照随机数字表法分为对照组和氯马斯汀治疗组。对照组予以空白溶剂,氯马斯汀治疗组予以氯马斯汀治疗4个月,结合fVEP实验评估氯马斯汀对小鼠老化过程中视觉传导功能的影响。
1.4 基因型鉴定报告基因小鼠出生后第6天剪取脚趾,与tail缓冲溶液和蛋白酶K混合,在PCR仪中提取基因。基因提取完成之后,与PCR反应液和基因提取液混合,在PCR仪中扩增。用电泳仪对扩增完成的基因进行电泳检测,最后在凝胶成像仪下进行结果分析。基因鉴定引物:Cspg4-CreERT正义链: 5′-TGCCACGACCA-AFTFACAGCAATG-3′,反义链: 5′-ACCAGACGCAAA-TCCATCGCTC-3′;mT/mG引物1: CTTTAAGCCTGC-CCAGAAGA,引物2: TA GAGCTTGCGGAACCCTTC,引物3: AGGGAGCTGCAGTGGAGTAG;Tau-mGFP引物1: CCTTGTCCCCAACTCCATAC,引物2:TGTGTAT-GTCCACCCACTG,引物3: AAACAGTCCGCTCCAG。
1.5 报告基因小鼠诱导使用他莫昔芬诱导Cre重组酶实现绿色荧光蛋白时空特异性表达[6]。他莫昔芬以30 mg·kg-1·d-1的剂量对转基因小鼠进行灌胃,持续5 d,诱导完成后小鼠按之前条件继续饲养至取材时间点。
Cspg4-CreERt; mT/mG小鼠诱导前细胞膜上表达红色荧光蛋白,但经他莫昔芬诱导后,OPCs的细胞膜上转而表达绿色荧光蛋白,并且由OPCs分化成熟的OLs以及新生髓鞘都会表达绿色荧光蛋白。
Cspg4-CreERt; Tau-mGFP小鼠经过他莫昔芬诱导后OPCs分化成熟的OLs的细胞膜上表达绿色荧光蛋白,而OPCs细胞膜上的绿色荧光蛋白表达量极低。
1.6 免疫荧光染色小鼠腹腔内注射25~50 mg/kg 1%戊巴比妥麻醉,用磷酸缓冲液和4%多聚甲醛灌注。视神经取材后在4%多聚甲醛中固定过夜,再在30%的蔗糖溶液中脱水。脱水完成后于冰冻切片机以10 μm等距切片。视神经切片用5% BSA和0.2% Triton X-100封闭2 h,一抗4 ℃孵育过夜,洗涤后二抗(1 ∶1 000)室温孵育2 h,再次洗涤后置于载玻片上封片。一抗稀释比例:NG2(1 ∶500)、CC1(1 ∶500)。
1.7 免疫印迹新鲜视神经与RIPA裂解液和蛋白酶磷酸酶抑制剂结合,4 ℃ 12 000 r/min离心12 min,取上清液,BCA法测定蛋白浓度并配平。200 mA电流下经过0.5~2 h,裂解液在SDS-聚丙烯酰胺凝胶上分离并转移到聚偏氟乙烯膜上。将膜在含有0.1% Tween-20的TBST中洗涤后,在5%脱脂奶粉中封闭1.5 h。然后,膜与兔来源的NG2抗体(1 ∶500)结合过夜。洗涤后与辣根酶标记的二抗(1 ∶5 000)室温摇床孵育1.5 h。洗涤后使用ECL发光液均匀覆盖膜表面,曝光仪曝光显影,条带由Image J软件进行光密度分析。
1.8 闪光视觉诱发电位测量小鼠明适应后,腹腔内注射25~50 mg/kg 1%戊巴比妥麻醉,放置加热垫上,保持体温在38 ℃。记录电极位于视觉皮层中线皮下,参考电极位于额叶皮层中线皮下,接地电极位于尾部皮下[7]。对侧未被检查的眼睛被防光黑色眼罩覆盖。每次fVEP实验中,发送频率1 Hz,持续10 μs的50次连续白色闪光(强度为120~200 mJ)。VEPs信号由视觉电生理检查系统记录。
1.9 氯马斯汀治疗氯马斯汀以30 mg/mL的浓度溶于DMSO中,以灌胃给药的形式,10mg/(kg·d)的剂量处理氯马斯汀治疗组小鼠[4],对照小鼠使用同浓度的溶剂处理。
1.10 统计学方法使用共焦激光扫描显微镜(Olympus, fv3000)和蔡司显微镜采集荧光图像。采用Image J软件进行图像计数,利用GraphPad Prism 6软件进行数据分析和生成统计图。所有的数据以x±s表示。若所得数据符合正态分布,则两组间均值的比较使用非配对t检验;若不符合正态分布,则使用Mann-Whitney秩和检验进行统计学比较,当实验设计中存在3个或3个以上分组时,使用单因素方差分析进行检验。P<0.05表示差异具有统计学意义。
2 结果 2.1 视神经老化过程中少突胶质前体细胞和成熟少突胶质细胞改变通过免疫荧光染色对4月龄和13月龄小鼠的OPCs和OLs进行计数,如图 1A所示,无论是4月龄还是13月龄小鼠,视神经均存在大量分布基本均匀的NG2+的OPCs。相比4月龄,13月龄小鼠视神经NG2+细胞数量无明显下降(图 1B);相比4月龄,13月龄小鼠NG2+细胞面积无明显下降(图 1C);相比4月龄和8月龄,13月龄小鼠视神经CC1+成熟少突胶质细胞数量明显下降(P < 0.01,P < 0.05,图 1D~E)。通过蛋白质印迹检测进一步明确不同年龄组视神经NG2蛋白表达量,发现相比4月龄,13月龄视神经NG2蛋白表达量未见明显改变(图 1F~G)。
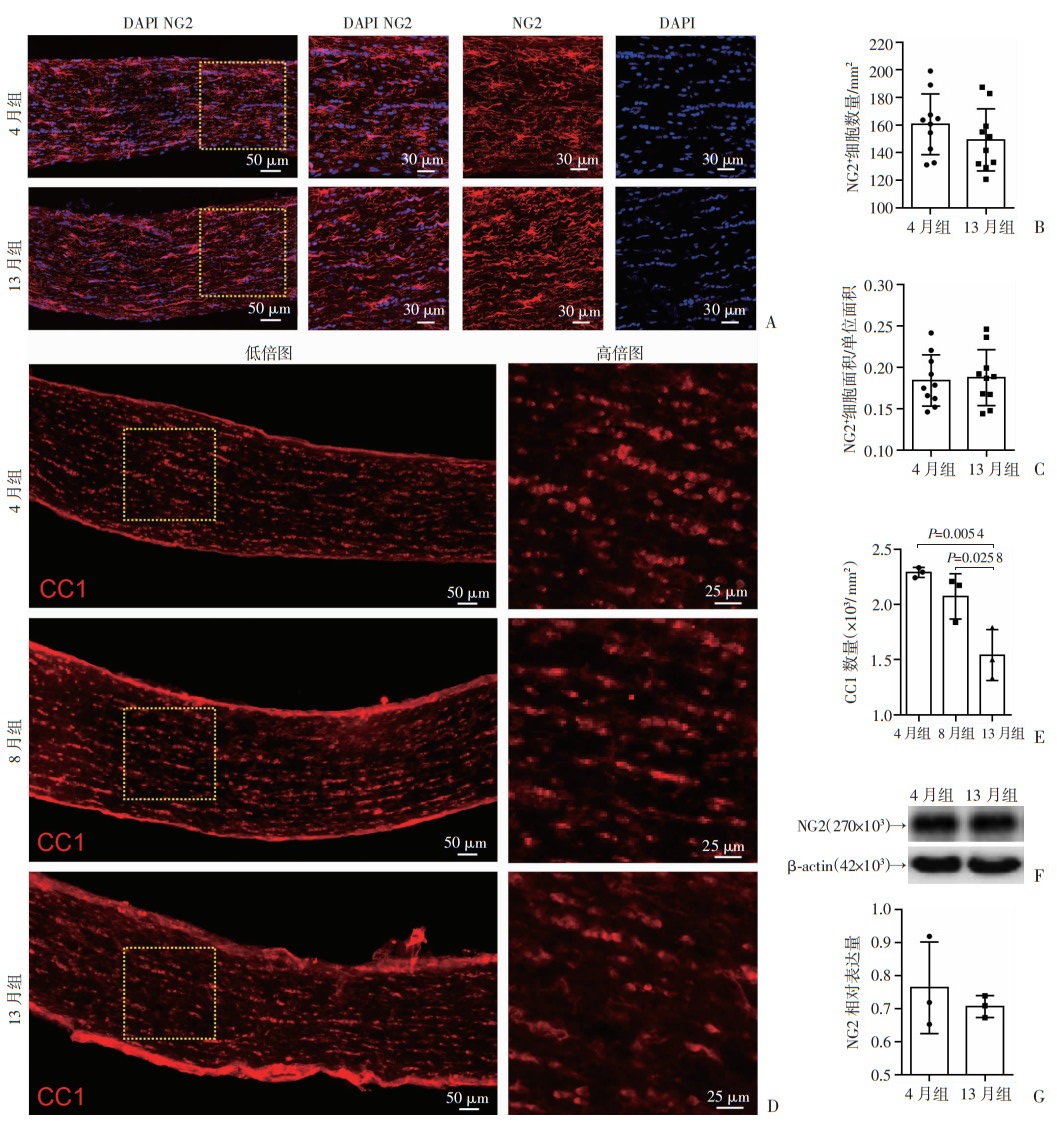
|
| A:视神经NG2免疫荧光染色观察;B:视神经NG2+细胞数量计数;C:视神经NG2+细胞面积计数;D:视神经CC1免疫荧光染色观察;E: 视神经CC1+细胞数量计数;F: 视神经NG2蛋白定量;G: 视神经NG2蛋白定量结果 图 1 不同年龄组视神经少突胶质前体细胞和成熟少突胶质细胞改变 |
2.2 视神经老化过程中少突胶质前体细胞分化成熟能力与新生髓鞘数量改变
通过Cspg4-CreERT; mT/mG报告基因小鼠,结合少突胶质前体细胞特异性标志物NG2免疫荧光染色,如图 2所示,可以观察到条索状成簇分布的新生髓鞘, 其中NG2-mGFP+代表新生成髓鞘; NG2+mGFP+代表少突胶质前体细胞。与4月龄相比,13月龄小鼠视神经在10 d内新生成髓鞘的面积明显减少(P < 0.05),提示视神经老化过程中少突胶质前体细胞分化成熟能力下降,新生髓鞘数量下降。

|
| 箭头示新生髓鞘 图 2 不同年龄组报告基因小鼠视新生髓鞘数量改变 |
2.3 闪光视觉诱发电位明确小鼠视觉传导功能改变
通过fVEP对4月龄和13月龄野生型小鼠视神经传导功能检测,如图 3所示,与4月龄小鼠相比,13月龄小鼠视神经P2波潜伏期明显延长(P < 0.01),提示13月龄小鼠视神经信号传导能力下降。
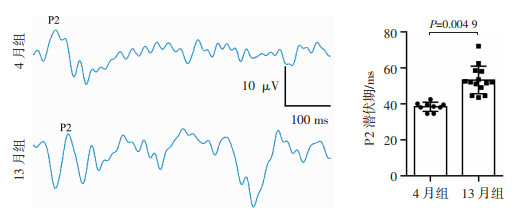
|
| 图 3 不同年龄组小鼠闪光视觉诱发电位结果 |
2.4 氯马斯汀治疗后小鼠视神经新生髓鞘数量变化
通过Cspg4-CreERT; Tau-mGFP报告基因小鼠观察视神经新生髓鞘,mGFP+区域代表成簇分布的新生髓鞘(图 4)。相比对照组,氯马斯汀治疗组经氯马斯汀治疗1个月后,小鼠视神经mGFP+区域明显增多(P < 0.05),提示氯马斯汀能促进视神经OPCs向OLs分化和髓鞘再生。
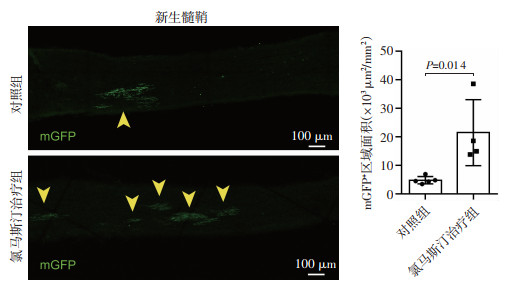
|
| 箭头示新生髓鞘 图 4 氯马斯汀治疗组与对照组视神经新生髓鞘数量改变 |
2.5 氯马斯汀治疗后小鼠视觉传导功能改变
通过fVEP对氯马斯汀治疗组和对照组视神经传导功能进行测量,如图 5所示,与对照组相比,氯马斯汀治疗组P2波潜伏期明显缩短(P < 0.01),提示氯马斯汀治疗能促进视神经信号传导。
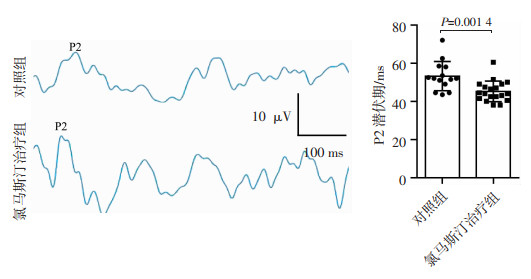
|
| 图 5 氯马斯汀治疗组与对照组小鼠视觉诱发电位结果 |
3 讨论
视神经老化慢性退行性病变时刻威胁着老年人群的视功能,并且在多发性硬化、视神经炎等视神经病变过程中,常合并视神经老化病变。探究小鼠老化过程中视神经髓鞘的改变,及促髓鞘形成药物氯马斯汀对小鼠老化过程中视觉传导功能的影响具有重要的意义。
少突胶质前体细胞(OPCs)分化形成成熟少突胶质细胞(OLs),OLs包绕轴突形成髓鞘[8]。通过对OLs的特征性标志物CC1[9]进行免疫荧光染色,我们发现,相比运动皮层OLs数量在18月龄出现下降[6],视神经OLs数量在13月龄就已经出现下降。这可能与视神经只有50%~60%的成熟少突胶质细胞能够存活1年半以上,其比例低于运动皮层(70%)等其他中枢神经系统有关[10]。此结果提示视神经的老化可能早于运动皮层等其他中枢神经系统。与13月龄小鼠运动皮层OPCs数量未见明显下降[6]一致,相比4月龄小鼠,13月龄小鼠视神经无论是少突胶质前体细胞数量、少突胶质前体细胞面积、少突胶质细胞NG2表达量均未见明显下降。然而另有研究表明,相比2月龄小鼠,19月龄小鼠胼胝体少突胶质前体细胞NG2表达量下降[11]。这可能是由于实验采用不同年龄小鼠,且观察部位不同导致的。
视神经多发性硬化症慢性脱髓鞘改变被认为是导致轴突损伤和神经功能障碍的重要原因之一,尽管在多发性硬化损伤区域存在许多OPCs,然而髓鞘再生是十分困难的[12]。而老化小鼠视神经同样如此,本实验证实与4月龄小鼠相比,13月龄小鼠视神经新生髓鞘数量明显下降。而成年后新生髓鞘主要有以下两个功能:已形成的神经环路为了保持功能,可能需要新生髓鞘来替代丢失的髓鞘;学习并建立新的神经环路需要新生髓鞘参与[13-15]。fVEP是用光刺激视网膜,在枕叶视皮层诱发电活动,其P2潜伏期主要由视神经轴索以及髓鞘的功能状态决定[16]。MARENNA等[17]认为非侵入式皮下fVEP检测是评估小鼠视神经功能可靠的方法。通过fVEP检测,我们发现,与4月龄小鼠相比,13月龄小鼠视神经信号传导能力下降,这可能与13月龄小鼠视神经新生髓鞘数量下降,成熟少突胶质细胞数量减少有关。
老化小鼠视神经存在大量的OPCs,我们可以通过氯马斯汀促进这些OPCs向OLs分化,促进髓鞘再生[18]。与对照组相比,13月龄小鼠氯马斯汀治疗1个月后,视神经新生髓鞘数量明显增加;氯马斯汀治疗4个月后,与对照组相比,fVEP P2波潜伏期明显缩短,提示氯马斯汀能够促进视神经髓鞘再生和改善视神经信号传导。但必须指出的是,氯马斯汀治疗后,不仅视神经新生髓鞘数量增加,中枢神经系统其他区域新生髓鞘数量也会增加[6],本研究暂无法观察中枢神经系统其他区域新生髓鞘数量增加对小鼠闪光视觉诱发电位的P2潜伏期的影响。本研究关于氯马斯汀的研究不足之处:①氯马斯汀促进视神经信号传导的治疗效果停药后能否维持。②氯马斯汀的毒副作用不明。既往研究表明,氯马斯汀治疗多发性硬化患者后出现疲乏症状加重的副作用,但暂未发现其他严重并发症。③氯马斯汀能改善视神经信号传导, 但是对于小鼠的整体视功能而言,其临床意义有待进一步验证。
综上,本文主要研究了视神经髓鞘相关细胞在老化过程中的病理改变,且视神经的特殊之处在于其老化改变可能早于运动皮层等其他中枢神经系统。此外本研究也发现氯马斯汀在视神经老化慢性退行性病变中的治疗作用,为氯马斯汀治疗多发性硬化、视神经炎等其他视神经疾病奠定了基础。
| [1] |
LU Y C, BROMMER B, TIAN X, et al. Reprogramming to recover youthful epigenetic information and restore vision[J]. Nature, 2020, 588(7836): 124-129. |
| [2] |
BLAZSÓ G, GÁBOR M. Evaluation of the anti-oedematous effects of some H1-receptor antagonists and methysergide in rats[J]. Pharmacol Res, 1997, 35(1): 65-71. |
| [3] |
GREEN A J, GELFAND J M, CREE B A, et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial[J]. Lancet, 2017, 390(10111): 2481-2489. |
| [4] |
WANG F, YANG Y J, YANG N, et al. Enhancing oligodendrocyte myelination rescues synaptic loss and improves functional recovery after chronic hypoxia[J]. Neuron, 2018, 99(4): 689-701. |
| [5] |
MEI F, FANCY S P J, SHEN Y A, et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis[J]. Nat Med, 2014, 20(8): 954-960. |
| [6] |
WANG F, REN S Y, CHEN J F, et al. Myelin degeneration and diminished myelin renewal contribute to age-related deficits in memory[J]. Nat Neurosci, 2020, 23(4): 481-486. |
| [7] |
ZHANG Z, LIU W Y, HUANG Y B, et al. NLRP3 deficiency attenuates secondary degeneration of visual cortical neurons following optic nerve injury[J]. Neurosci Bull, 2020, 36(3): 277-288. |
| [8] |
STADELMANN C, TIMMLER S, BARRANTES-FREER A, et al. Myelin in the central nervous system: structure, function, and pathology[J]. Physiol Rev, 2019, 99(3): 1381-1431. |
| [9] |
BEHRANGI N, LORENZ P, KIPP M. Oligodendrocyte lineage marker expression in eGFP-GFAP transgenic mice[J]. J Mol Neurosci, 2021, 71(11): 2237-2248. |
| [10] |
TRIPATHI R B, JACKIEWICZ M, MCKENZIE I A, et al. Remarkable stability of myelinating oligodendrocytes in mice[J]. Cell Rep, 2017, 21(2): 316-323. |
| [11] |
BAO C C, HE C Q, SHU B, et al. Aerobic exercise training decreases cognitive impairment caused by demyelination by regulating ROCK signaling pathway in aging mice[J]. Brain Res Bull, 2021, 168: 52-62. |
| [12] |
LUBLIN F D, HÄRING D A, GANJGAHI H, et al. How patients with multiple sclerosis acquire disability[J]. Brain, 2022, 145(9): 3147-3161. |
| [13] |
MCKENZIE I A, OHAYON D, LI H L, et al. Motor skill learning requires active central myelination[J]. Science, 2014, 346(6207): 318-322. |
| [14] |
XIAO L, OHAYON D, MCKENZIE I A, et al. Rapid production of new oligodendrocytes is required in the earliest stages of motor-skill learning[J]. Nat Neurosci, 2016, 19(9): 1210-1217. |
| [15] |
MONIE M. Myelin Plasticity and Nervous System Function[J]. Annu Rev Neurosci, 2018, 41: 61-76. |
| [16] |
ARRUDA J E, MCINNIS M C, STEELE J. The flash visual evoked potential-P2 and the detection of amnestic mild cognitive impairment: a review of empirical literature[J]. Int J Psychophysiol, 2020, 155: 162-167. |
| [17] |
MARENNA S, CASTOLDI V, D'ISA R, et al. Semi-invasive and non-invasive recording of visual evoked potentials in mice[J]. Doc Ophthalmol, 2019, 138(3): 169-179. |
| [18] |
NAJM F J, MADHAVAN M, ZAREMBA A, et al. Drug-based modulation of endogenous stem cells promotes functional remyelination in vivo[J]. Nature, 2015, 522(7555): 216-220. |




