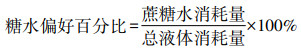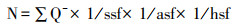2. 400016 重庆,重庆医科大学基础医学院病理生理学教研室;
3. 400016 重庆,重庆医科大学生命科学研究院;
4. 400016 重庆,重庆医科大学基础医学院生理学教研室;
5. 400016 重庆,重庆医科大学基础医学院放射医学教研室
2. Department of Pathophysiology, Chongqing Medical University, Chongqing, 400016, China;
3. Institute of Life Sciences, Chongqing Medical University, Chongqing, 400016, China;
4. Department of Physiology, Chongqing Medical University, Chongqing, 400016, China;
5. Department of Radioactive Medicine, College of Basic Medical Sciences
抑郁症是一种常见的精神疾病[1]。目前针对抑郁症的治疗存在许多不足。临床研究显示,跑步作为一种简单有效的干预手段可以有效改善患者的抑郁症状[2]。本团队前期研究也发现跑步可以有效改善CUS抑郁模型小鼠的抑郁样行为[3],但是跑步抗抑郁作用的具体机制尚不完全清楚。
内侧前额叶皮质是抑郁症患者大脑结构和功能改变的主要区域之一[4]。GABA能中间神经元是以释放中枢抑制性神经递质GABA为特点的中间神经元[5]。BANASR等[6]发现皮质酮或地塞米松诱导的抑郁模型大鼠皮质内GABA能中间神经元密度显著减少。但POCHWAT等[7]发现慢性轻度应激并未显著改变大鼠PFC中GAD67蛋白水平。TAI等[8]发现跑步增加了焦虑小鼠海马中GABA的含量。而COXON等[9]发现跑步并未改变参与人背外侧前额叶皮层内GABA神经递质的浓度。以上研究显示,跑步对GABA能中间神经元的作用及抑郁症小鼠mPFC内GABA能中间神经元的数量的影响尚不完全清楚。
皮层的GABA中间神经元亚型以PV+中间神经元和CCK+中间神经元为主[10]。PV+中间神经元是主要的GABA能中间神经元亚型[11]。CZÉH等[12]发现慢性温和应激(chronic mild stress, CMS)抑郁模型大鼠内侧前额叶下边缘皮层中PV+中间神经元数量减少,但是在mPFC的前扣带回和边缘皮层的PV+中间神经元的数量没有显著变化。NGUYEN等[13]发现跑步30 d后,成年雄性大鼠海马区PV+中间神经元密度增加。SELAKOVIC等[14]发现跑步并未逆转焦虑大鼠海马CA2/3区域中PV+中间神经元密度的减少。PV+/GAD67+细胞比例被发现与兴奋/抑制连接程度有关[15]。LUSSIER等[16]发现产前应激显著降低了海马和mPFC内PV+/GAD67+细胞比例。综上所述,CUS抑郁模型小鼠mPFC内GABA能中间神经元、PV+中间神经元和GAD67+/PV+细胞比例的改变均参与抑郁症的发病,但其在mPFC内精确的数量改变以及跑步在改善CUS抑郁症小鼠模型抑郁样行为的同时能否改善上述指标尚不清楚。因此,本课题采用qRT-PCR检测小鼠mPFC中GAD1、GAD2、PV和CCK的mRNA表达水平,并运用免疫组织化学和无偏体视学方法探讨CUS抑郁模型小鼠mPFC内GABA能中间神经元、PV+中间神经元和GAD67+/PV+细胞比例的改变情况以及跑步能否通过改善上述结构从而改善CUS抑郁模型小鼠的抑郁样症状,为寻找跑步治疗抑郁症的结构靶点提供重要的科学依据。
1 材料与方法 1.1 实验动物选取4~6周龄,体质量10~15 g的雄性C57BL/6小鼠,由本校实验动物中心提供并饲养。所有小鼠饲养于IVC环境内,昼夜节律每12小时交替,室温控制在(22±2)℃, 对照组小鼠5只/笼,CUS组小鼠1只/笼,给予充足的食物和饮水,每周固定时间更换垫料并交换笼子位置。
1.2 试剂及耗材小鼠抗GAD67(货号G5419,美国Sigma公司),小鼠抗PV(货号P3088,美国Sigma公司),抗小鼠HRP-DAB细胞组织染色试剂盒(货号SP-9002,中国北京诺伯瑞德科技有限公司)。冰冻切片机(德国Leica公司),体视学测量分析系统(美国MBF Bioscience公司)。
1.3 实验分组将雄性C57BL/6小鼠按照分层随机方法分为对照组(n=16)和CUS模型组(n=32)。建模成功后,将CUS模型组按照分层随机方法分为CUS模型对照组(n=16)和CUS模型+跑步组(n=16)。本实验为期8周。在实验开始之前,动物在IVC房间中进行为期1周的适应性喂养。CUS模型小鼠在1~8周内接受慢性不可预知性应激(每天2~3种,连续4周)。CUS模型+跑步组4~8周进行跑台跑步。在1~8周末均进行糖水偏好实验;在第8周末进行悬尾实验和强迫游泳实验。实验流程见图 1。
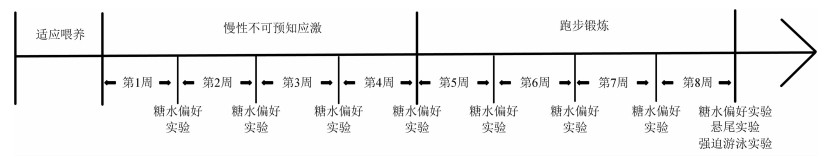
|
| 图 1 实验流程图 |
对照组小鼠正常进食进水;CUS模型组以WILLNER等[17]建模方法为基础,结合YOHN等[18]和LOGAN等[19]的方法,对每日应激种类和强度进行改进,每天接受2~3种不同的应激(表 1),共持续8周。每周用糖水偏好实验评估各组小鼠快感缺乏状态的影响。CUS模型+跑步组小鼠在CUS模型组基础上进行跑步干预,采用小动物水平电动跑台仪进行跑步,每周5 d,每天10 min。小鼠在第1周以5 m/min的速度奔跑,第2周以8 m/min的速度奔跑,第3周以10 m/min的速度奔跑,最后1周保持这一速度[20-21]。
| 时间 | 星期一 | 星期二 | 星期三 | 星期四 | 星期五 | 星期六 | 星期日 |
| 第1周 | 空垫料、倾斜、摇床 | 禁食、束缚 | 冷环境、昼夜颠倒 | 禁饮、电击、频闪 | 空瓶、噪音、长昼 | 糖水测试 | 噪音、束缚、交换垫料 |
| 第2周 | 潮湿垫料、倾斜、冷环境 | 摇床、禁饮、电击 | 空瓶、冷环境、昼夜颠倒 | 摇床、噪音、禁食 | 束缚、电击、频闪 | 糖水测试 | 摇床、噪音、交换垫料 |
| 第3周 | 倾斜/空垫料、禁饮、电击 | 束缚、空瓶刺激、频闪 | 冷环境、噪音、禁食 | 摇床、频闪、昼夜颠倒 | 电击、冷环境、禁食禁饮 | 糖水测试 | 噪音、禁食、电击 |
| 第4周 | 交换垫料、摇床、束缚 | 倾斜、空垫料、频闪 | 束缚、噪音、禁饮 | 空瓶、电击、昼夜颠倒 | 摇床、频闪、冷环境 | 糖水测试 | 电击、频闪 |
| 第5周 | 交换垫料、悬尾测试、强迫游泳 | 噪音、束缚、禁饮 | 空瓶、频闪 | 摇床、束缚、昼夜颠倒 | 电击、频闪、冷环境 | 糖水测试 | 噪音、频闪、交换垫料 |
| 第6周 | 倾斜、湿垫料、束缚、噪音 | 摇床、电击、禁饮、换垫料 | 冷环境、空瓶刺激、禁食 | 摇床、电击、昼夜颠倒 | 束缚、冷环境、禁食禁饮 | 糖水测试 | 禁食、噪音、电击 |
| 第7周 | 交换垫料、摇床、束缚、热环境 | 倾斜、空垫料、频闪、冷环境 | 束缚、噪音、电击、禁饮 | 空瓶刺激、电击、束缚、昼夜颠倒 | 摇床、热环境、频闪、冷环境 | 糖水测试 | 摇床、交换垫料、频闪 |
| 第8周 | 倾斜、湿垫料、电击、束缚 | 束缚、摇床、禁饮、冷环境 | 电击、噪音、空瓶刺激、禁食 | 摇床、冷环境、昼夜颠倒 | 束缚、热环境、噪音、频闪 | 糖水测试 | 强迫游泳实验、悬尾实验 |
1.4 行为学检测 1.4.1 糖水偏好实验
糖水偏好(sucrose preference,SPT)是评价快感缺失的金标准[17, 22]。在CUS干预前、干预后及处死前分别进行糖水偏好测试。测试时,小鼠均单笼饲养并保证饲料充足,同时提供1%蔗糖水及纯水各1瓶,左右位置每12小时进行交换,保证小鼠24 h内不受干扰。24 h后对剩余蔗糖水量和纯水量进行测定,根据以下公式计算出小鼠24 h糖水偏好百分比。
1.4.2 强迫游泳实验强迫游泳实验(forced swimming test,FST)用于评价动物的绝望状态[23],是一项广泛用于评估抗抑郁效果的行为学测试方法。在强迫游泳实验之前,小鼠被转移到另一个行为学房间,适应24 h。小鼠被置于透明有机玻璃圆筒(直径20 cm,高30 cm)中,容器中含有水(23±1)℃,深度15 cm。小鼠在圆筒中放置6 min,并记录6 min中最后4 min的静止时间。
1.4.3 悬尾实验悬尾实验(tail suspension test, TST)是通过测定动物的不动时间来判断实验动物的绝望状态,是评价抗抑郁作用效果的行为学手段[24]。测试时,将小鼠的尾部后1/3处用胶带固定后悬挂于支架上,小鼠头部距离台面15 cm,用摄像机记录小鼠6 min的活动视频。记录小鼠在实验的后4 min内的不动时间。
1.5 RNA的提取和cDNA的制备从每组动物中抽取3只小鼠,通过腹腔注射1%的戊巴比妥钠(0.4 mL/100 g)进行麻醉、断颈并剥离出完整大脑,于冰上快速解剖出mPFC组织,立即将组织放入无核酸酶的离心管内,按照试剂盒的步骤提取总RNA。在1.5 mL无酶EP管中加入一侧mPFC和300 mL RNA裂解液,置于冰浴中,运用超声波破碎仪将组织制备成匀浆;向无酶EP管中加入300 μL RNA稀释液并充分吸放混合均匀,置于室温3~5 min;室温12 000 r/min(后面的温度条件及离心机转速均相同)离心5 min;用无酶枪头小心吸取上清液并转移到新的无酶离心管内,避免吸入气泡,加入一半上清液体积的无水乙醇并用移液枪吸放使混合均匀;准备好离心柱和收集管,将上述混合液体转移到离心柱内;离心1 min,丢弃滤过的液体;加入600 μL含乙醇的RNA洗液,离心45 s,丢弃滤过;加入50 μL的DNA酶I孵育液,室温放置15 min;再加入600 μL RNA洗液,离心45 s,丢弃滤过的液体,该步骤重复2次;将离心柱安放在准备好的收集管,离心2 min;将离心管转移至洗脱管上,加入50 μL的无核酸酶水,室温放置2 min,然后离心1 min。每个样品吸取1 μL的溶液测定RNA浓度后,按照试剂盒的步骤将RNA去除基因组DNA的反应后逆转录成cDNA。
1.6 标本固定及切片制备每组抽取5只小鼠,于1%的戊巴比妥钠(0.4 mL/100 g)腹腔注射麻醉后,迅速暴露心脏。利用恒流灌注泵将含有肝素钠的生理盐水和含4%多聚甲醛的磷酸缓冲液依次灌入大鼠心脏进行灌洗固定,直至大鼠四肢抽搐、全身僵硬时停止灌注。剖开颅骨,取出完整的大脑组织,并将其浸泡于上述相同固定液中进行固定。每只大鼠随机选取一侧半脑,将其浸入含10%、20%和30%的蔗糖的0.1 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)溶液中进行梯度脱水。快速冷冻大脑组织后利用低温切片机将其切成60 μm厚的连续切片,在含有mPFC的切片中按照1/4的抽样分数进行抽样,每侧半脑平均抽得12张切片。用0.01 mol/L PBS和75%乙醇冲洗后,将切片保存在-20 ℃的75%乙醇中。
1.7 实时定量PCR(qRT-PCR)检测基因引物序列见表 2。cDNA稀释5倍,按照试剂盒说明书进行PCR反应,用实时荧光定量PCR仪的三步法反应程序进行扩增。以β-actin为内参,采用2-ΔΔCt法对基因的相对表达量进行分析。
| 基因 | 引物(5′→3′) |
| GAD1 | 上游:AAGAACGGGGAGGAGCAAAC 下游:CTGGTGTGGGTGGTGGAAAT |
| GAD2 | 上游:TGTGACGAGAGAGGGAAAATGA 下游:ATCAAAAGCCCCATACACGG |
| PV | 上游:GCCTGAAGAAAAAGAACCCG 下游:TTGCCGTCCCCATCCTT |
| CCK | 上游:TGGAACTCGCCAAGCCA 下游:CATCACCACGCACAGACATAC |
| SST | 上游:CTGAGGCAAGGAAGATGCTGT 下游:AAACTGACGGAGTCTGGGGT |
| β-actin | 上游:CATCCGTAAAGACCTCTATGCCAAC 下游:ATGGAGCCACCGATCCACA |
1.8 免疫组织化学染色
用0.01 mol/L PBS漂洗切片5 min×3次后,用含有0.3% Triton X-100和0.1% Tween-20的0.01 mol/L PBS(PBS+T)漂洗20 min×4次。用3%过氧化氢溶液避光孵育切片30 min,PBS+T溶液漂洗10 min×3次,再将切片放入枸橼酸盐溶液中进行沸水浴修复30 min,PBS+T溶液漂洗10 min×3次。将切片置于PBS+T溶液配置的封闭液中(20%山羊血清SP9002-A,1%胎牛血清), 37 ℃孵育2 h后,孵育一抗小鼠抗GAD67抗体(1 ∶1 000)/ 一抗小鼠抗PV抗体(1 ∶1 000),4 ℃孵育48 h。用PBS+T溶液漂洗20 min×4次后孵育二抗SP9002-B(1 ∶10,生物素化的山羊抗小鼠IgG),37 ℃孵育3 h。用PBS+T溶液漂洗10 min×3次后孵育SP9002-C(1 ∶20,辣根酶标记链霉卵白素), 37 ℃孵育2 h。用0.01 mol/L PBS漂洗10 min×3次。3,3-二氨基联苯胺四盐酸(3,3′-diaminobenzidine tetrahydrochloride,DAB)避光显色1 min,用0.01 mol/L PBS漂洗过夜,随后用大量去离子水漂洗切片。贴片后用苏木精复染5 min,随后用大量去离子水漂洗切片, 再将切片放入饱和的NA2HPO4溶液中浸泡30 s,再用大量去离子水漂洗切片。用梯度乙醇(70%、80%、90%各5 min,100%和100%各1 min)脱水,二甲苯3次,各5 min透明,最后使用中性树胶封片。
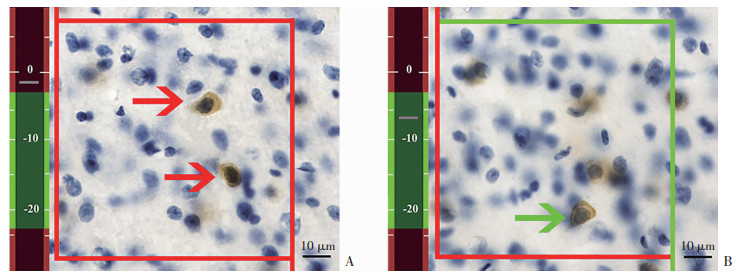
1.9 体视学分析根据mPFC神经元的形态学特征,划定mPFC区域的边界(图 2)[25]。随后在100倍油镜下设置面积抽样分数为80%进行抽样计数。光学体视框以系统随机的方式放置在划定区域内。体视框计数高度为20 μm,在每个切片的顶部边缘设置上表面保护高度3 μm,计数高度的体视框内GAD67+细胞的细胞核被清楚聚焦,同时没有与体视框的禁止线有任何交叉(图 3),PV+细胞也采用同样方法进行计数。mPFC内GAD67+细胞和PV+细胞的数量按如下公式计算。

|
| 在2.5倍光学显微镜下划定小鼠脑组织连续切片中mPFC的边界,黑色实线所覆盖的区域代表mPFC 图 2 小鼠脑组织连续切片抽样后mPFC的分区示意图 |
|
| A:保护高度内GAD67+细胞免疫组化示意图红色箭头示保护高度内的GAD67+细胞未被计数;B:保护高度以下GAD67+细胞免疫组化示意图绿色箭头示GAD67+细胞被计数 图 3 体视框计数小鼠mPFC内GAD67+细胞示意图 |
其中∑Q-为样本中实际计数的GAD67+或PV+细胞数,ssf为切片抽样分数,asf为面积抽样分数,hsf为高度抽样分数。
1.10 统计学分析采用SPSS 23.0统计软件进行分析。数据以x±s表示,Shapiro-Wilk检验评估数据是否正态分布。Levene检验评估各组之间的方差是否相似。对第1周和第4周糖水偏好数据采用独立样本t检验比较对照组和CUS模型组的差异。其他数据如果符合正态且方差相似,采用单因素方差分析后行LSD检验,若不符合,进行数据转换后服从正态分布,则采用单因素方差分析和LSD事后多重检验;若通过转换数据仍不符合,则采用非参数检验。估计各次测量的变异系数(coefficient of variation,cv)和误差系数(coefficient of error,ce)。以P<0.05为差异具有统计学意义。
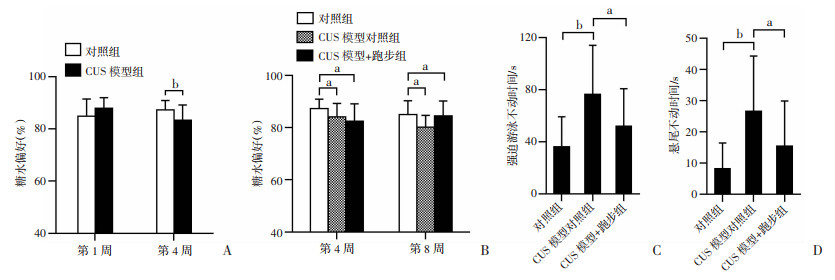
2 结果 2.1 跑步逆转CUS抑郁模型小鼠的抑郁样行为在实验开始时,对照组与CUS模型组小鼠的糖水偏好百分比差异无统计学意义(P>0.05, 图 4A)。干预至第4周时,CUS模型组小鼠的糖水偏好百分比显著低于对照组(P<0.01,图 4A),表明CUS抑郁症模型建立成功。干预第8周末,CUS模型对照组小鼠的糖水偏好百分比仍然显著低于对照组(P<0.05,图 4B)。CUS模型+跑步组小鼠的糖水偏好百分比显著高于CUS模型对照组(P<0.05,图 4B)。对照组小鼠的强迫游泳不动时间显著低于CUS模型对照组(P<0.01,图 4C),CUS模型+跑步组小鼠的强迫游泳不动时间显著低于CUS模型对照组(P<0.05, 图 4C)。对照组小鼠的悬尾不动时间显著低于CUS模型对照组(P<0.01,图 4D),CUS模型+跑步组小鼠的悬尾不动时间显著低于CUS模型对照组(P<0.05,图 4D)。表明跑步能够逆转CUS抑郁模型小鼠的抑样行为。
|
|
a:P<0.05,b:P<0.01 A:对照组(n=16)和CUS模型组(n=32)干预第1、4周的糖水偏好实验结果;B:各组干预第4、8周的糖水偏好实验结果(n=16);C:各组小鼠干预第8周末强迫游泳不动时间(n=16);D:各组小鼠干预第8周末悬尾不动时间(n=16) 图 4 跑步逆转CUS抑郁模型小鼠抑郁样行为(x±s) |
2.2 跑步对CUS抑郁模型小鼠mPFC内GABA能神经元数量的影响
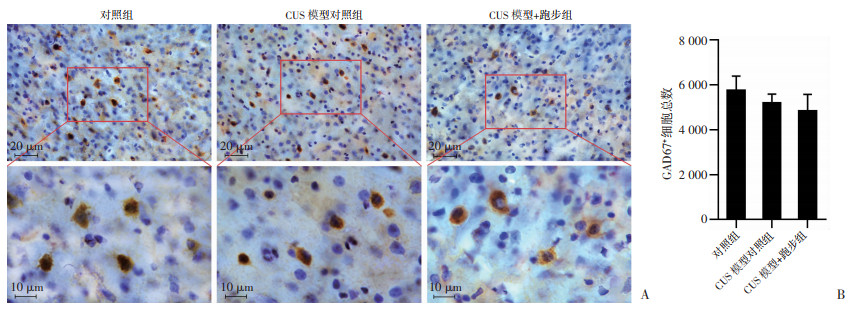
各组小鼠mPFC内GAD67+细胞免疫组化染色结果见图 5A,小鼠mPFC内GAD67+细胞数量的体视学参数见表 3,可见观察到的动物内变异系数(observed coefficient of variation,oce)<0.15且GAD67+细胞的oce2/ocv2<0.5,则认为动物只数的选择符合统计学标准。体视学结果显示,3组小鼠内侧前额叶皮质内GAD67+细胞数量差异无统计学意义(P > 0.05,图 5B)。
|
| A:免疫组化观察各组小鼠mPFC内高倍镜和低倍镜下GAD67+细胞情况下排为上排红框部分的放大图像;B:各组小鼠mPFC内GAD67+细胞数量分析(n=5,x±s) 图 5 跑步对CUS抑郁模型小鼠mPFC内GAD67+细胞数量的影响 |
| 组别 | 切片数量/片 | 切片厚度/μm | PV+细胞总数/个 | ocv | oce | oce2/ocv2 |
| 对照组 | 12.60±0.55 | 33.48±5.19 | 5 751.9±6.31 | 0.11 | 0.03 | 0.07 |
| CUS模型对照组 | 12.40 ±0.55 | 31.44±4.11 | 5 212.00±3.85 | 0.07 | 0.03 | 0.18 |
| CUS模型+跑步组 | 12.20 ±0.84 | 24.01±12.11 | 4 855.50±7.24 | 0.15 | 0.03 | 0.05 |
| ocv:观察到的动物内变异系数;oce:体视学抽样变异的观察误差系数 | ||||||
2.3 跑步对CUS抑郁模型小鼠mPFC内GAD1、GAD2、CCK和PV基因表达水平的改变
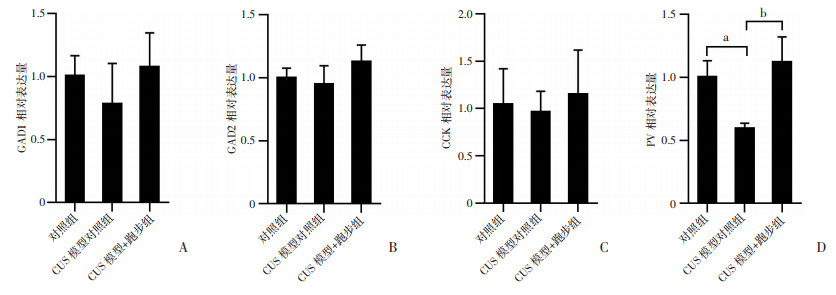
3组小鼠内侧前额叶皮质内GAD1、GAD2和CCK的mRNA表达差异无统计学意义(P > 0.05,图 6A~C)。但CUS模型对照组mPFC中PV的mRNA表达水平显著低于对照组(P<0.05,图 6D)和CUS模型+跑步组(P<0.01, 图 6D)。
|
|
a:P<0.05,b:P<0.01 A~D:分别为各组小鼠内侧前额叶皮质内GAD1、GAD2、CCK和PV的mRNA表达 图 6 跑步逆转CUS抑郁模型小鼠mPFC内PV的mRNA表达水平的减少(n=16,x±s) |
2.4 跑步逆转CUS抑郁模型小鼠mPFC内PV+中间神经元数量的减少
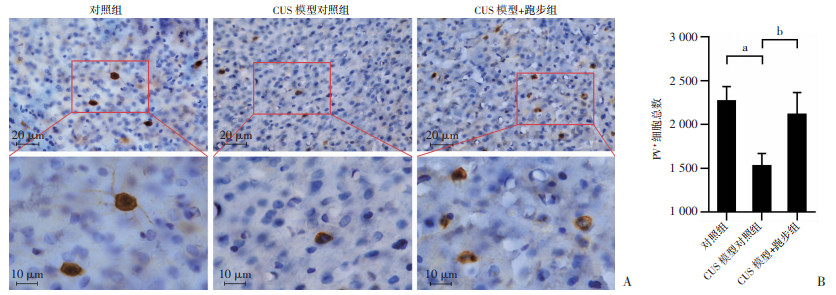
各组小鼠mPFC内PV+细胞免疫组化染色结果见图 7A,小鼠mPFC内PV+细胞数量的体视学参数见表 4,可见oce<0.15且PV+细胞的oce2 /ocv2<0.5,则认为动物只数的选择符合统计学标准。结果显示,CUS模型对照组mPFC中PV+细胞数量显著低于对照组(P<0.05, 图 7B)和CUS模型+跑步组(P<0.01, 图 7B)。
|
|
a:P<0.05,b:P<0.01 A:免疫组化观察各组小鼠mPFC内高倍镜和低倍镜下PV+细胞情况下排为上排红框部分的放大图像;B:各组小鼠mPFC内PV+细胞数量分析(n=5,x±s) 图 7 跑步逆转CUS抑郁模型小鼠mPFC内PV+细胞数量的减少 |
| 组别 | 切片数量/片 | 切片厚度/μm | PV+细胞总数/个 | ocv | oce | oce2/ocv2 |
| 对照组 | 12.40±0.55 | 29.59±4.07 | 2 263.40±1.51 | 0.07 | 0.05 | 0.49 |
| CUS模型对照组 | 12.20±0.84 | 27.95±3.80 | 1 531.10±1.39 | 0.09 | 0.06 | 0.4 |
| CUS模型+跑步组 | 11.80±0.84 | 29.42±4.38 | 2 118.70±2.46 | 0.12 | 0.05 | 0.18 |
| ocv:观察到的动物内变异系数;oce:体视学抽样变异的观察误差系数 | ||||||
2.5 跑步逆转CUS抑郁模型小鼠mPFC内PV+/GAD67+细胞比值的下降
体视学结果显示,CUS模型对照组mPFC中PV+/GAD67+细胞比值显著低于对照组和CUS模型+跑步组(P<0.01, 图 8)。
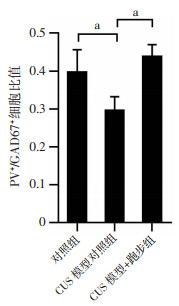
|
| a:P<0.01 图 8 跑步逆转CUS抑郁模型小鼠mPFC内PV+/GAD67+细胞比值的下降 |
3 讨论
CUS模型是一种被广泛接受的抑郁症动物模型,常被用来模拟人的快感缺失等症状[26]。糖水偏好实验是评估快感缺乏的金标准[22]。在本研究中,小鼠暴露在不可预测的慢性压力下4周后,糖水偏好百分比显著降低,小鼠表现出快感缺失,表明成功地建立了CUS抑郁模型小鼠。4周的跑步显著提高了CUS抑郁模型小鼠的糖水偏好百分比, 同时显著减少了强迫游泳实验和悬尾实验中的CUS抑郁模型小鼠的不动时间。强迫游泳实验和悬尾实验常作为评价动物抗抑郁治疗效果的主要标准测试[23-24]。以上结果表明跑步可以改善CUS抑郁模型小鼠抑郁样行为,对治疗抑郁症起到了一定的效果,与本团队前期研究结果相似[3]。
本研究结果显示,对照组与CUS模型对照组小鼠mPFC之间的GABA能中间神经元数量没有统计学差异。以往对抑郁症mPFC内GABA能中间神经元数量的研究属于半定量研究,无法准确反映抑郁症mPFC内GABA能中间神经元数量的改变。本团队运用免疫组织化学结合无偏体视学方法能精确定量神经元数量,已用于研究海马PGC-1α特异性敲除小鼠的行为学及海马各亚区星形胶质细胞数量的改变以及跑步对APP/PS1阿尔兹海默症小鼠mPFC内小胶质细胞数量的影响[27-28]。因此,本研究采用免疫组织化学结合无偏体视学方法更真实地反映了抑郁症mPFC内GABA能中间神经元数量的改变,提示GABA能中间神经元总数量可能不直接参与抑郁症的发病。
本研究qRT-PCR结果显示,暴露4周CUS后小鼠mPFC内GAD1、GAD2和CCK的mRNA表达水平无统计学差异,PV的mRNA表达水平、PV+中间神经元数量和PV+/GAD67+细胞比例显著低于对照组。PV+中间神经元是主要的GABA能中间神经元亚型[11]。PERIC等[29]发现CSIS不能改变抑郁模型大鼠海马CA2区多形层的GABA中间神经元的密度,但能显著降低抑郁模型大鼠海马CA2区多形层中PV+中间神经元的密度。因此我们推测,在mPFC内PV+神经元的数量改变而非总的GABA能中间神经元数量参与CUS抑郁症模型小鼠的发病机制。研究显示,PV+/GAD67+细胞比例与兴奋/抑制连接程度有关[15]。本研究结果显示,CUS显著降低小鼠mPFC中PV+/GAD67+细胞比例,提示mPFC中PV+/GAD67+细胞的比例可能是抑郁症发病及治疗过程中的重要结构之一,具体机制尚需进一步研究。
本研究结果显示,跑步显著增加了CUS抑郁模型小鼠mPFC内PV的mRNA表达水平以及mPFC内PV+中间神经元的数量和PV+/GAD67+细胞比值。跑步作为一种简单有效的干预手段可以有效改善患者的抑郁症状[2]。但是跑步的抗抑郁作用具体机制尚不完全清楚。以往的研究[13]和本研究均表明跑步对PV+中间神经元有积极的作用。跑步影响PV+中间神经元的可能机制是什么呢?TODOROVIC等[30]发现氟西汀能逆转慢性孤立导致的抑郁模型大鼠mPFC内PV+中间神经元的凋亡数量增加。KANG等[31]研究发现跑步锻炼可以抑制CUMS抑郁症模型大鼠海马内神经元的凋亡。另有研究发现跑步可以增加精神分裂模型小鼠海马DG区内新生PV+神经元的数量[32]。我们猜测跑步增加CUS抑郁模型小鼠mPFC内PV+中间神经元数量可能与跑步减少PV+中间神经元凋亡有关,具体的机制尚需进一步深入研究。
综上所述,本研究运用免疫组织化学结合无偏体视学方法精确地定量研究CUS抑郁模型小鼠mPFC内GABA能中间神经元、PV+中间神经元数量的改变和PV+/GAD67+细胞比例以及跑步对上述神经结构改变的作用,运用qRT-PCR检测CUS抑郁模型小鼠mPFC内GAD1、GAD2、CCK和PV的mRNA表达水平的改变以及跑步对其的影响,结果显示GABA能中间神经元mRNA水平、总数量在CUS抑郁症模型小鼠中无显著改变,而mPFC内的PV+中间神经元的mRNA水平、数量和PV+/GAD67+细胞在CUS抑郁症模型小鼠中显著降低,提示在mPFC内PV+中间神经元的改变参与CUS抑郁症模型小鼠的发病机制。而跑步在改善CUS抑郁症模型小鼠抑郁样行为的同时,能够显著改善郁症模型小鼠mPFC内PV的mRNA表达水平、PV+中间神经元和PV+/GAD67+细胞的比例,可能是跑步治疗抑郁症的重要结构基础之一。
| [1] |
MCCARRON R M, SHAPIRO B, RAWLES J, et al. Depression[J]. Ann Intern Med, 2021, 174(5): AITC202105180. |
| [2] |
SCHMITTER M, SPIJKER J, SMIT F, et al. Exercise enhances: study protocol of a randomized controlled trial on aerobic exercise as depression treatment augmentation[J]. BMC Psychiatry, 2020, 20(1): 585. |
| [3] |
TANG J, LIANG X, DOU X Y, et al. Exercise rather than fluoxetine promotes oligodendrocyte differentiation and myelination in the hippocampus in a male mouse model of depression[J]. Transl Psychiatry, 2021, 11(1): 622. |
| [4] |
HOWARD D M, ADAMS M J, CLARKE T K, et al. Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions[J]. Nat Neurosci, 2019, 22(3): 343-352. |
| [5] |
MARKRAM H, TOLEDO-RODRIGUEZ M, WANG Y, et al. Interneurons of the neocortical inhibitory system[J]. Nat Rev Neurosci, 2004, 5(10): 793-807. |
| [6] |
BANASR M, LEPACK A, FEE C, et al. Characterization of GABAergic marker expression in the chronic unpredictable stress model of depression[J]. Chronic Stress, 2017, 1: 247054701772045. |
| [7] |
POCHWAT B, NOWAK G, SZEWCZYK B. Brain glutamic acid decarboxylase-67kDa alterations induced by magnesium treatment in olfactory bulbectomy and chronic mild stress models in rats[J]. Pharmacol Rep, 2016, 68(5): 881-885. |
| [8] |
TAI F, WANG C, DENG X, et al. Treadmill exercise ameliorates chronic REM sleep deprivation-induced anxiety-like behavior and cognitive impairment in C57BL/6J mice[J]. Brain Res Bull, 2020, 164: 198-207. |
| [9] |
COXON J P, CASH R F H, HENDRIKSE J J, et al. GABA concentration in sensorimotor cortex following high-intensity exercise and relationship to lactate levels[J]. J Physiol, 2018, 596(4): 691-702. |
| [10] |
WHISSELL P D, CAJANDING J D, FOGEL N, et al. Comparative density of CCK- and PV-GABA cells within the cortex and hippocampus[J]. Front Neuroanat, 2015, 9: 124. |
| [11] |
DELEUZE C, BHUMBRA G S, PAZIENTI A, et al. Strong preference for autaptic self-connectivity of neocortical PV interneurons facilitates their tuning to γ-oscillations[J]. PLoS Biol, 2019, 17(9): e3000419. |
| [12] |
CZÉH B, VARDYA I, VARGA Z, et al. Long-term stress disrupts the structural and functional integrity of GABAergic neuronal networks in the medial prefrontal cortex of rats[J]. Front Cell Neurosci, 2018, 12: 148. |
| [13] |
NGUYEN J C D, KILLCROSS A S, JENKINS T A. Effect of low-intensity treadmill exercise on behavioural measures and hippocampal parvalbumin immunoreactivity in the rat[J]. Behav Brain Res, 2013, 256: 598-601. |
| [14] |
SELAKOVIC D, JOKSIMOVIC J, ZALETEL I, et al. The opposite effects of nandrolone decanoate and exercise on anxiety levels in rats may involve alterations in hippocampal parvalbumin-positive interneurons[J]. PLoS One, 2017, 12(12): e0189595. |
| [15] |
TRIPODI M, BHANDARI K, CHOWDHURY A, et al. Parvalbumin interneuron plasticity for consolidation of reinforced learning[J]. Cold Spring Harb Symp Quant Biol, 2018, 83: 25-35. |
| [16] |
LUSSIER S J, STEVENS H E. Delays in GABAergic interneuron development and behavioral inhibition after prenatal stress[J]. Dev Neurobiol, 2016, 76(10): 1078-1091. |
| [17] |
WILLNER P, TOWELL A, SAMPSON D, et al. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant[J]. Psychopharmacology, 1987, 93(3): 358-364. |
| [18] |
YOHN N L, BLENDY J A. Adolescent chronic unpredictable stress exposure is a sensitive window for long-term changes in adult behavior in mice[J]. Neuropsychopharmacology, 2017, 42(8): 1670-1678. |
| [19] |
LOGAN R W, EDGAR N, GILLMAN A G, et al. Chronic stress induces brain region-specific alterations of molecular rhythms that correlate with depression-like behavior in mice[J]. Biol Psychiatry, 2015, 78(4): 249-258. |
| [20] |
WANG J, TANG J, LIANG X, et al. Hippocampal PGC-1α-mediated positive effects on parvalbumin interneurons are required for the antidepressant effects of running exercise[J]. Transl Psychiatry, 2021, 11(1): 222. |
| [21] |
YOOK J S, RAKWAL R, SHIBATO J, et al. Leptin in hippocampus mediates benefits of mild exercise by an antioxidant on neurogenesis and memory[J]. Proc Natl Acad Sci USA, 2019, 116(22): 10988-10993. |
| [22] |
LIU M Y, YIN C Y, ZHU L J, et al. Sucrose preference test for measurement of stress-induced anhedonia in mice[J]. Nat Protoc, 2018, 13(7): 1686-1698. |
| [23] |
HARRO J. Animal models of depression: pros and cons[J]. Cell Tissue Res, 2019, 377(1): 5-20. |
| [24] |
STERU L, CHERMAT R, THIERRY B, et al. The tail suspension test: a new method for screening antidepressants in mice[J]. Psychopharmacology, 1985, 85(3): 367-370. |
| [25] |
ZHU L, FAN J H, CHAO F L, et al. Running exercise protects spinophilin-immunoreactive puncta and neurons in the medial prefrontal cortex of APP/PS1 transgenic mice[J]. J Comp Neurol, 2022, 530(6): 858-870. |
| [26] |
SONG J, KIM Y K. Animal models for the study of depressive disorder[J]. CNS Neurosci Ther, 2021, 27(6): 633-642. |
| [27] |
邓宇辉, 罗艳敏, 梁芯, 等. 海马PGC-1α对小鼠抑郁样行为及海马各亚区星形胶质细胞数量的影响[J]. 陆军军医大学学报, 2022, 44(10): 975-983. DENG Y H, LUO Y M, LIANG X, et al. Effects of hippocampal PGC-1α on depression-like behaviors and number of astrocytes in hippocampal subregions in mice[J]. J Army Med Univ, 2022, 44(10): 975-983. |
| [28] |
郭一静, 蒋林, 张钐钐, 等. 跑步运动对APP/PS1小鼠内侧前额叶皮质及其小胶质细胞的作用[J]. 陆军军医大学学报, 2022, 44(9): 862-873. GUO Y J, JIANG L, ZHANG S S, et al. Effects of running on medial prefrontal cortex and microglia in APP/PS1 mice[J]. J Army Med Univ, 2022, 44(9): 862-873. |
| [29] |
PERIC I, STANISAVLJEVIC A, INTA D, et al. Tianeptine antagonizes the reduction of PV+ and GAD67 cells number in dorsal hippocampus of socially isolated rats[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2019, 89: 386-399. |
| [30] |
TODOROVIC N, MICIC B, SCHWIRTLICH M, et al. Subregion-specific protective effects of fluoxetine and clozapine on parvalbumin expression in medial prefrontal cortex of chronically isolated rats[J]. Neuroscience, 2019, 396: 24-35. |
| [31] |
KANG J, WANG D, DUAN Y C, et al. Aerobic exercise prevents depression via alleviating hippocampus injury in chronic stressed depression rats[J]. Brain Sci, 2020, 11(1): 9. |
| [32] |
YI Y D, SONG Y L, LU Y S. Parvalbumin interneuron activation-dependent adult hippocampal neurogenesis is required for treadmill running to reverse schizophrenia-like phenotypes[J]. Front Cell Dev Biol, 2020, 8: 24. |