2. 408399 重庆,重庆市垫江县人民医院泌尿外科
2. Department of Urology, Dianjiang People's Hospital of Chongqing, Chongqing, 408399, China
据2022年CA Cancer J Clin报道, 前列腺癌(prostate cancer, PCa) 为男性最常见的恶性肿瘤,也是癌症相关死亡的第二大原因[1]。在我国,前列腺癌发病率近年来逐渐升高,从2008年开始,前列腺癌已经上升为泌尿系统肿瘤第一位[2]。我国的多中心研究资料显示,68%的前列腺癌患者已处于晚期,导致我国前列腺癌患者的总体预后远远差于西方发达国家,而远处转移患者的5年总生存率仅为30%[3]。研究发现前列腺癌的发生发展与多种癌基因过度表达以及抑癌基因的失活密切相关,但是目前对这个过程的具体分子机制尚不完全清楚。因此,进一步探索新的基因功能改变和前列腺癌的发生发展及其恶性特征的关系,对揭示前列腺癌发生发展的分子机制、设计合理的治疗药物及判断预后有重要意义。
激活转录因子6 (activating transcription factor 6, ATF6)是一种定位于内质网的蛋白质,是亮氨酸拉链转录因子家族的成员[4]。作为内质网应激信号因子,ATF6通过将信号转导至顺式受体来发挥核转录因子的作用[5]。ATF6在各种生理过程中发挥着至关重要的作用,包括细胞分化、促存活、细胞凋亡和炎症,而ATF6的这些功能使其自身与肿瘤发生有关[6]。研究表明,ATF6的表达水平在结肠癌中显著增加[7],且高表达的ATF6与癌症转移和复发之间也存在相关性[8]。在前列腺癌中,ATF6的表达水平明显上调,与前列腺癌的恶性程度、预后不良有关[9]。然而,ATF6促进前列腺癌的恶性进展的分子机制尚未得到充分研究。YAP是Hippo信号通路中的关键因子,可以通过影响癌细胞增殖、迁移和侵袭促进肿瘤形成[10-11]。我们前期研究表明,在前列腺癌组织及PC3细胞中YAP呈高表达,且与细胞的增殖和凋亡明显相关[12]。在肝癌细胞中,内质网应激和Hippo-YAP通路之间存在双重调节作用[13]。ATF6作为内质网应激重要因子之一,推测ATF6也能通过激活YAP从而影响前列腺癌细胞的生物学功能。本研究通过生物信息学、荧光素酶报告基因、免疫荧光、细胞实验、动物实验等方法,探讨ATF6在前列腺癌细胞中的作用以及潜在的分子机制,为前列腺癌的诊疗提供新的思路。
1 材料与方法 1.1 病例与组织标本收集2020年3月至2021年12月在重庆医科大学附属第一医院泌尿外科接受手术的前列腺癌组织标本16例,所有患者未接受化疗、放疗和雄激素剥脱治疗。另收集良性前列腺增生组织标本16例作为对照组。本研究经重庆医科大学附属第一医院伦理委员会审查批准实施(批号2022-051)。
1.2 细胞培养和感染RWPE-1、PC3和DU145细胞系购买自美国模式培养物集存库(American Type Culture Collection, ATCC)。RWPE-1细胞在前列腺上皮细胞培养基PEpiCM-b(Sciencell,美国)中培养,DU145细胞在含有10%胎牛血清(Gibco, 美国)的MEM培养基(Gibco, 美国)中培养,PC3细胞在含有10%胎牛血清(Gibco, USA)的F12K培养基(Gibco, 美国)中培养,所有细胞置于37 ℃、5% CO2培养箱内培养。通过慢病毒感染技术,采用含有ATF6 shRNA的pLVX-ShRNA2-puro载体(英杰生命技术有限公司,美国)感染PC3细胞敲降ATF6,对照组采用Scramble shRNA慢病毒载体进行感染,感染后的PC3细胞分别标注为shATF6和shScr细胞。使用含有5 mg/mL嘌呤霉素的培养基进行筛选。通过Western blot和qRT-PCR检测感染效率。见表 1。
| 慢病毒名称 | 慢病毒序列(5′→3′) |
| shATF6-1 | 正义链: GATCCGCAATTGGAAGCAGCAAATGATTCAAGAGATCATTTGCTGCTTCCAATTGCTTTTTTCTCGAGG 反义链: AATTCCTCGAGAAAAAAGCAATTGGAAGCAGCAAATGATCTCTTGAATCATTTGCTGCTTCCAATTGCG |
| shATF6-2 | 正义链: GATCCGCAAAGCAGCAACCAATTATCTTCAAGAGAGATAATTGGTTGCTGCTTTGCTTTTTTCTCGAGG 反义链: AATTCCTCGAGAAAAAAGCAAAGCAGCAACCAATTATCTCTCTTGAAGATAATTGGTTGCTGCTTTGCG |
| shATF6-3 | 正义链: GATCCGCTGTTCAATACACAGAAACCTTCAAGAGAGGTTTCTGTGTATTGAACAGCTTTTTTCTCGAGG 反义链: AATTCCTCGAGAAAAAAGCTGTTCAATACACAGAAACCTCTCTTGAAGGTTTCTGTGTATTGAACAGCG |
| shScramble | 正义链: GATCCGCTCGCCTGTCTACTAACTAATTCAAGAGATTAGTTAGTAGACAGGCGAGCTTTTTTCTCGAGG 反义链: AATTCCTCGAGAAAAAAGCTCGCCTGTCTACTAACTAATCTCTTGAATTAGTTAGTAGACAGGCGAGCG |
1.3 CCK-8实验检测细胞活力
通过CCK-8检测PC3细胞活力的影响。将感染后的PC3细胞接种在96孔板中,每组3个复孔,每孔接种2 000个细胞,分别于24、48、72 h后,每孔加入10 μL CCK-8试剂(七海生物,中国),在37 ℃细胞培养箱中培养2 h后,使用酶标仪检测各组细胞在450 nm处的光密度值。
1.4 EdU实验检测细胞增殖能力通过5-ethynyl-20-deoxyuridine (EdU) 检测试剂盒(锐博生物,中国)检测细胞增殖能力。将感染后的PC3细胞以1×104/孔的密度接种在96孔板中,每组3个复孔,每孔加入300 μL含EdU培养基孵育细胞2 h,其中EdU的终浓度为10 μmol/L。根据试剂盒说明书进行EdU染色。通过荧光显微镜(Olympus,日本)拍照观察并用ImageJ软件(National Institutes of Health,美国)计数。通过计算EdU染色阳性细胞占总细胞的比率来测定细胞增殖能力。
1.5 划痕实验检测细胞迁移能力将感染后的PC3细胞接种于6孔板中,每组3个复孔,当细胞生长到90% 汇合时,使用200 μL枪头均匀划一条直线。0 h和24 h在显微镜(Olympus)下对划痕区域拍照,通过ImageJ软件测量划痕面积。迁移面积计算如下:(0 h时的划痕面积-24 h时的划痕面积)/ 0 h时的划痕面积×100%。
1.6 Transwell侵袭实验检测细胞侵袭能力将8 μm孔径的Transwell小室(康宁,美国)底部均匀涂上80 μL基质胶, 并在37 ℃条件下孵育30 min。将1×105个感染后的PC3细胞悬浮在200 μL无血清F12K培养基中并加入Transwell小室,同时将600 μL含10%胎牛血清的F12K培养基加入下室。孵育24 h后除去上表面的非侵袭细胞,用4%多聚甲醛固定下表面上的侵袭细胞,并用0.5%的结晶紫染色。光学显微镜下随机选择3个视野拍照并通过Image J软件进行细胞计数。
1.7 RNA提取和qRT-PCR检测mRNA的表达水平使用TRIzol试剂盒(TaKaRa,日本)按照说明书要求从组织标本和细胞中提取总RNA,然后使用PrimescriptTMR试剂盒(TaKaRa,日本)按照说明书要求将2 μg RNA逆转录为cDNA,利用TB Green Premix Ex Taq Ⅱ (TaKaRa,日本)进行实时荧光定量PCR,每组设3个复孔。ATF6、YAP、CTGF、Cyr61和GAPDH引物购自美国英杰生命技术有限公司(表 2)。mRNA相对表达量使用2-△Cq△Cq方法计算。
| 基因名称 | 引物序列(5′→3′) |
| ATF6 | 正义链: GCCTTTATTGCTTCCAGCAG 反义链: TGAGACAGCAAAACCGTCTG |
| YAP | 正义链: CAGTGGACTAAGCATGAGCA 反义链: TCAAGGTAGTCTGGGAAACG |
| CTGF | 正义链: CCAATGACAACGCCTCCTG 反义链: TGGTGCAGCCAGAAAGCTC |
| CYR61 | 正义链: AGCCTCGCATCCTATACAACC 反义链: TTCTTTCACAAGGCGGCACTC |
| GAPDH | 正义链: TGGAAGGACTCATGACCACA 反义链: TTCAGCTCAGGGATGACCTT |
1.8 蛋白质提取和Western blot检测蛋白质的表达水平
使用RIPA裂解液(碧云天生物技术,中国)从组织标本和细胞中提取总蛋白。使用BCA蛋白质测定试剂盒(碧云天生物技术,中国)测量蛋白质浓度。将40 μg的蛋白质加到凝胶上进行电泳分离,然后转移到PVDF膜(通用电气,美国)上,含有5%脱脂牛奶的TBST封闭2 h。一抗(ATF6, 1 ∶1 000, Abcam, ab37149; β-actin, 1 ∶1 000, Cell Signaling Technology, No.58169; YAP, 1 ∶1 000, Cell Signaling Technology, No.12395)4 ℃孵育过夜,然后与辣根过氧化物酶偶联的二抗(碧云天生物技术,中国)在室温下孵育2 h。使用ECL试剂盒(Advansta, 美国) 通过GelDoc XR+成像仪(BioRad,美国) 对条带进行化学发光检测。使用Image J软件定量各目的条带的灰度值,用目的蛋白/β-actin来表示目的蛋白的相对表达量。
1.9 转录因子结合位点预测使用转录因子预测数据库JASPAR (http://jaspar.genereg.net)预测ATF6和YAP之间的相互作用。操作流程步骤参考Castro-Mondragon组报道[14],使用JASPAR数据库分析ATF6的结合序列,选择YAP的上游2 000 bp序列来预测相互作用。选择负链上的预测位点用于荧光素酶报告基因检测。
1.10 荧光素酶报告基因检测转录调控通过PCR扩增含有预测的YAP结合序列的启动子区域,并插入荧光素酶载体(吉玛基因,中国),海肾荧光素酶作为内部对照。然后使用Lipofectamine 3000试剂(英杰生命技术有限公司, 美国) 用荧光素酶构建体和内部对照荧光素酶载体转染shScr和shATF6细胞。根据荧光素酶双重测定试剂盒(Omega,美国)说明书操作流程,使用荧光酶标仪(Tecan Spark,中国)检测荧光素酶活性。
1.11 免疫荧光检测YAP蛋白质表达水平及亚细胞分布将细胞接种于盖玻片上生长,待细胞融合率为70%左右时取出盖玻片,用预冷的4%多聚甲醛固定20 min,用0.2%的Triton X-100(Biosharp,中国)通透5 min,然后用含有5%牛血清白蛋白(赛维尔生物科技有限公司,中国)的PBS封闭2 h。一抗在4 ℃孵育过夜,Cy3标记的二抗(英杰生命技术有限公司,美国)室温孵育2 h,滴加DAPI,室温放置3 min,然后使用荧光显微镜拍照观察。
1.12 动物实验评估ATF6在体内对肿瘤生长的影响5只4周龄雄性BALB/c-nu裸鼠购自北京华阜康生物科技股份有限公司,体质量(247±16) g。将感染shATF6的PC3细胞(5×106个细胞)接种于裸鼠右侧背部,并将相同数量的shScramble (shScr)的PC3细胞接种于左侧背部。每周使用游标卡尺沿2个垂直轴测量肿瘤直径。使用以下公式计算肿瘤体积:体积=1/2(长度×宽度×宽度)。接种7周后处死小鼠,取出肿瘤称重。动物实验经重庆医科大学动物伦理委员会审查批准实施(批号2020-020)。
1.13 统计学分析使用SPSS 18.0软件进行数据分析,GraphPad Prism 8.0软件进行统计及绘图。3次重复进行的实验数据表示为x±s。两组之间比较采用t检验。P < 0.05表示差异具有统计学意义。
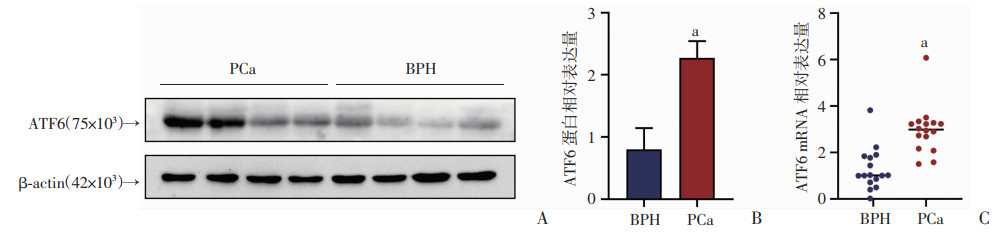
2 结果 2.1 ATF6在前列腺癌组织高表达Western blot和qRT-PCR分析显示,在前列腺癌组织中,ATF6的蛋白质和mRNA水平均高于前列腺增生组织,差异具有统计学意义(P < 0.05)。见图 1。
|
|
a: P < 0.05, 与BPH比较 A:ATF6在前列腺癌组织和前列腺增生组织中的蛋白表达;B:ATF6在前列腺癌组织和前列腺增生组织中的蛋白表达;C:ATF6在前列腺癌组织和前列腺增生组织中的mRNA表达 图 1 ATF6在前列腺癌组织和细胞中的表达水平 |
2.2 慢病毒ATF6-shRNA感染PC3细胞后敲降ATF6的表达
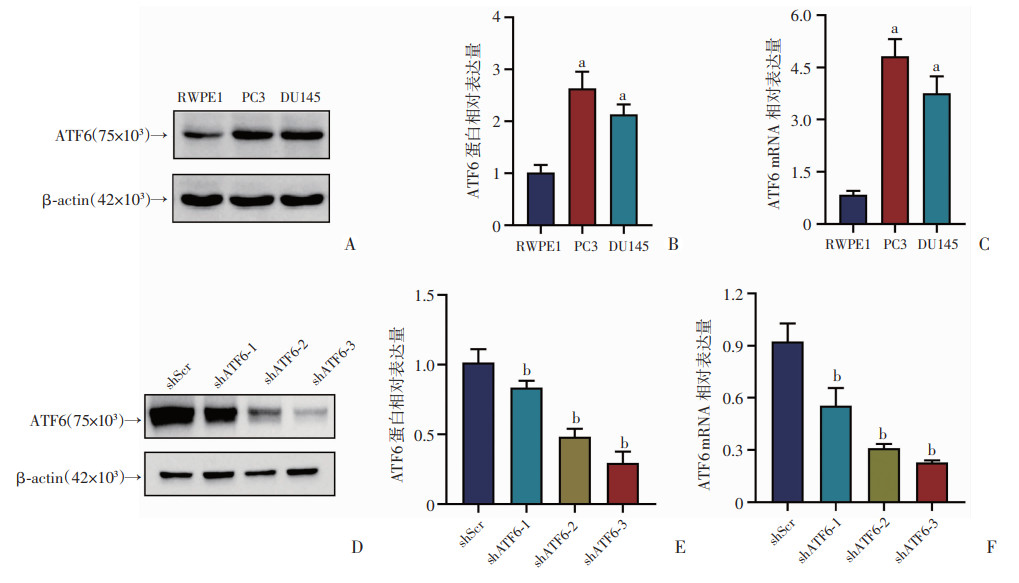
Western blot和qRT-PCR分析显示,在前列腺癌PC3和DU145细胞中,ATF6的蛋白和mRNA表达水平明显高于正常前列腺上皮细胞RWPE1细胞(图 2A~C)。通过慢病毒感染技术,用3种包含不同ATF6特异性shRNA序列的慢病毒分别感染PC3细胞敲降ATF6的表达。采用Western blot和qRT-PCR分析感染效率,结果显示,3条不同序列均能下调ATF6的表达,其中shATF6-3下调最明显(P < 0.05,图 2D~F)。结果表明,shATF6慢病毒成功敲降PC3细胞ATF6的表达。选择感染shATF6-3序列的PC3细胞(shATF6)作进一步研究,感染shScramble序列的PC3细胞(shScr)作为对照组。
|
|
a: P < 0.05, 与RWPE1比较;b: P < 0.05, 与shScr比较 A:Western blot检测ATF6在不同前列腺癌细胞系中的蛋白质表达;B:ATF6在不同前列腺癌细胞系中的蛋白质相对表达量;C:ATF6在不同前列腺癌细胞系中的mRNA表达;D:Western blot检测ATF6在感染慢病毒的PC3细胞中的蛋白质表达;E:ATF6在感染慢病毒的PC3细胞中的蛋白质相对表达量;F:ATF6在感染慢病毒的PC3细胞中的mRNA表达 图 2 慢病毒ATF6-shRNA感染PC3细胞后敲降ATF6的表达 |
2.3 敲降ATF6后抑制PC3细胞增殖、迁移和侵袭能力
EdU染色实验结果显示(图 3A、B),敲降ATF6后PC3细胞的增殖活性明显低于对照组(P < 0.05)。CCK-8实验结果显示(图 3C),敲降ATF6后PC3细胞的增殖活性明显低于对照组(P < 0.05)。划痕实验结果显示(图 3D、E),敲降ATF6后PC3细胞的24 h迁移面积率明显低于对照组(P < 0.05),表明敲降ATF6能抑制PC3细胞的迁移能力。Transwell侵袭实验结果显示(图 3F、G),与对照组相比,敲降ATF6后PC3细胞的侵袭能力明显受到抑制(P < 0.05)。以上结果表明,敲降ATF6后能够抑制前列腺癌PC3细胞的增殖、迁移和侵袭能力。

|
|
a: P < 0.05, 与shScr比较 A:EdU实验检测细胞增殖能力;B:EdU阳性细胞率统计;C:CCK8实验检测细胞活力;D:划痕实验检测细胞迁移能力;E:划痕实验细胞相对迁移面积统计;F:Transwell实验检测细胞侵袭能力;G:侵袭细胞数量统计 图 3 敲降ATF6后抑制PC3细胞增殖、迁移和侵袭能力 |
2.4 敲降ATF6抑制体内肿瘤生长
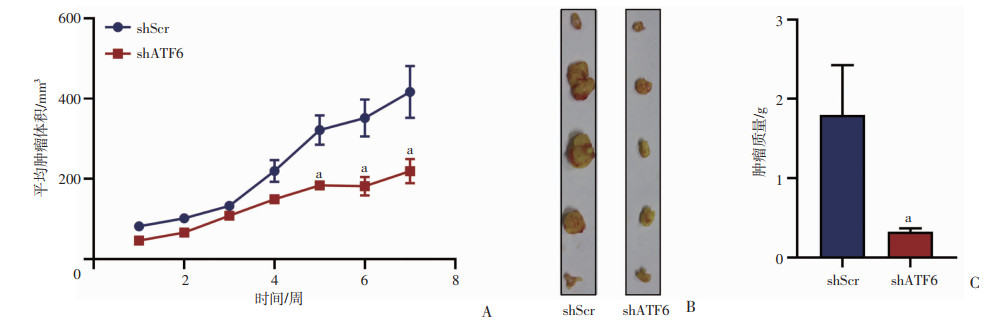
与对照组相比,ATF6敲降组肿瘤大小在第5、6周和第7周均较低(P < 0.05)。第7周时,处死小鼠取出肿瘤后拍照,并对肿瘤进行称重,结果发现敲降组的质量明显低于对照组(P < 0.05,图 4)。结果表明,敲降ATF6能在体内抑制前列腺癌的生长。
|
| A:接种细胞后肿瘤体积的变化;B:接种7周后同一时间段取出的对照组和ATF6敲降组肿瘤标本(n=5);C:肿瘤质量统计;a: P < 0.05, 与shScr比较 图 4 敲降ATF6抑制体内肿瘤生长 |
2.5 ATF6调节YAP和下游基因的转录
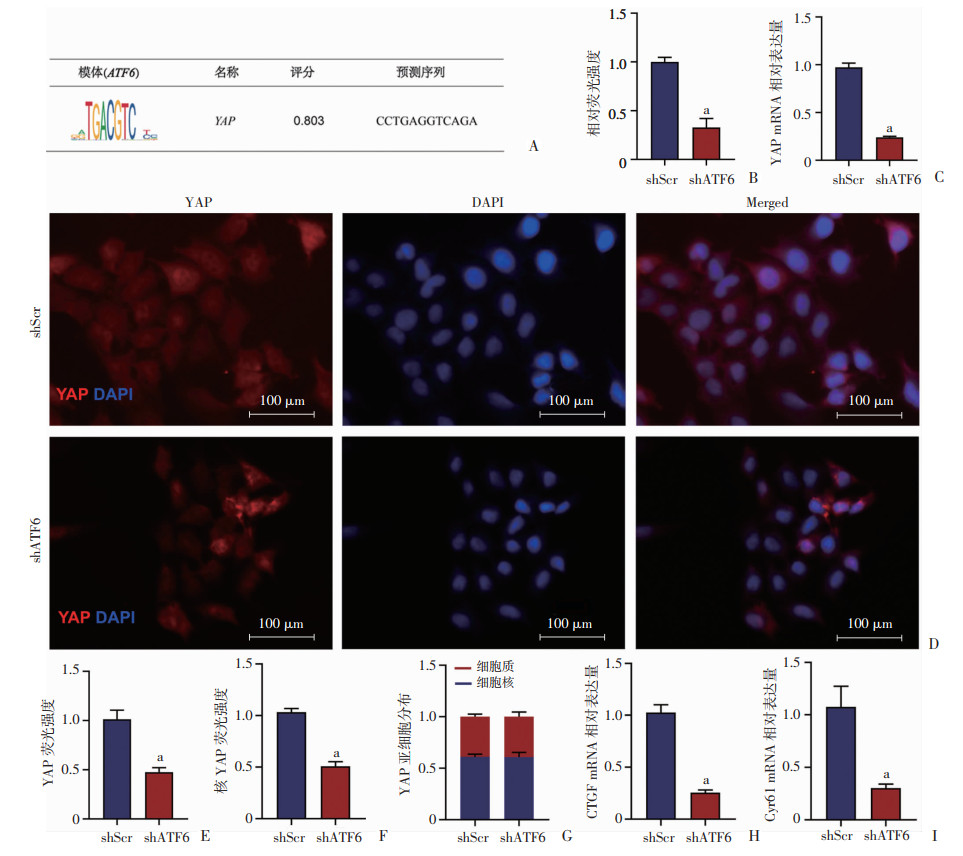
通过JASPAR数据库(www.jaspar.genereg.net)预测ATF6和YAP之间是否存在相互作用,结果表明,YAP启动区域包含一个与ATF6结合的序列(图 5A)。荧光素酶报告基因结果显示,敲降ATF6后YAP启动子驱动的荧光素酶活性明显下调(P < 0.05),进一步证实ATF6与YAP之间存在直接相互作用(图 5B)。qRT-PCR分析显示(图 5C),敲降ATF6后PC3细胞中YAP的mRNA水平下调。免疫荧光分析显示,敲降ATF6后细胞中总YAP和核内YAP表达均降低(P < 0.05),但YAP的亚细胞分布保持不变(图 5D~G)。qRT-PCR分析显示,敲降ATF6后CTGF和Cyr61的mRNA表达均下调(P < 0.05,图 5H、I)。以上结果表明ATF6能调控YAP下游基因的转录。
|
|
a: P < 0.05, 与shScr比较 A:JASPAR数据库预测结果;B:荧光素酶报告基因检测荧光强度;C:qRT-PCR检测YAP的mRNA表达水平;D:免疫荧光检测YAP的蛋白质表达水平和亚细胞分布;E:总YAP蛋白质荧光强度;F:核YAP蛋白质荧光强度;G:YAP蛋白质亚细胞分布;H:qRT-PCR检测CTGF的mRNA表达水平;I:qRT-PCR检测Cyr61的mRNA表达水平 图 5 ATF6调节YAP和下游基因的转录 |
3 讨论
前列腺癌为最常见的男性泌尿系肿瘤,在西方国家其发病率仅次于肺癌。随着中国人口老龄化加剧等原因,我国前列腺癌发病率和死亡率近年来呈明显上升趋势,逐步成为影响我国中老年男性健康的首要问题。因此,探究前列腺癌恶性进展机制尤为重要。本课题组前期研究发现[9],ATF6在前列腺癌组织中高表达,且与前列腺癌的恶性程度呈正相关。然而国际上ATF6在前列腺癌中致癌分子机制尚不明确。
ATF6是定位于内质网上的内质网应激感受因子,通过将信号转导至顺式受体来发挥核转录因子的作用。根据课题组前期研究[9],ATF6的高表达与前列腺癌患者高T分期、高Gleason评分以及高血清PSA水平明显相关,且ATF6高表达患者手术后发生肿瘤特异性死亡时间以及去势治疗后发生生化复发时间明显缩短,这提示ATF6在前列腺癌恶性进展过程中具有重要作用,但其具体作用机制尚需要进一步研究。为此本研究重点对ATF6在前列腺癌细胞中的作用进行研究,结果发现ATF6在前列腺癌细胞表达水平高于正常前列腺上皮细胞,且在PC3细胞中表达水平最高,通过慢病毒感染PC3细胞敲降ATF6后,能明显抑制PC3细胞的增殖、迁移和侵袭能力,并且动物实验证实,敲降ATF6后抑制体内肿瘤生长,表明ATF6在前列腺癌发生发展过程中起促进作用。
YAP是Hippo信号通路中的关键因子,主要参与调节细胞增殖、器官发育和肿瘤的发生[15]。YAP可以通过影响癌细胞增殖、迁移和侵袭促进肿瘤形成[10-11]。研究表明,YAP蛋白的表达与头颈部鳞状细胞癌、非小细胞肺癌、卵巢癌、肝细胞癌、胃癌、肾透明细胞癌以及前列腺癌的发生发展明显相关[16-22]。在前列腺癌PC3及DU145细胞中YAP呈高表达,且与细胞的增殖和凋亡有关[12, 23]。YAP的活性受到机械力、G蛋白偶联受体信号传导和内质网应激的影响[24]。有研究表明,软组织肉瘤中Yap/NF-κB轴能抑制ATF6,这与分化过程中的生物钟活动和存活有关[25]。还有研究表明,当用内质网应激抑制剂处理细胞时,能下调YAP的蛋白质水平和激活,过表达或下调人肝癌细胞YAP时,能促进或抑制细胞内质网应激水平,而这一过程与ATF6明显相关,表明内质网应激和Hippo-YAP通路之间存在双重调节作用[13]。因此推测ATF6作为内质网应激重要因子之一,通过激活YAP从而影响前列腺癌细胞的生物学功能。本研究通过JASPAR数据库预测发现,ATF6与YAP启动序列之间存在结合位点,因此推测ATF6能够直接调控YAP的激活,荧光素酶报告基因结果进一步证实ATF6与YAP的直接联系。在前列腺癌PC3细胞中,敲降ATF6后明显抑制了YAP的转录水平。CTGF和Cyr61是YAP的两个下游因子,由YAP介导的转录促进并参与许多癌症的肿瘤进展[26-28]。研究表明YAP在激活后转移至细胞核并与TEAD4结合,促进下游基因CTGF和Cyr61的转录以促进细胞增殖和迁移[29]。与敲降ATF6后YAP转录减少一致,CTGF和Cyr61的mRNA水平也显著下调。以上结果表明,敲降ATF6可以直接抑制YAP的转录,从而参与诱导前列腺癌细胞增殖、迁移和侵袭。
综上所述,本研究发现ATF6在前列腺癌组织和前列腺癌细胞中表达升高,敲降ATF6能够抑制前列腺癌PC3细胞的增殖、迁移和侵袭能力,这一过程可能与ATF6靶向调节YAP转录有关,揭示了ATF6-YAP这一新的信号通路,提示靶向ATF6-YAP轴的药物可能是前列腺癌的潜在治疗策略,为前列腺癌的精准诊疗提供了新的思路。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. |
| [2] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. |
| [3] |
REBELLO R J, OING C, KNUDSEN K E, et al. Prostate cancer[J]. Nat Rev Dis Primers, 2021, 7: 9. |
| [4] |
HILLARY R F, FITZGERALD U. A lifetime of stress: ATF6 in development and homeostasis[J]. J Biomed Sci, 2018, 25(1): 48. |
| [5] |
YAMAMOTO K, YOSHIDA H, KOKAME K, et al. Differential contributions of ATF6 and XBP1 to the activation of endoplasmic Reticulum stress-responsive Cis-acting elements ERSE, UPRE and ERSE-Ⅱ[J]. J Biochem, 2004, 136(3): 343-350. |
| [6] |
WU X P, XIN Z H, ZHANG W, et al. A missense polymorphism in ATF6 gene is associated with susceptibility to hepatocellular carcinoma probably by altering ATF6 level[J]. Int J Cancer, 2014, 135(1): 61-68. |
| [7] |
LIU C Y, HSU C C, HUANG T T, et al. ER stress-related ATF6 upregulates CIP2A and contributes to poor prognosis of colon cancer[J]. Mol Oncol, 2018, 12(10): 1706-1717. |
| [8] |
SIWECKA N, ROZPEDEK W, PYTEL D, et al. Dual role of endoplasmic Reticulum stress-mediated unfolded protein response signaling pathway in carcinogenesis[J]. Int J Mol Sci, 2019, 20(18): E4354. |
| [9] |
LIU J N, XIAO M L, LI J J, et al. Activation of UPR signaling pathway is associated with the malignant progression and poor prognosis in prostate cancer[J]. Prostate, 2017, 77(3): 274-281. |
| [10] |
ZANCONATO F, CORDENONSI M, PICCOLO S. YAP/TAZ at the roots of cancer[J]. Cancer Cell, 2016, 29(6): 783-803. |
| [11] |
PANCIERA T, AZZOLIN L, CORDENONSI M, et al. Mechanobiology of YAP and TAZ in physiology and disease[J]. Nat Rev Mol Cell Biol, 2017, 18(12): 758-770. |
| [12] |
SHENG X, LI W B, WANG D L, et al. YAP is closely correlated with castration-resistant prostate cancer, and downregulation of YAP reduces proliferation and induces apoptosis of PC-3 cells[J]. Mol Med Rep, 2015, 12(4): 4867-4876. |
| [13] |
WU H T, WEI L Y, FAN F Q, et al. Integration of Hippo signalling and the unfolded protein response to restrain liver overgrowth and tumorigenesis[J]. Nat Commun, 2015, 6: 6239. |
| [14] |
CASTRO-MONDRAGON J A, RIUDAVETS-PUIG R, RAULUSEVICIUTE I, et al. JASPAR 2022: the 9th release of the open-access database of transcription factor binding profiles[J]. Nucleic Acids Res, 2021, 50(D1): D165-D173. |
| [15] |
YU F X, ZHAO B, GUAN K L. Hippo pathway in organ size control, tissue homeostasis, and cancer[J]. Cell, 2015, 163(4): 811-828. |
| [16] |
GE L, SMAIL M, MENG W X, et al. Yes-associated protein expression in head and neck squamous cell carcinoma nodal metastasis[J]. PLoS One, 2011, 6(11): e27529. |
| [17] |
WANG Y, DONG Q Z, ZHANG Q F, et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer[J]. Cancer Sci, 2010, 101(5): 1279-1285. |
| [18] |
XIA Y, CHANG T, WANG Y M, et al. YAP promotes ovarian cancer cell tumorigenesis and is indicative of a poor prognosis for ovarian cancer patients[J]. PLoS One, 2014, 9(3): e91770. |
| [19] |
XU M Z, YAO T J, LEE N P, et al. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma[J]. Cancer, 2009, 115(19): 4576-4585. |
| [20] |
CAO J J, ZHAO X M, WANG D L, et al. YAP is overexpressed in clear cell renal cell carcinoma and its knockdown reduces cell proliferation and induces cell cycle arrest and apoptosis[J]. Oncol Rep, 2014, 32(4): 1594-1600. |
| [21] |
ZHANG L, YANG S P, CHEN X C, et al. The hippo pathway effector YAP regulates motility, invasion, and castration-resistant growth of prostate cancer cells[J]. Mol Cell Biol, 2015, 35(8): 1350-1362. |
| [22] |
PAN Z J, TIAN Y Q, ZHANG B, et al. YAP signaling in gastric cancer-derived mesenchymal stem cells is critical for its promoting role in cancer progression[J]. Int J Oncol, 2017, 51(4): 1055-1066. |
| [23] |
JIN X, ZHAO W C, ZHOU P, et al. YAP knockdown inhibits proliferation and induces apoptosis of human prostate cancer DU145 cells[J]. Mol Med Rep, 2018, 17(3): 3783-3788. |
| [24] |
YU F X, ZHAO B, PANUPINTHU N, et al. Regulation of the Hippo-YAP pathway by G-protein-coupled receptor signaling[J]. Cell, 2012, 150(4): 780-791. |
| [25] |
RIVERA-REYES A, YE S, E MARINO G, et al. YAP1 enhances NF-κB-dependent and independent effects on clock-mediated unfolded protein responses and autophagy in sarcoma[J]. Cell Death Dis, 2018, 9: 1108. |
| [26] |
CHENG T Y, WU M S, HUA K T, et al. Cyr61/CTGF/Nov family proteins in gastric carcinogenesis[J]. World J Gastroenterol, 2014, 20(7): 1694-1700. |
| [27] |
HSU Y L, HUNG J Y, CHOU S H, et al. Angiomotin decreases lung cancer progression by sequestering oncogenic YAP/TAZ and decreasing Cyr61 expression[J]. Oncogene, 2015, 34(31): 4056-4068. |
| [28] |
LAI D, HO K C, HAO Y W, et al. Taxol resistance in breast cancer cells is mediated by the hippo pathway component TAZ and its downstream transcriptional targets Cyr61 and CTGF[J]. Cancer Res, 2011, 71(7): 2728-2738. |
| [29] |
SHOME D, VON WOEDTKE T, RIEDEL K, et al. The HIPPO transducer YAP and its targets CTGF and Cyr61 drive a paracrine signalling in cold atmospheric plasma-mediated wound healing[J]. Oxid Med Cell Longev, 2020, 2020: 4910280. |




