2型糖尿病(type 2 diabetes,T2DM)患者在糖尿病群体中占比超过90%,患者因胰岛素抵抗或伴胰岛素分泌异常,糖脂代谢紊乱,易发生心血管、肝、肾、骨骼、神经等多系统并发症。糖尿病性骨质疏松症(diabetic osteoporosis,DOP)是T2DM患者骨骼系统常见并发症,发病率高达37.8%[1],患者多呈现骨矿物质密度降低、骨脆性增加等特征。
大豆异黄酮属于植物雌激素,可发挥抗动脉粥样硬化、改善胰岛素分泌障碍、抑制癌症发生、抗骨质疏松症等多种生物学效应[2]。雌马酚(equol,Eq)是大豆异黄酮在体内代谢的终产物之一,其生物学效应较大豆异黄酮更强。课题组前期研究发现Eq可促进成骨细胞增殖,改善患者绝经后骨质疏松症[3-4]。绝经后骨质疏松症以雌激素缺乏为主要发病机制,而DOP的发病涉及糖脂代谢毒性、细胞因子水平变化、氧化应激、炎症反应、糖尿病并发症等多种因素,其发病机制相较于绝经后骨质疏松症更为复杂[5]。迄今为止关于Eq对DOP的疗效及机制鲜有报道。本研究开展体外实验探讨Eq在高糖高脂环境下对成骨细胞增殖和凋亡的影响及机制,为DOP的预防和治疗提供新的实验依据。
1 材料与方法 1.1 材料本研究主要使用的材料:ROS17/2.8成骨细胞(武汉普诺赛生命科技有限公司),S-雌马酚(上海大赛璐药物手性技术有限公司),高糖高脂试剂盒(西安鲲创科技发展有限公司),细胞周期与凋亡检测试剂盒(上海碧云天公司)、Annexin V-EGFP/PI细胞凋亡检测试剂盒(武汉赛维尔公司),磷脂酰肌醇3激酶(phosphatidyl inositol 3 kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)及磷酸化PI3K、AKT多克隆抗体(p-PI3K,p-AKT)(美国Proteintech公司),细胞周期蛋白D1(Cyclin D1)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl2-Associated X,Bax)、切割型半胱氨酸天冬氨酸蛋白水解酶-3(cleaved caspase-3)多克隆抗体(上海Abmart公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)单克隆抗体(上海碧云天公司),LY294002(PI3K抑制剂,上海碧云天公司)。
1.2 方法 1.2.1 细胞培养ROS17/2.8细胞在DMEM培养基(10%胎牛血清,1%青-链霉素)中培养。在细胞密度达80%后,胰酶消化细胞然后离心、重悬、传代。在培养箱内(37 ℃,5% CO2)传至第3代后收集对数期细胞进行后续实验。
1.2.2 细胞分组及干预采用25 mmol/L葡萄糖+250 μmol/L棕榈酸钠模拟T2DM机体成骨细胞高糖高脂细胞微环境,S-Eq粉剂溶于DMSO溶剂配制不同浓度梯度Eq母液。实验分组依次为对照组(C组,5.5 mmol/L葡萄糖)、模型组(M组,25mmol/L葡萄糖+250 μmol/L棕榈酸钠)、Eq-7组(25 mmol/L葡萄糖+250 μmol/L棕榈酸钠,1×10-7 mol/L Eq)、Eq-6组(25 mmol/L葡萄糖+250 μmol/L棕榈酸钠,1×10-6mol/L Eq)、Eq-5组(25 mmol/L葡萄糖+250 μmol/L棕榈酸钠,1×10-5mol/L Eq),药物干预24 h后进行后续检测。
1.2.3 CCK-8检测细胞活力细胞接种于96孔板(5×103/孔),待细胞贴壁后更换低血清DMEM培养基(5% FBS),按1.2.2所述进行分组干预,每组6个复孔,24 h后CCK-8检测细胞活力,重复实验3次。细胞存活率=[(As-Ab)/(Ac-Ab)]×100%,细胞抑制率=[(Ac-As)/(Ac-Ab)]×100%。As: 实验孔吸光度;Ac: 对照孔吸光度;Ab: 空白孔吸光度。
1.2.4 HE染色观察细胞形态细胞接种于6孔板(2×104/孔),制备细胞爬片,待细胞贴壁后更换低血清DMEM培养基,分组干预24 h后取出爬片,HE染色检测细胞形态变化。
1.2.5 流式细胞术检测细胞凋亡分组干预24 h后收集细胞,PBS洗涤、重悬后依次加入Loading Buffer、PI、Annexin V-FITC染液,避光孵育10 min后流式细胞仪检测细胞凋亡。
1.2.6 流式细胞术检测细胞周期分组干预24 h后收集细胞,经PBS洗涤、70%乙醇4 ℃固定、PBS重悬,依次加入Loading Buffer、PI、RNase A染液,37 ℃避光孵育30 min,流式细胞仪检测细胞周期。
1.2.7 Western blot实验细胞经离心、裂解后获取蛋白上清,按照常规操作进行电泳、转膜、封闭,一抗4 ℃孵育过夜,TBST洗膜3×10 min后二抗室温孵育1 h,TBST洗膜3×10 min,ECL显影液显影,以GAPDH为内参,Image J软件计算各组蛋白相对表达量。
1.2.8 联合PI3K抑制剂细胞干预分组依次为C组(5.5 mmol/L葡萄糖)、M组(25 mmol/L葡萄糖+250 μmol/L棕榈酸钠)、Eq组(25 mmol/L葡萄糖+250 μmol/L棕榈酸钠,1×10-5mol/L Eq)、Eq+LY294002组(Eq组联合LY294002),M+LY294002组(M组联合LY294002),重复前述实验步骤。
1.3 统计学分析采用SPSS 19.0软件对数据进行统计学检验。用x±s表示计量资料,多组间比较采用单因素方差分析,两组间比较采用LSD检验。检验标准设定α=0.05,当P < 0.05为差异具有统计学意义。
2 结果 2.1 Eq改善高糖高脂环境下ROS17/2.8细胞活性及形态结构CCK-8结果显示,与C组比较,M组细胞存活率降低、细胞抑制率增加(P < 0.05),细胞萎缩,细胞胞质和胞核浓缩,细胞凸起回缩或消失。与M组比较,各Eq干预组细胞存活率显著增加、细胞抑制率显著降低(P < 0.05),细胞形态结构损伤明显减轻,且Eq的干预效应随浓度升高而增强。见图 1。
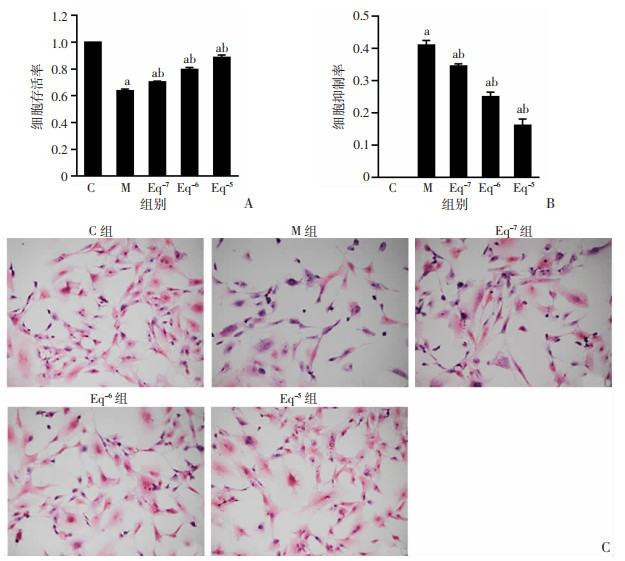
|
| A:CCK-8检测高糖高脂环境下不同浓度Eq干预对ROS17/2.8细胞存活率的影响;B:CCK-8检测高糖高脂环境下不同浓度Eq干预对ROS17/2.8细胞抑制率的影响a:P < 0.001,与C组比较;b:P < 0.001,与M组比较;C:HE染色检测高糖高脂环境下不同浓度Eq干预对ROS17/2.8细胞形态的影响(×200) 图 1 Eq改善高糖高脂环境下ROS17/2.8细胞活性及形态结构(n=6,x±s) |
2.2 Eq减少高糖高脂环境下ROS17/2.8细胞凋亡、加快细胞周期
流式细胞术结果显示,M组细胞凋亡率为(20.53±1.02)%,细胞周期G1期比例为(53.90±4.36)%,均显著高于C组(P < 0.05),细胞周期S期比例为(24.2±0.26)%,显著低于C组(P < 0.05)。与M组相比,各Eq组细胞凋亡率显著降低(P < 0.05),细胞周期G1期比例减少、S期比例增加(P < 0.05),且Eq对细胞周期、细胞凋亡的调控效应随着浓度升高而增强,在S-Eq浓度达到10-5mol/L时,细胞凋亡率降至(9.03±0.44)%,细胞周期G1期降至(37.63±1.45)%,S期比例升至(35.53±1.00)%。见图 2。
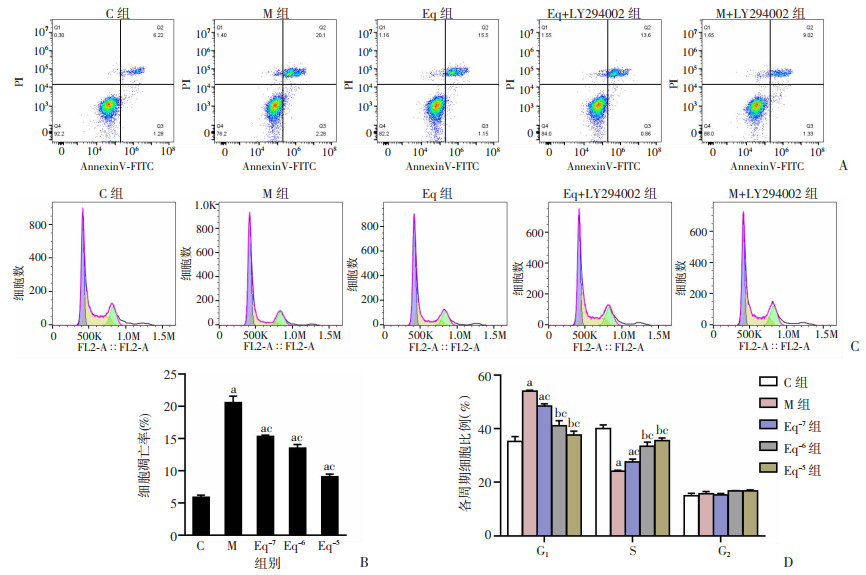
|
| A:流式细胞术检测高糖高脂环境下不同浓度Eq干预对ROS17/2.8细胞凋亡的影响;B: 高糖高脂环境下不同浓度Eq干预后ROS17/2.8细胞凋亡比例;C:流式细胞术检测高糖高脂环境下不同浓度Eq干预对ROS17/2.8细胞周期的影响; D: 高糖高脂环境下不同浓度Eq干预后ROS17/2.8细胞各周期比例a:P < 0.001,b:P < 0.01,与C组比较;c:P < 0.001,与M组比较 图 2 Eq对高糖高脂环境下ROS17/2.8细胞凋亡及周期的影响(n=3,x±s) |
2.3 Eq调节高糖高脂环境下ROS17/2.8细胞相关蛋白的表达
Western blot结果显示,与C组比较,M组ROS17/2.8成骨细胞PI3K、AKT磷酸化程度显著下调(P < 0.05),Bax、cleaved caspase-3表达增加(P < 0.05),Bcl-2、Cyclin D1表达减少(P < 0.05)。与M组比较,Eq干预可上调PI3K、AKT磷酸化程度(P < 0.05),抑制Bax、cleaved caspase-3表达、促进Bcl-2、Cyclin D1表达(P < 0.05),且Eq对上述蛋白表达的调控效应随着浓度升高而增强。见图 3。
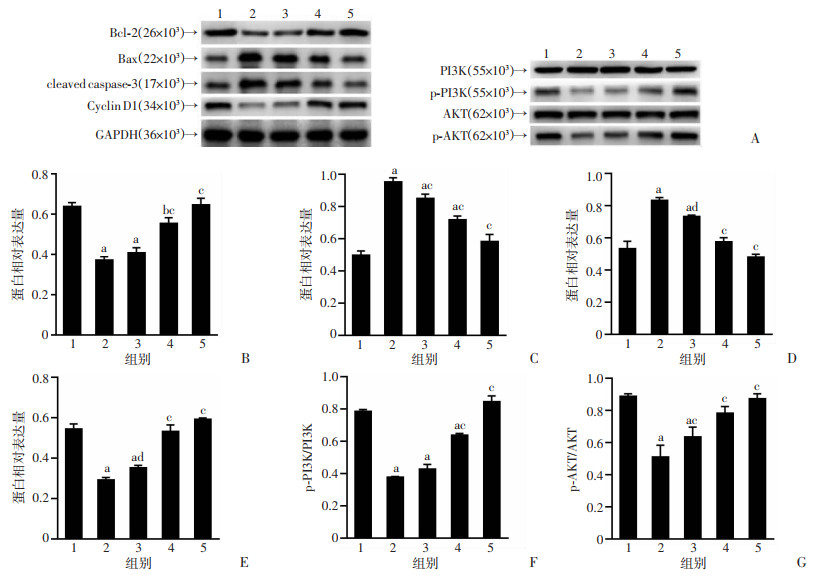
|
| A:Western blot检测高糖高脂环境下不同浓度Eq干预对ROS17/2.8细胞蛋白表达的影响;B~G:Bcl-2、Bax、cleaved caspase-3、Cyclin D1、p-PI3K、p-AKT的蛋白相对表达量;1:C组;2:M组;3:Eq-7组;4:Eq-6组;5:Eq-5组;a:P < 0.001,b:P < 0.05,与C组比较;c:P < 0.001,d:P < 0.01,与M组比较 图 3 Eq对高糖高脂环境下ROS17/2.8细胞相关蛋白表达的影响(n=3,x±s) |
2.4 LY294002显著降低Eq对高糖高脂环境下ROS17/2.8细胞活性的影响
与M组比较,Eq组细胞存活率显著增加、细胞抑制率显著降低(P < 0.05),分别为(83.53±1.69)%、(16.47±1.69)%。与Eq组比较,Eq+LY294002组细胞存活率显著降低、细胞抑制率显著增加(P < 0.05),分别为(61.12±1.05)%、(38.89±1.05)%。见图 4。
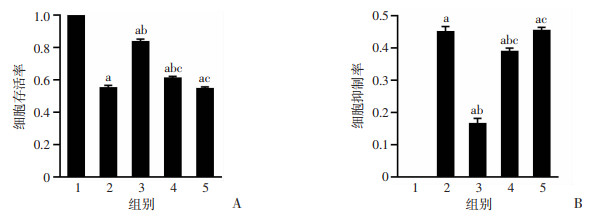
|
| A:CCK-8检测高糖高脂环境下Eq联合LY294002干预对ROS17/2.8细胞存活率的影响,B:CCK-8检测高糖高脂环境下Eq联合LY294002干预对ROS17/2.8细胞抑制率的影响1:C组;2:M组;3:Eq组;4:Eq+LY294002组;5:M+LY294002组;a:P < 0.001,与C组比较;b:P < 0.001,与M组比较;c:P < 0.001,与Eq组比较 图 4 联合LY294002后Eq对高糖高脂环境下ROS17/2.8细胞活性的影响(n=6,x±s) |
2.5 LY294002显著降低Eq对高糖高脂环境下ROS17/2.8细胞凋亡和周期的影响
流式细胞术结果显示,Eq组细胞凋亡率(11.13±2.30)%、细胞周期G1期比例(41.3±1.51)%,均显著低于M组(P < 0.05),细胞周期S期比例为(38.57±1.35)%,显著高于M组(P < 0.05)。与Eq组相比,Eq+LY294002组细胞凋亡率显著升高(P < 0.05),达(16.57±2.31)%,细胞周期G1期比例显著增加(P < 0.05)、S期比例明显降低(P < 0.05),分别为(50.80±1.57)%、(30.93±2.20)%。见图 5。
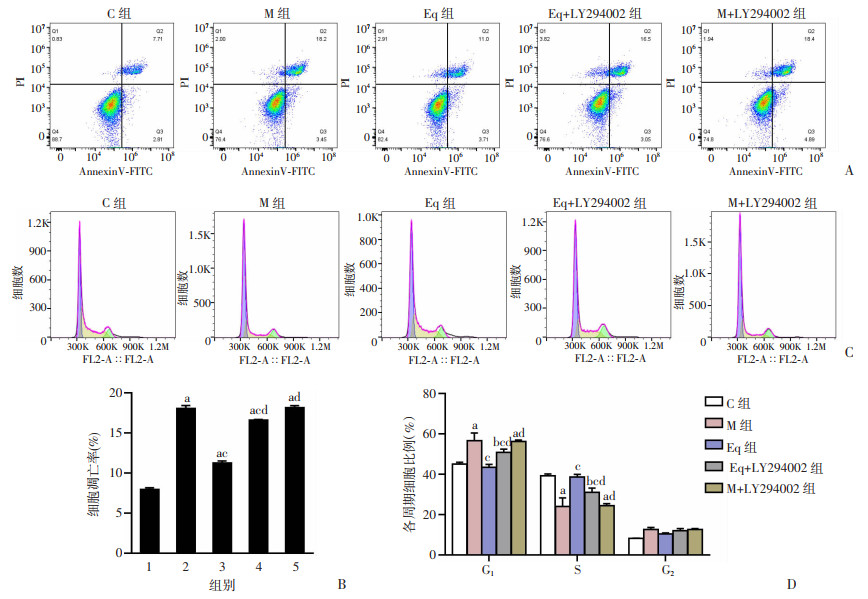
|
| A:高糖高脂环境下Eq联合LY294002干预对ROS17/2.8细胞凋亡的影响;B:高糖高脂环境下Eq联合LY294002干预后ROS17/2.8细胞凋亡率;C:高糖高脂环境下Eq联合LY294002干预对ROS17/2.8细胞周期的影响;D: 高糖高脂环境下Eq联合LY294002干预后ROS17/2.8细胞各周期比例1:C组;2:M组;3:Eq组;4:Eq+LY294002组;5:M+LY294002组;a:P < 0.001,b:P < 0.01,与C组比;c:P < 0.001,与M组比较;d:P < 0.001,与Eq组比较 图 5 联合LY294002后Eq对高糖高脂环境下ROS17/2.8细胞凋亡和周期的影响(n=3,x±s) |
2.6 LY294002显著降低Eq对高糖高脂环境下ROS17/2.8细胞相关蛋白表达的调控作用
Western blot结果显示,与M组比较,Eq干预可显著上调AKT磷酸化程度,促进Bcl-2、Cyclin D1蛋白表达、抑制Bax、cleaved caspase-3表达(P < 0.05)。与Eq组比较,Eq+LY294002组AKT磷酸化程度受到显著抑制,Bcl-2、Cyclin D1蛋白表达显著下调,Bax、cleaved caspase-3表达显著上调(P < 0.05)。见图 6。
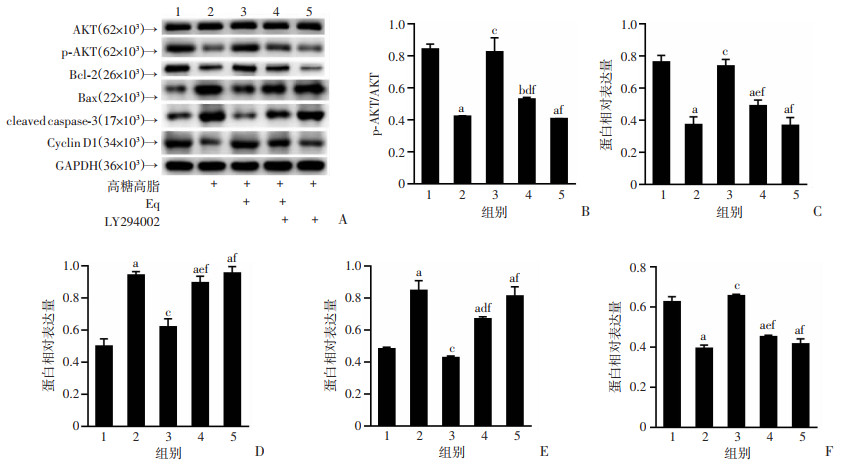
|
| A:Western blot检测高糖高脂环境下Eq联合LY294002干预对ROS17/2.8细胞蛋白表达的影响;B~F:p-AKT、Bcl-2、Bax、cleaved caspase-3、CyclinD1的蛋白相对表达量1:C组;2:M组;3:Eq组;4:Eq+LY294002组;5:M+LY294002组;a:P < 0.001,b:P < 0.01,与C组比较;c:P < 0.001,d:P < 0.01,e:P < 0.05,与M组比较;f:P < 0.001, 与Eq组比较 图 6 联合LY294002后Eq对高糖高脂环境下ROS17/2.8细胞相关蛋白表达的影响(n=3,x±s) |
3 讨论
Eq是植物雌激素大豆异黄酮的体内代谢产物,与大豆异黄酮相比,Eq的结构更稳定、生物学效应更强。研究表明大豆异黄酮对人体的健康效应与机体能否将大豆异黄酮代谢为Eq密切相关[6],能将大豆异黄酮代谢为Eq者可通过摄入大豆异黄酮获得更大的健康益处。自Eq被首次分离提取后,应用于多种疾病的预防和治疗研究[7-8]。但目前关于Eq对DOP是否具有改善作用及机制鲜有研究报道。本研究探讨Eq对高糖高脂环境下成骨细胞增殖、凋亡的影响及其机制。
3.1 Eq对高糖高脂环境下成骨细胞的保护作用糖脂代谢紊乱是T2DM患者最显著临床特征,主要表现为高糖高脂血症[9]。本研究采用葡萄糖联合棕榈酸钠模拟T2DM患者机体成骨细胞高糖高脂微环境[10]。CCK-8结果显示,在高糖高脂(25 mmol/L葡萄糖+250 umol/L棕榈酸钠)环境下成骨细胞存活率显著降低、细胞抑制率显著增加。结合HE染色发现,高脂高糖环境导致成骨细胞形态结构明显损伤,而在给予不同浓度梯度Eq干预后,可显著提高成骨细胞存活率、改善成骨细胞形态结构,且呈浓度梯度趋势。此外,流式细胞术检测结果显示高糖高脂环境下成骨细胞凋亡率增高,细胞周期G1期比例增加、S期比例降低。细胞周期主要由G1/S期、G2/M期、纺锤体装配3个检测点进行调节,细胞周期进展的关键在于G1/S期的过渡[11]。高脂高糖环境下成骨细胞的细胞周期阻滞于G1期,提示成骨细胞的增殖分裂能力降低,而Eq干预不仅降低了成骨细胞凋亡率,还能加快G1/S期进展,促进成骨细胞分裂增殖,且Eq的干预效应随浓度升高而增强。
3.2 PI3K/AKT通路与成骨细胞的增殖、凋亡PI3K/AKT通路是调节骨骼生长发育的关键通路,在成骨细胞增殖、凋亡等生理过程中发挥重要作用。PI3K/AKT通路由PI3K、中间效应因子、AKT构成,在受体酪氨酸激酶激活后,PI3K将磷脂酰肌醇-二磷酸磷酸化,导致磷脂酰肌醇-三磷酸积累并激活AKT,调控下游Cyclin D1、胰岛素样生长因子1、Runt相关转录因子2、Bax、Bcl-2等多种蛋白表达,进而调节成骨细胞的增殖、分化和凋亡过程[12]。而T2DM可降低成骨细胞PI3K和AKT的磷酸化程度、抑制PI3K/AKT通路效应,是DOP发生发展的重要促进因素[13]。Cyclin D1是调控细胞周期G1期的关键蛋白,能够推动细胞周期由G1期向S期转换,在整个细胞周期进展及细胞增殖中发挥关键作用。文献[14]指出,在PI3K/AKT通路受抑制后,GSK-3β等磷酸化程度升高,Cyclin D1蛋白经泛素蛋白酶体降解增多,细胞增殖分裂受抑制。Bcl-2基因家族属于原癌基因家族,在调控线粒体途径介导的细胞凋亡中发挥重要作用,该基因家族表达的Bcl-2属于抗凋亡蛋白,可通过蛋白的跨膜锚定区锚定于线粒体外膜,抑制线粒体细胞色素C的释放及caspase-3的活化,减少线粒体介导的细胞凋亡。Bax功能与Bcl-2相反,是Bcl-2家族最重要的促凋亡因子,可与Bcl-2构成异源二聚体,改变线粒体膜通透性、激活caspase-3,导致细胞凋亡增加。相关研究发现PI3K/AKT通路抑制可导致成骨细胞Bcl-2/Bax比例降低,cleaved caspase-3表达增多,导致细胞凋亡[15]。
3.3 Eq激活PI3K/AKT通路、调控下游靶蛋白表达Western blot结果显示,高糖高脂环境下成骨细胞PI3K及AKT磷酸化程度显著降低,与王昆[16]研究结果一致。另外本次研究发现,高糖高脂环境下成骨细胞Cyclin D1、Bcl-2表达显著降低、Bax和cleaved caspase-3表达显著升高,而Eq干预能够激活PI3K/AKT通路、提高Cyclin D1、Bcl-2表达水平、下调Bax、cleaved caspase-3表达水平,减轻高糖高脂诱发的成骨细胞凋亡、推动细胞周期进展,并且随着Eq浓度升高,其干预效应增强。综合上述结果,本研究推测Eq可能通过调节PI3K/AKT通路进而调控Cyclin D1、Bcl-2、Bax、cleaved caspase-3等下游分子表达,发挥成骨细胞保护效应。为进一步验证PI3K/AKT通路的作用,本研究联合应用PI3K抑制剂,结果显示在联合应用PI3K抑制剂后,Eq抑制高脂高糖环境下成骨细胞凋亡、促进细胞增殖的效应显著降低,对Cyclin D1、Bcl-2、Bax、cleaved caspase-3等蛋白的调控能力显著减弱,提示Eq主要通过PI3K/AKT通路对高糖高脂环境下成骨细胞发挥保护效应。另外,在应用LY294002后,本研究发现M+LY294002组ROS17/2.8细胞的细胞活性、细胞凋亡和周期、细胞蛋白表达等指标虽然略高于或低于M组,但两组各指标尚无统计学差异,分析原因可能如下:①根据2.3结果,ROS17/2.8细胞的PI3K/AKT通路在高糖高脂环境下已被显著抑制,在此情况下联合应用LY294002效应不显著,因而未出现叠加效应;②根据2.1结果,高糖高脂环境下ROS17/2.8细胞形态显著改变、活性极大降低,导致细胞对LY294002反应不明显、LY294002效应不显著。
本研究首次探讨了Eq对高糖高脂环境下成骨细胞增殖、凋亡的影响及机制,为Eq的健康效应研究及DOP的防治工作提供了实验依据。
| [1] |
SI Y H, WANG C Y, GUO Y, et al. Prevalence of oste oporosis in patients with type 2 diabetes mellitus in the Chinese mainland: a systematic review and meta-analysis[J]. Iran J Public Health, 2019, 48(7): 1203-1214. |
| [2] |
李硕, 王建. 大豆异黄酮临床应用的研究进展[J]. 大豆科学, 2020, 39(4): 633-640. LI S, WANG J. Research progress on the clinical application of soybean isoflavones[J]. Soybean Sci, 2020, 39(4): 633-640. |
| [3] |
WANG J, XU J, WANG B, et al. Equol promotes rat osteoblast proliferation and differentiation through activating estrogen receptor[J]. Genet Mol Res, 2014, 13(3): 5055-5063. |
| [4] |
吴彬, 张勇, 陈明亮, 等. 雌马酚对去卵巢后大鼠骨质疏松症的影响[J]. 第三军医大学学报, 2015, 37(3): 256-260. WU B, ZHANG Y, CHEN M L, et al. Equol improves osteoporosis in ovarietomized rats[J]. J Third Mil Med Univ, 2015, 37(3): 256-260. |
| [5] |
王盼, 吴科锋, 崔燎. 不同阶段2型糖尿病诱发骨质疏松症的致病机制研究进展[J]. 中国骨质疏松杂志, 2020, 26(4): 619-624. WANG P, WU K F, CUI L. Research progress on the pathogenesis type 2 diabetes-induced osteoporosis of different stages[J]. Chin J Osteoporos, 2020, 26(4): 619-624. |
| [6] |
MAGEE P J. Is equol production beneficial to health?[J]. Proc Nutr Soc, 2011, 70(1): 10-18. |
| [7] |
任梓溢, 韦震, 姜宁, 等. 雌马酚对慢性睡眠干扰所致小鼠抑郁样行为的改善作用[J]. 大豆科学, 2022, 41(3): 323-329. REN Z Y, WEI Z, JIANG N, et al. Protective effects of equol on depression-like behavior of mice induced by chronic sleep deprivation[J]. Soybean Sci, 2022, 41(3): 323-329. |
| [8] |
SEKIKAWA A, IHARA M, LOPEZ O, et al. Effect of S-equol and soy isoflavones on heart and brain[J]. Curr Cardiol Rev, 2019, 15(2): 114-135. |
| [9] |
中华医学会内分泌学分会脂代谢学组. 中国2型糖尿病合并血脂异常防治专家共识(2017年修订版)[J]. 中华内分泌代谢杂志, 2017(11): 925-936. Lipid Metabolism Group of Chinese Society of Endocrinology. Expert consensus on prevention and treatment of type 2 diabetes complicated with dyslipidemia in China (revised edition 2017)[J]. Chin J Endocrinol Metab, 2017(11): 925-936. |
| [10] |
吴娟, 邱绮虹, 杨骥锋, 等. 高糖高脂抑制成骨细胞增殖及促进凋亡[J]. 中华老年口腔医学杂志, 2018, 16(2): 65-70. WU J, QIU Q H, YANG J F, et al. High glucose and free fatty acid inhibit proliferation and induce apoptosis in osteoblast[J]. Chin J Geriatr Dent, 2018, 16(2): 65-70. |
| [11] |
柯芷茵, 梁爱玲, 刘勇军. 细胞周期检测点激酶与肺癌耐药研究进展[J]. 中国肺癌杂志, 2021, 24(4): 265-270. KE Z Y, LIANG A L, LIU Y J. Cell cycle checkpoint kinase and drug resistance of lung cancer[J]. Chin J Lung Cancer, 2021, 24(4): 265-270. |
| [12] |
梁宁, 何斌, 张奇文, 等. 调控干细胞成骨分化的PI3K/Akt信号通路及相关因素[J]. 现代医学, 2022, 50(1): 126-130. LIANG N, HE B, ZHANG Q W, et al. Stem cell development into osteoblasts is regulated by the PI3K/Akt signaling pathway and other factors[J]. Mod Med J, 2022, 50(1): 126-130. |
| [13] |
张莹, 周艳红, 李江雁, 等. 基于PI3K/Akt通路研究利拉鲁肽对2型糖尿病骨质疏松大鼠的作用[J]. 中国骨质疏松杂志, 2021, 27(7): 985-989. ZHANG Y, ZHOU Y H, LI J Y, et al. Effect of liraglutide on type 2 diabetic osteoporosis rats based on the study of PI3K/Akt pathway[J]. Chin J Osteoporos, 2021, 27(7): 985-989. |
| [14] |
袁玥. SHP2通过PI3K/AKT/GSK3β信号通路调节Cyclin D1的稳定性来促进乳腺癌细胞的增殖[D]. 天津: 天津医科大学, 2020. YUAN Y. SHP2 promotes proliferation of breast cancer cells through regulating cyclin D1 stability via the PI3K/AKT/GSK3β signaling pathway[D]. Tianjin: Tianjin Medical University, 2020. |
| [15] |
张丰姣, 毛雨, 何丽, 等. 二甲双胍调控PI3K/Akt/mTOR通路减轻糖皮质激素诱导的成骨细胞凋亡[J]. 中国骨质疏松杂志, 2021, 27(9): 1323-1328. ZHANG F J, MAO Y, HE L, et al. Metformin attenuates glucocorticoid-induced osteoblast apoptosis by regulating PI3K/Akt/mTOR pathway[J]. Chin J Osteoporos, 2021, 27(9): 1323-1328. |
| [16] |
王昆. 柚皮苷通过抑制由PI3K-Akt-mTOR通路介导的自噬改善高糖/高脂应激造成的内皮细胞功能失常[D]. 南昌: 南昌大学, 2020. WANG K. Naringin inhibits autophagy mediated by PI3K-Akt-mTOR pathway to ameliorate endothelial cell dysfunction induced by high glucose/high fat stress[D]. Nanchang: Nanchang University, 2020. |




