2. 450042 郑州,联勤保障部队988医院心内科
2. Department of Cardiology, No. 988 Hospital of Joint Logistic Force of PLA, Zhengzhou, Henan Province, 450042, China
动脉粥样硬化是不良心血管事件的重要诱因。既往研究发现,动脉粥样硬化的早期病理改变是血管内皮细胞功能异常[1-2]及其通透性的改变[3-4]。氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)聚积于血管壁,形成典型的脂质斑块。在此过程中,ox-LDL不仅是参与形成泡沫细胞(吞噬了ox-LDL的巨噬细胞),其本身也是一种致病因子,参与调节内皮细胞的功能以及通透性改变[5-7]。但ox-LDL对血管内皮细胞通透性改变的调节机制仍未明确。
既往研究发现,钙离子参与调节血管内皮细胞通透性和细胞骨架排列[8-10]。钙库操纵性钙内流(store-operated calcium entry,SOCE)是大多数非兴奋性细胞钙内流的主要方式[11-12]。前期研究发现,SOCE参与调节血管内皮细胞的增殖和迁移[13],推测SOCE可能参与调节血管内皮细胞的通透性改变。本研究利用体外培养的人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs),初步探讨SOCE在ox-LDL诱导的HUVEC通透性变化中的作用。
1 材料与方法 1.1 细胞培养及处理分组HUVECs(HUM-CELL-0020,武汉原生原代)用含20%胎牛血清的1640培养基(Hyclon)的培养瓶贴壁培养,培养瓶置于37℃、5% CO2培养箱中。每3天传代1次,第3次传代根据目标实验分别接种于Millicell培养皿、激光共聚焦培养皿、6孔培养板中。培养于Millicell培养皿的细胞用于检测跨内皮电阻(transendothelial electrical resistance,TER),随机分为对照组和不同剂量ox-LDL(10、25、50、100 μg/mL)干预组(n=3)。培养于含载玻片的6孔板的细胞用于细胞骨架的免疫荧光及蛋白印迹检测,随机分为(n=5):对照组、ox-LDL 24 h组(100 μg/mL)和ox-LDL 48 h组(100 μg/mL,48 h)。培养于激光共聚焦培养皿的细胞用于检测细胞内钙含量以及SOCE (n=8~12):钙含量检测中利用2-APB为SOCE抑制剂,细胞随机分为对照组、ox-LDL组(100 μg/ml)和ox-LDL+2APB组(ox-LDL 100 μg/ml;2-APB 50 μmol/L),分别于24 h和48 h检测。SOCE检测的细胞随机分为对照组、ox-LDL 24 h组(100 μg/ml)和ox-LDL 48 h组(100 μg/ml)。
1.2 跨内皮电阻(transendothelial electrical resistance, TER)检测采用Millicell ERS-2电阻仪检测TER。以无细胞的Millicell培养皿为空白对照(TER0),接种了细胞的Millicell培养皿先置于细胞培养箱24 h,随后添加不同剂量的ox-LDL(10、25、50、100 μg/mL),分别于0、3、6、12、24、48 h检测TERt,按照公式TER=TERt-TER0计算。
在观察抑制SOCE对TER影响的检测中,将细胞分为对照组、ox-LDL组(100 μg/ml)和ox-LDL+2APB组(ox-LDL 100 μg/ml, 2-APB 50 μmol/L)。
1.3 细胞骨架免疫荧光检测细胞用4%多聚甲醛室温固定15 min,0.01 mol/L PBS洗3 min×3次。加入兔血清封闭液封闭37 ℃孵育20 min。分别加入VE-cadherin抗体(1∶200稀释,中国碧云天生物技术有限公司),Actin-Tracker Red-Rhodamine (1∶100稀释,中国碧云天生物技术有限公司)后,置于保湿盒后,于4℃冰箱孵育过夜。0.01 mol/L PBS洗3 min×3次,再加入FITC标记的羊抗兔抗体(1∶100稀释,美国Earthox公司),37 ℃避光孵育1 h。0.01 mol/L PBS洗3 min×3次,加入DAPI染液,室温孵育5 min。0.01 mol/L PBS洗3 min×3次后,激光共聚焦显微镜观察荧光阳性细胞并拍照。
1.4 VE-cadherin水平免疫印迹检测取接种于6孔板的细胞,RIPA裂解液(按1∶100添加PMSF,中国碧云天生物技术有限公司)裂解细胞提取总蛋白,离心后取上清,BCA法测蛋白浓度。添加SDS上样缓冲液(中国碧云天生物技术有限公司)后95 ℃变性5 min,取20 μg蛋白进行SDS-PAGE胶电泳后转移至PVDF膜,5%BSA室温封闭1 h,孵育VE-cadherin抗体(1∶500, 中国碧云天生物技术有限公司)、β-actin(1∶1 000,中国碧云天生物技术有限公司)于4 ℃过夜,漂洗后与HRP标记的IgG抗体37 ℃孵育1 h,以ECL试剂盒显影,Quantity One软件分析条带灰度值。
1.5 钙离子探针孵育取接种于激光共聚焦培养皿并培养1 d的细胞,加入终浓度为5 μmol/L的Fluo-3/AM钙离子探针(中国碧云天生物技术有限公司),37℃避光孵育30 min后,吸弃培养液并以PBS漂洗3次,加入新鲜培养液再次避光孵育60 min后,即于激光共聚焦下检测细胞内钙含量以及SOCE。
1.6 细胞内游离钙浓度检测取孵育钙离子探针的细胞置于显微镜载物台。选取视野后(每个视野含8~12个细胞),共聚焦显微镜扫描1 min(激发波长488 nm,发射波长530 nm)。因Fluo-3/AM选择性与细胞内游离钙结合后呈荧光性。以细胞边界圈定兴趣窗(region of interest, ROI),计算每个ROI区域的平均荧光强度F,以此代表细胞内游离钙浓度。
1.7 SOCE检测SOCE检测依既往研究实施[14]。其基本原理是在孵育钙离子探针后,细胞首先置于无钙离子的缓冲液中,添加毒胡萝卜素(可特异性抑制内质网上G2+-ATP酶,从而引起细胞内钙库的耗竭),此过程将激活介导SOCE的钙离子通道,随后再向缓冲液中添加含钙离子的溶液,此时,引起的钙内流被认为是SOCE。取孵育钙离子探针的细胞,吸弃原培养液,以无钙离子的HBSS漂洗3次后每个培养皿加入1 mL无钙离子的HBSS并置于显微镜载物台。选取视野后,共聚焦显微镜行基线扫描1 min(激发波长488 nm,发射波长530 nm,连续扫描模式),基线荧光值计为F0。向培养皿中加入终浓度为2 μmol/L的毒胡萝卜素(Sigma)并继续扫描直至基线稳定,向培养皿中加入钙离子终浓度为2 mmol/L的氯化钙溶液,继续扫描10 min。加入氯化钙后引起的荧光强度上升,其峰值计为Fmax,以荧光值变化的绝对值代表细胞内游离钙的改变(Δ[Ca2+]i=Fmax-F0),此研究触发的游离钙改变条件为激活SOCE,因此以Δ[Ca2+]i代表SOCE强度。
1.8 统计学分析计量结果以x±s表示,Western blot结果以对照组的倍数表示。采用SPSS 16.0软件进行统计分析,均数比较采用t检验。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 Ox-LDL增加HUVEC通透性如图 1所示,ox-LDL对HUVEC的TER影响呈现剂量与时间依赖性。10 μg/mL的ox-LDL对TER无明显影响,25 μg/mL的ox-LDL处理12 h内,TER无明显变化,在24、48 h引起TER降低,但结果无统计学意义。50、100 μg/mL的ox-LDL在6 h内对TER影响不明显,但在12 h引起TER降低(与同时相对照组比较, 分别降低26.5%、35.8%,P < 0.05),此效应在24 h(与对照组比较,分别降低27.6%、55.9%,P < 0.05)、48 h(与对照组比较,分别降低44.3%、63.0%,P < 0.05)更加明显。
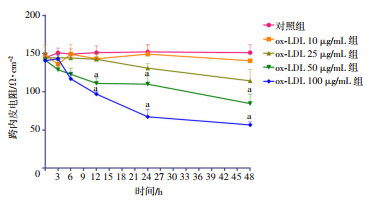
|
| a:P < 0.05,与对照组比较 图 1 各组HUVECs在不同时相点的TER (n=3,x±s) |
2.2 Ox-LDL减少VE-cadherin蛋白表达并引起细胞骨架重排
鉴于细胞骨架及细胞间紧密连接与通透性密切相关,本研究观察了ox-LDL对HUVEC细胞紧密链接关键蛋白VE-Cadherin表达的影响以及对细胞骨架蛋白F-actin的分布影响。如图 2A所示,免疫印迹结果显示,Ox-LDL处理后24、48 h,VE-cadherin的表达减少(与对照组比较分别减少51%、63%,P < 0.05)。免疫荧光结果显示,VE-cadherin主要分布于细胞内,ox-LDL处理24、48 h后,其表达降低(图 2B)。F-actin主要沿着细胞膜分布,微丝结构在细胞质内规律分布。如图 2B所示,ox-LDL处理后,F-actin的形态和分布均发生改变,应力纤维和板状伪足的数量均减少。这些结果提示,ox-LDL引起的HUVECs通透性的增加,可能与F-actin的重新排列以及VE-cadherin的表达降低有关。
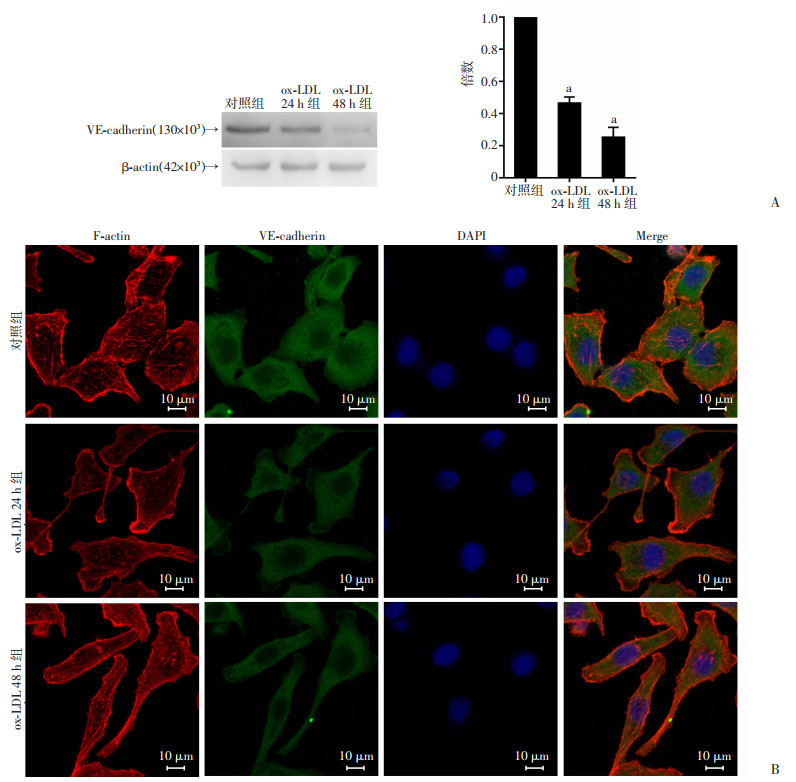
|
|
A:Western blot检测ox-LDL处理24、48 h后VE-cadherin表达;B:免疫荧光检测VE-cadherin及F-actin的表达与分布 a:P < 0.05,与对照组比较 图 2 Ox-LDL对HUVECs VE-cadherin表达水平及F-actin分布的影响(n=3,x±s) |
2.3 Ox-LDL增加HUVECs细胞的游离钙浓度
采用钙离子探针(Fluo-3/AM)评估HUVEC的游离钙浓度。如图 3A所示,Ox-LDL(100 μg/mL) 处理24 h后,HUVECs的游离钙浓度显著增加(与对照组比较增加260%,P < 0.05),此效应被SOCE抑制剂2-APB(50 μmol/L)阻断,即同时给予ox-LDL和2-APB后,细胞内游离钙浓度与对照组无明显差异,与单独给予ox-LDL组相比显著减低(降低68.4%,P < 0.05)。在ox-LDL处理48 h后(图 3B),细胞内游离钙浓度显著增加(与对照组比较增加273%,P < 0.05),同时给予ox-LDL和2-APB后,细胞内游离钙浓度虽较对照组是增加的,但与单独给予ox-LDL组相比是显著减低的(降低44.6%,P < 0.05)。这部分结果提示ox-LDL上调HUVECs游离钙浓度是SOCE依赖的。
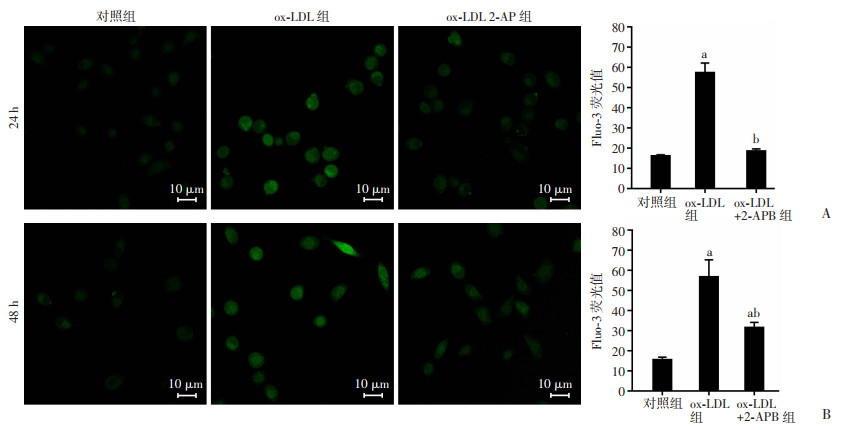
|
| A:各组细胞24 h钙离子探针荧光值统计;B:各组细胞48 h钙离子探针荧光值统计a:P < 0.05,与对照组比较;b:P < 0.05,与ox-LDL组比较 图 3 Ox-LDL显著降低HUVEC细胞内游离钙浓度(n=10~12, x±s) |
2.4 抑制SOCE可减弱ox-LDL引起的HUVECs通透性增高
前述实验结果提示ox-LDL引起的HUVECs通透性增加可能是SOCE依赖的。为验证此假设,尝试利用2-APB阻断SOCE,并观察对HUVECs通透性的影响。结果发现,ox-LDL (100 μg/mL) 在6 h引起TER降低(与同时相对照组相比降低31.5%,P < 0.05),TER在12、24、48 h(分别降低35.8%、51.6%、60.8%)降低更加明显(P < 0.05)。此效应能被SOCE抑制剂2-APB(50 μmol/L)减弱(图 4),在6 h和12 h,ox-LDL+2-APB组细胞的TER较对照组无明显下降,在24、48 h,其TER较对照组有显著降低(分别降低30.7%、34.7,P < 0.05),但下降幅度低于ox-LDL组。提示ox-LDL对HUVECs通透性的影响虽不完全,但至少部分是通过SOCE发生的(图 4)。
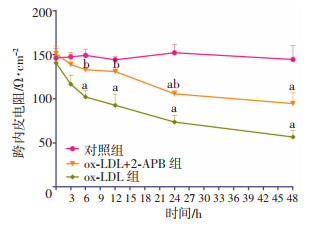
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与ox-LDL组比较 图 4 各组HUVECs在不同时相点的TER (n=3,x±s) |
2.5 Ox-LDL降低SOCE的振幅并增加SOCE持续时间
如上所述,在ox-LDL作用下,HUVECs游离钙增加是SOCE依赖的。如图 5A所示,在无钙离子的缓冲液中,给予TG(2 μmol/L)后引起钙库内钙离子钙释放,表现为图中的第一个波峰。随后给予钙离子(2 mmol/L),立即出现第二个更为明显的钙内流波峰。统计分析SOCE的振幅(由基线到波峰的荧光值差ΔF)发现,ox-LDL(100 μg/mL)处理24 h后,SOCE的振幅较对照组有降低趋势,但差异无统计学意义(图 5B)。而在ox-LDL(100 μg/mL)处理48 h后,SOCE的振幅显著降低(降低48%,P < 0.05)。进一步分析不同组间SOCE波形变化,如图 5A所示,以钙离子开始回填到SOCE波峰的时间区域代表SOCE的升支,以波峰到峰后的120 s区域代表SOCE的降支。分别计算每个细胞的升支速度和降支速度(ΔF/Δs)后再予以统计,结果如图 5C、D所示。ox-LDL处理后,HUVECs的SOCE的升支速度呈降低趋势,但无统计学意义。降支速度在ox-LDL处理24 h后呈现降低趋势,而在ox-LDL处理48 h后则呈显著下降(降低45.8%,P < 0.05)。SOCE降支速度的降低,说明SOCE持续时间/介导SOCE离子通道开放时间的延长,这也说明在SOCE振幅降低的情况下,ox-LDL仍能引起细胞内游离钙浓度的增加。

|
| A:各组细胞孵育钙离子探针后的实时荧光曲线;B:SOCE振幅统计;C:SOCE升支速度统计;D:SOCE降支速度统计; 1: 对照组;2: ox-LDL 24 h组;3: ox-LDL 48 h组; a:P < 0.05,与对照组比较 图 5 Ox-LDL降低SOCE的振幅并延长SOCE持续时间(n=10,x±s) |
3 讨论
血管内皮细胞功能异常是动脉粥样硬化发生的早期病理改变。Ox-LDL作为一种致病因子,可通过直接和间接的方式,影响血管内皮细胞的增殖、迁移等功能。但目前对ox-LDL是否影响血管内皮细胞的通透性仍未明确。本研究发现,ox-LDL能够降低HUVECs的TER,TER与细胞间紧密连接的完整性密切相关,而细胞间紧密连接的完整性是维系内皮细胞通透性的关键,既往研究也多把TER作为检测细胞通透性的指标之一[15],因此,TER的降低间接提示ox-LDL可增加HUVEC的通透性。
TER及血管内皮细胞的通透性的维持依赖于完整的细胞骨架以及正常的细胞间连接。其中F-actin蛋白[16-17]和VE-cadherin蛋白[18-19]在维持正常的细胞骨架和细胞间连接中起关键作用,也参与调节血管内皮细胞的通透性[20]。本研究发现,ox-LDL降低HUVECs的VE-cadherin表达,并改变F-actin蛋白的在HUVECs的分布,这提示ox-LDL可能是通过影响细胞骨架的排列和细胞间连接的完整性从而引起TER的改变。
细胞内游离钙的浓度改变参与调节诸多细胞功能。既往研究也发现,细胞内游离钙的浓度与细胞骨架的稳定性相关,参与调节VE-cadherin蛋白的功能[21]。本研究发现,ox-LDL引起HUVECs游离钙浓度增加,此效应能被SOCE的特异阻断剂2-APB阻断,说明ox-LDL对细胞游离钙的影响是SOCE依赖的。提示ox-LDL可通过影响SOCE而增加HUVECs的游离钙浓度,进而下调VE-cadherin蛋白的表达并影响F-actin蛋白的分布,从而引起TER的改变。随后的研究也证实,2-APB不仅能阻断细胞内游离钙的增加,还能减轻ox-LDL对HUVECs的TER的影响,说明SOCE的改变,是引起HUVECs通透性变化的上游调节环节。
本研究观察了ox-LDL对HUVECs的SOCE产生何种影响。结果提示ox-LDL虽然降低SOCE的振幅,但显著延长了SOCE的持续时间,即介导SOCE的钙离子通道持续开放的时间延长,进而引起细胞内游离钙浓度的增加。
Ox-LDL对细胞通透性的影响可能存在多种机制。本研究重点观察SOCE在其中的作用。研究结果提示ox-LDL通过延长内皮细胞SOCE的持续时间上调细胞内游离钙浓度,也观察到ox-LDL对TER、细胞骨架和细胞间连接的影响。虽未提供游离钙与TER、细胞骨架和细胞间连接相关的直接证据,但根据既往研究结果,游离钙的增加会导致细胞骨架和细胞间连接的改变[21]。因而推测ox-LDL对细胞骨架、细胞间连接的影响是通过SOCE相关的游离钙改变而实现。
综上所述,本研究结果显示,ox-LDL通过延长内皮细胞SOCE的持续时间上调细胞内游离钙浓度,进而可能影响细胞骨架的排列和细胞间连接的完整性,引起细胞通透性的增加。
| [1] |
GIMBRONE M A Jr, GARCÍA-CARDEÑA G. Endothelial cell dysfunction and the pathobiology of atherosclerosis[J]. Circ Res, 2016, 118(4): 620-636. |
| [2] |
PIRCHER A, TREPS L, BODRUG N, et al. Endothelial cell metabolism: a novel player in atherosclerosis? Basic principles and therapeutic opportunities[J]. Atherosclerosis, 2016, 253: 247-257. |
| [3] |
CALCAGNO C, LAIREZ O, HAWKINS J, et al. Combined PET/DCE-MRI in a rabbit model of atherosclerosis: integrated quantification of plaque inflammation, permeability, and burden during treatment with a leukotriene A4 hydrolase inhibitor[J]. JACC Cardiovasc Imaging, 2018, 11(2 Pt 2): 291-301. |
| [4] |
PHINIKARIDOU A, ANDIA M E, PROTTI A, et al. Noninvasive magnetic resonance imaging evaluation of endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent[J]. Circulation, 2012, 126(6): 707-719. |
| [5] |
CHAVAKIS E, DERNBACH E, HERMANN C, et al. Oxidized LDL inhibits vascular endothelial growth factor-induced endothelial cell migration by an inhibitory effect on the Akt/endothelial nitric oxide synthase pathway[J]. Circulation, 2001, 103(16): 2102-2107. |
| [6] |
GALLE J, HANSEN-HAGGE T, WANNER C, et al. Impact of oxidized low density lipoprotein on vascular cells[J]. Atherosclerosis, 2006, 185(2): 219-226. |
| [7] |
HONG D, BAI Y P, GAO H C, et al. Ox-LDL induces endothelial cell apoptosis via the LOX-1-dependent endoplasmic reticulum stress pathway[J]. Atherosclerosis, 2014, 235(2): 310-317. |
| [8] |
DE BOCK M, CULOT M, WANG N, et al. Connexin channels provide a target to manipulate brain endothelial calcium dynamics and blood-brain barrier permeability[J]. J Cereb Blood Flow Metab, 2011, 31(9): 1942-1957. |
| [9] |
KOOIMAN K, VAN DER STEEN A F W, DE JONG N. Role of intracellular calcium and reactive oxygen species in microbubble-mediated alterations of endothelial layer permeability[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2013, 60(9): 1811-1815. |
| [10] |
SANDOVAL R, MALIK A B, MINSHALL R D, et al. Ca(2+) signalling and PKC alpha activate increased endothelial permeability by disassembly of VE-cadherin junctions[J]. J Physiol, 2001, 533(Pt 2): 433-445. |
| [11] |
PRAKRIYA M, LEWIS R S. Store-operated calcium channels[J]. Physiol Rev, 2015, 95(4): 1383-1436. |
| [12] |
ZHANG S L, YU Y, ROOS J, et al. STIM1 is a Ca2+ sensor that activates CRAC channels and migrates from the Ca2+ store to the plasma membrane[J]. Nature, 2005, 437(7060): 902-905. |
| [13] |
王连友, 杨杰, 黄岚. 钙库操纵性钙内流参与调节血管内皮细胞增殖与迁移[J]. 第三军医大学学报, 2019, 41(5): 424-429. WANG L Y, YANG J, HUANG L. Store-operated calcium entry is involved in proliferation and migration of vascular endothelial cells[J]. J Third Mil Med Univ, 2019, 41(5): 424-429. |
| [14] |
ZOU J J, GAO Y D, GENG S, YANG J. Role of STIM1/Orai1-mediated store-operated Ca2+ entry in airway smooth muscle cell proliferation[J]. J Appl Physiol, 2011, 110(5): 1256-1263. |
| [15] |
MEUREN L M, COELHO S V A, ARRUDA L B. Evaluation of DENV-induced endothelial cell permeability by measurements of transendothelial electrical resistance (TEER) and extravasation of proteins and virus[J]. Methods Mol Biol, 2022, 24(9): 207-222. |
| [16] |
BARBERA S, RAUCCI L, LUGANO R, et al. CD93 signaling via rho proteins drives cytoskeletal remodeling in spreading endothelial cells[J]. Int J Mol Sci, 2021, 22(22): 12417. |
| [17] |
WU L M, ISLAM M R, LEE J, et al. ErbB3 is a critical regulator of cytoskeletal dynamics in brain microvascular endothelial cells: implications for vascular remodeling and blood brain barrier modulation[J]. J Cereb Blood Flow Metab, 2021, 41(9): 2242-2255. |
| [18] |
BLECHARZ K G, DRENCKHAHN D, FORSTER C Y. Glucocorticoids increase VE-cadherin expression and cause cytoskeletal rearrangements in murine brain endothelial cEND cells[J]. J Cereb Blood Flow Metab, 2008, 28(6): 1139-1149. |
| [19] |
YANG J J, YAO W, QIAN G S, et al. Rab5-mediated VE-cadherin internalization regulates the barrier function of the lung microvascular endothelium[J]. Cell Mol Life Sci, 2015, 72(24): 4849-4866. |
| [20] |
HARKI O, TAMISIER R, PEPIN J L, et al. VE-cadherin cleavage in sleep apnoea: new insights into intermittent hypoxia-related endothelial permeability[J]. Eur Respir J, 2021, 58(4): 2004518. |
| [21] |
DENG T L, YU L, GE Y K, et al. Intracellular-free calcium dynamics and F-actin alteration in the formation of macrophage foam cells[J]. Biochem Biophys Res Commun, 2005, 338(2): 748-756. |




