2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系;
3. 400020 重庆,陆军军医大学(第三军医大学)958医院骨科
2. Department of Microbiology and Biochemical Pharmacy, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Orthopaedics, No. 958 Hospital, Army Medical University (Third Military Medical University), Chongqing, 400020, China
近年来,随着骨科内固定器械的广泛使用,骨科植入物手术部位的铜绿假单胞菌(Pseudomonas aeruginosa, PA)感染愈发严重。据研究报道,5%~20%的革兰阴性杆菌骨感染是由PA引起[1],其中约14%的开放性骨折患者会合并PA感染[2]。特别是免疫力低下人群,可因PA引发的感染而致病[3]。PA感染导致的耐药问题十分严峻,已发展成为多重耐药菌。抗生素的效果越发难以满足需求,导致临床上抗生素治疗PA感染的效果不理想[4]。因此,PA引起的骨折术后感染的预防和治疗成为亟待解决的医学难题。
疫苗接种是有效预防PA感染与流行的重要策略之一。自20世纪60年代以来,全球共计研发了60余种对抗PA的疫苗,仅有11种进入临床试验,其中3种进入Ⅲ期临床阶段,最终均宣告失败,尚无PA疫苗上市[5]。抗原是疫苗核心成分,PcrV作为PA Ⅲ型分泌系统关键蛋白[6],参与效应蛋白从PA到宿主细胞的转移过程。其在结构和功能上保守,87.7%~90.2%的PA菌株携带PcrV编码基因[7-9]。然而,基于PcrV重组表达抗原却未见在PA疫苗上应用。有研究表明,PcrV在大肠杆菌中的表达量低,易沉淀、降解,限制了PcrV蛋白作为PA的抗原[10]。OprI作为PA的外膜脂蛋白,能激活Toll样受体(Toll-like receptor,TLR),进而启动固有免疫应答发挥免疫佐剂的作用,刺激机体产生多种类型的免疫应答[11]。抗原融合是有效提高保护效果的重要手段。本研究拟将PcrV与OprI抗原融合,构建PcrV-OprI融合蛋白,并在开放性骨折感染模型上评价PcrV-OprI抗原免疫保护作用。
1 材料与方法 1.1 菌株铜绿假单胞菌菌株PAO1(ATCC, Manassas VA, United States),-80 ℃冻存;PcrV-OprI的编码序列PcrV28-294-OprI25-62由上海生工公司合成,连接至载体pGEX-6P-1,转化至E.coli BL21(DE3)感受态细胞,得到pGEX-6P-1-PcrV-OprI/BL21(DE3)工程菌。
1.2 试剂与仪器Al(OH)3佐剂(CRODA, Denmark),山羊抗小鼠IgG Fc HRP(北京中杉生物公司),GST 4B亲和填料和PreScission Protease酶(GE公司),异丙基-β-D硫代半乳糖苷(上海生工生物公司),TMB底物显色液(北京天根生物公司),Avant Pure 150纯化仪(GE, 美国),高效液相色谱仪(Aligent,美国),低温高速离心机(卢湘仪,中国),光学显微镜(永科光学,中国),IVIS Spectrum CT分析仪(PerkinElmer,美国)。
1.3 PcrV-OprI抗原表达与纯化将重组质粒pGEX-6P-1-PcrV-OprI转化至E.coli BL21(DE3),抗性平板上挑取单克隆接种至含氨苄抗生素LB培养基中,180 r/min、37 ℃培养过夜。取20 mL的菌液加入到2 L含氨苄的LB培养基中,220 r/min、37 ℃培养至D(600)约为0.8时,加入终浓度200 μmol/L IPTG诱导剂,150 r/min、16 ℃培养12 h。诱导结束后,收集菌体并经超声裂解后上清液与GST 4B结合,PreScission Protease酶切,收集PcrV-OprI初纯样品。PcrV-OprI初纯样品经Avant pure 150纯化仪通过阴离子交换层析、疏水层析,内毒素吸附树脂进行精细纯化。通过SDS-PAGE及HPLC分析PcrV-OprI纯化结果,N端氨基酸测序验证PcrV-OprI抗原表达准确性。
1.4 小鼠与免疫选取6~8周龄SPF级雌性C57BL/6J小鼠(北京维通利华实验动物公司),按随机数字表法分为2组,每组10只,体质量18~22 g。免疫组(PcrV-OprI)将20 μg的PcrV-OprI抗原与Al(OH)3佐剂混合吸附1 h,经肌肉注射免疫。对照组(PBS)用等体积抗原保存缓冲液PBS作为阴性对照。各组小鼠分别在0、14、21 d免疫,共计免疫3次。实验动物遵循3R原则,符合伦理标准(动物实验伦理编号:AMUWEC20211289)。
1.5 血清中特异性抗体的检测末次免疫后7 d,小鼠尾静脉取血分离血清,通过ELISA法测定免疫小鼠血清中抗PcrV-OprI IgG的滴度。酶标板每孔100 μL将PcrV-OprI稀释到6 μg/mL的抗原包被液,4 ℃包被过夜,洗涤3次。每孔250 μL 1%BSA封闭液,37 ℃封闭2 h,洗涤。将抗PcrV-OprI血清(1 ∶1 000)梯度稀释,37 ℃孵育1 h,洗涤。将HRP标记的山羊抗鼠IgG、IgG1、IgG2a、IgG2b抗体(1 ∶5 000)分别加入酶标板中,37 ℃孵育40 min,洗涤。加入100 μL TMB底物显色液,避光孵育10 min并终止,在450 nm处读取光密度值。以待测样本(S)与阴性对照(N)比值即S/N值≥2.1作为阳性结果判断标准。
1.6 开放性骨折术后感染模型的构建参考OEZEL等[12]进行开放性骨折模型构建。小鼠腹腔麻醉,待深度麻醉,侧卧固定,剃除腿部毛发并用碘伏消毒。保持小鼠左下肢伸直状态下于前外侧沿股骨从髋关节至膝关节做一纵向切口,长0.8~1.0 cm,分离股外侧肌和股二头肌,抬起张阔筋膜肌,将股骨充分暴露在手术视野中,使用线锯在股骨骨干中上1/3交界处断开股骨。将长度为0.8 cm的克氏针置于股骨骨折断端两侧的骨髓腔内,使股骨得以固定,生理盐水冲洗伤口,6-0蚕丝线缝合切口,用微量注射器于骨折处接种1.0×107 CFU的铜绿假单胞菌PAO1。术后常规给水及饮食,观察小鼠切口的愈合情况以及造模前后小鼠体质量的变化数值。
1.7 PcrV-OprI抗原免疫保护效果及对骨折愈合的影响PAO1细菌感染后3 d,小鼠实施安乐死,从胫骨近端到股骨中段采集组织样本,分离股骨与植入物。软组织样本通过匀浆器研磨,股骨与植入物经1 mL PBS 25 kHz超声处理10 min,涡旋2 min后分离细菌。组织匀浆和超声处理溶液进行梯度稀释后,取10 μL涂布于LB平皿上,37 ℃培养15 h,进行菌落计数。小鼠骨折术后感染第1、7、14天,使用IVIS Spectrum CT小动物活体三维成像仪CT扫描记录骨折及其愈合情况。
1.8 统计学分析采用GraphPad Prism 9软件进行统计学分析。实验数据以x±s表示,两组间采用非配对t检验,多组间采用单因素方差分析。P<0.05示差异有统计学意义。
2 结果 2.1 重组PcrV-OprI蛋白的纯化与鉴定pGEX-6P-1-PcrV-OprI/BL21(DE3)工程菌经200 μmol/L IPTG诱导,PcrV-OprI抗原以可溶形式表达。经纯化后,SDS-PAGE检测结果显示,PcrV-OprI抗原理论分子量为35.5×103,电泳条带位置与理论值相符且纯度较高(图 1A)。进一步通过HPLC检测PcrV-OprI抗原的纯度,结果显示其纯度为98.3%(图 1B)。PcrV-OprI抗原N端氨基酸检测序列与理论氨基酸序列一致。
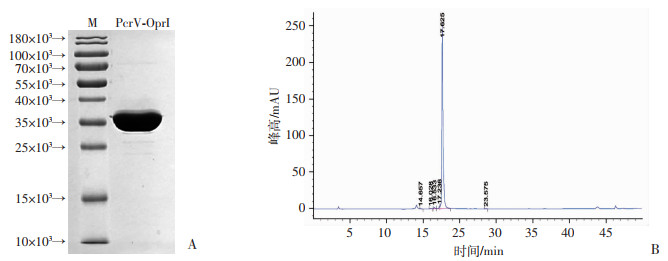
|
| A:纯化后PcrV-OprI重组蛋白条带M:标准;B:PcrV-OprI重组蛋白的HPLC检测 图 1 PcrV-OprI重组蛋白纯化SDS-PAGE电泳及HPLC检测 |
2.2 重组PcrV-OprI诱导的体液免疫应答
为了分析小鼠血清中PcrV-OprI特异性IgG及亚型,末次免疫后7 d进行ELISA检测。PcrV-OprI抗原在小鼠体内可诱导产生高效价的特异性抗体,较PBS组明显升高(P<0.05,图 2A);PcrV-OprI组IgG亚型IgG1、IgG2a、IgG2b均能检出,IgG1、IgG2b抗体滴度较PBS组明显升高(P<0.05,图 2B~D),且IgG1明显高于IgG2a、IgG2b。结果提示PcrV-OprI能有效刺激Th1和Th2型体液免疫反应,且主要是Th2型应答。
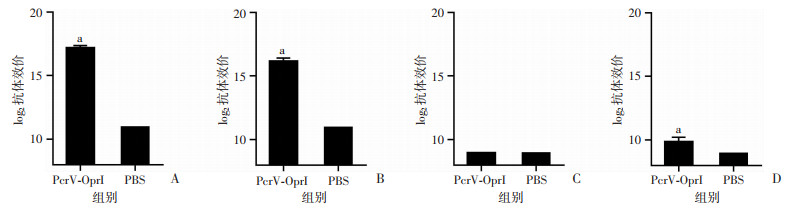
|
|
a:P<0.05,与PBS组比较 A:抗PcrV-OprI抗体的应答水平;B:抗PcrV-OprI IgG1的效价分析;C:抗PcrV-OprI IgG2a的效价分析;D:抗PcrV-OprI IgG2b的效价分析 图 2 ELISA法检测抗PcrV-OprI抗体效价及抗体亚型分析 |
2.3 重组PcrV-OprI抗原免疫保护效果
为了评价PcrV-OprI抗原在小鼠体内的保护作用,构建了开放性骨折感染PA模型。如图 3A显示,感染后3 d,PcrV-OprI组手术切口逐渐愈合,PBS组切口未见愈合且伴有少量脓液;第7天,PcrV-OprI组腿部毛发逐渐恢复生长,PBS组手术切口周围未见生长。此外,PcrV-OprI组体质量减轻幅度明显低于PBS组(P<0.05,图 3B)。软组织、股骨、植入物细菌定植分析显示,PcrV-OprI组的细菌负荷显著低于PBS组(P<0.05,图 3C)。结果提示PcrV-OprI抗原通过抑制铜绿假单胞菌在软组织、股骨、植入物上的定植而发挥保护作用。
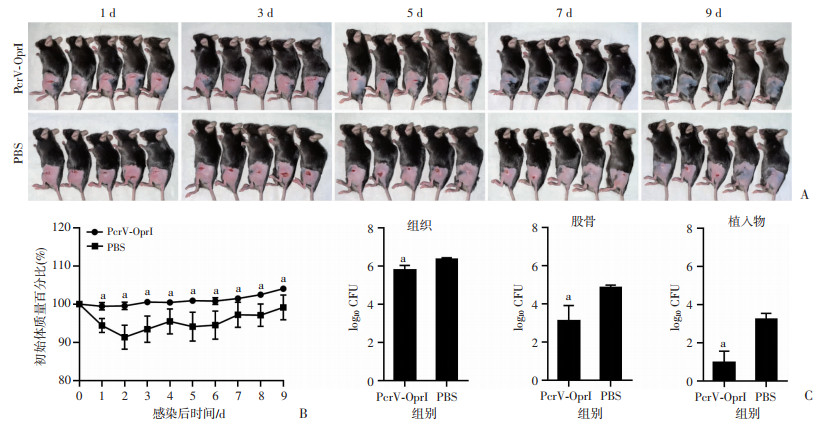
|
|
a:P<0.05,与PBS组比较 A:PAO1感染后小鼠大体观察;B:PAO1感染后小鼠体质量变化;C:PAO1感染后小鼠组织、股骨、植入物细菌定植量变化 图 3 PcrV-OprI重组蛋白对小鼠骨折固定术后感染铜绿假单胞菌的免疫保护效果 |
2.4 重组PcrV-OprI抗原免疫对小鼠骨折愈合的影响
为了在开放性骨折感染PA模型中进一步评价PcrV-OprI抗原免疫对骨折愈合的影响,对骨组织进行组织病理学观察,结果显示PcrV-OprI组的肌肉软组织形态正常,而PBS组的软组织被PAO1细菌吞噬分解,伴有明显的炎症病理改变,包括炎性细胞浸润和出血。PcrV-OprI组的股骨仅出现少量炎症细胞浸润,而PBS组股骨感染严重且伴有大量出血(图 4A)。CT扫描结果显示,PcrV-OprI组骨折处出现丘状钙化骨痂,且随时间增加骨折线逐渐清晰且逐渐闭合,呈愈合趋势;而PBS组骨折处钙化骨痂形成较少,感染后出现固定植入物穿透膝关节,未见明显愈合(图 4B)。这些结果提示PcrV-OprI抗原免疫对PA感染后骨折的愈合具有改善作用。
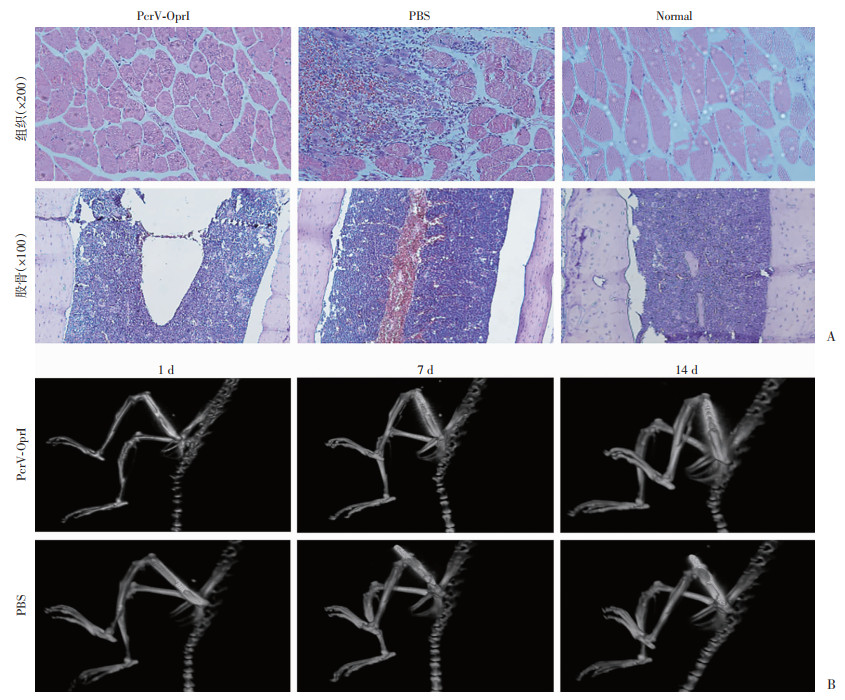
|
| A:HE染色观察PAO1感染后小鼠组织、股骨形态变化;B:PAO1感染后小鼠左侧股骨(左股骨骨干中部骨折)X线表现 图 4 HE染色和X线观察PcrV-OprI重组蛋白免疫对小鼠股骨骨折愈合的影响 |
3 讨论
抗原筛选和优化是成功研制PA疫苗的核心环节。将PcrV与OprI抗原通过柔性Linker(Gly-Ser-Gly-Gly-Ser-Gly)融合,有助于融合蛋白的正确折叠[13-14]。所以,本研究中的PcrV、OprI抗原经融合后,抗原稳定且可溶性较好,避免了PcrV抗原溶解性差和易降解的问题。本研究证实PcrV-OprI抗原能诱导机体产生较强的Th1和Th2免疫应答,其中以Th2型应答为主。这可能取决于本研究采用Al(OH)3佐剂,该佐剂主要倾向于Th2型免疫应答[15]。有研究表明,PcrV抗原能够诱导Th17应答反应,细胞因子IL-17在PA感染早期表达迅速升高,并持续存在从而发挥保护效果[16]。PcrV-OprI蛋白所诱导的免疫效应物主要是B淋巴细胞产生的抗PcrV-OprI特异性IgG抗体,它可能通过以下途径发挥其功能:第一,抗PcrV-OprI抗体结合毒素的酶活性位点,阻断毒素的释放[17];第二,调理吞噬和抗PcrV-OprI抗体依赖的细胞介导的细胞毒性作用[18];第三,抗PcrV-OprI抗体通过经典途径激活补体系统[19],产生多种效应功能,有效杀伤铜绿假单胞菌。
本研究构建的小鼠铜绿假单胞菌开放性骨折感染模型,可为PA疫苗临床试验候选模型提供理论指导。对于PA开放性骨折感染模型,国内外鲜有报道。大多数骨折感染模型动物多选择家兔、羊、犬等[20],但对于疫苗评价需大批量的模型进行保护性验证。因此,构建小鼠开放性骨折感染模型具有十分重要的意义。THOMPSON等[21]通过小鼠股骨关节植入携带PA的克氏针造成感染。SHIELS等[22]将克氏针置入鼠双侧股骨骨髓腔内,于鼠尾静脉中注入细菌。细菌感染方式也是影响模型稳定的重要因素,植入物携带细菌以及尾静脉注射细菌等方式依然存在诸多局限性。细菌感染剂量不准确、细菌定植部位不精确是造成模型失败的主要原因之一。本研究骨折感染模型在参考THOMPSON等[21]基础上,模拟临床上骨折病理症状,股骨中处折断,并用克氏针固定,微量注射器精准定植PA。模型构建简便,易操作,感染剂量可控。然而该模型不足之处在于髓内植入物单一固定未有钛固定材料稳定。需进一步了解小鼠股骨髓腔的形态结构、皮质厚度以及髓内针的直径或长度是否会影响骨愈合。
铜绿假单胞菌易感染复发,难以清除[23]。研究报道,铜绿假单胞菌感染定植主要在皮肤软组织、肺部、创口处[24-28]。临床上抗生素治疗PA感染愈发困难,患者感染PA后治疗周期长。疫苗等免疫学方法是防控PA感染的重要手段。本研究初步探索了PcrV-OprI抗原免疫能有效减少PA骨折感染细菌定植,对PA骨折感染后愈合具有改善作用。
综上所述,PcrV-OprI免疫能有效引起小鼠体液免疫应答,在开放性骨折髓内针固定术后PA感染模型中具有显著保护效果。
| [1] |
BASSETTI M, VENA A, CROXATTO A, et al. How to manage Pseudomonas aeruginosa infections[J]. Drugs Context, 2018, 7: 212527. |
| [2] |
TRIFFAULT-FILLIT C, FERRY T, LAURENT F, et al. Microbiologic epidemiology depending on time to occurrence of prosthetic joint infection: a prospective cohort study[J]. Clin Microbiol Infect, 2019, 25(3): 353-358. |
| [3] |
CHEVALIER S, BOUFFARTIGUES E, BODILIS J, et al. Structure, function and regulation of Pseudomonas aeruginosa porins[J]. FEMS Microbiol Rev, 2017, 41(5): 698-722. |
| [4] |
PELEGRIN A C, PALMIERI M, MIRANDE C, et al. Pseudomonas aeruginosa: a clinical and genomics update[J]. FEMS Microbiol Rev, 2021, 45(6): fuab026. |
| [5] |
HOGGARTH A, WEAVER A, PU Q Q, et al. Mechanistic research holds promise for bacterial vaccines and phage therapies for Pseudomonas aeruginosa[J]. Drug Des Devel Ther, 2019, 13: 909-924. |
| [6] |
THANABALASURIAR A, SUREWAARD B G, WILLSON M E, et al. Bispecific antibody targets multiple Pseudomonas aeruginosa evasion mechanisms in the lung vasculature[J]. J Clin Invest, 2017, 127(6): 2249-2261. |
| [7] |
BORKAR D S, FLEISZIG S M, LEONG C, et al. Association between cytotoxic and invasive Pseudomonas aeruginosa and clinical outcomes in bacterial keratitis[J]. JAMA Ophthalmol, 2013, 131(2): 147-153. |
| [8] |
FELTMAN H, SCHULERT G, KHAN S, et al. Prevalence of type Ⅲ secretion genes in clinical and environmental isolates of Pseudomonas aeruginosa[J]. Microbiology (Reading), 2001, 147(Pt 10): 2659-2669. |
| [9] |
GAREY K W, VO Q P, LAROCCO M T, et al. Prevalence of type Ⅲ secretion protein exoenzymes and antimicrobial susceptibility patterns from bloodstream isolates of patients with Pseudomonas aeruginosa bacteremia[J]. J Chemother, 2008, 20(6): 714-720. |
| [10] |
WAN C, GAO C, XIE Q, et al. Flagella hook protein FlgE is a novel vaccine candidate of Pseudomonas aeruginosa identified by a genomic approach[J]. Vaccine, 2021, 39(17): 2386-2395. |
| [11] |
刘潇, 李文桂. 铜绿假单胞菌外膜蛋白I(OprI)疫苗的研制现状[J]. 中国病原生物学杂志, 2017, 12(6): 590-595. LIU X, LI W G. Status of research on the outer membrane protein I of Pseudomonas aeruginosa[J]. J Pathog Biol, 2017, 12(6): 590-595. |
| [12] |
OEZEL L, BVREN C, SCHOLZ A O, et al. Effect of antibiotic infused calcium sulfate/hydroxyapatite (CAS/HA) insets on implant-associated osteitis in a femur fracture model in mice[J]. PLoS One, 2019, 14(3): e0213590. |
| [13] |
GU J, LIU Y Q, YU S, et al. Enterohemorrhagic Escherichia coli trivalent recombinant vaccine containing EspA, intimin and Stx2 induces strong humoral immune response and confers protection in mice[J]. Microbes Infect, 2009, 11(10/11): 835-841. |
| [14] |
GU H, LIAO Y L, ZHANG J, et al. Rational design and evaluation of an artificial Escherichia coli K1 protein vaccine candidate based on the structure of OmpA[J]. Front Cell Infect Microbiol, 2018, 8: 172. |
| [15] |
LUO M, SHAO B, YU J Y, et al. Simultaneous enhancement of cellular and humoral immunity by the high salt formulation of Al(OH)3 adjuvant[J]. Cell Res, 2017, 27(4): 586-589. |
| [16] |
WANG Y, CHENG X, WAN C, et al. Development of a chimeric vaccine against Pseudomonas aeruginosa based on the Th17-stimulating epitopes of PcrV and AmpC[J]. Front Immunol, 2020, 11: 601601. |
| [17] |
SAWA T, ITO E, NGUYEN V H, et al. Anti-PcrV antibody strategies against virulent Pseudomonas aeruginosa[J]. Hum Vaccin Immunother, 2014, 10(10): 2843-2852. |
| [18] |
WARRENER P, VARKEY R, BONNELL J C, et al. A novel anti-PcrV antibody providing enhanced protection against Pseudomonas aeruginosa in multiple animal infection models[J]. Antimicrob Agents Chemother, 2014, 58(8): 4384-4391. |
| [19] |
MEYER S, LEUSEN J H W, BOROSS P. Regulation of complement and modulation of its activity in monoclonal antibody therapy of cancer[J]. mAbs, 2014, 6(5): 1133-1144. |
| [20] |
WONG R M Y, LI T K, LI J, et al. A systematic review on current osteosynthesis-associated infection animal fracture models[J]. J Orthop Translat, 2020, 23: 8-20. |
| [21] |
THOMPSON J M, MILLER R J, ASHBAUGH A G, et al. Mouse model of Gram-negative prosthetic joint infection reveals therapeutic targets[J]. JCI Insight, 2018, 3(17): 121737. |
| [22] |
SHIELS S M, BEDIGREW K M, WENKE J C. Development of a hematogenous implant-related infection in a rat model[J]. BMC Musculoskelet Disord, 2015, 16: 255. |
| [23] |
HALL-STOODLEY L, STOODLEY P. Evolving concepts in biofilm infections[J]. Cell Microbiol, 2009, 11(7): 1034-1043. |
| [24] |
SHORTRIDGE D, PFALLER M A, STREIT J M, et al. Antimicrobial activity of ceftolozane/tazobactam tested against contemporary (2015-2017) Pseudomonas aeruginosa isolates from a global surveillance programme[J]. J Glob Antimicrob Resist, 2020, 21: 60-64. |
| [25] |
BASSETTI M, VENA A, CROXATTO A, et al. How to manage Pseudomonas aeruginosa infections[J]. Drugs Context, 2018, 7: 212527. |
| [26] |
BURROWS L L. The therapeutic pipeline for Pseudomonas aeruginosa infections[J]. ACS Infect Dis, 2018, 4(7): 1041-1047. |
| [27] |
NGUYEN L, GARCIA J, GRUENBERG K, et al. Multidrug-resistant Pseudomonas infections: hard to treat, but hope on the horizon?[J]. Curr Infect Dis Rep, 2018, 20(8): 23. |
| [28] |
PARKINS M D, SOMAYAJI R, WATERS V J. Epidemiology, biology, and impact of clonal Pseudomonas aeruginosa infections in cystic fibrosis[J]. Clin Microbiol Rev, 2018, 31(4): e00019-e00018. |






