巨噬细胞是单核吞噬细胞系统的一部分,在体内发挥着重要作用。巨噬细胞具有多种表型,不同表型巨噬细胞功能各异[1],常以类似于T细胞命名方法对其亚型进行命名,分为经典活化(M1)型和替代活化(M2)型。M1型巨噬细胞可分泌一些炎症因子,如IL-1β、IL-6和白介素12(IL-12)等,并高表达用于合成一氧化氮的iNOS,从而促进炎症的发生、发展;M2型可产生抗炎细胞因子和促进修复的酶,如IL-10、转化生长因子β(TGF-β)和Arg-1,清除细胞组织碎片和凋亡细胞的能力较强,具有促进血管生成和纤维生长的能力,使局部微环境从炎症状态向修复状态转变,从而有效促进组织修复和伤口愈合。生理条件下,创面中的巨噬细胞早期为M1表型,促进创面的炎症,有利于杀灭创面中的微生物;后期则转换为M2表型,使创面进入修复状态,促进创面愈合[2];在糖尿病足、下肢静脉溃疡和压疮等慢性创面中,巨噬细胞停留在M1表型,不能向M2表型转换,一直处于炎症阶段,从而无法启动创面的修复[3]。因此,如果能使M1型巨噬细胞转换为M2型,将有可能改善慢性创面的愈合。
光动力疗法(photodynamic therapy,PDT)作为一种新兴的治疗手段,通过局部光敏剂给药,然后运用与光敏剂相匹配波长的光照射靶组织,发生光化学反应,产生活性氧(ROS)而发挥光生物学效应。5-氨基酮戊酸(5-aminolevulinic acid,ALA)是临床上常用的一种光敏剂,已用于治疗多种疾病。研究表明,大剂量的ALA-PDT疗法产生较多的ROS,可引发细胞凋亡[4],从而发挥抗微生物和抗肿瘤作用;而采用小剂量的ALA-PDT治疗,效果则不同,产生较少的ROS,可激活体内抗氧化相关因子[5],具有抗氧化应激的作用;同时,小剂量的光动力疗法还可激活自噬[6],而自噬在巨噬细胞极性转换过程中也起着重要作用[7]。
本研究观察低剂量ALA-PDT对M1型巨噬细胞的作用,探讨ALA-PDT对巨噬细胞表型转换的影响及其作用机制,为ALA-PDT在慢性创面中的应用提供实验依据。
1 材料与方法 1.1 试剂与仪器RAW264.7巨噬细胞购自浙江美森细胞科技有限公司。胎牛血清购自Vivacell公司,培养基购自上海生工科技有限公司,细胞刮购自上海生工科技有限公司,LPS购自美国Sigam公司,ALA购自上海复旦张江生物医药公司,3-甲基腺嘌呤(3-MA)购自美国MCE公司,TRIzol购自上海碧云天生物技术有限公司,引物购自上海生工科技有限公司,逆转录试剂盒和实时定量PCR试剂盒购自日本TaKaRa公司;仪器为美国Biorad CFX96荧光定量PCR仪。细胞裂解液购自上海碧云天生物技术有限公司,一抗购自武汉三鹰生物技术公司,具体如下:iNOS(兔来源单克隆抗体,1 ∶1 000),IL-1β(兔来源单克隆抗体,1 ∶1 000),Arg-1(兔来源单克隆抗体,1 ∶1 000),LC3(兔来源单克隆抗体,1 ∶1 000),P62(兔来源单克隆抗体,1 ∶1 000),GAPDH(鼠来源单克隆抗体,1 ∶20 000);羊抗兔和羊抗鼠二抗购于武汉三鹰生物技术公司(1 ∶5 000)。ELISA试剂盒购自深圳达科为生物技术公司。
1.2 细胞培养及分组在含10%胎牛血清的高糖培养基中培养RAW264.7细胞,温度设置为37 ℃,CO2浓度设置为5%,细胞处于对数生长期时进行传代。对照组采用不含LPS的培养基培养24 h,M1组采用100 ng/mL的LPS刺激RAW264.7细胞24 h,诱导其成为M1型巨噬细胞。M1型诱导成功后,在孵育低剂量(0.1 mmol/L)ALA的条件下,分别给予0(M1)、0.5、1、1.5、2、2.5、3 J/cm2的红光进行照射,CCK-8检测其对M1型巨噬细胞活性的影响。Western blot检测M1型巨噬细胞在孵育低剂量ALA的条件下,不同光照强度(0、1、2、3、4 J/cm2)对M1型标志物iNOS的影响。尔后,细胞分为4组:M1组正常培养,ALA组仅孵育0.1 mmol/L ALA,红光组仅用红光对细胞进行照射,ALA-PDT组为孵育0.1 mmol/L ALA后,根据实验条件,用相应强度红光对细胞进行照射。
1.3 实时荧光定量PCR(RT-PCR)利用TRIzol提取各组细胞总RNA,将其逆转为cDNA,分别设计小鼠引物GAPDH、iNOS、IL-6、IL-10和Arg-1(表 1),以cDNA为模板,进行实时定量扩增,观察各基因mRNA转录水平,采用2-ΔΔCt法进行分析,每个反应设置3个复孔,实验至少重复3次。
| 引物名称 | 序列(5′ →3′) | 碱基数/bp |
| GAPDH | 上游: GGTGAAGGTCGGTGTGAACG | 20 |
| 下游: CTCGCTCCTGGAAGATGGTG | 20 | |
| iNOS | 上游: CAGCTGGGCTGTACAAACCTT | 21 |
| 下游: CATTGGAAGTGAAGCGTTT | 19 | |
| IL-6 | 上游: ACTCACCTTCAGAACGAATTG | 21 |
| 下游: CCATCTTTGGAAGGTTG | 17 | |
| Arg-1 | 上游: AGGACAGCCTCGAGGAGGGG | 22 |
| 下游: CCTGGCGTGGCCAGAGATGC | 20 | |
| IL-10 | 上游: CCAGTACAGCCGGGAAGACA | 20 |
| 下游: GAAGGCAGTCCGCAGCTCTA | 20 |
1.4 蛋白质印迹(Western blot)
于10 cm培养皿中培养细胞,全蛋白提取方法如下,实验条件处理后,PBS清洗3遍,加入细胞裂解液,用细胞刮反复刮取2 min,将混悬液收集于EP管中,冰上裂解30 min后,15 000×g、4 ℃离心15 min,小心吸取上清液,即为所需蛋白。采用BCA法测量蛋白浓度并调平蛋白浓度,尔后将蛋白煮沸变性,储存于-80 ℃冰箱中。电泳程序为90 V转140 V,转膜程序为200 mA恒流120 min,快速封闭液封闭30 min,一抗孵育过夜,一抗孵育后,TBST洗涤3次,二抗孵育1 h,而后TBST洗涤3次,配置ECL发光液,凝胶成像系统曝光照相记录,采用Image J对条带灰度进行分析。实验至少重复3次。
1.5 ELISA收集细胞24 h上清液,2 500 r/min离心,各孔加入100 μL标准品或样品,再加入50 μL检测抗体,37 ℃孵育90 min;洗板,各孔加入100 μL HRP工作液,37 ℃孵育30 min;洗板后,各孔加入100 μL显色液,37 ℃避光孵育15 min,加入终止液,酶标仪读取450 nm处光密度值[D(450)]。实验至少重复3次。
1.6 检测指标建立M1型巨噬细胞模型:LPS处理后,用PCR、Western blot和ELISA等方法检测M1型标志物IL-1 β、IL-6、iNOS和M2型标志物Arg-1的表达情况。
CCK-8法检测在不同ALA-PDT条件下M1型巨噬细胞的活力情况。
不同光照条件的ALA-PDT处理M1型巨噬细胞后,Western blot检测M1型标志物iNOS的表达情况,探索ALA-PDT使M1型巨噬细胞极性转换条件。
qPCR、Western blot及ELISA验证极性转换是否成功:ALA-PDT处理后,检测M2型标志物Arg-1、IL-10和M1型标志物IL-1 β、IL-6、iNOS的表达情况。
Western blot检测ALA-PDT处理M1型巨噬细胞后自噬相关蛋白P62和LC3表达情况;使用自噬抑制剂3-MA后,M1型标志物iNOS和自噬相关蛋白LC3的表达情况。
1.7 统计学分析采用SPSS 22.0软件进行分析,使用GraphPad Prism8绘制图表。计量资料以x±s表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。
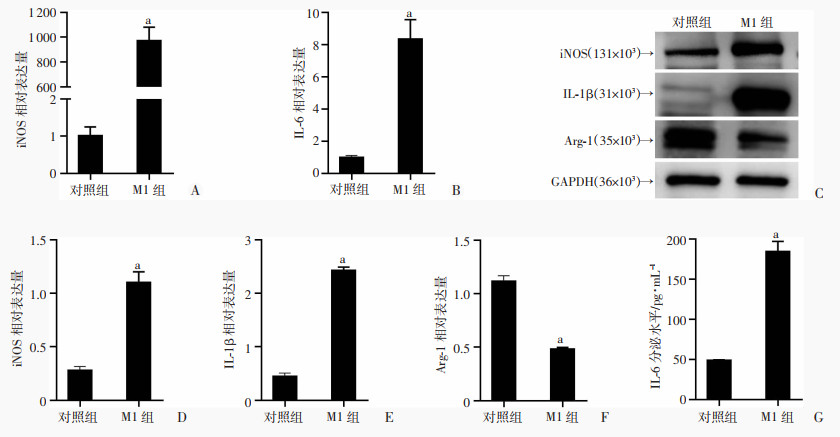
2 结果 2.1 LPS诱导巨噬细胞为M1表型RT-PCR结果显示,M1组LPS刺激后,巨噬细胞iNOS和IL-6表达较对照组明显增强(P < 0.05,图 1A、B),Western blot结果显示,M1组巨噬细胞iNOS和IL-1β表达较对照组明显增强,Arg-1较对照组表达降低(P < 0.05,图 1C~F)。ELISA结果显示,M1组IL-6分泌量较对照组显著增多(P < 0.05,图 1G)。
|
|
a:P < 0.05,与对照组比较 A、B:iNOS和IL-6的mRNA相对表达;C:Western blot检测两组iNOS、IL-1β和Arg-1蛋白表达;D~F:分别为iNOS、IL-1β和Arg-1蛋白半定量分析;G:ELISA检测两组IL-6分泌水平 图 1 LPS对RAW264.7细胞极性相关标志物的影响 |
2.2 低剂量ALA-PDT疗法促进M1型巨噬细胞转换为M2型 2.2.1 不同光照强度的低剂量ALA-PDT疗法对M1型巨噬细胞活性影响
CCK-8结果显示,随着光照强度的增强,M1型巨噬细胞活性逐渐下降(P < 0.05,图 2A)。

|
|
a:P < 0.05,与M1组比较 A:不同光照强度的低剂量ALA-PDT疗法对细胞增殖影响 1:M1组;2:ALA-PDT(0.5 J/cm2)组;3:ALA-PDT(1 J/cm2)组;4:ALA-PDT(1.5 J/cm2)组;5:ALA-PDT(2 J/cm2)组;6:ALA-PDT(2.5 J/cm2)组;7:ALA-PDT(3 J/cm2)组;B、C:Western blot检测各组iNOS蛋白的表达及半定量分析 1:M1组;2:ALA-PDT(1 J/cm2)组;3:ALA-PDT(2 J/cm2)组;4:ALA-PDT(3 J/cm2)组;5:ALA-PDT(4 J/cm2)组 图 2 不同光照强度的低剂量ALA-PDT疗法对M1型巨噬细胞活性影响和iNOS表达的影响 |
2.2.2 不同光照强度的低剂量ALA-PDT疗法对M1型巨噬细胞标志物iNOS的影响
孵育ALA后,分别给予0(M1)、1、2、3、4 J/cm2的红光进行照射,Western blot结果显示,光照强度为2、3、4 J/cm2时,iNOS表达下降(P < 0.05,图 2B、C),结合不同光照强度对细胞活性的影响,选择2 J/cm2这一光照强度用于后续实验。
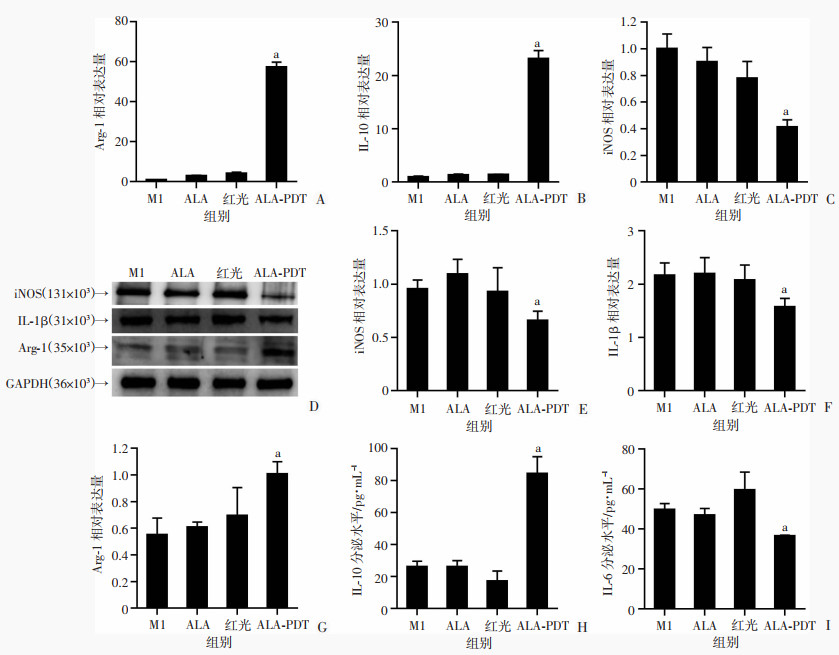
2.2.3 低剂量ALA-PDT处理后巨噬细胞相关标志物表达情况RT-PCR检测M1标志物iNOS和M2标志物Arg-1、IL-10的mRNA表达情况,结果显示,ALA-PDT组Arg-1和IL-10的mRNA表达升高,iNOS表达降低(P < 0.05,图 3A~C)。Western blot结果显示,ALA-PDT组M1型标志物iNOS和IL-1β表达降低,M2型标志物Arg-1表达升高(P < 0.05,图 3D~G)。ELISA结果显示,M1组、ALA组和红光组IL-10、IL-6分泌量差异无统计学意义;与M1组、ALA组和红光组比较,ALA-PDT组IL-10分泌量增加,IL-6分泌量减少(P < 0.05,图 3H、I)。
|
|
a:P < 0.05,与M1组比较 A~C:分别为Arg-1、IL-10和iNOS的mRNA相对表达水平;D:Western blot检测各组Arg-1、IL-1 β和iNOS蛋白表达;E~G:分别为iNOS、IL-1 β和Arg-1蛋白半定量分析;H、I:ELISA检测各组IL-10和IL-6分泌水平 图 3 低剂量ALA-PDT疗法对M1型巨噬细胞相关标志物的影响 |
2.3 自噬介导低剂量ALA-PDT疗法对M1型巨噬细胞的极性转换作用 2.3.1 低剂量ALA-PDT疗法对P62和LC3表达的影响
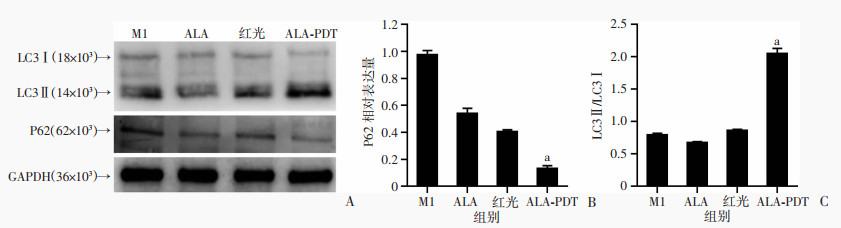
光动力处理后,Western blot结果显示,P62在ALA-PDT组中表达显著降低,LC3Ⅱ/LC3Ⅰ在ALA-PDT组中显著增高(P < 0.05,图 4),提示自噬可能在M1型巨噬细胞极性转换过程中发挥了作用。
|
|
a:P < 0.05,与M1组比较 A:Western blot检测各组P62和LC3蛋白表达;B、C:P62和LC3蛋白半定量分析 图 4 低剂量ALA-PDT疗法对P62和LC3的影响 |
2.3.2 3-MA对M1型巨噬细胞活性和LC3、iNOS蛋白表达的影响
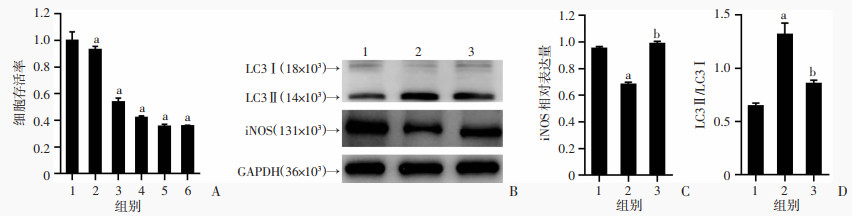
使用自噬抑制剂3-MA对自噬进行抑制,CCK-8结果显示,随着3-MA浓度的增大,其细胞毒性作用变大(P < 0.05,图 5A)。因此,选择细胞毒性较小的浓度1 mmol/L,孵育24 h后进行光动力处理,结果显示,自噬被抑制后,iNOS的表达显著升高(P < 0.05,图 5B~D),提示自噬介导了M1型巨噬细胞的极性转换作用。
|
|
a:P < 0.05,与M1组比较;b:P < 0.05,与PDT组比较 A:不同浓度3-MA对细胞增殖影响 1:M1组;2~6:分别为1、2、3、4、5 mmol/L 3-MA组;B:Western blot检测各组iNOS和LC3蛋白的表达;C、D:iNOS和LC3蛋白半定量分析 1:M1组;2:PDT组;3:PDT+3-MA组 图 5 3-MA对M1型巨噬细胞活性和LC3、iNOS蛋白表达的影响 |
3 讨论
创面愈合是一个连续的过程,简单来说,分为4个部分,即止血、炎症、增殖和重塑[8],生理情况下,这4个过程序贯进行,创面顺利愈合。在慢性创面中,这一进程是被阻止的,尤其是从炎症过渡到增殖这一关键节点被抑制[9],从而使慢性创面停留在炎症阶段,无法愈合。巨噬细胞在创面愈合中起类似于“总指挥”的作用[2],其从M1表型转换为M2表型,分泌一些促修复因子,协调其他细胞进入修复程序,启动了炎症向增殖的转变。因此,将慢性创面中的巨噬细胞表型从M1型转换为M2表型,是促进慢性创面愈合的一个可行思路。
光动力的效应多样,目前临床上应用较多的主要是对肿瘤和细菌、病毒等感染物质的杀伤作用,但其对创面愈合也有显著的促进作用:一项关于光动力疗法用于伴有感染的糖尿病足溃疡患者的临床研究表明,ALA-PDT疗法可促进糖尿病足愈合,并有可能避免截肢[10];另一项关于将光动力疗法应用于伴有铜绿假单胞菌感染的小鼠皮肤创面的动物实验中,结果显示ALA-PDT不仅可以杀灭细菌,同时还能促进创面愈合[11]。结合巨噬细胞极性转换在创面愈合中的重要作用,提示ALA-PDT疗法可能参与了巨噬细胞的极性转换作用。
光动力疗法既可引起细胞凋亡,又可引起细胞自噬,在光动力疗法应用于肿瘤疾病时,所用光敏剂剂量较大,主要引起细胞凋亡[12],继而介导核碎裂、核固缩等细胞死亡事件;光动力疗法导致的细胞自噬[6],常被认为是参与细胞成分回收的过程,可以发挥细胞保护作用。P62和LC3是自噬机制的重要参与者,常用于监测自噬活性,自噬活跃时,自噬底物P62常被降解,LC3Ⅰ则转变为LC3Ⅱ,因而LC3Ⅱ/ LC3Ⅰ比值升高。自噬在巨噬细胞极性转换过程中可能发挥着重要作用,ZHAO等[13]研究显示,miR-326过表达促进自噬并抑制M1型巨噬细胞标志物iNOS的表达,在LIU等[14]的研究中,泛素特异性蛋白酶19可通过激活自噬来抑制炎症小体的活化,并促进巨噬细胞极性转换。因此,光动力疗法对巨噬细胞极性转换的影响可能是通过自噬介导的。
RAW264.7细胞是单核细胞/巨噬细胞样细胞系,来源于小鼠,呈圆形或椭圆形,贴壁生长,具有很强的黏附和吞噬抗原能力,是常用的巨噬细胞模型之一。对于RAW264.7细胞,常用的有100 ng/mL的LPS刺激24 h、20 ng/mL的IFN-γ刺激24 h和LPS(100 ng/mL) 联合IFN-γ(20 ng/mL)刺激12 h等方案诱导其成为M1型巨噬细胞。本实验采用应用较为广泛的100 ng/mL的LPS诱导形成M1型巨噬细胞,结果发现M1型巨噬细胞标志物iNOS、IL-6和IL-1 β表达升高,而M2型巨噬细胞标志物Arg-1表达则降低。iNOS可持续合成大量的NO,促进炎症的进展[15];IL-6是经典的促炎细胞因子,可诱导产生许多急性期蛋白,如血清淀粉样蛋白A和C反应蛋白等,还可促进中性粒细胞运输到炎症部位来参与炎症的启动和维持,进而导致产生更多的炎性介质[16];IL-1 β也是一种重要的炎症细胞因子,可促进急性炎症反应和慢性炎症反应[17];Arg-1是一种催化精氨酸转化为鸟氨酸和尿素的酶[18],由于其与iNOS竞争精氨酸底物,因此能有效下调NO的产生,是一个重要的M2型巨噬细胞标志物。本研究结果表明,通过LPS刺激,成功诱导M1型巨噬细胞表型。
本实验探究了不同光照强度的低剂量ALA-PDT疗法对M1型巨噬细胞活性的影响,低剂量是个相对概念,不同细胞及动物均有不同的浓度,研究表明,应用0.5 mmol/L的ALA-PDT疗法于RAW264.7细胞,可促使其极化为M1型[19],应用0.25 mmol/L的ALA-PDT疗法于小鼠骨髓巨噬细胞,则可减轻其炎症反应[20],结合课题组前期研究成果,0.1 mmol/L的ALA-PDT疗法可激活成纤维细胞的抗氧化应激通路,发挥抗老化的作用[21]。因此,本实验低剂量选定的浓度为0.1 mmol/L。结果表明,在孵育低剂量ALA的条件下,随着光照强度的逐渐增强,M1型巨噬细胞的活性逐渐下降。HUANG等[22]在焦磷脂-α甲酯介导的光动力疗法对巨噬细胞炎症影响的研究中也发现,随着光照强度的增加,细胞活性逐渐下降;ZHOU等[4]研究表明,随着ALA孵育时间的延长和光照强度的增加,ALA-PDT疗法对成纤维细胞增殖活性影响逐渐增强。这些研究成果一定程度上也佐证了本研究结果。梯度实验结果表明,光照强度在1 J/cm2时,对iNOS的表达无影响,光照强度增大为2、3、4 J/cm2时,均可显著抑制iNOS表达,结合不同光照强度的光动力疗法对细胞活性的影响,本研究选择2 J/cm2用于后续实验。
本研究在0.1 mmol/L、2 J/cm2这一条件下,PCR、Western blot和ELISA等实验发现,光动力组M1型标志物iNOS、IL-1 β和IL-6表达降低,M2型标志物Arg-1和IL-10表达升高;表明低剂量光动力疗法使M1型巨噬细胞转换为M2型,并且这一转换作用是由光动力效应来实现的,而不是依赖ALA和红光。
本研究发现,光动力组巨噬细胞的LC3Ⅱ/LC3Ⅰ的比值增高,P62表达降低。相关研究显示,M2型巨噬细胞的基因特征中并未包含自噬相关基因[23],我们推测低剂量ALA-PDT可能通过激活自噬促进M1型巨噬细胞发生极性转换。随后,使用自噬抑制剂3-MA对自噬进行抑制,LC3Ⅱ/LC3Ⅰ的表达随之被下调,同时在光动力组受到抑制的iNOS的表达也重新升高,证实自噬在M1型巨噬细胞极性转换过程中起了重要作用。
慢性创面的愈合结果不甚理想,当前缺乏能取得较好疗效的治疗方法,ALA-PDT疗法既能杀灭引发创面感染的微生物,还能调节创面局部微环境中巨噬细胞的极性,将有望成为改善慢性创面愈合情况的新治疗方式。
综上,本研究发现,低剂量ALA-PDT疗法可通过激活自噬促进M1型巨噬细胞转换为M2型巨噬细胞,为低剂量ALA-PDT疗法应用于慢性创面的治疗提供了相关的细胞实验基础。
| [1] |
FUNES S C, RIOS M, ESCOBAR-VERA J, et al. Implications of macrophage polarization in autoimmunity[J]. Immunology, 2018, 154(2): 186-195. |
| [2] |
KIM S Y, NAIR M G. Macrophages in wound healing: activation and plasticity[J]. Immunol Cell Biol, 2019, 97(3): 258-267. |
| [3] |
BONIAKOWSKI A E, KIMBALL A S, JACOBS B N, et al. Macrophage-mediated inflammation in normal and diabetic wound healing[J]. J Immunol, 2017, 199(1): 17-24. |
| [4] |
ZHOU B R, ZHANG L C, PERMATASARI F, et al. ALA-PDT elicits oxidative damage and apoptosis in UVB-induced premature senescence of human skin fibroblasts[J]. Photodiagn Photodyn Ther, 2016, 14: 47-56. |
| [5] |
D'AUTRÉAUX B, TOLEDANO M B. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis[J]. Nat Rev Mol Cell Biol, 2007, 8(10): 813-824. |
| [6] |
KESSEL D. Apoptosis, paraptosis and autophagy: death and survival pathways associated with photodynamic therapy[J]. Photochem Photobiol, 2019, 95(1): 119-125. |
| [7] |
YUAN Y J, LI L, ZHU L L, et al. Mesenchymal stem cells elicit macrophages into M2 phenotype via improving transcription factor EB-mediated autophagy to alleviate diabetic nephropathy[J]. Stem Cells, 2020, 38(5): 639-652. |
| [8] |
WILKINSON H N, HARDMAN M J. Wound healing: cellular mechanisms and pathological outcomes[J]. Open Biol, 2020, 10(9): 200223. |
| [9] |
HAALBOOM M. Chronic wounds: innovations in diagnostics and therapeutics[J]. Curr Med Chem, 2018, 25(41): 5772-5781. |
| [10] |
LI X Y, KOU H L, ZHAO C Q, et al. Efficacy and safety of ALA-PDT in treatment of diabetic foot ulcer with infection[J]. Photodiagn Photodyn Ther, 2022, 38: 102822. |
| [11] |
YANG T, TAN Y, ZHANG W, et al. Effects of ALA-PDT on the healing of mouse skin wounds infected with Pseudomonas aeruginosa and its related mechanisms[J]. Front Cell Dev Biol, 2020, 8: 585132. |
| [12] |
KESSEL D. Photodynamic therapy: apoptosis, paraptosis and beyond[J]. Apoptosis, 2020, 25(9/10): 611-615. |
| [13] |
ZHAO X H, WANG Y B, YANG J, et al. MicroRNA-326 suppresses iNOS expression and promotes autophagy of dopaminergic neurons through the JNK signaling by targeting XBP1 in a mouse model of Parkinson's disease[J]. J Cell Biochem, 2019, 120(9): 14995-15006. |
| [14] |
LIU T, WANG L Q, LIANG P P, et al. USP19 suppresses inflammation and promotes M2-like macrophage polarization by manipulating NLRP3 function via autophagy[J]. Cell Mol Immunol, 2021, 18(10): 2431-2442. |
| [15] |
PASHA A, KUMBHAKAR D V, DONETI R, et al. Inhibition of inducible nitric oxide synthase (iNOS) by andrographolide and in vitro evaluation of its antiproliferative and proapoptotic effects on cervical cancer[J]. Oxid Med Cell Longev, 2021, 2021: 6692628. |
| [16] |
ATAIE-KACHOIE P, POURGHOLAMI M H, RICHARDSON D R, et al. Gene of the month: interleukin 6 (IL-6)[J]. J Clin Pathol, 2014, 67(11): 932-937. |
| [17] |
LOPEZ-CASTEJON G, BROUGH D. Understanding the mechanism of IL-1β secretion[J]. Cytokine Growth Factor Rev, 2011, 22(4): 189-195. |
| [18] |
ARLAUCKAS S P, GARREN S B, GARRIS C S, et al. Arg1 expression defines immunosuppressive subsets of tumor-associated macrophages[J]. Theranostics, 2018, 8(21): 5842-5854. |
| [19] |
JI J, WANG P R, ZHOU Q, et al. CCL8 enhances sensitivity of cutaneous squamous cell carcinoma to photodynamic therapy by recruiting M1 macrophages[J]. Photodiagnosis Photodyn Ther, 2019, 26: 235-243. |
| [20] |
LI L, YANG Y, YANG Z J, et al. Effects of ALA-PDT on the macrophages in wound healing and its related mechanisms in vivo and in vitro[J]. Photodiagnosis Photodyn Ther, 2022, 38: 102816. |
| [21] |
CHEN J Y, LUO J F, TAN Y, et al. Effects of low-dose ALA-PDT on fibroblast photoaging induced by UVA irradiation and the underlying mechanisms[J]. Photodiagnosis Photodyn Ther, 2019, 27: 79-84. |
| [22] |
HUANG L Y, CHEN Q, YU L H, et al. Pyropheophorbide-α methyl ester-mediated photodynamic therapy induces apoptosis and inhibits LPS-induced inflammation in RAW264.7 macrophages[J]. Photodiagnosis Photodyn Ther, 2019, 25: 148-156. |
| [23] |
ORECCHIONI M, GHOSHEH Y, PRAMOD A B, et al. Macrophage polarization: different gene signatures in M1(LPS+) vs. classically and M2(LPS-) vs. alternatively activated macrophages[J]. Front Immunol, 2019, 10: 1084. |




