非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)是最常见的慢性非传染性肝脏疾病,定义为无过量饮酒和其他致病因素存在的情况下,超过5%的肝细胞发生脂肪变性[1]。NAFLD是代谢综合征的肝脏表现,已成为一个日益严重的公共卫生问题[2]。过氧化物酶体增殖物激活受体α (peroxisome proliferator-activated receptor alpha, PPARα)和固醇调节元件结合蛋白-1c(sterol-regulatory element binding protein-1c, SREBP-1c)在NAFLD的发生、发展过程中发挥着重要作用。SREBP-1c及其下游靶基因脂肪酸合成酶(fatty acid synthase, FAS)表达升高会促进肝脏新生脂质生成(de novo lipid synthesis, DNL),而PPARα及其下游基因肉碱棕榈酰转移酶I(carnitine palmitoyltransferase 1, CPT-1)表达降低会导致肝细胞脂质β-氧化不足,肝DNL增多或者脂质β-氧化不足均会导致肝脏脂质的异常累积,因此,SREBP-1c和PPARα有望成为治疗NAFLD的潜在靶点[3-5]。雌激素在肝脏脂质代谢调节中发挥重要作用,雌激素水平不足会导致肝DNL增加,脂肪酸氧化减少,补充雌激素可以预防NAFLD的发生和发展,但其增加癌症发生风险限制了其在临床实践中的应用[6]。大豆异黄酮(soy isoflavones, SIF) 是迄今为止研究最多的植物雌激素,在豆类植物中含量较为丰富,具有广泛的生物学效应,既可以替代合成雌激素的作用,同时能避免合成雌激素不良反应的发生[7]。人群研究发现,增加膳食SIF摄入量可降低NAFLD患病率[8-9]。动物研究发现,饲粮中添加SIF可下调大鼠脂质合成相关基因的表达,改善肝脂肪病变[10-11]。SIF的生物学效应与其在肠道中的代谢产物雌马酚(equol, Eq)密切相关,Eq比其他异黄酮或异黄酮代谢物具有更高的雌激素活性[12]。课题组前期研究报道了Eq干预对绝经后模型大鼠肝脂肪变性的健康效应[13], 而Eq干预对NAFLD脂质代谢的调控作用目前尚不清楚。本研究利用油酸钠(sodium oleate, NaOL)诱导的HepG2细胞脂肪变性模型,观察Eq干预对肝细胞脂肪变性的影响,并探讨其可能作用机制。
1 材料与方法 1.1 主要试剂Eq购自上海大赛璐药物手性技术有限公司,E2、油红O试剂盒购自北京Solarbio公司;NaOL购自西安鲲创科技公司;甘油三酯(triglyceride, TG) 试剂盒购自南京建成生物工程研究所;总RNA提取试剂盒、反转录试剂盒、qRT-PCR试剂盒、引物、GAPDH一抗、过氧化物酶偶联的二抗购自上海生工生物技术有限公司;RIPA裂解缓冲液、BCA蛋白检测试剂盒、CCK-8试剂盒、SREBP-1c、FAS、PPARα和CPT-1A一抗购自上海碧云天生物科技公司。
1.2 方法 1.2.1 细胞培养HepG2细胞购自Procell(武汉,中国),在含100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清的DMEM高糖培养基,37 ℃,95%空气,5%CO2的湿化培养箱中常规培养,对数生长期细胞消化进行实验。
1.2.2 不同浓度Eq、NaOL干预后细胞活力的测定取对数生长期的HepG2细胞,以5 000/孔在96孔微孔板中孵育细胞,每孔100 μL,细胞贴壁后分别在不同的96孔微孔板中加入不同浓度的Eq(0、10-7、10-6、10-5、10-4、10-3、10-2 mol/L)和NaOL(0、0.12、0.24、0.36、0.48、0.60、0.72 mmol/L),每个浓度设6个复孔,干预时间为48 h,干预结束后在96孔板中加入CCK-8溶液(10 μL/孔),37 ℃孵育1 h,使用全波长多功能酶标仪(VarioskanFLUX,美国)在450 nm波长下检测光密度值[D(450)],计算细胞相对活力值。
1.2.3 NaOL诱导HepG2细胞脂肪变性取对数生长期的HepG2细胞,在6孔板中以3×105/孔孵育细胞,每孔体积2.5 mL。细胞贴壁后融合至70%~80%时,用不含血清的DMEM高糖培养基饥饿24 h,根据1.2.2步骤得到的NaOL安全浓度范围向6孔板中分别加入不同浓度的NaOL,每组3个复孔,37 ℃孵育48 h。
1.2.4 筛选诱导HepG2细胞脂肪变性的NaOL适宜处理浓度① 按照1.2.3处理细胞,吸去HepG2细胞6孔板内培养基,PBS漂洗3次,4%多聚甲醛固定液固定30 min,油红O染液染色10 min,60%乙醇分化,自来水终止分化,苏木精复染核,自来水冲洗反蓝后甘油封片;显微镜(Olympus,日本)下摄像并观察染色情况,评价细胞脂质积累程度。②按照1.2.3处理细胞,干预后弃去细胞培养液,收集细胞后用低温超声破碎仪器制备细胞匀浆。按照试剂盒说明书测定细胞内TG含量。③结合1.2.2步骤筛选出细胞出现明显脂肪变性,同时细胞活力无明显减少时的NaOL浓度,作为诱导HepG2细胞脂肪变性的条件。
1.2.5 Eq对NaOL诱导脂肪变性细胞的干预根据1.2.2和1.2.4步骤确定干预的Eq对NaOL浓度,将细胞分为对照组,NaOL组,NaOL+Eq低、中、高浓度组(10-7、10-6、10-5 mol/L),NaOL+E2(10-7 mol/L)组,按照1.2.3步骤,在加入NaOL后,分别加入不同浓度的Eq和E2干预48 h。干预结束后,对细胞进行油红O染色,并检测细胞内TG含量。
1.2.6 实时聚合酶链反应(qRT-PCR)干预结束后,按照试剂盒的说明,用TRIzol试剂提取HepG2细胞总RNA。测定RNA浓度,用逆转录酶试剂盒将RNA转录为cDNA。设计人SREBP-1c、FAS、PPARα和CPT-1A和GAPDH序列特异性引物(表 1)。Bio-Rad PCR仪进行qRT-PCR,采用比较周期阈值(Ct) (2-ΔΔCt)方法定量RNA的相对表达量。
| 名称 | 引物序列 |
| SREBP-1c | 上游: 5′-TTCCCTGGCCTATTTGACCC-3′ 下游: 5′-ACTCTTCCTTGATACCAGGCC-3′ |
| FAS | 上游: 5′-GTCTTGAACTCCTTGGCGGA-3′ 下游: 5′-AGGAAGATAGCCATGCCGAG-3′ |
| PPARα | 上游: 5′-ATGGTGGACACGGAAAGCC-3′ 下游: 5′-CGATGGATTGCGAAATCTCTTGG-3′ |
| CPT-1A | 上游: 5′-TCCAGTTGGCTTATCGTGGTG-3′ 下游: 5′-TCCAGAGTCCGATTGATTTTTGC-3′ |
| GAPDH | 上游: 5′-GGGTGTGAACCATGAGAAGT-3′ 下游: 5′-CCTTCCACGATACCAAAGTTGT-3′ |
1.2.7 Western blot检测
干预结束后,HepG2细胞用含有蛋白酶抑制剂的RIPA裂解液匀浆,在10 000×g转速下4 ℃离心10 min。按试剂盒说明测定上清液中的蛋白浓度后,Western blot检测HepG2细胞等量蛋白SREBP-1c、FAS、PPARα和CPT-1A、GAPDH的表达情况,显影后用Image J软件计算灰度值,并进行分析。
1.3 统计学分析采用SPSS 20.0软件进行统计分析。数据以x±s表示。采用单因素方差分析,然后进行Tukey事后检验。P<0.05被认为差异具有统计学意义。
2 结果 2.1 Eq和NaOL对HepG2细胞活力的影响与未加Eq处理的对照组(0 mol/L)相比,Eq浓度为10-4 mol/L时细胞活力显著降低(P<0.05),选取10-7、10-6、10-5 mol/L作为Eq干预条件。与未加NaOL处理的对照组(0 mmol/L)相比,NaOL浓度为0.48 mmol/L时细胞活力显著降低(P<0.05),见图 1。
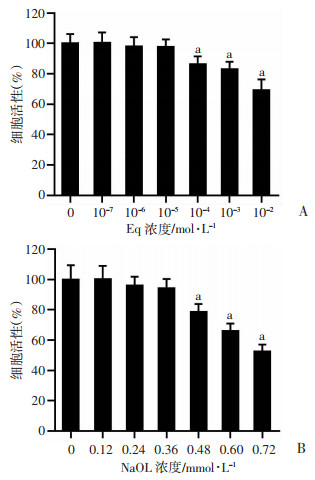
|
|
a: P<0.05,与对应对照组(0)比较 A: Eq对HepG2细胞活力的影响;B: NaOL对HepG2细胞活力的影响 图 1 Eq和NaOL对HepG2细胞活力的影响 |
2.2 诱导HepG2细胞脂肪变性的NaOL适宜处理浓度
随着NaOL浓度的增加,细胞内TG含量逐渐升高,与对照组(0 mmol/L NaOL)相比,当NaOL浓度为0.24 mmol/L时,细胞内TG含量显著升高(P<0.05,图 2A);随着NaOL浓度的增加,细胞内红染颗粒和脂滴浸润程度逐渐增多,当NaOL浓度为0.24 mmol/L时,细胞内可见成片状的脂滴聚集,与细胞内TG含量变化趋势一致,见图 2B~E。结合NaOL对HepG2细胞活性的影响、细胞内TG含量及细胞油红O染色结果,后续实验中选取0.24 mmol/L NaOL处理作为诱导HepG2细胞脂肪病变的条件。
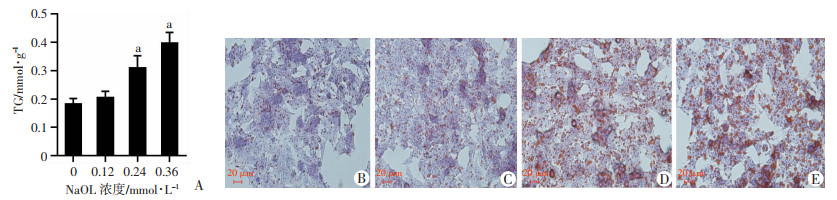
|
| A: 细胞TG含量a: P<0.05,与对照组(0 mmol/L)比较;B~E: 分别为油红O染色观察对照组,0.12、0.24、0.36 mmol/L NaOL组HepG2细胞红染颗粒和脂滴浸润程度 图 2 不同浓度NaOL对HepG2细胞内TG含量影响及油红O染色 |
2.3 Eq对NaOL处理的HepG2细胞脂质蓄积的影响
与对照组比较,NaOL处理组细胞内TG水平显著升高(P<0.05),Eq或E2干预后细胞内TG水平较NaOL组显著降低(P<0.05),随着干预浓度的升高,Eq降低细胞内TG的作用更明显,呈一定的浓度依赖效应,见图 3A;与对照组比较,NaOL组细胞内可见大量红染颗粒,脂滴浸润明显,而Eq干预后NaOL诱导的细胞脂滴浸润减少,其具有浓度效应趋势,与E2具有相似的干预效果,见图 3B~G。
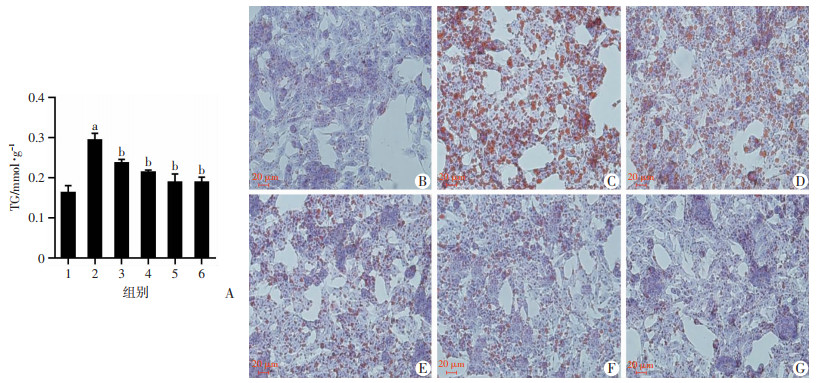
|
| A: 细胞TG含量1:对照组;2:NaOL组;3~5:分别为NaOL+Eq低、中、高浓度组;6:NaOL+E2组;a: P<0.05,与对照组比较;b: P<0.05,与NaOL组比较;B~G: 分别为油红O染色观察对照组,NaOL组,NaOL+Eq低、中、高浓度组,NaOL+E2组HepG2细胞红染颗粒和脂滴浸润程度 图 3 不同浓度Eq对NaOL处理的HepG2细胞内TG含量影响及油红O染色 |
2.4 Eq对NaOL诱导的HepG2细胞SREBP-1c、FAS、PPARα和CPT-1A mRNA表达的影响
与对照组比较,NaOL处理组细胞SREBP-1c、FAS mRNA表达水平显著升高(P<0.05),PPARα、CPT-1A表达水平显著降低(P<0.05);与NaOL处理组比较,Eq干预后细胞SREBP-1c、FAS mRNA表达水平显著降低(P<0.05),PPARα、CPT-1A表达水平显著增高(P<0.05),并与E2具有相似的作用效果,见图 4。
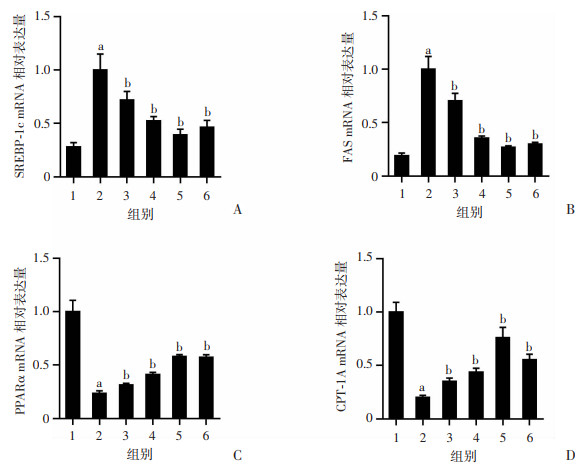
|
|
1:对照组;2:NaOL组;3~5:分别为NaOL+Eq低、中、高浓度组;6:NaOL+E2组;a: P<0.05,与对照组比较;b: P<0.05,与NaOL组比较 A: SREBP-1c;B: FAS;C: PPARα;D: CPT-1A 图 4 各组细胞SREBP-1c、FAS、PPARα和CPT-1A mRNA表达水平比较 |
2.5 Eq对NaOL诱导的HepG2细胞SREBP-1c、FAS、PPARα和CPT-1A蛋白表达的影响
与对照组比较,NaOL组细胞SREBP-1c、FAS蛋白表达水平显著升高(P<0.05),PPARα、CPT-1A表达水平显著降低(P<0.05);与NaOL组比较,Eq干预后细胞SREBP-1c、FAS蛋白表达水平显著降低(P<0.05),PPARα、CPT-1A表达水平显著增高(P<0.05),与E2具有相似的作用效果,见图 5。
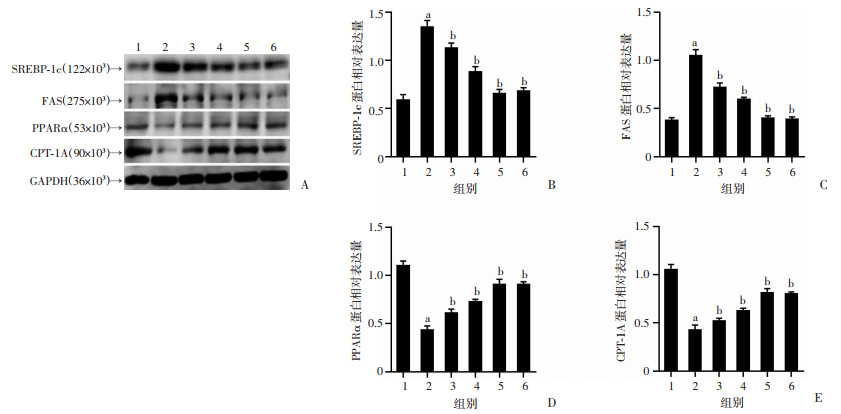
|
|
1:对照组;2:NaOL组;3~5:分别为NaOL+Eq低、中、高浓度组;6:NaOL+E2组;a: P<0.05,与对照组比较;b: P<0.05,与NaOL组比较 A: Western blot检测结果;B~E: 分别为SREBP-1c、FAS、PPARα、CPT-1A蛋白半定量分析 图 5 各组细胞SREBP-1c、FAS、PPARα和CPT-1A蛋白表达水平比较 |
3 讨论
膳食结构不合理和能量摄入过高, 以及久坐少动等不健康生活方式是NAFLD发病率逐年升高的主要危险因素。NAFLD将成为肝硬化和肝细胞癌的主要原因,并导致原位肝移植快速增长[14]。NAFLD严重危害人类健康并对社会造成巨大经济负担,其发病机制复杂,目前针对NAFLD的治疗并不理想,尚无获批的治疗药物,饮食和生活方式干预仍是该病的主要治疗措施[1-2]。和体内研究一样,体外细胞模型研究可以很好地阐明NAFLD的疾病机制,同时可以为探索更好的治疗方法提供新的理论依据。本研究利用NaOL诱导的HepG2细胞脂肪变性模型,探讨Eq干预对脂肪变性及脂质代谢基因表达的影响。
正常情况下,肝脏每天处理大量的脂肪酸,但以TG的形式储存的量很少,稳定状态下TG含量小于5%,脂质生成、氧化等一系列失衡会导致肝脂肪异常堆积[15]。DNL与肝内TG水平独立相关,DNL升高可引起肝脏脂肪变性和/或高甘油三酯血症,现有临床数据表明,无法调节DNL是NAFLD患者肝脏脂质积累的一个主要特征,SREBP-1c是调控DNL的关键转录因子,在肝脏脂质合成中发挥重要作用,在NAFLD患者中SREBP-1c表达升高,进而促进FAS等脂质合成基因表达,加速肝脏脂质合成和累积[3]。肝脏PPARα对全身脂肪酸稳态至关重要,PPARα可以通过增加靶基因CPT-1的表达,将脂肪酸转运到线粒体进行β氧化,减少肝脏脂质累积,对NAFLD具有保护作用,而在过量摄入高脂饮食等条件刺激下,会引起肝脏PPARα表达降低导致CPT-1的转录受损[16]。CAMPOREZ等[17]发现补充E2能促进CPT1表达上调,恢复去卵巢雌性小鼠肝脏中的脂肪酸氧化水平。PIGHON等[18]发现E2治疗可以降低SREBP-1c等脂肪生成基因的表达水平,抑制去卵巢雌性大鼠肝脏脂肪积累。PAQUETTE等[19]的研究也发现,卵巢切除可引起大鼠肝脏SREBP-1c表达增高,PPARα表达降低,导致大鼠肝脏脂质累积的增加,而E2干预有效逆转了这一过程。以上研究提示雌激素信号通路可影响SREBP-1c、PPARα的转录过程。尽管雌激素替代疗法可降低患NAFLD的风险,但会增加乳腺癌、卵巢癌等恶性疾病的风险,因此不被推荐使用;植物雌激素结构与合成雌激素相似,且毒副作用小;近年来,植物雌激素在脂肪肝治疗中的作用开始受到密切关注[7]。
本研究利用0.24 mmol/L NaOL处理HepG2细胞48 h后,油红O染色显示细胞内可见大量红染颗粒,脂滴浸润明显,细胞内TG含量明显增加,表明细胞脂肪变性模型建造成功。PANNEERSELVAM等[10]研究发现,SIF干预可以改善卵巢切除加高脂饮食诱导的大鼠的高脂血脂和肝脂肪病变,同时肝组织PPARα表达水平增加,SREBP-1c表达水平降低。LIU等[20]的研究也报道了相似的实验结果。SAKAMOTO等[21]研究发现,Eq前体大豆苷元以浓度依赖的方式增加PPARα的转录活性抑制促炎基因的表达。KIM等[22]研究发现,补充大豆苷元可上调PPARα靶基因表达增强脂肪酸β氧化能力,有效减轻NAFLD。本研究通过不同浓度的Eq干预,结果发现Eq可显著减少NaOL诱导的HepG2细胞内TG水平,同时油红O染色显示Eq干预后细胞内脂滴浸润明显减少,随着Eq浓度增加,干预效果更加明显,通过检测细胞脂质代谢相关基因可发现Eq显著降低了模型组细胞SREBP-1c和FAS基因的表达水平,同时升高了PPARα和CPT-1A的表达水平,具有与E2相似的作用效果。
综上所述,Eq可有效改善NaOL诱导的HepG2细胞脂肪变性,其部分机制可能是Eq通过降低细胞SREBP-1c和FAS表达,同时升高PPARα和CPT-1A表达有效减少了细胞脂质积累。本研究结果对进一步揭示Eq的健康益处有重要意义,也为探索NAFLD临床防治提供了新的科学依据。值得注意的是本结论基于体外实验结果,其在动物包括人体的具体作用和相关机制仍有待研究。Eq作为一种天然的、副作用较小的化合物,在未来有可能成为NAFLD的预防和治疗药物。
| [1] |
European Association for the Study of the Liver, European Association for the Study of Diabetes, European Association for the Study of Obesity. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease[J]. J Hepatol, 2016, 64(6): 1388-1402. |
| [2] |
YOUNOSSI Z M. Non-alcoholic fatty liver disease—A global public health perspective[J]. J Hepatol, 2019, 70(3): 531-544. |
| [3] |
IPSEN D H, LYKKESFELDT J, TVEDEN-NYBORG P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease[J]. Cell Mol Life Sci, 2018, 75(18): 3313-3327. |
| [4] |
MONTAGNER A, POLIZZI A, FOUCHÉ E, et al. Liver PPARα is crucial for whole-body fatty acid homeostasis and is protective against NAFLD[J]. Gut, 2016, 65(7): 1202-1214. |
| [5] |
AHMED M H, BYRNE C D. Modulation of sterol regulatory element binding proteins (SREBPs) as potential treatments for non-alcoholic fatty liver disease (NAFLD)[J]. Drug Discov Today, 2007, 12(17/18): 740-747. |
| [6] |
PALMISANO B T, ZHU L, STAFFORD J M. Role of estrogens in the regulation of liver lipid metabolism[J]. Adv Exp Med Biol, 2017, 1043: 227-256. |
| [7] |
LEE C B, KIM J, JUNG Y. Potential therapeutic application of estrogen in gender disparity of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. Cells, 2019, 8(10): 1259. |
| [8] |
ZHANG S M, KUMARI S, GU Y Q, et al. Soy food intake is inversely associated with newly diagnosed nonalcoholic fatty liver disease in the TCLSIH cohort study[J]. J Nutr, 2020, 150(12): 3280-3287. |
| [9] |
WANG X M, WANG Y, XU W L, et al. Dietary isoflavones intake is inversely associated with non-alcoholic fatty liver disease, hyperlipidaemia and hypertension[J]. Int J Food Sci Nutr, 2022, 73(1): 60-70. |
| [10] |
PANNEERSELVAM S, PACKIRISAMY R M, BOBBY Z, et al. Soy isoflavones (Glycine max) ameliorate hypertriglyceridemia and hepatic steatosis in high fat-fed ovariectomized Wistar rats (an experimental model of postmenopausal obesity)[J]. J Nutr Biochem, 2016, 38: 57-69. |
| [11] |
XIAO C W, WOOD C M, WEBER D, et al. Dietary supplementation with soy isoflavones or replacement with soy proteins prevents hepatic lipid droplet accumulation and alters expression of genes involved in lipid metabolism in rats[J]. Genes Nutr, 2014, 9(1): 373. |
| [12] |
MAYO B, VÁZQUEZ L, FLÓREZ A B. Equol: a bacterial metabolite from the daidzein isoflavone and its presumed beneficial health effects[J]. Nutrients, 2019, 11(9): 2231. |
| [13] |
张贵明, 倪向敏, 崔涵强, 等. 雌马酚干预对高脂饮食诱导的去卵巢大鼠非酒精性脂肪肝的影响[J]. 陆军军医大学学报, 2022, 44(21): 2129-2137. ZHANG G M, NI X M, CUI H Q, et al. Effect of equol intervention on high-fat diet-induced non-alcoholic fatty liver disease in ovariectomized rats[J]. J Army Med Univ, 2022, 44(21): 2129-2137. |
| [14] |
CHEN X Y, WANG C, HUANG Y Z, et al. Nonalcoholic fatty liver disease shows significant sex dimorphism[J]. World J Clin Cases, 2022, 10(5): 1457-1472. |
| [15] |
DONNELLY K L, SMITH C I, SCHWARZENBERG S J, et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease[J]. J Clin Invest, 2005, 115(5): 1343-1351. |
| [16] |
SILVA A K S, PEIXOTO C A. Role of peroxisome proliferator-activated receptors in non-alcoholic fatty liver disease inflammation[J]. Cell Mol Life Sci, 2018, 75(16): 2951-2961. |
| [17] |
CAMPOREZ J P, JORNAYVAZ F R, LEE H Y, et al. Cellular mechanism by which estradiol protects female ovariectomized mice from high-fat diet-induced hepatic and muscle insulin resistance[J]. Endocrinology, 2013, 154(3): 1021-1028. |
| [18] |
PIGHON A, GUTKOWSKA J, JANKOWSKI M, et al. Exercise training in ovariectomized rats stimulates estrogenic-like effects on expression of genes involved in lipid accumulation and subclinical inflammation in liver[J]. Metabolism, 2011, 60(5): 629-639. |
| [19] |
PAQUETTE A, WANG D H, JANKOWSKI M, et al. Effects of ovariectomy on PPAR alpha, SREBP-1c, and SCD-1 gene expression in the rat liver[J]. Menopause, 2008, 15(6): 1169-1175. |
| [20] |
LIU H, ZHONG H, LENG L, et al. Effects of soy isoflavone on hepatic steatosis in high fat-induced rats[J]. J Clin Biochem Nutr, 2017, 61(2): 85-90. |
| [21] |
SAKAMOTO Y, KANATSU J, TOH M, et al. The dietary isoflavone daidzein reduces expression of pro-inflammatory genes through PPARα/γ and JNK pathways in adipocyte and macrophage co-cultures[J]. PLoS One, 2016, 11(2): e0149676. |
| [22] |
KIM M H, PARK J S, JUNG J W, et al. Daidzein supplementation prevents non-alcoholic fatty liver disease through alternation of hepatic gene expression profiles and adipocyte metabolism[J]. Int J Obes (Lond), 2011, 35(8): 1019-1030. |




