非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)已成为威胁我国居民健康的第一大慢性肝病,为突出“代谢紊乱”、“代谢异常”在NAFLD疾病进程中的核心作用,NAFLD已更名为代谢相关脂肪性肝病(metabolic-associated fatty liver disease,MAFLD)[1]。MAFLD全球患病率高达25%[2],目前尚无获得批准的治疗药物,饮食和运动等生活方式干预仍然是防治MAFLD的主要策略[3]。二氢杨梅素(dihydromyricetin,DHM)属于多酚类植物化学物,在天然植物藤茶中含量较高。研究表明,DHM对多种慢性代谢性疾病(如糖尿病、MAFLD等)具有潜在预防或治疗作用[4]。本实验室前期人群研究发现DHM可以延缓NAFLD发生发展[5],动物实验研究发现DHM可以改善肝细胞线粒体呼吸链功能和氧化还原稳态延缓NAFLD发生[6],还可通过增强肝自然杀伤细胞介导的杀伤作用抑制肝星状细胞活化改善肝纤维化进程[7-8],但是DHM防治MAFLD的作用机制尚未完全阐明。近年来研究发现,包括MAFLD在内的多种慢性代谢性疾病的发生与肠道功能(包括肠黏膜屏障、肠道菌群等)密切相关。DHM是否可能通过调节肠黏膜屏障功能改善MAFLD尚不清楚。本研究通过高脂饮食诱导C57BL/6J小鼠建立MAFLD模型,研究DHM对MAFLD发生的影响,并围绕肠黏膜屏障功能深入揭示DHM作用机制,旨在为MAFLD防治提供新的干预靶点,同时为DHM用于慢性代谢性疾病防治提供新的实验依据。
1 材料与方法 1.1 实验动物6周龄雄性SPF级C57BL/6J小鼠购自于湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2019-0004],饲养于陆军军医大学实验动物中心SPF级饲养室,动物房为恒温(22~25 ℃)、恒湿(50%±5%)环境,12 h/12 h昼夜交替,自由饮食和饮水。研究方案经过陆军军医大学实验动物福利伦理审查委员会审核,符合动物伦理和动物福利要求。
1.2 主要试剂高脂饲料(H10045,脂肪供能比为45%)、纯化对照饲料(H10010,脂肪供能比为10%)购自北京华阜康生物科技股份有限公司;DHM购自成都曼思特生物科技有限公司(A0049);总胆固醇(A111-1)、甘油三酯(A110-1)、谷丙转氨酶(C009-2)、谷草转氨酶(C009-2)检测试剂盒购自南京建成生物工程研究所;小鼠内毒素检测鲎试剂盒购自GrenScript公司(L00350);异硫氰酸荧光素-葡聚糖购自Sigma公司(46944);ZO-1、Occludin兔多克隆抗体购自美国abcam公司;胶原酶D和分散酶购自瑞士Roche公司;foxp3/转录因子染色试剂盒(00552300)购自美国eBioscience公司;大鼠抗小鼠CD45 APC-CY7、CD3 FITC、CD90.2 PE-CY7、RORγt PE及IL-22 PerCP eFluor710均购自美国BD Bioscience公司。
1.3 动物分组及干预方法小鼠适应性喂养1周,参考课题组前期研究方法[6],随机分为4组(n=8):CON组(纯化对照饮食)、HFD组(高脂饮食)、HFD+DHM组(添加质量比0.6% 的DHM高脂饲料)及DHM组(添加质量比0.6% DHM的纯化对照饲料)。干预12周,每周记录各组小鼠的体质量和摄食量。
1.4 葡萄糖耐量实验(oral glucose tolerance test,OGTT)12周末,小鼠禁食8 h,尾静脉取血测定空腹血糖,然后按照2.0 g/kg体质量通过灌胃给予葡萄糖溶液,分别在灌胃后15、30、60、90、120 min时间点取尾静脉血测小鼠血糖,记录并计算糖耐量曲线下面积(area under the curve, AUC)。
1.5 肠道通透性实验12周末,小鼠禁食8 h,按照600 mg/kg体质量灌胃给予异硫氰酸荧光素-葡聚糖2 h后,进行眼眶取血。全血静置2 h后,4 ℃、6 000 r/min离心10 min,取150 μL血清加入等体积PBS稀释并混匀后加100 μL在96孔板中,设置3个平行孔,在激发波长485 nm和发射波长535 nm条件下用酶标仪检测吸光度,根据标准曲线计算异硫氰酸荧光素-葡聚糖浓度,反映肠道通透性。
1.6 肝脏组织病理学检测取小鼠肝脏组织,按照常规方法进行冰冻切片和石蜡切片,然后分别进行油红O染色和HE染色,在光学显微镜下观察并采集图像。
1.7 血清生化指标检测小鼠麻醉后取眼眶血,全血置于室温2 h后,4 ℃、6 000 r/min离心10 min,取上层血清,检测血清中总胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶含量,操作方法参照试剂盒说明书进行。
1.8 流式细胞法检测结肠固有层3型固有淋巴样细胞(group 3 innate lymphoid cells, ILC3)细胞比例和IL-22水平参照本实验室常规方法分离结肠ILC3细胞[9]。取出小鼠结肠,去除脂肪和派氏结,纵向切开肠道并用PBS洗去粪便和碎屑,然后在含5 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、10 mmol/L羟乙基哌嗪乙硫磺酸(N-2-hydroxyethylpiperazine-N-ethane-sulphonic acid,HEPES)的D-Hanks平衡盐溶液中消化去除肠上皮细胞。将剪碎的肠组织放入含有500 μg/mL胶原酶D、500 μg/mL DNA聚合酶Ⅰ(DNase Ⅰ)、0.5 U/mL分散酶和2%FBS的Hanks平衡盐溶液中消化得到固有淋巴样细胞。利用抗CD45、CD90.2、CD3流式抗体进行表面染色,然后用foxp3/转录因子染色试剂盒对固有层淋巴样细胞进行破膜固定,再加入抗RORγt和IL-22流式抗体进行核内染色,PBS洗涤2次后,流式细胞仪(BD FCSverse)上机检测。
1.9 RT-qPCR检测按照TRIzol reagent试剂说明书提取结肠和肝脏组织总RNA,测定RNA浓度后按照说明书进行反转录。然后按照TB GreenⓇ Premix Ex TapTMⅡ试剂盒的说明书配置PCR反应液,然后使用QuantStudio 3型实时荧光定量PCR仪进行扩增和检测。采用2-ΔΔCt 法计算基因的相对表达量,内参基因为β-actin。引物序列如表 1所示。
| 基因 | 引物序列(5'→3') |
| TNF-α | 正义:CAGAAAGCATGATCCGCGAC |
| 反义:GGTCTGGGCCATAGAACTGA | |
| IL-1β | 正义:TTGTGCAAGTGTCTGAAGCA |
| 反义:GCTTGGGAGTGAAGAGGTCA | |
| IL-6 | 正义:CCTCTGGTCTTCTGGAGTACC |
| 反义:TCTGTATCTCTCTGAAGGACTCT | |
| Occludin | 正义:TGCTTCATCGCTTCCTTAGTAA |
| 反义:GGGTTCACTCCCATTATGTACA | |
| ZO-1 | 正义:TGGGTTTGGATTTGGAATTGCA |
| 反义:TCCGTTAACCATTGCAACTCG | |
| Reg3b | 正义:ACTCCCTGAAGAATATACCCTCC |
| 反义:CGCTATTGAGCACAGATACGAG | |
| Reg3g | 正义:ATGCTTCCCCGTATAACCATCA |
| 反义:GGCCATATCTGCATCATACCAG | |
| Muc2 | 正义:ACGATGCCTACACCAAGGTC |
| 反义:TGATCTTTACATGTTCCCA | |
| β-actin | 正义:GTGCTATGTTCTAGACTTCG |
| 反义:ATGCCACAGGATTCCATACC |
1.10 蛋白免疫印迹实验
称取结肠组织30 mg左右,加入500 μL蛋白提取液和磁珠,研磨打匀后冰上裂解30 min,在4 ℃、12 000×g离心30 min,吸取上清液,采用BCA法检测蛋白浓度。取40 μg总蛋白进行蛋白免疫印迹实验,使用Image J软件计算各条带灰度值,根据内参蛋白计算相对表达量。
1.11 统计学处理使用SPSS 25.0进行数据统计学分析,用GraphPad Prism 9.0软件作图。多组数据比较采用单因素方差分析,两组数据比较采用LSD法检验。当P < 0.05时差异具有统计学意义。
2 结果 2.1 DHM对高脂饮食诱导小鼠体质量和摄食量的影响小鼠体质量从第2周开始出现明显差异,HFD组体质量明显高于CON组(P < 0.05,图 1A);第3周后,HFD+DHM组体质量较HFD组明显降低。各组小鼠摄食量无明显差异(图 1B)。结果表明DHM能够改善高脂饮食诱导的小鼠体质量增加。

|
| A:体质量变化a: P < 0.05,与CON组比较;b: P < 0.05,与HFD+DHM组比较;B:24 h摄食量 图 1 小鼠体质量和摄食量(n=8, x±s) |
2.2 DHM对高脂饮食诱导小鼠葡萄糖耐量的影响
干预12周后,各组小鼠空腹血糖无统计学差异(图 2A)。小鼠葡萄糖耐量结果显示(图 2B、C),灌胃葡萄糖溶液后,HFD组小鼠血糖明显升高,DHM干预后小鼠葡萄糖耐量显著改善(P < 0.05)。结果表明DHM能够改善高脂饮食诱导的小鼠糖耐量水平。
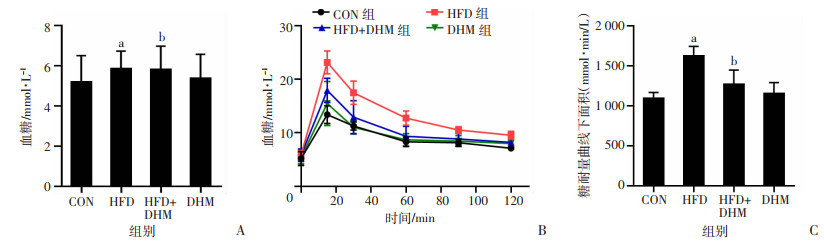
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较; A:干预12周末各组小鼠空腹血糖;B:各组小鼠OGTT实验;C:OGTT实验曲线下面积 图 2 小鼠葡萄糖耐量实验(n=8, x±s) |
2.3 DHM对高脂饮食诱导小鼠血清生化指标的影响
如图 3A、B所示,HFD组小鼠血清甘油三酯和总胆固醇水平明显高于CON组(P < 0.05),但DHM干预后,与HFD组相比,血清甘油三酯和总胆固醇水平明显降低(P < 0.05)。如图 3C、D所示,HFD组谷丙转氨酶和谷草转氨酶水平较CON组明显升高(P < 0.05),但DHM干预后能够明显降低谷丙转氨酶和谷草转氨酶水平(P < 0.05)。结果表明DHM能够改善高脂饮食诱导小鼠的血脂水平和肝脏功能。
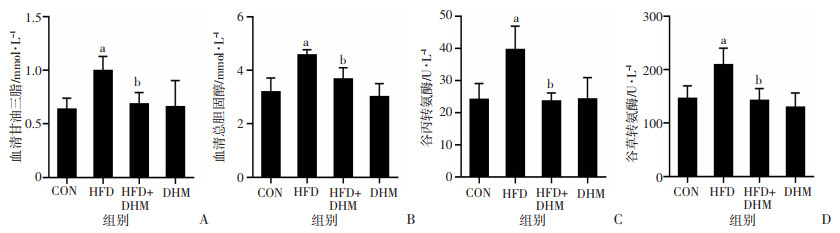
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较;A:甘油三酯;B:总胆固醇;C:谷丙转氨酶;D:谷草转氨酶 图 3 小鼠血清生化指标检测(n=6, x±s) |
2.4 DHM对高脂饮食诱导小鼠肝脏脂质沉积和炎症的影响
各组小鼠肝脏大体形状和肝指数比较(图 4A、B),HFD组小鼠肝指数明显升高,而DHM干预后肝指数降低(P < 0.05)。小鼠肝脏油红O染色结果显示(图 4C、5A),与CON组比较,HFD组小鼠肝脏脂肪空泡和脂滴含量增多,DHM干预后明显减少。小鼠肝脏HE染色结果显示,HFD组汇管区炎性细胞浸润,HFD+DHM组较HFD组炎症程度明显改善(图 4D)。通过RT-qPCR法检测小鼠肝脏组织中促炎性细胞因子mRNA表达水平(图 5B~D),结果发现高脂饮食干预后,HFD组肝脏IL-1β、IL-6、TNF-α的mRNA表达水平明显高于CON组(P < 0.05),而DHM干预后表达水平明显下降,结果有统计学意义(P < 0.05)。结果表明DHM可以改善高脂饮食诱导的小鼠肝脏脂肪沉积和炎症反应。

|
| A:大体观察;B:肝指数a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较;C:油红O染色;D:HE染色 图 4 小鼠肝脏组织病理学变化(n=4~8, x±s) |
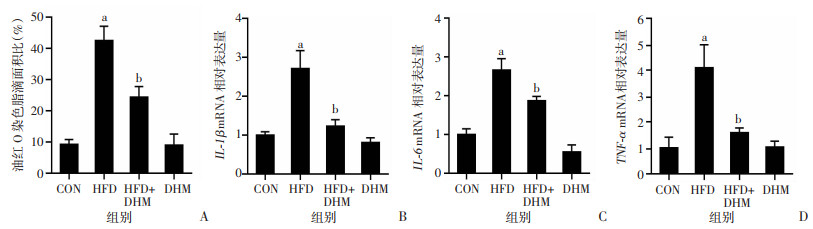
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较A:油红O染色脂滴面积比;B:IL-1β mRNA表达水平;C:IL-6 mRNA表达水平;D:TNF-α mRNA表达水平 图 5 小鼠肝脏组织病理学变化和炎性因子mRNA表达水平(n=4~8, x±s) |
2.5 DHM对高脂饮食诱导小鼠结肠黏膜屏障功能的影响
与CON组小鼠相比,HFD组小鼠肠道通透性增加(图 6A;P < 0.05),血清LPS含量增加(图 6B;P < 0.05),肠道紧密连接蛋白ZO-1和Occludin的mRNA和蛋白表达水平明显降低(图 6C~E;P < 0.05)。与HFD组比较,DHM干预后,小鼠结肠长度增加,肠道通透性降低(图 6A;P < 0.05),血清LPS含量减少(图 6B;P < 0.05),紧密连接蛋白ZO-1和Occludin的mRNA和蛋白表达水平升高(图 6C~E;P < 0.05)。结果表明,DHM能够改善高脂饮食诱导的小鼠肠黏膜屏障功能,增加肠黏膜完整性、减少通透性及LPS渗漏,降低血清LPS水平。

|
| a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较A:肠道通透性检测;B:血清LPS水平;C:ZO-1和Occludin mRNA表达水平;D:Western blot检测ZO-1和Occludin蛋白表达;E:ZO-1和Occludin蛋白表达半定量分析 图 6 小鼠结肠黏膜屏障功能及紧密连接蛋白表达水平(n=3~4, x±s) |
2.6 DHM对高脂饮食诱导小鼠结肠抗菌肽表达水平的影响
如图 7,RT-qPCR检测小鼠结肠中抗菌肽RegⅢβ、RegⅢγ和Muc2 mRNA表达水平结果显示:HFD组RegⅢβ、RegⅢγ mRNA表达水平明显降低(P < 0.05),DHM干预后RegⅢβ、RegⅢγ mRNA表达水平明显升高;Muc2 mRNA表达水平变化趋势与RegⅢβ、RegⅢγ相似,但是结果无统计学差异(P>0.05)。结果表明,DHM能够增加高脂饮食诱导小鼠结肠抗菌肽表达水平,改善肠屏障功能。
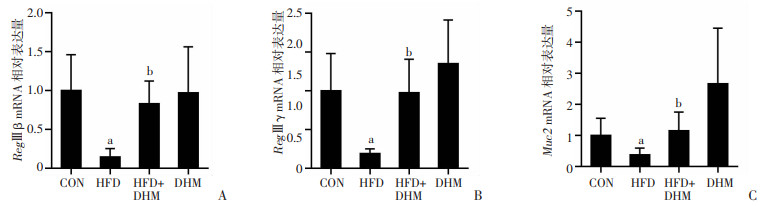
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较A:RegⅢβ mRNA;B:RegⅢγ mRNA;C:Muc2 mRNA 图 7 小鼠结肠组织抗菌肽mRNA表达水平(n=5~6, x±s) |
2.7 DHM对小鼠结肠黏膜固有层ILC3细胞比例和IL-22表达水平的影响
通过流式细胞术分析小鼠肠黏膜固有层ILC3细胞比例的变化(图 8、表 2),结果显示,与CON组比较,HFD组小鼠结肠ILC3细胞(CD45+CD90.2+CD3-RORγt+)在淋巴细胞中的比例以及IL-22+ILC3(CD45+CD90.2+CD3-RORγt+ IL-22+)比例明显降低,DHM干预后较HFD组均明显增加。结果表明,DHM可以增加肠道固有层ILC3比例并促进ILC3细胞的IL-22表达水平,增强肠黏膜免疫屏障功能。

|
| 图 8 小鼠结肠ILC3占淋巴细胞比例及IL-22+ILC3比例 |
| 组别 | ILC3占淋巴细胞比例 | IL-22+ILC3/ILC3 |
| CON组 | 1.17±0.38 | 68.04±7.92 |
| HFD组 | 0.60±0.16a | 42.40±12.08a |
| HFD+DHM组 | 1.01±0.28b | 59.36±11.08b |
| DHM组 | 1.32±0.82 | 72.01±9.54 |
| a: P < 0.05,与CON组比较;b: P < 0.05,与HFD组比较 | ||
3 讨论 3.1 DHM是防治MAFLD的理想植物化学物
随着经济社会发展和生活水平的提高,MAFLD(既往称为NAFLD)已经成为影响全球居民健康的主要肝脏疾病和重要公共卫生问题之一。MAFLD负担迅速增加,MAFLD在中国内地的发病率从2007年至2010年的4.2%上升至2014年至2016年间的5.2%,超过了欧洲国家和美国的发病率[10]。MAFLD患病率和患病人数都在不断增加,且呈年轻化趋势,预计到2030年我国MAFLD患病人数将达到3.1亿[11]。MAFLD发病机制复杂,目前尚无获批的治疗药物,生活方式干预尤其是合理膳食、适量运动是防治MAFLD的主要措施。二氢杨梅素属于多酚类中的黄酮类化合物,在天然植物藤茶中含量较高,在其嫩茎叶中含量高达30%以上,远远高于藤茶中其它黄酮类化合物。本研究通过高脂饮食诱导小鼠建立MAFLD模型,发现HFD组小鼠体质量增加,糖耐量受损,血清总胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶升高,肝脏脂质沉积和炎性因子IL-1β、IL-6、TNF-α mRNA表达水平升高,说明高脂饮食成功诱导小鼠建立MAFLD模型。DHM干预后明显改善高脂饮食诱导的小鼠体质量增加,糖耐量受损,同时减少肝脏脂质沉积和炎性因子表达,说明DHM改善高脂饮食诱导的MAFLD发生发展。本研究结果显示,DHM可能成为防治MAFLD的理想植物化学物。
3.2 DHM有效改善MAFLD小鼠肠黏膜屏障功能MAFLD的发病机制存在多种假说,其中“多重打击学说”逐渐被广泛接受[12]。该学说认为,MAFLD不仅是代谢综合征的肝脏表现,肝外多种器官或组织包括肠道、脂肪组织等都与MAFLD的发生发展密切相关[13-14],其中肠源性LPS渗漏可能是导致持续性肝脏炎性损伤和MAFLD发生发展的重要原因。肠黏膜屏障能够抵御肠道细菌易位和减少LPS渗漏,被称为抵御肠源性致病因子的“第一道防线”。肠黏膜屏障主要包括上皮屏障、化学屏障和免疫屏障等,改善肠黏膜屏障功能可能成为防治MAFLD的重要干预靶点。既往研究发现,一些植物化学物如姜黄素、根皮苷等可以调节肠黏膜屏障功能[15-16],改善高脂诱导的肠黏膜屏障受损。也有研究发现,DHM可调节肠道菌群改善小鼠结肠炎症,预防炎症性结肠癌发生[17]。本研究围绕MAFLD小鼠肠黏膜屏障(包括肠上皮屏障、化学屏障和免疫屏障等)功能开展研究,发现HFD组小鼠肠道通透性和血清LPS增加,肠黏膜紧密连接蛋白ZO-1、Occludin及抗菌肽RegⅢβ、RegⅢγ表达水平降低,结肠ILC3及IL-22+ILC3比例降低(P < 0.05),说明HFD组小鼠肠黏膜屏障出现受损。DHM干预后明显降低血清LPS水平,促进肠紧密连接蛋白和抗菌肽表达水平,减少肠道通透性,增加结肠ILC3和IL-22+ILC3比例(P < 0.05),DHM干预后增加了肠黏膜完整性,减少肠黏膜通透性,增加抗菌肽表达以抵御肠道致病因子侵袭,增强肠道固有免疫功能,减少LPS进入肝脏,改善MAFLD发生发展。
3.3 DHM可能通过调节肠上皮细胞和ILC3改善肠黏膜屏障功能大量研究表明,多酚类植物化学物可能对多种慢性代谢性疾病具有潜在的防治作用。本研究提示,DHM可能作用于肠上皮细胞或肠道固有层ILC3细胞,以调节肠黏膜屏障功能,但是相关作用机制尚有待进一步研究。DHM在体内生物利用率较低,清除速率快,但在粪便内容物中能够检出其原型形式,提示其可能以原型形式作用与肠上皮细胞或ILC3细胞[18]。本实验室前期通过16 sRNA和代谢组学研究发现,DHM干预后肠道菌群和代谢物都有明显改变,提示DHM也可能通过其代谢物间接调节肠上皮细胞和ILC3细胞。研究发现,ILC3表面存在芳香烃受体(aryl hydrocarbon receptor,AhR),膳食中的部分植物化学物或其肠道菌群代谢物如吲哚醛能够作为天然配体作用于AhR受体,促进ILC3活化、分化及相关细胞因子表达[19]。研究发现,IL-22可促进肠黏膜上皮细胞分泌多种抗菌活性物质如粘蛋白、抗菌肽、RegⅢβ、RegⅢγ等[20],因此DHM可能通过促进ILC3产生IL-22增加肠道抗菌肽的表达水平。下一步可利用多种实验模型,进一步深入研究DHM调节肠道菌群以及肠黏膜多种细胞的效应靶点和作用机制,为MAFLD防治提供新的干预靶点,同时为DHM用于慢性代谢性疾病防治提供新的实验依据。
| [1] |
ESLAM M, SANYAL A J, GEORGE J, et al. MAFLD: a consensus-driven proposed nomenclature for metabolic associated fatty liver disease[J]. Gastroenterology, 2020, 158(7): 1999-2014. |
| [2] |
YOUNOSSI Z, ANSTEE Q M, MARIETTI M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(1): 11-20. |
| [3] |
MOORE M P, CUNNINGHAM R P, DASHEK R J, et al. A fad too far? Dietary strategies for the prevention and treatment of NAFLD[J]. Obesity (Silver Spring), 2020, 28(10): 1843-1852. |
| [4] |
TONG H H, ZHANG X J, TAN L F, et al. Multitarget and promising role of dihydromyricetin in the treatment of metabolic diseases[J]. Eur J Pharmacol, 2020, 870: 172888. |
| [5] |
CHEN S H, ZHAO X L, WAN J, et al. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease: a randomized controlled trial[J]. Pharmacol Res, 2015, 99: 74-81. |
| [6] |
ZENG X L, YANG J N, HU O, et al. Dihydromyricetin ameliorates nonalcoholic fatty liver disease by improving mitochondrial respiratory capacity and redox homeostasis through modulation of SIRT3 signaling[J]. Antioxid Redox Signal, 2019, 30(2): 163-183. |
| [7] |
ZHOU X, YU L, ZHOU M, et al. Dihydromyricetin ameliorates liver fibrosis via inhibition of hepatic stellate cells by inducing autophagy and natural killer cell-mediated killing effect[J]. Nutr Metab (Lond), 2021, 18(1): 64. |
| [8] |
HUANG L, ZENG X L, LI B, et al. Dihydromyricetin attenuates palmitic acid-induced oxidative stress by promoting autophagy via SIRT3-ATG4B signaling in hepatocytes[J]. Nutr Metab (Lond), 2021, 18(1): 83. |
| [9] |
余利, 蒋玲, 周杰, 等. 小鼠肠道3型固有淋巴样细胞检测与分析方法研究[J]. 局解手术学杂志, 2022, 31(2): 113-118. YU L, JIANG L, ZHOU J, et al. Detection and analysis method of group 3 innate lymphoid cells in miceintestine[J]. J Reg Anat Oper Surg, 2022, 31(2): 113-118. |
| [10] |
ZHOU J H, ZHOU F, WANG W X, et al. Epidemiological features of NAFLD from 1999 to 2018 in China[J]. Hepatology, 2020, 71(5): 1851-1864. |
| [11] |
ESTES C, ANSTEE Q M, ARIAS-LOSTE M T, et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016-2030[J]. J Hepatol, 2018, 69(4): 896-904. |
| [12] |
BUZZETTI E, PINZANI M, TSOCHATZIS E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism, 2016, 65(8): 1038-1048. |
| [13] |
LI X Y, WANG H. Multiple organs involved in the pathogenesis of non-alcoholic fatty liver disease[J]. Cell Biosci, 2020, 10(1): 140. |
| [14] |
ZHANG X, JI X T, WANG Q, et al. New insight into inter-organ crosstalk contributing to the pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Protein Cell, 2018, 9(2): 164-177. |
| [15] |
GHOSH S S, HE H L, WANG J, et al. Curcumin-mediated regulation of intestinal barrier function: the mechanism underlying its beneficial effects[J]. Tissue Barriers, 2018, 6(1): e1425085. |
| [16] |
ZHANG X Y, CHEN J, YI K, et al. Phlorizin ameliorates obesity-associated endotoxemia and insulin resistance in high-fat diet-fed mice by targeting the gut microbiota and intestinal barrier integrity[J]. Gut Microbes, 2020, 12(1): 1-18. |
| [17] |
DONG S J, ZHU M, WANG K, et al. Dihydromyricetin improves DSS-induced colitis in mice via modulation of fecal-bacteria-related bile acid metabolism[J]. Pharmacol Res, 2021, 171: 105767. |
| [18] |
GOTO Y, OBATA T, KUNISAWA J, et al. Innate lymphoid cells regulate intestinal epithelial cell glycosylation[J]. Science, 2014, 345(6202): 1254009. |
| [19] |
ZELANTE T, IANNITTI R G, CUNHA C, et al. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22[J]. Immunity, 2013, 39(2): 372-385. |
| [20] |
PATNAUDE L, MAYO M, MARIO R, et al. Mechanisms and regulation of IL-22-mediated intestinal epithelial homeostasis and repair[J]. Life Sci, 2021, 271: 119195. |




