2. 400042 重庆,重庆医科大学神经科学研究中心
2. Neuroscience Research Center, Chongqing Medical University, Chongqing, 400042, China
阿尔茨海默病(Alzheimer’s disease,AD)是一种严重的大脑神经退行性疾病,目前还没有治愈的方法。在大脑出现大范围的病理改变之前,尽早发现并治疗对疾病的预后至关重要[1]。AD的确诊需依赖脑组织活检,但具体实施十分困难。第一代AD诊断标准主要依据临床症状,第二代诊断标准提出通过神经心理特征结合生物标记物的方法来识别和诊断AD[2]。目前能够帮助诊断AD的生物标志物要么是有创的(如通过腰椎穿刺采集的脑脊液样本),要么是昂贵的(如神经成像),均不宜推广普适[3]。同时,前往就医的患者中,也往往存在表达困难、听力减退,难以配合完成量表评测、影像学或有创检查等问题。因此,开发一种可靠、无创、方便、低成本的检测方法尤为重要。
AD病理改变的部位为脑组织,这种病理改变会影响位于人类脑组织的正常视觉通路[4],从而出现眼球活动方式的改变,即眼动障碍。有研究[5-6]表明存在认知障碍的患者普遍有注意力、视空间、执行力和眼动纠错方面的损害,更重要的是,眼动障碍可以在疾病早期甚至在神经心理测试发现认知障碍之前就出现[7]。
眼动跟踪技术,通过一套红外瞳孔追踪摄像自动记录分析系统,借助不同的光学镜头及软件功能模块,测定、跟踪、记录单眼瞳孔的移动,从而记录眼球活动轨迹和眼球活动的相关数据。与检测脑脊液和神经成像相比,眼球追踪技术具备无创和低成本的特点[8-9],这使得它特别适合于在一般人群中和临床特定人群(如痴呆患者)中开展。本研究基于眼球跟踪技术提供的患者眼动信息建立并验证AD的Logistic回归模型,旨在探讨眼球跟踪技术在AD的诊断方面的应用价值。
1 对象与方法 1.1 研究对象 1.1.1 AD组为2021年1-11月因主诉记忆下降>3个月到重庆医科大学附属第一医院老年科记忆门诊就诊的患者。纳入标准:(1)年龄≥50岁;(2)符合2011年美国国立老化研究所和阿尔茨海默病协会(National Institute on Aging-Alzheimer’s Association,NIA-AA)发布的AD诊断标准。①隐袭起病;②有明确的认知功能恶化史;③在询问病史和体检中发现的早期和最显著的认知损害属于遗忘表现或非遗忘表现(如语言障碍、视空间障碍或执行功能障碍)的一种,以及至少1项其他认知功能缺损的证据。排除标准:(1)出现严重的脑血管病、路易体痴呆、额颞叶痴呆、原发性进行性语义型失语以及有其他活动性神经疾病并发症等。(2)其他原因导致的认知能力减退,包括血管原因导致的意识障碍、癫痫、精神性疾病等。(3)其他重大躯体疾病及严重影响视力的眼疾。(4)能理解测试内容并独立配合完成完整眼动测试。
1.1.2 认知正常对照组同期募集自愿参加研究的认知正常体检者。纳入标准:(1)自诉无记忆损害的表现;(2)日常生活能力、社会交往能力无异常;(3)年龄≥50岁;(4)临床痴呆分级量表(clinical dementia rating,CDR)=0;(5)简易智力状态检查量表(Mini-Mental State Examination,MMSE)>27分。排除标准:有重大躯体疾病及影响视力的眼疾。
研究对象均为居住在中国西南地区的汉族人,样本量确定采用多元统计建模kendall准则,即样本量按照进入最终模型自变量个数的15~20倍。由重医附一院老年科记忆门诊研究生团队进行量表评定,进行统一培训。受试者均签署知情同意书,本研究方案得到重庆医科大学附属第一医院临床科研伦理委员会批准[批件号:2021年科伦药审(20212901)号]。
1.2 观察指标 1.2.1 眼动数据采集眼动数据采集采用注视、追随、正向眼跳(间隙范式)、反向眼跳(间隙范式)共计四项任务。眼动检测利用tobii4L型(杭州极智)桌面式眼动仪,采用瞳孔及角膜反射模式记录被试眼动信息,采用正反三角校准模式,采集被试优势眼数据,采样频率为250 Hz。被试眼位与屏幕中心等高,距屏幕60 cm,被试者头部放置于固定好的额托上,以双眼的圆形影像指示于屏幕正中,大小在0.5~1 cm左右、明亮态确认为头部固定位恰当。仪器追踪水平位置(±30°)、垂直位置(±30°)内的眼球运动。屏幕为15.6寸显示器,分辨率为1 920×1 080像素。试验在独立、安静、无强光刺激的房间进行。眼动程序、数据分析程序均采用内置的TOBII官方驱动软件。
1.2.2 相关眼动变量 1.2.2.1 注视眼跳(fixate-saccades)次数被试双眼注视眼动仪屏幕中央的白色十字(固定点)的20 s内发生的注视点完全离开固定点,然后快速地纠正并扫视回到固定点的次数。
1.2.2.2 追随眼跳(smooth pursuit-saccades)次数被试20 s内双眼注视并追随屏幕中以水平直线(0.4 Hz)运动的白色圆圈(目标刺激),发生在追随过程中眼跳视总次数。
1.2.2.3 正向眼跳(pro-saccades)延迟时间被试双眼注视眼动仪屏幕中央的白色十字(固定点)后间隔200 ms,屏幕左右外侧随机出现白色圆圈(目标刺激),要求目标刺激出现时立即扫视它,从目标刺激呈现到被试者做出第一次眼跳之间的时间间隔称为正向眼跳延迟时间。一次任务中上述过程共执行8次,正向眼跳延迟时间结果取8次结果的平均值。
1.2.2.4 反向眼跳(anti-saccades)延迟时间及错误率被试双眼注视眼动仪屏幕中央的白色十字(固定点),200 ms后屏幕左右外侧随机出现白色圆圈(目标刺激),要求被试主动抑制指向目标的正向眼跳,把注意转向目标刺激的对侧,产生与目标到中央固定点的距离大致相等的眼跳。从目标刺激出现到被试者做出第一次反向眼跳之间的时间间隔称为反向眼跳延迟时间。
一次任务中上述过程共执行8次,反向眼跳延迟时间结果取8次结果的平均值。用反向眼跳方向执行错误数除以总执行次数得到的百分比计为反向眼跳错误率。
1.2.3 认知评估方法采用中文版自由延迟线索回忆(free and cued selective reminding test,FCSRT)、画钟试验(clock drawing task,CDT)、数字广度测试(digit span test,DST)、连线试验(trail making test,TMT)、听觉词语学习检测(auditory verbal learning test,AVLT)、波士顿命名测验(Boston naming test,BNT)等分别对受试者的情景记忆能力、视空间、注意力、学习能力、语言功能进行测评。主要认知评估人员由为本团队的2名高年级研究生,在试验前均接受了专业培训,由他们对测试结果进行初步评分,测试时间约为60 min,评分一致则予以记录,如不一致则交由高年资医师进行最终评估。两名评估人员评分的一致性为90%。
1.3 统计学分析采用SPSS 23.0进行统计学分析,ROC曲线用R version 4.1.3实现。用Kolmogorov-Smirnov检验对计量资料进行正态性检验,正态分布计量资料用x±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料用M(P25,P75)表示,计数资料以频数表示,组间比较采用χ2检验。
将本研究收集的总计167例数据按照7∶3的比例分为训练集(117例)和测试集(50例)。训练集是用来学习的样本集,用于分类参数的拟合。测试集是用于对已经训练好的分类器进行性能评估的样本集。将在临床上认为与AD关系密切的变量筛选为输入变量,是否诊断为AD作为结局变量,将上述筛选出的变量以及眼动预测变量包括注视眼跳次数、追随任务眼跳次数、正向眼跳任务眼跳延迟时间、反向眼跳任务眼跳延迟时间、反向眼跳任务错误率等5个指标进行逐步多因素Logistic回归模型的构建,用测试集数据进行模型验证。并分别用受试者工作曲线(receiver operating characteristic curve,ROC)评判模型诊断受试者操作曲线下面积(area under the subject curve,AUC)、准确度、特异度及灵敏度。P<0.05则认为存在统计学差异。
根据数据分布形态,将两组受试者间有显著性统计学意义的变量分别和FCSRT、CDT、DST、TMT、AVLT和BNT测试值进行Pearson相关性分析或Spearman相关性分析,P<0.05认为差异存在统计学意义。
2 结果 2.1 一般资料研究最终纳入113例AD患者,正常对照组54例,2组受试者性别、年龄、文化程度、吸烟、饮酒情况间差异无统计学意义(P>0.05),认知情况组间差异有统计学意义(P<0.001),见表 1。
| 一般资料 | 正常对照组 (n=54) |
AD组 (n=113) |
χ2/t | P |
| 性别 | 1.857 | 0.173 | ||
| 男 | 17(31.5) | 39(34.5) | ||
| 女 | 37(68.5) | 74(65.5) | ||
| 年龄/岁 | 75.8±7.8 | 75.50±8.29 | 0.433 | 0.666 |
| 文化程度 | 0.378 | 0.828 | ||
| 小学及以下 | 19(35.2) | 45(39.8) | ||
| 中学/中专 | 24(44.4) | 48(42.5) | ||
| 大学及以上 | 11(20.4) | 20(17.7) | ||
| 吸烟 | 17(31.5) | 37(32.7) | 0.947 | 0.334 |
| 饮酒 | 23(42.6) | 49(43.4) | 0.008 | 0.925 |
| MMSE/分 | 28.63±0.556 | 23.47±1.284 | 3.825 | 0.000 |
训练集和测试集间性别、年龄、文化程度、吸烟、饮酒情况、认知情况组间差异均无统计学意义,一般特征比较见表 2。
| 一般资料 | 测试集 (n=50) |
训练集 (n=117) |
χ2/t | P |
| 性别 | 0.006 99 | 0.933 | ||
| 男 | 17(33.7) | 39(33.3) | ||
| 女 | 33(66.3) | 78(66.7) | ||
| 年龄/岁 | 76.4±7.11 | 74.70±8.96 | 0.142 | 0.118 |
| 文化程度 | 4.988 | 0.289 | ||
| 小学及以下 | 15(30.7) | 49(41.9) | ||
| 中学/中专 | 28(55.2) | 44(37.6) | ||
| 大学及以上 | 7(13.8) | 24(20.5) | ||
| 吸烟 | 15(30.0) | 39(33.3) | 0.178 | 0.673 |
| 饮酒 | 22(44.0) | 50(42.7) | 0.023 | 0.880 |
| MMSE/分 | 26.75±0.729 | 26.21±1.135 | 1.465 | 0.635 |
2.2 各组眼动检查指标
注视眼跳次数、追随任务眼跳次数、正向眼跳任务眼跳延迟时间、反向眼跳任务眼跳延迟时间、反向眼跳任务错误率均服从正态分布。对正常对照组和AD组的眼动数据进行非参数秩和检验结果显示,正常对照组和AD组受试者的正向眼跳任务眼跳延迟时间、反向眼跳任务眼跳延迟时间、反向眼跳任务错误率间的差异均有统计学意义(P < 0.01),两组受试者的注视眼跳次数、追随任务眼跳次数间的差异均无统计学意义(P>0.05),见表 3。
| 组别 | n | 注视眼跳次数/次 | 追随任务眼 跳次数/次 |
正向眼跳 延迟时间/ms |
反向眼跳 延迟时间/ms |
反向眼跳任务 错误率(%) |
| 正常对照组 | 54 | 7.00 (4.00,17.00) | 30.00 (27.75,5.00) | 240.56 (205.31,291.63) | 531.32 (408.16,604.70) | 0.00 (0.00,0.00) |
| AD组 | 113 | 8.00 (3.00,13.00) | 31.00 (25.00,34.00) | 311.40 (265.43,373.72) | 790.98 (604.18,1 098.14) | 75.00 (13.00,100.00) |
| Z | -1.025 | -0.971 | -5.474 | -5.625 | -8.467 | |
| P | 0.306 | 0.331 | 0.000 | 0.000 | 0.000 |
2.3 Logistic回归模型建立与验证
将训练集中在临床上认为与AD关系密切的5项检测指标:注视眼跳次数、追随任务眼跳次数、正向眼跳任务眼跳延迟时间、反向眼跳任务眼跳延迟时间、反向眼跳任务错误率进行逐步回归多因素Logistic回归模型的构建,结果显示:两组受试者间注视眼跳次数、反向眼跳延迟时间、反向错误率结果因素差异有统计学意义(P < 0.05,表 4)。故AD Logistic回归预测模型建立如下: Logit P=-3.320-0.105×注视眼跳次数+0.006×反向延迟时间(ms)+0.091×反向错误率(%)。
| 指标 | β | SE | OR(95%CI) | P |
| 静息次数 | -0.105 | 0.044 | 0.900(0.825-0.892) | 0.018 |
| 反向延迟时间 | 0.006 | 0.002 | 1.006(1.002-1.010) | 0.001 |
| 反向错误率 | 0.091 | 0.030 | 1.096(1.033-1.162) | 0.002 |
| 常量 | -3.320 | 1.105 | 0.036 | 0.003 |
通过测试集数据验证Logistic预测模型,ROC分析显示,在训练集中当临界值(cutoff)为0.711时,AUC、准确性、特异度、灵敏度分别为0.913、0.880、0.909、0.759,在测试集当临界值(cutoff)为0.804时,AUC、准确度、特异度、灵敏度分别为0.964、0.852、0.840、0.793,当P≥0.711时,诊断患者为AD可能性大,见图 1。
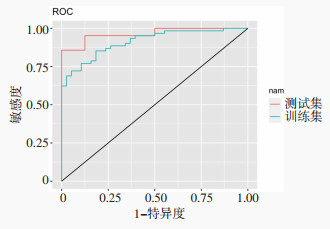
|
| 图 1 Logistic回归模型预测AD的ROC曲线 |
2.4 AD组的各量表分值与各眼动检查指标的相关性
对AD组中113例受试者分别进行FCSRT、CDT、DST、TMT、AVLT和BNT测试,6项测试评分均不服从正态分布。测评结果和眼动数据的Spearman相关性分析结果显示,AD组的反向眼跳延迟时间与FCSRT呈负相关(P < 0.01),与TMT、AVLT测试分数呈负相关(P < 0.05);反向眼跳错误率与FCSRT、TMT、AVLT、BNT测试分数均呈负相关(P < 0.01);注视眼跳次数与上述测验分数无相关性,见表 5。
| 项目 | 自由延迟线索回忆 | 画钟试验 | 数字广 度测试 |
连线试验 | 听觉词语 学习检测 |
波士顿命 名测验 |
|
| 自由回忆总数 | 线索索引指数 | ||||||
| 得分 | 12.88±9.80 | 0.66±2.30 | 9.9±4.51 | 7.16±1.54 | 21.01±5.37 | 13.62±6.36 | 20.82±5.52 |
| 注视眼跳次数 | 0.122 | -0.840 | -0.099 | -0.029 | -0.066 | 0.005 | 0.039 |
| 反向眼跳延迟时间 | -0.360b | -0.057 | -0.152 | -0.073 | -0.237a | -0.253a | -0.080 |
| 反向眼跳错误率 | -0.327b | -0.109 | -0.567b | -0.191 | -0.430b | -0.358b | -0.330b |
| a: P < 0.05;b: P < 0.01 | |||||||
2.5 常用认知功能筛查工具与本眼动预测模型的比较
与其他常用认知功能筛查工具相比,眼动预测模型的敏感性适中,特异性具有显著优势,实施时间短,适用于临床辅助诊断AD,见表 6。
| 项目 | 实施时间 | 敏感性 | 特异性 | 优点 | 不足 |
| MMSE[10] | 5~12 min | 69% | 87% | 涵盖的认知项目较为广泛,操作简单方便。预测痴呆特异性较高,几乎适用于所有研究 | 可能会受到年龄和教育的影响,耗时较长; 多次使用会导致学习效应 |
| MOCA[11] | 10~15 min | 100% | 87% | 和MMSE相比,其筛查MCI的病人的效果更好 | 可能会受到教育的影响,耗时长,受试者体验感较差 |
| CASI[12] | 15~20 min | 91% | 33% | 更适合于文盲,跨文化应用也是适合的 | 耗时长,受试者体验感较差,特异性较低 |
| HDS[10] | 约15 min | 92% | 74% | 更符合东方民族文化背景 | 耗时较长,不能做机制分析和记忆策略,不能反映各认知区域的变化特点 |
| CDT[13] | 1~4 min | 59% | 65% | 实施时间短,和MMSE相比,很少被影响,联合应用可能更有效 | 对视力和书写能力有要求,特异性较低 |
| 眼动预测模型 | 4~5 min | 75.9% | 90.9% | 简单快速,对测试者无培训需求,不受测试者差异影响,特异性高 | 需要设备,对视力有要求 |
3 讨论 3.1 AD治疗所面临的困境
AD尚无特效药面市,是导致老年人最终失能的罪魁祸首之一,成为我国老龄化社会面临的重要挑战。因此,早期诊断AD以达到及时治疗和有效预防认知功能进行性下降成为了该病的研究热点。然而目前诊断AD的生物标志物存在着侵入性和昂贵的局限性,发现一种可靠的非侵入性和低成本的生物标志物对AD早发现早诊断早治疗至关重要。眼球运动异常是一种敏感、低成本且无创的认知改变或认知恶化的标志,因此本研究探究了一种使用基于眼动追踪技术的AD诊断模型,结果显示其具有较好的诊断效用,存在临床应用价值。
3.2 各个眼病任务具备诊断价值的机制本研究发现,注视眼跳次数、反向眼跳任务眼跳延迟时间、反向眼跳任务错误率间的差异等均为显著因素。人类眼球运动有3种基本类型:注视、眼跳和追随运动[14]。自从1980年,国外有研究者提出了“眼-脑”假说(Eye-Mind),认为眼球运动与大脑认知功能相关[15],其后多项研究结果表明,眼球运动不仅仅是为了配合完成视觉过程,还能反映受试者的视觉空间、短时记忆和执行功能,因此眼球运动可应用于神经系统疾病和认知障碍的评估和诊断[16]。
微眼跳是注视过程中注视的微小变化(<1°视角)[17]。微眼跳在神经系统上的产生机制方面与正向眼跳基本相同,研究表明,这两种眼跳都是通过一个共同的脑干神经通路完成的[18]。在本研究中我们利用“注视眼跳次数”这一指标来测量和量化该过程,与健康的老年人相比,AD患者的微眼跳发生的次数更多,但纠正并扫视回固定点的减少的比例较微眼跳增加的比例更大[19],本预测模型中“注视眼跳次数”前的系数为负值,为-0.105,表明注视眼跳次数对诊断AD有价值,即“注视眼跳次数”愈小,患AD的风险愈大,这与上述研究中认知障碍的患者纠正微眼跳的能力下降的结论一致。
正向眼跳需要受试者在任务开始时注视一个固定点,然后在固定点以外的目标刺激出现时立即扫视它。正向眼跳的产生在大脑中涉及的神经通路较为复杂,涉及大脑皮层和脑干的多个区域[20]。额叶视功能区(frontal eye field)和顶叶视功能区(parietal eye field)的活动分别触发主动性和反射性扫视[21]。此外其他视功能区(supplementary eye field)也参与眼跳过程,如监测眼跳错误和发生在眼跳过程中的问题[22-23]。虽然上述多个大脑功能区域存在认知障碍相关的病理改变均可影响正向眼跳准确完成,但正向眼跳障碍在AD中可能并不普遍存在,多项试验也发现AD患者正向眼跳功能正常,包括正向眼跳延迟时间[24-25]、准确性[24-25]、速度[26-27]等。本试验一开始将正向眼跳延迟时间作为独立危险因素纳入对AD的预测分析,经过逐步回归得出该指标对AD的预测价值没有统计学意义,这与上述研究的结果一致。
反向眼跳行为产生的神经过程有赖于前额叶背外侧(Dorsolateral Prefrontal Lobe,DLPFC)发送到上丘的抑制信号,以抑制对目标做出反射性的正向眼跳行为[28]。然后,通过后额叶视功能区和顶叶视功能区把将要发生的正向眼跳的方向从刺激目标反转到相反的视区[29-30]。最后由额叶视功能区通过和进行正向眼跳同样的方式完成最后的反向眼跳过程[31]。国外相关研究表明[32],与健康老年人相比,AD患者按照测试要求对刺激目标做出反向眼跳时的错误眼跳更多,纠正次数更少,并且在执行反向眼跳后也表现出延迟时间增加的情况。由于反眼跳过程中的抑制信号起源于前额叶背外侧,有研究者将抑制反射性正向眼跳功能的下降即反向眼跳功能的下降归因于DLPFC的退化[33]。本研究的结果同样证实了在AD的Logistic回归诊断模型中反向眼跳延迟时间和反向眼跳错误率可以作为独立危险因素,且反向眼跳延迟时间越长,错误率愈高患有AD的可能性愈大。
在追随眼动任务中,受试者的目光需要不断地跟踪并注视着一个移动的目标。准确的追随眼动能力代表了受试者保持注视移动目标的能力,同时尽量减少在目标运动方向上的预期眼跳的数量和补偿性的“追赶”眼跳[34]。追随眼动的过程机制是运动目标的运动信息由外侧枕颞叶皮层(lateral occipitotemporal cortex)提取,该皮层向额叶视功能区负责物体追踪的部位和其他视功能区发送信号[35]。然后,该信号继续传递到大脑中负责眼跳的区域,并发送最终的眼动命令来移动眼睛以完成追随任务[36-38]。有研究表明,认知功能下降的患者对要追随的目标进行眼球运动时经常向目标运动的方向进行预期的眼跳[39-40]。此外由于执行能力和注意力的下降,在跟随目标运动时患者会产生明显更多的代偿性眼跳[41]。但是尽管有上述关于追随眼动中异常眼跳次数增加的报道,但也有研究发现AD患者可以表现出正常的追随眼动功能[42]。本研究中的统计分析结果显示,对照组和AD组受试者的追随眼跳次数组间无差异,且logistics回归分析也显示追随眼跳次数也不是预测AD的独立危险因素。
3.3 对眼动任务具备诊断效力来源的探讨临床上常用一系列量表来评估患者各方面的认知水平,FCSRT是评价情景记忆最常用的神经心理学测验,FCSRT和线索索引指数分别反映了受试者的自由回忆的能力和提示回忆的能力[43]。CDT、DST、TMT、AVLT、BNT则分别反映了受试者的视空间、注意力、学习能力、语言功能。本研究的相关性研究显示,AD患者的反向眼跳延迟时间与FCSRT、TMT、AVLT检测分数呈负相关,提示反向眼跳延迟时间至少是通过反映受试者自由回忆能力、注意力和学习能力三方面的缺陷来体现该指标的诊断效力的;反向错误率与FCSRT、CDT、AVLT、BNT测验分数呈负相关,提示反向眼跳错误率则至少是通过反映受试者自由回忆能力、视空间能力、学习能力和语言功能等4方面的缺陷来体现该指标的诊断效力。
3.4 本研究的局限性及总结综上所述,基于眼动数据建立AD的预测模型是可行的,认知障碍患者的眼动特点可以反映该患者在自由回忆能力、注意力、视空间能力、学习能力和语言功能方面的缺损。注视眼跳次数、反向延迟时间、反向错误率是其独立预测因子。在构建AD患者的预测模型后训练集和测试集中均表现了优秀的敏感性和特异性,且相比于常用认知功能筛查工具存在明显优势,该模型应用于老年认知障碍诊断方面除价值较高以外还兼具简单快速、对测试者无培训需求、被测体验感好、不受测试者差异影响等优点,适合未来在临床工作中普及。
本研究的创新之处在于:首先,国内的眼动研究主要集中在帕金森疾病[44]、抑郁症[45]和孤独症谱系障碍[46]等,目前国内鲜有研究通过探索眼球运动在AD中的诊断作用。其次,国外眼动在老年认知障碍领域相关研究仅仅证实了在不同范式下的眼球运动可以区分认知正常人群和AD患者[47],但并未形成一个诊断模型,临床应用受到明显限制。本研究的亮点为建立了AD的诊断模型,并进行了验证,效果良好。应用该模型能经过快速简易的测试获得眼动数据后通过简单的换算即能得出AD的阴性阳性结果,这使得在该诊断模型人群中的大规模筛查和临床上辅助诊断AD方面应用前景较好。本研究与临床常用认知子领域量表进行相关性分析,发现了眼动主要是通过某一个或某几个认知域对AD的诊断发挥作用。
本研究在所选的眼动任务及数据方面仅选择了和认知相关最经典的几种类型,类型较单一;在探索独立危险因素的诊断机制方面,未能发现“注视眼跳次数”是通过反映何种类型的认知功能障碍进行预测的,未来在增加了更多种能反映其他类型认知障碍的量表后可能会得到答案;本研究严格按照纳排标准,虽已尽可能纳入更多的患者,但对照组受试者较少,两组资料不平衡,客观性稍显不足。目前研究仅证实了眼动技术的有效性,但尚未深入探索其机制(包括其特异性相对较低的原因问题)。
在今后的研究中,可纳入其他认知障碍类型,如额颞叶痴呆、路易体痴呆、帕金森痴呆等。为增加纳排标准中AD诊断的特异性,可以通过纳入接受了Aβ淀粉样蛋白PET-CT检测的正常对照组和AD患者来实现。对眼动范式进行创新,与现有眼动范式进行对比,探索更加灵敏的眼动范式。应扩大样本量,对本研究眼动预测模型进行外部验证,对其进行优化,增加模型的普适性。
| [1] |
Alzheimer's and Dementia. What is Alzheimer's Disease?[EB/OL]. [2020-06-18]. https://www.alz.org/alzheimers-dementia/what-is-alzheimers
|
| [2] |
GOLDFARB D. Advances in diagnosis of Alzheimer disease and emerging treatment targets[J]. J Clin Psychiatry, 2021, 82(3): LI19012AS1C. |
| [3] |
ATRI A. The Alzheimer's disease clinical spectrum: diagnosis and management[J]. Med Clin North Am, 2019, 103(2): 263-293. |
| [4] |
PEREIRA M, CAMARGO M, BELLAN A F R, et al. Visual search efficiency in mild cognitive impairment and Alzheimer's disease: an eye movement study[J]. J Alzheimers Dis, 2020, 75(1): 261-275. |
| [5] |
KREBS C, FALKNER M, NIKLAUS J, et al. Application of eye tracking in puzzle games for adjunct cognitive markers: pilot observational study in older adults[J]. JMIR Serious Games, 2021, 9(1): e24151. |
| [6] |
杨晓帆, 丰雷, 冯媛, 等. 眼动追踪范式在抑郁症评估中的研究进展[J]. 神经疾病与精神卫生, 2020, 20(5): 333-337. YANG X F, FENG L, FENG Y, et al. Advances in study of the eye movement tracking technology in depression assessment[J]. J Neurosci Ment Heal, 2020, 20(5): 333-337. |
| [7] |
MAO Y X, HE Y H, LIU L M, et al. Disease classification based on eye movement features with decision tree and random forest[J]. Front Neurosci, 2020, 14: 798. |
| [8] |
TAO L, WANG Q, LIU D, et al. Eye tracking metrics to screen and assess cognitive impairment in patients with neurological disorders[J]. Neurol Sci, 2020, 41(7): 1697-1704. |
| [9] |
GRIMA-MURCIA M D, SANCHEZ-FERRER F, RAMOS-RINCÓN J M, et al. Use of eye-tracking technology by medical students taking the objective structured clinical examination: descriptive study[J]. J Med Internet Res, 2020, 22(8): e17719. |
| [10] |
PINTO T C C, MACHADO L, BULGACOV T M, et al. Is the Montreal Cognitive Assessment (MoCA) screening superior to the Mini-Mental State Examination (MMSE) in the detection of mild cognitive impairment (MCI) and Alzheimer's Disease (AD) in the elderly?[J]. Int Psychogeriatr, 2019, 31(4): 491-504. |
| [11] |
孙伟铭, 董香丽, 张军, 等. MoCA与MMSE在脑外伤患者认知功能障碍评估中的效果比较[J]. 现代预防医学, 2019, 46(5): 939-943. SUN W M, DONG X L, ZHANG J, et al. Differences between MoCA and MMSE in the assessment of cognitive dysfunction in patients with traumatic brain injury[J]. Mod Prev Med, 2019, 46(5): 939-943. |
| [12] |
OBHI H K, MARGRETT J A, RUSSELL D W, et al. Factor analysis of the cognitive abilities screening instrument: Kuakini Honolulu-Asia aging study[J]. Int Psychogeriatr, 2022, 34(6): 543-551. |
| [13] |
TALWAR N A, CHURCHILL N W, HIRD M A, et al. The neural correlates of the clock-drawing test in healthy aging[J]. Front Hum Neurosci, 2019, 13(4): 25. |
| [14] |
PARISOT K, ZOZOR S, GUÉRIN-DUGUÉ A, et al. Micro-pursuit: a class of fixational eye movements correlating with smooth, predictable, small-scale target trajectories[J]. J Vis, 2021, 21(1): 9. |
| [15] |
PRICE R B, DUMAN R. Neuroplasticity in cognitive and psychological mechanisms of depression: an integrative model[J]. Mol Psychiatry, 2020, 25(3): 530-543. |
| [16] |
HODGSON T L, EZARD G, HERMENS F. Eye movements in neuropsychological tasks[J]. Curr Top Behav Neurosci, 2019, 41: 393-418. |
| [17] |
HSU T Y, CHEN J T, TSENG P, et al. Role of the frontal eye field in human microsaccade responses: a TMS study[J]. Biol Psychol, 2021, 165: 108202. |
| [18] |
DALMASO M, CASTELLI L, GALFANO G. Microsaccadic rate and pupil size dynamics in pro-/ anti-saccade preparation: the impact of intermixed vs. blocked trial administration[J]. Psychol Res, 2020, 84(5): 1320-1332. |
| [19] |
TIAN X G, YOSHIDA M, HAFED Z M. Dynamics of fixational eye position and microsaccades during spatial cueing: the case of express microsaccades[J]. J Neurophysiol, 2018, 119(5): 1962-1980. |
| [20] |
HANUŠKA J, DUŠEK P, RUSZ J, et al. Eye movement abnormalities are associated with brainstem atrophy in Wilson disease[J]. Neurol Sci, 2020, 41(5): 1097-1103. |
| [21] |
MIRPOUR K, BISLEY J W. The roles of the lateral intraparietal area and frontal eye field in guiding eye movements in free viewing search behavior[J]. J Neurophysiol, 2021, 125(6): 2144-2157. |
| [22] |
CHEN X M, ZIRNSAK M, VEGA G M, et al. Frontal eye field neurons selectively signal the reward value of prior actions[J]. Prog Neurobiol, 2020, 195: 101881. |
| [23] |
KHANNA S B, SNYDER A C, SMITH M A. Distinct sources of variability affect eye movement preparation[J]. J Neurosci, 2019, 39(23): 4511-4526. |
| [24] |
KANEKO Y, SUZUKI M, KOU N G, et al. Differential effects of aging and cognitive decline on visual exploration behavior in the elderly[J]. Neurosci Res, 2021, 171: 62-66. |
| [25] |
POLDEN M, CRAWFORD T J. Active visual inhibition is preserved in the presence of a distracter: a cross-cultural, ageing and dementia study[J]. Cortex, 2021, 142: 169-185. |
| [26] |
WILCOCKSON T D W, MARDANBEGI D, XIA B Q, et al. Abnormalities of saccadic eye movements in dementia due to Alzheimer's disease and mild cognitive impairment[J]. Aging, 2019, 11(15): 5389-5398. |
| [27] |
KOÇO\\U011FLU K, HODGSON T L, ERASLAN BOZ H, et al. Deficits in saccadic eye movements differ between subtypes of patients with mild cognitive impairment[J]. J Clin Exp Neuropsychol, 2021, 43(2): 187-198. |
| [28] |
SALMAN F, CANGOZ B, OZEL KIZIL E T. Endogenous and exogenous attention in alzheimer type of dementia: effect of target position[J]. Turkish J Psychiatry, 2019. |
| [29] |
BALTARETU B R, MONACO S, VELJI-IBRAHIM J, et al. Parietal cortex integrates saccade and object orientation signals to update grasp plans[J]. J Neurosci, 2020, 40(23): 4525-4535. |
| [30] |
SINGH T, PERRY C M, FRITZ S L, et al. Eye movements interfere with limb motor control in stroke survivors[J]. Neurorehabil Neural Repair, 2018, 32(8): 724-734. |
| [31] |
JARVSTAD A, GILCHRIST I D. Cognitive control of saccadic selection and inhibition from within the core cortical saccadic network[J]. J Neurosci, 2019, 39(13): 2497-2508. |
| [32] |
PUTCHA D, BRICKHOUSE M, O'KEEFE K, et al. Hippocampal hyperactivation associated with cortical thinning in Alzheimer's disease signature regions in non-demented elderly adults[J]. J Neurosci, 2011, 31(48): 17680-17688. |
| [33] |
NOIRET N, CARVALHO N, LAURENT É, et al. Saccadic eye movements and attentional control in Alzheimer's disease[J]. Arch Clin Neuropsychol, 2017, 33(1): 1-13. |
| [34] |
RUSSELL L L, GREAVES C V, CONVERY R S, et al. Eye movements in frontotemporal dementia: abnormalities of fixation, saccades and anti-saccades[J]. A&D Transl Res Clin Interv, 2021, 7(1): e12218. |
| [35] |
ROBINSON D A. The neurophysiology of pursuit[J]. Prog Brain Res, 2022, 267(1): 423-435. |
| [36] |
STARTSEV M, AGTZIDIS I, DORR M. 1D CNN with BLSTM for automated classification of fixations, saccades, and smooth pursuits[J]. Behav Res Methods, 2019, 51(2): 556-572. |
| [37] |
SHINODA Y, TAKAHASHI M, SUGIUCHI Y. Brainstem neural circuits for fixation and generation of saccadic eye movements[J]. Prog Brain Res, 2019, 249: 95-104. |
| [38] |
DARLINGTON T R, LISBERGER S G. Mechanisms that allow cortical preparatory activity without inappropriate movement[J]. eLife, 2020, 9: e50962. |
| [39] |
NAM U, LEE K, KO H, et al. Analyzing facial and eye movements to screen for Alzheimer's disease[J]. Sensors (Basel), 2020, 20(18): 5349. |
| [40] |
OPWONYA J, DOAN D N T, KIM S G, et al. Saccadic eye movement in mild cognitive impairment and Alzheimer's disease: a systematic review and meta-analysis[J]. Neuropsychol Rev, 2022, 32(2): 193-227. |
| [41] |
POLETTI B, SOLCA F, CARELLI L, et al. Association of clinically evident eye movement abnormalities with motor and cognitive features in patients with motor neuron disorders[J]. Neurology, 2021, 97(18): e1835-e1846. |
| [42] |
FERNÁNDEZ G, OROZCO D, AGAMENNONI O, et al. Visual processing during short-term memory binding in mild Alzheimer's disease[J]. J Alzheimers Dis, 2018, 63(1): 185-194. |
| [43] |
ARIGHI A, CARANDINI T, MERCURIO M, et al. Word and picture version of the free and cued selective reminding test (FCSRT): is there any difference?[J]. J Alzheimers Dis, 2018, 61(1): 47-52. |
| [44] |
杨旭, 杨培红. 基于红外眼动系统探讨帕金森病多模式视觉探索障碍的发生机制[J]. 解放军医学杂志, 2022, 47(4): 382-389. YANG X, YANG P H. Mechanism of multimodel visual exploration disorder in Parkinson's disease based on an infrared eye movement system[J]. Med J Chin PLA, 2022, 47(4): 382-389. |
| [45] |
胡浅, 张蕾, 乔钰茜. 抑郁症患者对情绪图片注意偏向的眼动追踪[J]. 黑河学院学报, 2019, 10(8): 207-209. HU Q, ZHANG L, QIAO Y Q. A study on depression patients' eye tracking of attention bias on emotional pictures[J]. J Heihe Univ, 2019, 10(8): 207-209. |
| [46] |
姜幸智, 闫晓娜, 甘华松, 等. 孤独症谱系障碍与注意缺陷多动障碍眼动特点及其诊断价值[J]. 中国神经精神疾病杂志, 2021, 47(9): 534-539. JIANG X Z, YAN X N, GAN H S, et al. Characteristics and diagnostic value of eye movement in autism spectrum disorder and attention deficit hyperactivity disorder[J]. Chin J Nerv Ment Dis, 2021, 47(9): 534-539. |
| [47] |
NOIRET N, CARVALHO N, LAURENT É, et al. Saccadic eye movements and attentional control in Alzheimer's disease[J]. Arch Clin Neuropsychol, 2017, 33(1): 1-13. |




