垂体神经内分泌肿瘤(pituitary neuroendocrine tumors,PitNETs)是一种起源于腺垂体细胞的神经内分泌肿瘤[1-2],占原发性颅内肿瘤的10%~20%[3],人群中每年的发病率为3.9~7.4/10万[4-6]。PitNETs患者主要表现为垂体前叶激素分泌异常和肿瘤占位[7]。垂体前叶激素分泌异常会导致人体的下丘脑-垂体-性腺轴/甲状腺轴/肾上腺皮质轴/生长激素轴调节紊乱,引起一系列内分泌代谢疾病;同时肿瘤占位效应会引起头痛、垂体功能减退和视野缺陷。治疗上除泌乳素(prolactin,PRL)瘤首选多巴胺受体激动剂外,其他肿瘤均首选经鼻蝶窦肿瘤切除术[7]。目前,随着外科医生手术经验的不断积累,微PitNETs(肿瘤直径<1 cm)的缓解率已达到80%~90%,大PitNETs(肿瘤直径≥1 cm)缓解率达到40%~70%。但仍有10%~20%的肿瘤出现残余瘤再生长或复发[8-9],同时术后并发症时有发生,如垂体功能减退、尿崩症、脑脊液漏及中枢神经系统损伤等[10-11],所以术前对肿瘤增殖或侵袭行为的准确评估,以确定最佳切除范围具有重要临床意义。
2017年WHO对PitNETs的分类表明ki-67指数可以用来评估PitNETs的增殖及侵袭潜能,结合临床表现可评估预后[1]。UGGA等[12]发现基于术前T2 MRI可以预测PitNETs的ki-67指数;CAI等[13]通过对包括60例复发性PitNETs的439宗病例进行分析并建立了术前ki-67指数的预测模型。由此可见,临床上术前预测ki-67指数升高有一定价值。本研究收集449名初次确诊PitNETs患者的临床资料,验证ki-67指数升高的影响因素,构建术前预测Ki-67指数升高的预测模型,为初次确诊PitNETs患者的治疗方案和疾病管理提供参考,以期改善预后、提高患者生活质量。
1 资料与方法 1.1 研究对象本研究采用病例-对照研究设计方案,收集2015年1月至2019年12月在陆军军医大学第二附属医院收治的PitNETs患者的临床资料。纳入标准:①在我院初诊,行鞍区肿瘤切除术并根据术后病理结果确诊为PitNETs;②根据肿瘤组织的免疫组化结果识别出瘤体组织的ki-67指数;③有术前的鞍区磁共振成像(magnetic resonance imaging,MRI)/电子计算机断层扫描(computed tomography,CT)结果;④患者的术前一般情况、生化指标及影像学资料完整。排除标准:合并严重并发症,如心力衰竭、呼吸衰竭、血液系统疾病及其他恶性肿瘤等疾病。通过R studio软件将符合纳排标准的449名患者资料以7:3随机分为训练集(n=314)和验证集(n=135)。本研究获陆军军医大学第二附属医院医学伦理委员会审查批准(2021-研第-035-01)。
1.2 临床资料收集通过医院临床电子病历管理系统收集纳入研究患者的临床资料。
1.2.1 一般情况首次确诊年龄、性别、身高、体质量、收缩压(systolic blood Pressure,SBP)、舒张压(diastolic blood pressure,DBP),计算体质指数(body mass index,BMI)[体质指数=体质量(kg)/身高2(m)],糖尿病及高血压病史。
1.2.2 生化指标糖化血红蛋白(glycated hemoglobin,HBA1C)、游离甲状腺素(free thyroxine,FT4)、游离三碘甲腺原氨酸(free triiodothyronine,FT3)、促甲状腺激素(thyroid-stimulating hormone,TSH)、钾(kalium,K)、钠(natrium,Na)、尿素(urea nitrogen,UREA)、肌酐(creatinine,CREA)、尿酸(uric acid,UA)、白细胞(white blood cell,WBC)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TCH)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、睾酮(testosterone,TESTO)、PRL、促卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、血清胰岛素样生长因子-1(insulin-like growth factor-I,IGF-1)、随机生长激素(growth hormone,GH)、促肾上腺皮质激素(corticotropin,ACTH)。
1.2.3 鞍区MRI/CT检查449名患者均在我院行术前鞍区MRI/CT检查。评估肿瘤的大小,Knops分级和Hardy分级。
1.2.4 肿瘤组织病理及免疫组化收集由病理报告证实为PitNETs患者的ki-67指数的表达水平。
1.3 评判标准根据病理报告显示的ki-67指数分为:低水平(<3%)组和高水平(≥3%)组。
根据鞍区MRI/CT评估Knosp分级和Hardy分级。Knops分级评估肿瘤是否向两侧海绵窦侵袭生长,其中0~2级为非侵袭,3~4级为肿瘤已经向两侧侵袭海绵窦;Hardy分级评估肿瘤是否向鞍膈或鞍底上下方向侵袭,其中0~2级或A~C期为非侵袭,3~4级或D~E期提示肿瘤向鞍膈或鞍底上下方向侵袭。
PitNETs临床亚型包括①无功能垂体神经内分泌肿瘤(nonfunctional pituitary neuroendocrine tumors,NF-PitNETs):临床无内分泌激素分泌明显异常,但肿瘤过大时可压迫垂体柄导致PRL轻度升高(PRL≤200 μg/mL);②功能型垂体神经内分泌肿瘤(functional pituitary neuroendocrine tumors,F-PitNETs):表示通过生化实验室检测出至少有一种内分泌相关激素(GH、PRL、TSH、ACTH等)分泌异常。
1.4 统计学分析采用SPSS 26.0软件和R studio 1.3.1093软件进行统计学分析和作图。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验;多因素分析采用LASSO回归和二元Logistic逐步回归,并构建列线图模型;使用受试者操作曲线下面积(area under the subject curve,AUC)、校准曲线图和决策曲线(decision curve analysis,DCA)评估该模型的诊断价值。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料比较训练集和验证集患者临床基线资料经单因素分析差异无统计学意义(表 1)。ki-67低、高水平组一般资料见表 2,比较两组资料显示:ki-67高水平组患者发病年龄更早、肿瘤直径更大,根据Knosp分级显示更容易侵袭海绵窦,NF-PitNETs患者的占比更高,但是更少合并高血压及糖尿病;实验室检查显示高水平组的FT4和LH显著低于低水平组,但PRL水平显著高于低水平组(P < 0.05)。余变量均无明显差异(P>0.05)。
| 临床指标 | 训练集(n=314) | 验证集(n=135) | t/χ2/Z | P |
| Ki-67指数 | 2.471 | 0.116 | ||
| < 3% | 245 (78.03) | 96 (71.11) | ||
| ≥3% | 69 (21.97) | 39 (28.89) | ||
| 年龄/岁 | 49.08±13.46 | 48.09±11.46 | -0.799 | 0.425 |
| 性别 | 0.031 | 0.861 | ||
| 女性 | 161 (51.27) | 68 (50.37) | ||
| 男性 | 153 (48.73) | 67 (49.63) | ||
| 腺瘤最大直径/cm | 2.40 (1.80, 3.10) | 2.50 (1.80, 3.20) | -0.863 | 0.388 |
| Knosp分级 | 0.005 | 0.941 | ||
| 非侵袭海绵窦(0~2级) | 229 (72.93) | 98 (72.59) | ||
| 侵袭海绵窦(3~4级) | 85 (27.97) | 37 (27.41) | ||
| Hardy分级Ⅰ | 0.478 | 0.489 | ||
| 鞍底完整(非侵袭:0~2级) | 201 (66.56) | 91 (67.41) | ||
| 鞍底破坏(侵袭:3~4级) | 113 (35.99) | 44 (32.59) | ||
| Hardy分级Ⅱ | 0.005 | 0.942 | ||
| 肿瘤非向鞍低上下方向侵袭(非侵袭:A~C级) | 266 (84.71) | 114 (84.44) | ||
| 肿瘤向鞍低上下方向侵袭(侵袭:D~E级) | 48 (15.29) | 21 (15.56) | ||
| 临床亚型 | 3.009 | 0.083 | ||
| NF-PitNETs | 209 (66.56) | 101 (74.81) | ||
| F-PitNETs | 105 (33.44) | 34 (25.19) | ||
| FT4/pmol·L-1 | 12.95 (10.65, 15.79) | 13.73 (11.70, 15.62) | -1.252 | 0.211 |
| PRL/ng·L-1 | 17.73 (9.87, 42.60) | 18.32 (11.39, 41.17) | -0.238 | 0.812 |
| LH/mU·mL-1 | 2.77 (1.50, 5.35) | 2.81 (1.39, 5.65) | -0.112 | 0.911 |
| 临床指标 | 所有患者(n=449) | 低水平组(n=341) | 高水平组(n=108) | t/χ2/Z | P |
| 年龄/岁 | 48.78±12.88 | 49.82±12.66 | 45.51±13.09 | 3.007 | 0.002 |
| 性别 | 0.464 | 0.496 | |||
| 女性 | 229(51.00) | 177(51.91) | 52(48.15) | ||
| 男性 | 220(49.00) | 164(48.09) | 56(51.85) | ||
| 肿瘤最大直径/cm | 2.40 (1.80, 3.10) | 2.30 (1.70, 3.00) | 2.85 (2.20, 3.30) | -4.177 | < 0.001 |
| Knosp分级 | 4.615 | 0.032 | |||
| 非侵袭海绵窦(0~2级) | 327(72.83) | 257(75.37) | 70(64.81) | ||
| 侵袭海绵窦(3~4级) | 122(27.17) | 84(24.63) | 38(35.19) | ||
| Hardy分级Ⅰ | 3.637 | 0.057 | |||
| 鞍底完整(非侵袭:0~2级) | 292(65.03) | 230(67.45) | 62(57.41) | ||
| 鞍底破坏(侵袭:3~4级) | 157(34.97) | 111(32.55) | 46(42.59) | ||
| Hardy分级Ⅱ | 0.541 | 0.462 | |||
| 肿瘤非向鞍低上下方向侵袭(A~C级) | 380(84.63) | 291(85.34) | 89(82.41) | ||
| 肿瘤向鞍低上下方向侵袭(D~E级) | 69(15.37) | 50(14.66) | 19(17.59) | ||
| 临床亚型 | 6.210 | 0.013 | |||
| NF-PitNETs | 310(69.04) | 225(65.98) | 85(78.70) | ||
| F-PitNETs | 139(30.96) | 116(34.02) | 23(21.30) | ||
| FT4/pmol·L-1 | 13.29 (11.02, 15.72) | 13.53 (11.15, 16.24) | 12.75 (10.85, 14.21) | -2.667 | 0.008 |
| PRL/ng·L-1 | 17.90 (10.49, 42.42) | 17.02 (9.77, 33.95) | 23.11 (11.42, 53.02) | -2.735 | 0.006 |
| LH/mU·mL-1 | 2.77 (1.49, 5.36) | 3.05 (1.62, 6.16) | 2.15 (1.11, 4.06) | -3.026 | 0.002 |
2.2 PitNETs中ki-67指数的独立危险因素分析
ki-67指数与肿瘤增殖和侵袭行为密切相关,为了更准确地找出ki-67指数的危险因素,共纳入了33个自变量。在训练集中以ki-67指数水平是否≥3%为因变量,为了避免多个自变量之间的多重共线性问题,将33个自变量纳入LASSO回归中进行特征性选择。由图 1A可见随着lambda值变大,模型中一部分不重要的自变量系数逐渐压缩为0,表示该变量已被排除该模型;为了进一步优化模型和精简变量,再次进行200次的10折交叉验证,最终选择误差最小的λ=0.031为最佳惩罚系数(图 1B)。筛选出年龄、肿瘤最大直径、是否合并高血压、临床亚型及FT4共5个自变量。将5个自变量纳入二元Logistic逐步回归模型中,最终筛选出年龄、肿瘤最大直径及FT4等3个自变量为ki-67指数表达水平的独立危险因素(表 3)。
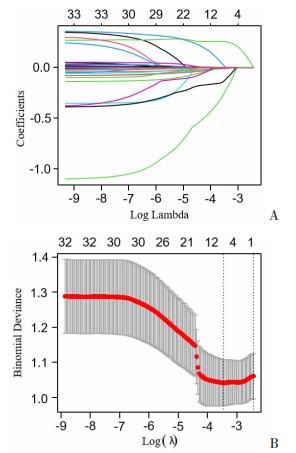
|
|
A:回归系数曲线图;B:200次10折交叉验证LASSO模型 虚线:示最优惩罚系数λ 图 1 采用LASSO回归算法在训练集中对两组的33个变量进行最佳变量选择 |
| 变量 | β | OR | 95%CI | P |
| 年龄 | -0.027 | 0.97 | 0.95~0.99 | 0.013 |
| 肿瘤最大直径 | 0.448 | 1.56 | 1.21~2.03 | < 0.001 |
| FT4 | -0.071 | 0.93 | 0.87~0.99 | 0.034 |
2.3 预测模型的构建与验证
根据3个独立危险因素构建列线图预测模型(图 2),通过AUC和校准曲线评判该列线图模型诊断效能。在训练集中,该模型的AUC为0.692,最佳临界值为0.154,灵敏度为89.9%,特异性为44.1%(图 3A);校准曲线显示预测值与实际观测值之间具有良好的拟合性(图 3C);在验证集中,模型的AUC显示为0.691,最佳临界值为0.272,灵敏度为71.8%,特异性为63.5%(图 3B);校准曲线结果也提示预测值与实际观测值之间具有良好的拟合性(图 3D);DCA分析显示在阈值0.1~0.35范围内,该列线图模型用于预测PitNETs患者瘤体组织的ki-67指数≥3%的净收益率有一定临床意义(图 4)。
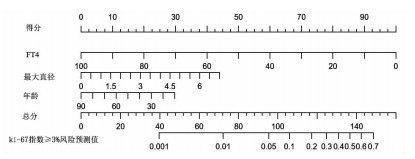
|
| 图 2 预测初次确诊PitNETs患者瘤体组织高表达ki-67 (≥3%)的列线图 |
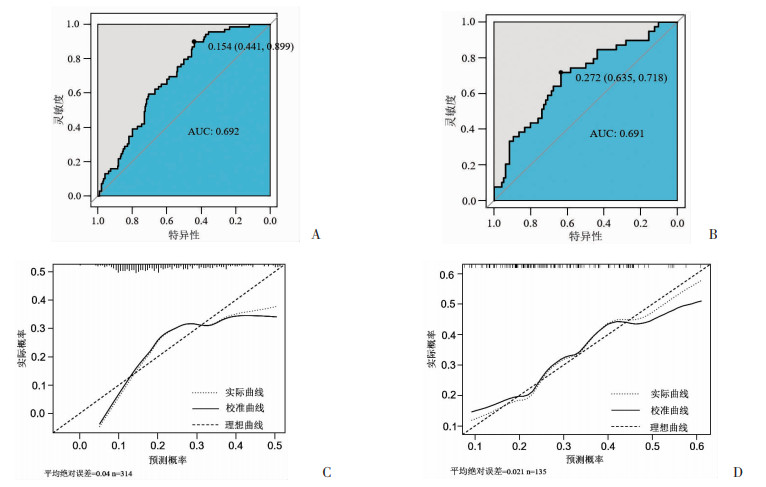
|
| A:训练集的ROC; B:验证集的ROC; C:训练集的校准曲线; D:验证集的校准曲线 图 3 列线图预测模型的预测效能 |
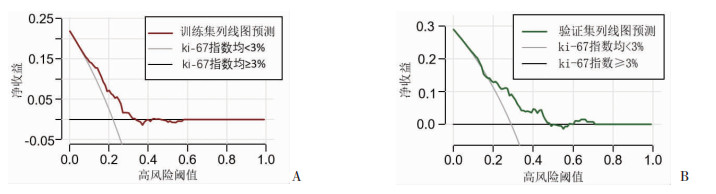
|
| 图 4 列线图决策曲线 |
3 讨论
本研究收集了449例初次经术后病理证实的PitNETs患者的临床资料,通过ki-67是否高表达(ki-67≥3%)分为低水平组和高水平组,比较分析两组患者的临床资料。并在训练集中进行多因素分析,发现年龄、肿瘤最大直径及FT4水平是ki-67指数的独立危险因素,基于3个因素构建了列线图预测模型,并经内部及验证集的外部验证证实该模型的预测能力良好,一定程度上可以在术前对PitNETs的ki-67水平做一个初步预测,让外科医师对患者的手术方案及预后有一个参考评估。
研究表明初次确诊PitNETs患者的肿瘤最大直径是术前ki-67指数的一个重要预测因子。目前,LV等[14]通过对107名PitNETs患者的回顾性研究证实初次行PitNETs切除术的患者,术前肿瘤直径越大,术后复发风险更高;PAPPY等[15]也通过对501例PitNETs患者进行回顾性分析证实更大的肿瘤直径和高水平ki-67(≥3%)表达是患者长期生存的重要预测因子;同时HASANOV等[16]也发现高ki-67指数PitNETs患者肿瘤最大直径更大(P < 0.01)。本研究发现PitNETs的最大直径是ki-67水平高表达的独立危险因素,二者存在显著正相关关系(P < 0.001),与上述文献结果一致。因此,肿瘤最大直径被纳入预测模型中。
此外,本研究还发现初次确诊PitNETs患者的年龄和术前FT4水平也是ki-67指数表达的重要预测因子并被纳入列线图模型中。通过Logistic回归分析结果证实患者年龄为ki-67指数的保护因素,提示初次确诊PitNETs患者的年龄越小,其肿瘤的增殖、侵袭能力可能更强;多项研究已经表明,PitNETs患者的年龄越小,肿瘤增殖、侵袭及复发可能性更高[17-18],这与本研究结果一致。同时,当PitNETs患者在术前出现血清FT4降低、LH降低可能涉及中枢性垂体功能减退。在我们的分析中发现ki-67表达越高其肿瘤最大直径更大和PRL水平更高;其次,术前FT4及LH水平在ki-67指数高水平组显著降低。大量研究证明PitNETs患者术前发生垂体功能减退常与肿瘤占位效应和高泌乳素血症密切相关[19],GUO等[20]亦通过对529名肢端肥大症患者的长期随访研究证实ki-67指数≥3%时与术前垂体功能减退显著相关,与本研究结果基本一致。因此,对于年轻的PitNETs患者术前合并垂体功能减退时,提示PitNETs ki-67指数高表达的可能性更大。
综上所述,年龄、肿瘤最大直径及FT4水平是初次确诊PitNETs患者ki-67指数水平的独立危险因素,并基于此建立了针对初次确诊为PitNETs患者的列线图预测模型来预测术前ki-67指数水平,有助于外科医师在术前根据ki-67指数对肿瘤的增殖、侵袭及预后有一个初步评估,同时优化患者的手术方式及术后管理。但是,本研究也尚有不足:本研究为单中心回顾性研究,在数据收集方面可能存在偏倚。我们后期将继续进行多中心、大样本研究,以进一步优化预测模型。
| [1] |
LOPES M B S. The 2017 World Health Organization classification of tumors of the pituitary gland: a summary[J]. Acta Neuropathol, 2017, 134(4): 521-535. |
| [2] |
ASA S L, METE O, PERRY A, et al. Overview of the 2022 WHO classification of pituitary tumors[J]. Endocr Pathol, 2022, 33(1): 6-26. |
| [3] |
OSTROM Q T, CIOFFI G, WAITE K, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2014-2018[J]. Neuro Oncol, 2021, 23(Supplement_3): iii1-iii105. |
| [4] |
DAY P F, LOTO M G, GLEREAN M, et al. Incidence and prevalence of clinically relevant pituitary adenomas: retrospective cohort study in a health management organization in Buenos Aires, Argentina[J]. Arch Endocrinol Metab, 2016, 60(6): 554-561. |
| [5] |
AGUSTSSON T T, BALDVINSDOTTIR T, JONASSON J G, et al. The epidemiology of pituitary adenomas in Iceland, 1955-2012: a nationwide population-based study[J]. Eur J Endocrinol, 2015, 173(5): 655-664. |
| [6] |
DALY A F, BECKERS A. The epidemiology of pituitary adenomas[J]. Endocrinol Metab Clin North Am, 2020, 49(3): 347-355. |
| [7] |
MOLITCH M E. Diagnosis and treatment of pituitary adenomas: a review[J]. JAMA, 2017, 317(5): 516-524. |
| [8] |
SWEARINGEN B. Update on pituitary surgery[J]. J Clin Endocrinol Metab, 2012, 97(4): 1073-1081. |
| [9] |
AMMIRATI M, WEI L, CIRIC I. Short-term outcome of endoscopic versus microscopic pituitary adenoma surgery: a systematic review and meta-analysis[J]. J Neurol Neurosurg Psychiatry, 2013, 84(8): 843-849. |
| [10] |
CIRIC I, RAGIN A, BAUMGARTNER C, et al. Complications of transsphenoidal surgery: results of a national survey, review of the literature, and personal experience[J]. Neurosurgery, 1997, 40(2): 225-236. |
| [11] |
BARKER F G, KLIBANSKI A, SWEARINGEN B. Transsphenoidal surgery for pituitary tumors in the United States, 1996-2000: mortality, morbidity, and the effects of hospital and surgeon volume[J]. J Clin Endocrinol Metab, 2003, 88(10): 4709-4719. |
| [12] |
UGGA L, CUOCOLO R, SOLARI D, et al. Prediction of high proliferative index in pituitary macroadenomas using MRI-based radiomics and machine learning[J]. Neuroradiology, 2019, 61(12): 1365-1373. |
| [13] |
CAI X, ZHU J, YANG J, et al. A nomogram for preoperatively predicting the ki-67 index of a pituitary tumor: a retrospective cohort study[J]. Front Oncol, 2021, 11: 687333. |
| [14] |
LV L, ZHANG B, WANG M, et al. Invasive pituitary adenomas with gross total resection: the wait-and-see policy during postoperative management[J]. J Clin Neurosci, 2018, 58: 49-55. |
| [15] |
PAPPY A L, SAVINKINA A, BICKNESE C, et al. Predictive modeling for pituitary adenomas: single center experience in 501 consecutive patients[J]. Pituitary, 2019, 22(5): 520-531. |
| [16] |
HASANOV R, AYDOǦAN B I, KIREMITÇI S, et al. The prognostic roles of the ki-67 proliferation index, P53 expression, mitotic index, and radiological tumor invasion in pituitary adenomas[J]. Endocr Pathol, 2019, 30(1): 49-55. |
| [17] |
DUBOIS S, GUYÉTANT S, MENEI P, et al. Relevance of Ki-67 and prognostic factors for recurrence/progression of gonadotropic adenomas after first surgery[J]. Eur J Endocrinol, 2007, 157(2): 141-147. |
| [18] |
BIAMONTE E, BETELLA N, MILANI D, et al. Impact of age on postsurgical outcomes of nonfunctioning pituitary adenomas[J]. Endocrine, 2021, 72(3): 915-922. |
| [19] |
IGLESIAS P, RODRÍGUEZ BERROCAL V, DÍEZ J J. Giant pituitary adenoma: histological types, clinical features and therapeutic approaches[J]. Endocrine, 2018, 61(3): 407-421. |
| [20] |
GUO X, ZHANG R, ZHANG D, et al. Hyperprolactinemia and hypopituitarism in acromegaly and effect of pituitary surgery: long-term follow-up on 529 patients[J]. Front Endocrinol (Lausanne), 2021, 12: 807054. |




