低氧是机体氧气供应不足或用氧障碍导致组织器官功能障碍的病理过程。高原、高空等极端环境,空气稀薄,导致机体出现低张性缺氧。随着人类生产生活宽度和深度的不断扩展,在极端低氧环境的作业活动越来越多,如何增强机体的抗缺氧能力成为一个重要的研究课题[1]。
对于高原、高空等极端低氧环境下所导致的低张性缺氧,仅靠额外提供氧气供给,不能完全满足实际需要。因为人们很难在吸氧的同时进行劳动作业,例如,很难在高原作战的同时吸氧。另外,一般便携式携氧装置供氧时长不足,难以保证长时间劳动作业的氧供。因此,研究者们致力于提高机体自身耐缺氧能力的研究[2]。既往在研究高原习服方案和机制方面已经取得了较好的进展[3-5]。其中间断缺氧、局部缺血缺氧、阶梯习服等均以将机体预先置于缺氧环境,通过机体自身代偿反应促进习服,此类方法有利于系统全面的习服,但是缺乏针对性。氧的运输主要靠红细胞,如果能够有效增强红细胞运输氧的能力,将是一个高效且特异的低氧习服措施。因此,本研究致力于如何预先提高红细胞运输氧的能力,促进低氧习服。
羟基脲(hydroxyurea,HU)是用于治疗镰刀型贫血和地中海贫血的一线用药,能够改善患者的缺氧症状。HU可能诱导高氧亲和力的胚胎样血红蛋白(hemoglobin, Hb)高表达来提高携氧,促进极端环境的缺氧耐受。因此本研究拟尝试利用HU处理小鼠,并观察其对密闭缺氧的保护作用和机制,为低氧环境下机体习服适应能力的提高提供新思路。
1 材料与方法 1.1 材料 1.1.1 实验材料羟基脲购于美国Sigma公司,PCR采用日本TaKaRa试剂盒,Anti-HBE(ab228709)抗体购于美国Abcam,α-tubulin抗体购于美国CST公司,缺氧探针Hypoxyprobe-1试剂盒购于探金生物;骨髓转录组测序送华大基因检测;氧离曲线用美国TCS HOMOX-ANALYZER进行检测。
1.1.2 实验动物60只6~8周龄、体质量18~22 g雄性C57BL/6J小鼠购自莱彼特生物科技有限公司,动物均有详细出生档案和检疫证书,合格证号为SCXK(湘)2019-0004。按照随机数字表法分成常氧对照组(NC组)10只,常氧HU组(NHU组)10只,缺氧对照组(HC组)20只,缺氧HU组(HHU组)20只。HU组予以腹腔注射HU 100 mg/kg,1次/d;NC组和HC组注射等量生理盐水,连续4周[6]。再将HC组和HHU组小鼠置于容积为250 mL的密封瓶内进行密闭缺氧,观察其生存时间,在缺氧15 min时,断颈处死小鼠后取脑和肾组织以备后续实验。而NC组和NHU组小鼠,摘取眼球取血,测定氧离曲线和进行Western blot实验,并取小鼠骨髓,送华大基因公司进行转录组测序。动物研究方案经动物福利委员会认证批准。
1.2 方法 1.2.1 转录组测序小鼠经HU腹腔注射4周后,在注射最后一次的第二天提取骨髓,用TRAzol法提取骨髓样本总RNA,对纯度、浓度、质量合格的样本,即NC组和NHU组样本各3个生物学重复,在DNBSEQ平台进行测序。测序结果利用Count reads表示各个样本的表达情况,再利用DESeq2法对NHU组和NC组之间的差异显著性进行分析,log2 Fold change≥1,P < 0.05为显著差异。再对差异基因进行GO和KEGG富集分析,P < 0.05为具有统计学意义。
1.2.2 RT-qPCR验证用TRAzol提取样本总RNA,酶标仪测量浓度,按照说明书配置反转录反应体系,cDNA置于-20 ℃保存,按照TaKaRa试剂盒说明书配置反应体系,置于PCR仪进行反应,引物序列(5′-3′)Hbb-y,正义:TGGCCTGTGGAGTAAGGTCAA,反义:GAAGCAGAGGACAAGTTCCCA;Hba-x,正义:CTA-CCCCCAGACGAAGACCTA,反义:CTTAACCGCATCCC-CTACGG;Hbb-bh1,正义:GAAACCCCCGGATTAGAGCC,反义:GAGCAAAGGTCTCCTTGAGGT,根据Ct值计算RNA的相对表达量。
1.2.3 Western blot检测蛋白表达蛋白提取后用BCA蛋白定量后上样,电泳,转膜,用5%的脱脂奶粉封闭,一抗a-tubulin 1∶2 000、HbE(ε-globin) 1∶1 000,在4 ℃摇床孵育过夜,洗膜后室温摇床孵育二抗,再次洗膜后显影。用Image J软件进行灰度值分析。
1.2.4 免疫组化检测小鼠组织缺氧程度实验组和对照组小鼠腹腔注射Hypoxyprobe-1溶液60 mg/kg剂量,1 h后置于密封瓶内进行密闭缺氧15 min(根据HHU组和HC组生存时间,取略低于最短生存时间作为该实验的时间节点),脱颈处死小鼠,取脑组织和肾组织于-80 ℃冰冻保存。而后将组织放入4%多聚甲醛固定24 h,依次放入不同浓度的酒精(70%、80%、90%、95%、100%)中进行脱水,用二甲苯浸泡标本30 s后用石蜡包埋组织标本。在切片机中进行组织切片,厚度设置为4 μm。然后进行免疫组化,中性树胶封片后,显微镜下观察,拍照记录。
1.3 统计学分析采用SPSS 22.0进行统计学分析,计量数据用x±s表示,利用独立样本t检验比较两组之间的差异,对于免疫组化用Image J进行分析,阳性信号率采用χ2检验,P < 0.05表示差异有统计学意义。对于转录组数据分析和结果可视化图均在华大基因在线分析工具https://biosys.bgi.com/进行分析和处理。
2 结果 2.1 HU预处理的小鼠密闭缺氧生存时间延长常氧条件下,NC组与NHU组小鼠持续存活率为100%,说明注射HU对小鼠的存活率没有影响。将小鼠置于密封瓶进行密闭缺氧后,HC组小鼠在21 min后快速出现死亡,24 min时小鼠全部死亡(图 1A);而HHU组小鼠在密闭缺氧环境下,与HC相比其生存率曲线明显右移,且在26 min后才出现大量死亡,最长存活时间达到31 min。HHU组小鼠密闭缺氧的生存时间[(25.20±3.94)min]显著高于HC组[(21.92±0.91)min],差异具有统计学意义(P < 0.05,图 1B)。说明HU处理小鼠后,小鼠密闭缺氧的生存时间明显延长,小鼠的抗缺氧能力增强。
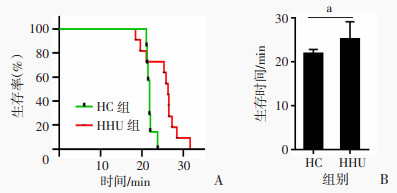
|
| A:生存曲线;B:生存时间 a:P < 0.01 图 1 HU预处理的小鼠密闭缺氧生存时间延长(n=18,x±s) |
2.2 HU预处理的小鼠脑和肾组织缺氧程度降低
为了探讨HU处理后的小鼠耐受密闭缺氧生存时间延长的原因,进一步采用缺氧探针的方法检测了小鼠脑组织和肾组织的缺氧程度。由于缺氧探针为硝基咪唑替代物(派诺硝唑),其可弥散至胞内,被还原后与大分子不可逆的结合,再用FITC偶联的抗派诺硝唑抗体进行免疫组化检测,缺氧程度越高,还原的硝基咪唑越多,可被抗体结合而染色越深,而含氧细胞内的亲电子硝基咪唑还原物被立即氧化而无法被抗体结合而不着色。NC组和NHU组脑、肾组织切片显色上未见明显差异,HC组脑和肾脏着色程度明显深于NC组和NHU组,其中肾脏最为明显;而HHU组着色明显减淡,但仍然略深于NC组和NHU组(图 2A、B)。对着色的深浅度半定量统计分析显示:NC组和NHU组脑和肾组织无显著差异;HC组脑和肾脏缺氧程度显著高于NC组和NHU组,而HHU组脑组织的缺氧程度降低了将近1倍,肾组织的缺氧程度降低了2倍,但尚未完全逆转缺氧,HHU组高于对照组,差异均具有统计学意义(P < 0.05,图 2C、D)。提示HU预处理后,小鼠密闭缺氧的生存时间延长,可能与局部组织缺氧程度降低有关。

|
| a: P < 0.01 A:脑组织缺氧探针免疫组化图;B: 肾脏缺氧探针免疫组化图;C:脑缺氧程度半定量灰度值统计图;D:肾缺氧程度半定量灰度值统计图 图 2 HU预处理小鼠的耐缺氧能力增强(n=6,x±s) |
2.3 高血氧亲和力提高了小鼠的耐缺氧能力
HHU组小鼠生存时间延长,组织缺氧程度降低。进一步检测小鼠外周血的氧离曲线显示:NHU组小鼠氧离曲线明显左移,P50下降,差异具有统计学意义(P < 0.05,图 3A、B),氧亲和力增加。将小鼠外周血的P50与密闭缺氧的生存时间进行相关性分析,发现P50与生存时间存在显著的负相关性(P < 0.05,见图 3C),即P50越大,小鼠的生存时间越短,小鼠外周血的氧亲和力越高,小鼠的生存时间越长。因此HU可能诱导了某种高血氧亲和力分子的表达,从而显著提高小鼠的耐缺氧能力。
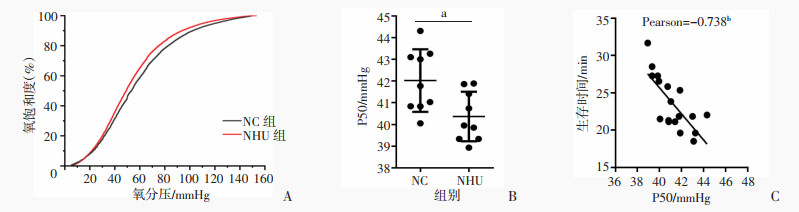
|
| A:两组小鼠的外周血氧离曲线;B:两组小鼠的P50统计图 a: P < 0.05;C:P50与生存时间的Pearson相关关系 b: P < 0.05 图 3 高氧亲和力的血红蛋白表达可促进小鼠密闭缺氧的生存时间(n=9,x±s) |
2.4 HU注射后小鼠骨髓转录组测序结果
为了进一步探讨高氧亲和力分子的来源,进一步分析了小鼠骨髓转录组测序情况。小鼠骨髓合格样本在DNBSEQ平台进行测序,原始数据经过滤后,所测的6个样本中,每个样本平均产出6.34G数据,所有样本的碱基质量值Q30均在93%以上,说明测序质量可靠,见表 1。共检测到65 389个基因,其中上调基因50个,下调基因272个(log2 FC≥ 1,Q < 0.05),差异具有统计学意义(图 4A)。对差异基因进行KEGG PATHWAY富集(图 4B),并呈现前20条,其中前8条具有显著差异的通路,可以看出差异较明显的集中在ECM-receptor interaction和Hematopoietic cell lineage,说明HU处理小鼠后,造血干细胞的功能受到显著影响。另外,对差异基因进行GO富集,结果GO Molecular function、Biological process、Cellular component分别富集到28、37和24条,其中图 4C~E分别显示了差异最明显的前20条注释。差异最为明显的GO注释提示,在分子组成上,血红蛋白复合体居于首位(图 4C);分子功能上,主要富集到影响血红蛋白各亚基结合的分子(图 4D);生物学功能上主要富集到红细胞发育相关的生物学过程(图 4E)。说明HU通过影响Hb各亚基的结合,产生不同类型的Hb复合体,影响红细胞发育的生物学过程。由此可推测HU注射小鼠后,血红蛋白类型发生一定程度的转换,红细胞的发育过程受到了较大的影响。因此我们对红细胞发育的差异基因进行聚类热图分析,发现Erfe、Hbb-y、Hbb-bh1、Hba-X与Alas1等5个基因显著上调,其中Erfe、Hbb-y、Hbb-bh1、Hba-x>1.5倍以上,而下调基因有Klf1、Sox6、Gata1、Slc4a1、Ank1、Rhd、Bpgm、Alas2、Hbb-bs、Hbb-bt、Hbb-b1、Hba-a1、Hba-a2 (图 4F)。说明HU注射小鼠后,胚胎样Hb基因表达显著提高,而成年Hb表达下降,HU能够诱导胚胎样Hb的表达。
| 样本 | 原始总 reads(×106) |
过滤后总 reads(×106) |
过滤后总 碱基/Gb |
过滤后 reads Q20 (%) |
过滤后 reads Q30 (%) |
过滤后 reads比率(%) |
| NC1B | 42.2 | 41.87 | 6.28 | 97.84 | 93.92 | 99.21 |
| NC2B | 42.22 | 41.98 | 6.3 | 97.8 | 93.84 | 99.45 |
| NC6B | 43.53 | 43.23 | 6.48 | 97.94 | 94.18 | 99.3 |
| NHU1B | 42.48 | 42.21 | 6.33 | 97.91 | 94.1 | 99.36 |
| NHU2B | 42.56 | 42.29 | 6.34 | 97.9 | 94.08 | 99.36 |
| NHU4B | 42.43 | 42.13 | 6.32 | 97.91 | 94.11 | 99.29 |
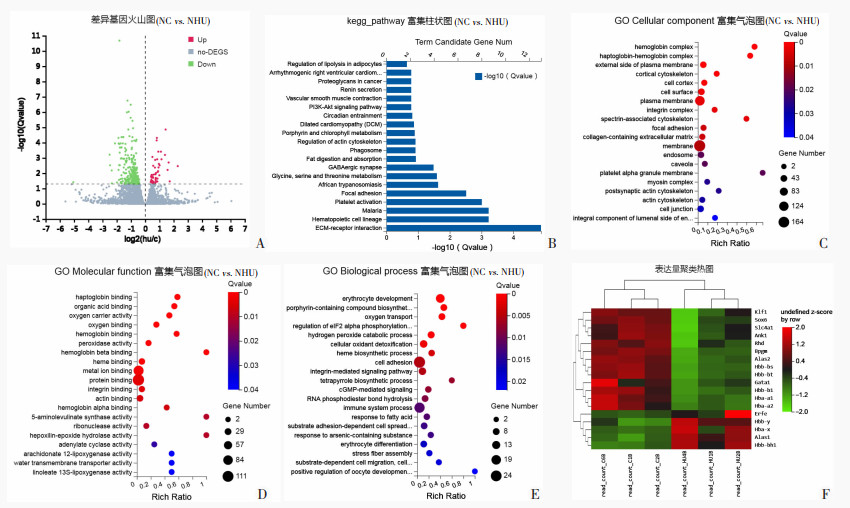
|
| A:小鼠骨髓转录组测序的差异基因火山图红色:示NHU与NC比较上调差异基因,绿色:示下调差异基因,灰色:示差异不显著基因;B:测序差异基因KEGG富集图;C:差异基因GO Cellular component富集气泡图前20条;D差异基因GO Molecular function富集气泡图前20条;E:差异基因GO Biological process富集气泡图前20条;F:红系发育差异基因聚类热图 图 4 HU注射后小鼠骨髓转录组测序结果 |
2.5 HU诱导正常小鼠胚胎样血红蛋白的表达
经上述测序分析得知HU处理小鼠胚胎样Hb基因表达增加,Hbb-y、Hba-x、Hbb-bh1为胚胎样血红蛋白基因,Hbb-bh1和Hbb-y是编码胚胎型β-globin和ε-globin的基因,Hba-x则是胚胎型ζ-globin的编码基因,该类基因的表达情况可以直观的反应胚胎样高氧亲和力血红蛋白基因的表达。对小鼠骨髓胚胎样Hb基因,Hbb-y、Hbb-bh1、Hba-x基因进行qPCR进行验证,结果HU注射后的小鼠,上述3个基因表达显著升高(P < 0.05,图 5A~C),与转录组测序结果具有一致性,因此转录组测序结果可靠。另外,对HU注射后的小鼠外周血进行Western blot验证,同样HU注射后的小鼠外周血HbE蛋白表达增加(P < 0.05)。说明HU注射小鼠后,能够诱导正常小鼠外周血胚胎样血红蛋白HbE的表达。
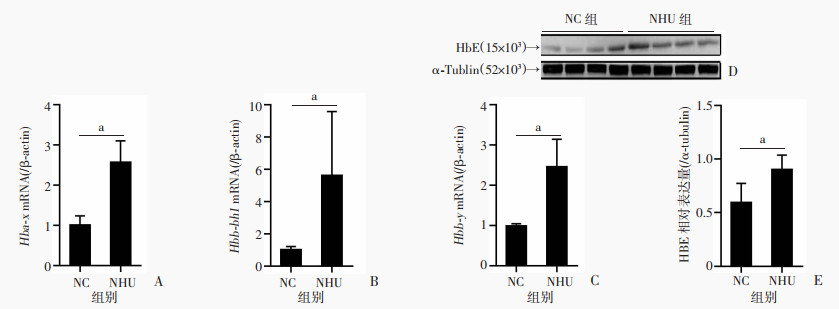
|
| a: P < 0.05 A:小鼠骨髓胚胎样Hb基因Hba-x mRNA表达量;B:小鼠骨髓胚胎样Hb基因Hbb-bh1 mRNA表达量;C:小鼠骨髓胚胎样Hb基因Hbb-y mRNA表达量;D:外周血HbE相对蛋白表达量;E:HbE相对蛋白表达量 图 5 HU诱导正常小鼠胚胎样血红蛋白的表达(n=4,x±s) |
3 讨论 3.1 成年后HbA可以再度向HbF表达转换
缺氧给机体造成损伤,机体可同时启动适应机制,促进低氧习服。将机体缓慢多次的置于缺氧环境,可以促进机体全面的习服,但是缺乏针对性。缺氧的核心是体内氧不足,如果能够提高体内整体的氧量,将是一个高效的抗缺氧措施。氧的运输分为肺组织的抓氧、循环系统运输氧、组织内卸氧3个过程。为了提高体内整体氧水平,可以通过呼吸加深加快,提高血气交换频率,肺血管收缩,减少无效通气腔等,但该代偿方式有限,在极端低氧环境收效甚微,且极易引发肺水肿[7]。循环系统可增加心输出量,加快氧的运输。从组织内氧的利用角度,可提高线粒体的用氧效率[8]。上述方法均有一定限制或缺乏实际有效的干预方案,主要靠机体自主代偿,但机体自身代偿能力有限,难以应对急性的极端低氧环境。由于红细胞是携带和运输氧的细胞,胞内血红蛋白对氧的亲和力是氧气运输的核心和关键。如果能提高血红蛋白的氧亲和力,将如同吸氧一样,直接全面提高体内整体氧量,从而促进机体低氧环境的习服。因此,我们致力于从红细胞携氧的角度来探讨提高对极端低氧环境习服的措施。
机体运输氧主要靠红细胞的Hb,人体Hb主要包括成人血红蛋白(adult hemoglobin,HbA,α2β2)和胎儿血红蛋白(fetal hemoglobin,HbF,α2γ2)以及卵黄囊期血红蛋白[9]。胎肝造血期,主要由2个γ-globin与2个α-globin形成四聚体的HbF组成,而出生后红细胞则主要表达β-globin,与α-globin形成四聚体HbA[10-11]。由于胎儿必须从母体血液中夺取氧分子,HbF的氧亲和力明显高于成人HbA[12-13]。HbF主要在胎肝造血期表达,出生后仅有0.1%~7%的红细胞能够检测到HbF表达,该类表达HbF的红细胞被称为F红细胞[14]。在缺氧、溶血、地中海贫血、镰刀形贫血中,骨髓红细胞造血增加,应激性红系造血不仅是红系谱系的增加还伴随F红细胞的表达增加[15]。在应激造血情况下,成年后HbA/A2和HbF表达转换的开关可以再次被打开。胎儿在子宫发育过程发生缺氧,HbF表达量增加[16]。高原出生的新生儿HbF表达高于平原新生儿[17]。成年灵长类动物狒狒在溶血和在低氧舱缺氧后也可导致HbF的表达增加[18]。暴露于海拔3 100~5 600 m数天的成年志愿者HbF表达增加[19]。上述均提示在体内成年动物可以再度激活HbF的表达,且在慢性缺氧后即可提高HbF的表达。而HbF的氧亲和力高于HbA,因此缺氧促进Hb向氧亲和力高的亚型转变,从而促进携氧。这也提示既往的缺氧预适应,一定程度地提高了血液系统的高氧亲和力血红蛋白的表达是习服适应的一种可能机制,鉴于此,针对急性的极端缺氧,我们可以预先诱导高氧亲和力的Hb也能够提高缺氧耐受能力,该法具有较好的理论基础。
3.2 HU可诱导HbA向HbF表达转换HU是唯一被美国和欧洲批准使用的胎儿血红蛋白诱导剂,镰刀型贫血长期治疗经验提示,其可安全有效地诱导HbF表达[20-21]。在镰刀型贫血和地中海贫血患者中,高表达胎儿血红蛋白HbF患者的缺氧症状明显轻于低表达HbF的患者[22-23]。说明预先诱导HbF的表达能够改善机体的缺氧程度。本研究利用HU处理小鼠4周后,能显著延长小鼠密闭缺氧的生存时间,可能是由于改善脑和肾脏缺氧。脑和肾脏缺氧程度的降低,说明向组织运输氧的能力提高。这与HU改善地贫、镰贫患者症状结果相似[15]。在阿尔茨海默氏病(Alzheimer’s disease, AD)小鼠模型中,HU对神经元具有保护作用,可改善线粒体生物合成,并改善AD小鼠空间记忆[24]。提示HU的确可从多个角度对机体具有一定的保护作用。我们进一步探究发现HU明显改善了外周血的氧亲和力,说明HU可改善肺组织抓取氧的能力,从而提高机体可用氧的总体水平。
然而普通啮齿类动物与灵长类动物的Hb基因簇具有较大的差异,人类的珠蛋白基因经历两次转换即ζ2ε2-α2γ2-α2β2,而小鼠的珠蛋白基因只经历一次转换即ζ、εy和βH1向α,βmajor和βminor的转换[25-26]。HU可诱导成年镰贫和地贫患者HbF(α2γ2)的表达,从而改善缺氧,但HU改善正常小鼠缺氧的机制仍不清楚,有可能与诱导成年Hb向胚胎样Hb转换有关。本研究通过进一步探讨经HU预处理4周后小鼠骨髓转录测序,结果发现HU可显著提高胚胎样血红蛋白基因Hbb-y、Hbb-bh1、Hba-x的表达,小鼠外周血HbE(ε-globin)表达显著升高,外周血氧离曲线左移,氧亲和力增加,从而改善了小鼠密闭缺氧程度,证实了我们的推测。这与遗传性高表达高亲和力Hb的人群上到高原更易习服高原,在高原的作业能力强于普通人群的研究结论一致[27]。由此表明诱导高氧亲和力Hb可以显著提高红细胞的携氧能力,改善小鼠缺氧程度,提高耐低氧的能力。
3.3 转录组测序预测HbA向胚胎样Hb表达转换的机制β-珠蛋白基因簇包含一个被称为基因座控制区(locus control region,LCR)的5远端调控元件,该元件具有5个活性DNAase I超敏位点(hypersensitive site, HS) 及HS1、HS2、HS3、HS4、HS5,这是珠蛋白基因表达所必需的调节元件[28]。β-珠蛋白基因簇顺序包含有为ε,Gγ,Aγ,δ,β基因,随着基因研究的不断深入,研究者提出不同基因转换模型,包括基因竞争模型:γ和β球蛋白基因在个体发育过程中以阶段特异性的方式竞争结合LCR,从而引起不同球蛋白基因的表达;染色质looping模型:LCR的HS位点形成环状向γ或β球蛋白靠近,则促进该靠近基因的转录;以及顺式和反式调控元件进行复杂的相互的作用,促进染色质重构等[29-30]。上述机制属于正常生理情况下,机体珠蛋白基因的表达转换机制,但是在病理情况下,如何实现逆转是目前的研究热点,具体机制仍然不清。同样HU诱导HbF表达的机制仍不完全清楚,可能与表观遗传、转录以及转录后修饰相关。正常成人的BCL11A、SOX-6和Mi-2/核小体质量塑和去乙酰化酶复合物共同占据β-珠蛋白位点,β-珠蛋白簇的远程重构象,从而实现γ-珠蛋白的转录沉默[10, 31]。虽然小鼠的珠蛋白基因只经历一次转换,但转换的机制可能与人类相似[32]。本次转录组发现NHU组小鼠的Sox-6表达下降,推测可能逆转了上述过程。Klf1是红系特有的转录因子,协调多个重要的过程,包括促进红系连接,γ到β球蛋白基因开关的激活,促进β球蛋白的表达,抑制γ球蛋白,而本次转录组发现HU可降低Klf1的表达[33-34]。HU可活化Gata2的表达,而抑制Gata1的表达,Gata1/ Gata2表达比例下降能够促进γ-珠蛋白的表达,我们转录组测序也发现相似结果[35]。
3.4 局限性和意义HU可诱导一氧化氮-鸟苷酸环化酶(NO-cGMP)信号通路,进一步通过PKG诱导γ-珠蛋白的表达,而HbF相对于HbA又更易促进NO向胞外释放,发挥扩血管作用,促进组织血供,改善缺氧,因此HU诱导HbF的表达不仅可以直接促进携氧来改善缺氧,还可以通过其它间接途径改善缺氧[36-37]。分析转录组结果,还发现差异分子Slc4a1、Ank1、Rhd,其主要为红细胞骨架蛋白,表达下降可能与HU的细胞毒性有关,抑制了无效红细胞造血[38]。本研究可能会因HU的基因毒性等副作用较难即刻推广应用到即将进入极端低氧环境的正常人,但是我们可以借鉴预先诱导高氧亲和力血红蛋白表达来促进低氧习服适应的思路,未来可开发研究副作用更小的,诱导HbF表达的方法来促进对低氧环境的习服。
综上所述,HU对密闭缺氧小鼠具有明显的保护作用,可能与HU诱导高氧亲和力的胚胎样血红蛋白的表达,从而促进携氧的作用有关。因此,用HU诱导高氧亲和力的胚胎样血红蛋白表达有望成为一种有效的抗缺氧措施。
| [1] |
BURTSCHER M, GATTERER H, BURTSCHER J, et al. Extreme terrestrial environments: life in thermal stress and hypoxia. A narrative review[J]. Front Physiol, 2018, 9: 572. |
| [2] |
STORZ J F, BAUTISTA N M. Altitude acclimatization, hemoglobin-oxygen affinity, and circulatory oxygen transport in hypoxia[J]. Mol Aspects Med, 2022, 84: 101052. |
| [3] |
WU D, LIU Y N, CHEN W, et al. How placenta promotes the successful reproduction in high-altitude populations: a transcriptome comparison between adaptation and acclimatization[J]. Mol Biol Evol, 2022, 39(6): msac120. |
| [4] |
YI H, YU Q J, ZENG D F, et al. Serum inflammatory factor profiles in the pathogenesis of high-altitude polycythemia and mechanisms of acclimation to high altitudes[J]. Mediators Inflamm, 2021, 2021: 8844438. |
| [5] |
WINTER C, BJORKMAN T, MILLER S, et al. Acute mountain sickness following incremental trekking to high altitude: correlation with plasma vascular endothelial growth factor levels and the possible effects of dexamethasone and acclimatization following re-exposure[J]. Front Physiol, 2021, 12: 746044. |
| [6] |
OSEGHALE A R, ZHU X G, LI B R, et al. Conjugate prodrug AN-233 induces fetal hemoglobin expression in sickle erythroid progenitors and β-YAC transgenic mice[J]. Blood Cells Mol Dis, 2019, 79: 102345. |
| [7] |
LI Y H, ZHANG Y J, ZHANG Y. Research advances in pathogenesis and prophylactic measures of acute high altitude illness[J]. Respir Med, 2018, 145: 145-152. |
| [8] |
MOORE L G. Measuring high-altitude adaptation[J]. J Appl Physiol (1985), 2017, 123(5): 1371-1385. |
| [9] |
YAMANE T. Cellular basis of embryonic hematopoiesis and its implications in prenatal erythropoiesis[J]. Int J Mol Sci, 2020, 21(24): 9346. |
| [10] |
WILBER A, NIENHUIS A W, PERSONS D A. Transcriptional regulation of fetal to adult hemoglobin switching: new therapeutic opportunities[J]. Blood, 2011, 117(15): 3945-3953. |
| [11] |
STEINBERG M H. Fetal hemoglobin in sickle cell anemia[J]. Blood, 2020, 136(21): 2392-2400. |
| [12] |
BRITTAIN T. Molecular aspects of embryonic hemoglobin function[J]. Mol Aspects Med, 2002, 23(4): 293-342. |
| [13] |
WELLS R M, BRITTAIN T. Transition to cooperative oxygen-binding by embryonic haemoglobin in mice[J]. J Exp Biol, 1981, 90: 351-355. |
| [14] |
MANNING J M, MANNING L R, DUMOULIN A, et al. Embryonic and fetal human hemoglobins: structures, oxygen binding, and physiological roles[J]. Subcell Biochem, 2020, 94: 275-296. |
| [15] |
EL HOSS S, COCHET S, GODARD A, et al. Fetal hemoglobin rescues ineffective erythropoiesis in sickle cell disease[J]. Haematologica, 2021, 106(10): 2707-2719. |
| [16] |
BARD H, LACHANCE C, WIDNESS J A, et al. The re-activation of fetal hemoglobin synthesis during anemia of prematurity[J]. Pediatr Res, 1994, 36(2): 253-256. |
| [17] |
BALLEW C, HAAS J D. Hematologic evidence of fetal hypoxia among newborn infants at high altitude in Bolivia[J]. Am J Obstet Gynecol, 1986, 155(1): 166-169. |
| [18] |
DESIMONE J, BIEL S I, HELLER P. Stimulation of fetal hemoglobin synthesis in baboons by hemolysis and hypoxia[J]. Proc Natl Acad Sci USA, 1978, 75(6): 2937-2940. |
| [19] |
RISSO A, FABBRO D, DAMANTE G, et al. Expression of fetal hemoglobin in adult humans exposed to high altitude hypoxia[J]. Blood Cells Mol Dis, 2012, 48(3): 147-153. |
| [20] |
FRIEDRICH M J. Hydroxyurea safe and effective for sickle cell anemia[J]. JAMA, 2019, 321(7): 637. |
| [21] |
TSHILOLO L, TOMLINSON G, WILLIAMS T N, et al. Hydroxyurea for children with sickle cell anemia in sub-Saharan Africa[J]. N Engl J Med, 2019, 380(2): 121-131. |
| [22] |
HENRY E R, METAFERIA B, LI Q, et al. Treatment of sickle cell disease by increasing oxygen affinity of hemoglobin[J]. Blood, 2021, 138(13): 1172-1181. |
| [23] |
ANSARI S H, ANSARI I, MUNIR M W, et al. Evaluation of the combination therapy of hydroxyurea and thalidomide in β-thalassemia[J]. Blood Adv, 2022: Apr27;bloodadvances. 2022007031. DOI: 10.1182/bloodadvances.2022007031.
|
| [24] |
BROSE R D, LEHRMANN E, ZHANG Y Q, et al. Hydroxyurea attenuates oxidative, metabolic, and excitotoxic stress in rat hippocampal neurons and improves spatial memory in a mouse model of Alzheimer's disease[J]. Neurobiol Aging, 2018, 72: 121-133. |
| [25] |
PALIS J, MALIK J, MCGRATH K E, et al. Primitive erythropoiesis in the mammalian embryo[J]. Int J Dev Biol, 2010, 54(6/7): 1011-1018. |
| [26] |
YAMANE T. Mouse yolk sac hematopoiesis[J]. Front Cell Dev Biol, 2018, 6: 80. |
| [27] |
DOMINELLI P B, WIGGINS C C, BAKER S E, et al. Influence of high affinity haemoglobin on the response to normoxic and hypoxic exercise[J]. J Physiol, 2020, 598(8): 1475-1490. |
| [28] |
MASUDA T, WANG X, MAEDA M, et al. Transcription factors LRF and BCL11A independently repress expression of fetal hemoglobin[J]. Science, 2016, 351(6270): 285-289. |
| [29] |
LIU N, XU S Q, YAO Q M, et al. Author Correction: transcription factor competition at the γ-globin promoters controls hemoglobin switching[J]. Nat Genet, 2021, 53(4): 586. |
| [30] |
SHEN Y, VERBOON J M, ZHANG Y, et al. A unified model of human hemoglobin switching through single-cell genome editing[J]. Nat Commun, 2021, 12(1): 4991. |
| [31] |
LISTÌ F, SCLAFANI S, AGRIGENTO V, et al. Study on the role of polymorphisms of the SOX-6 and MYB genes and fetal hemoglobin levels in Sicilian patients with β-thalassemia and sickle cell disease[J]. Hemoglobin, 2018, 42(2): 103-107. |
| [32] |
GUDMUNDSDOTTIR B, GUDMUNDSSON K O, KLARMANN K D, et al. POGZ is required for silencing mouse embryonic β-like hemoglobin and human fetal hemoglobin expression[J]. Cell Rep, 2018, 23(11): 3236-3248. |
| [33] |
WIENERT B, MARTYN G E, KURITA R, et al. KLF1 drives the expression of fetal hemoglobin in British HPFH[J]. Blood, 2017, 130(6): 803-807. |
| [34] |
HARIHARAN P, NADKARNI A. Insight of fetal to adult hemoglobin switch: genetic modulators and therapeutic targets[J]. Blood Rev, 2021, 49: 100823. |
| [35] |
ZHU X G, HU T X, HO M H, et al. Hydroxyurea differentially modulates activator and repressors of γ-globin gene in erythroblasts of responsive and non-responsive patients with sickle cell disease in correlation with index of hydroxyurea responsiveness[J]. Haematologica, 2017, 102(12): 1995-2004. |
| [36] |
LANZKRON S, STROUSE J J, WILSON R, et al. Systematic review: Hydroxyurea for the treatment of adults with sickle cell disease[J]. Ann Intern Med, 2008, 148(12): 939-955. |
| [37] |
SALHANY J M. The oxidative denitrosylation mechanism and nitric oxide release from humanfetal and adult hemoglobin, an experimentally based model simulation study[J]. Blood Cells Mol Dis, 2013, 50(1): 8-19. |
| [38] |
MUSIAŁEK M W, RYBACZEK D. Hydroxyurea-the good, the bad and the ugly[J]. Genes, 2021, 12(7): 1096. |




