大肠癌(colorectal cancer,CRC)是世界上常见的恶性肿瘤之一,按部位可分为结肠癌和直肠癌,其中直肠癌约占60%以上[1]。临床实践中,直肠癌患者就诊时往往已属中晚期[2],而放射治疗在中晚期直肠癌的治疗中有着重要地位。术前放疗能缩小肿瘤的体积,降低其临床分期,为患者争取根治性切除的机会,并降低术后局部复发率;同时对于低位直肠癌,术前放疗可能通过提高保肛率来使患者的生活质量得到提高[3-4]。目前局部晚期直肠癌的术前放疗主要有长程放疗(1.8~2.0 Gy×25次,5~5.5周完成)和短程放疗(5 Gy×5次,1周完成)两种模式[5]。两种模式的主要区别为单次剂量的照射强度和照射次数,即前者为常规分割多分次照射,而后者为大分割少分次照射。
肿瘤生长依赖于肿瘤血管的生成[6]。血管内皮生长因子(vascular endothelial growth factor,VEGF)拥有维持血管内皮细胞活性和诱导其增殖等多种功能,并在大多数癌细胞中过度表达,是肿瘤血管生成最重要的刺激因子[7-8]。缺氧诱导因子-1α(hypoxia inducible factor 1-alpha,HIF-1α)是VEGF的重要调控因子,HIF-1α/VEGF轴是低氧激活肿瘤血管生成的主要机制[9-10]。研究发现,放射辐照同样能诱导肿瘤细胞HIF-1α的表达,激活HIF-1α /VEGF通路[11],但目前关于不同剂量放射辐照对直肠癌肿瘤血管生成影响的研究较少。本研究在临床样本中发现,不同剂量分割模式的放疗对直肠癌肿瘤血管生成的影响可能存在差异,并通过体外细胞实验探讨不同剂量分割放射治疗对直肠癌血管生成的影响,以期为直肠癌放疗方案的优化提供一定参考。
1 材料与方法 1.1 材料 1.1.1 病例和组织标本收集2017-2020年重庆医科大学附属第一医院肿瘤科经病理确诊为直肠癌的患者56例,其中男性32例,女性24例,年龄44~74(61.00±9.90) 岁。患者均进行术前新辅助放疗,在放疗结束后6~8周内完成手术治疗,且在术后由病理科进行病理的肿瘤退缩评级(tumor regression grade,TRG)。根据术前放疗方案分为两组:常规分割放疗组(总剂量50 Gy,单次剂量2 Gy,共进行25次,每周5次,5周内完成)42例,大分割放疗组(总剂量为25 Gy,单次剂量5 Gy,共进行5次,1周内完成)14例。根据AJCC肿瘤退缩分级(tumor regression grade, TRG)系统对放疗效果进行分级:TRG0,无活的癌细胞残留;TRG1,单个或小簇癌细胞残留;TRG2,残留癌灶,间质纤维化;TRG3,仅少数或未见癌细胞消退。直肠腺癌组织样本来源于2021年1-12月在重庆医科大学附属第一医院胃肠外科病理确诊、并经术前局部放疗的直肠腺癌患者手术切除的肿瘤组织。其中术前行常规分割、大分割放射治疗各5例,男性3例,女性2例,年龄47~71(55.79±9.22)岁。从同一患者手术切除的肿瘤组织中取2份样本,一份多聚甲醛固定用于包埋切片,另一份超低温冰箱保存。本研究经本院伦理委员会审批通过(2022-57)。
1.1.2 细胞、试剂与仪器人脐静脉内皮细胞HUVEC由重庆医科大学附属第一医院分子肿瘤及表观遗传学重庆市重点实验室提供;人直肠腺癌细胞SW1463购自美国ATCC公司。胎牛血清和1640培养基分别购自BI公司和Gibco公司;HIF-1α和VEGF的兔抗人多克隆抗体均购自博士德公司;β-actin的鼠抗人单克隆抗体购自碧云天公司;HRP标记的羊抗兔、羊抗鼠二抗购自碧云天公司;PVDF膜、胰蛋白酶、RIPA裂解液和蛋白上样缓冲液均购自碧云天公司;BCA蛋白浓度测定试剂盒、SDS-PAGE电泳配胶试剂盒、ECL发光试剂盒、DAB显色试剂盒、CCK-8试剂盒和ELISA试剂盒等购自碧云天公司。直线加速器购自VARIAN Medical Systems公司。
1.2 方法 1.2.1 组织标本处理及免疫组化收集两组患者的术后直肠腺癌组织,多聚甲醛固定、石蜡包埋后切片。用内皮细胞标记物CD34抗体孵育,然后用DAB辣根过氧化物酶显色试剂盒按说明书步骤对癌组织切片进行DAB染色。显微镜下观察不同放疗方案癌组织中的CD34阳性表达情况,拍照记录,参照Weidner校正方法[12]计算微血管密度(microvessel density,MVD)。
1.2.2 细胞培养人直肠腺癌细胞株SW1463和人脐静脉内皮细胞株HUVEC在37 ℃、5% CO2的细胞孵箱环境中用1640培养基(含10%胎牛血清)单独培养。每2天进行细胞换液,当细胞处于生长对数期、融合度达80%左右可进行细胞传代或冻存。传代时用0.25%胰蛋白酶(含EDTA)在PBS清洗细胞后进行消化,冻存时采用无血清冻存液在-80 ℃超低温冰箱内保存细胞。
1.2.3 不同剂量照射肿瘤细胞及条件培养基制备采用放射线照射细胞以模拟体内放疗情况。将培养的SW1463细胞以5×107/皿接种于直径10 cm的细胞培养皿中,置于37 ℃、5% CO2细胞孵箱中培养。当细胞融合度达70%时分成4组,根据前期实验结果和文献[13],分别给予0、4、12、24 Gy单次放射线照射。以细胞培养皿表面为入射中心,SSD设置为100 cm,射野大小为10 cm×10 cm,输出辐射能量为6 MV。细胞辐照结束后立即进行细胞换液,用新鲜培养基继续培养细胞48 h。收集上述不同分组肿瘤细胞照射后培养基,1 000×g离心10 min。取离心后的上清并用0.45 μm无菌过滤器过滤即得到照射后条件培养基。
1.2.4 Western blot分别检测HIF-1α和VEGF在组织和细胞中的表达将收集的经常规分割放射治疗和经大分割放射治疗的直肠腺癌组织剪成合适大小,加入适量液氮冰冻后再加入100 μL裂解液长程研磨,再用匀浆器进一步研磨。研磨结束后移入1.5 mL EP管,用4 ℃离心机12 000 r/min离心10 min,离心后吸取上清移至新1.5 mL EP管得到组织总蛋白。
将不同剂量照射后的SW143细胞用PBS清洗3遍,每皿加入100 μL RIPA裂解液(含1%PMSF)后于摇床上反应25 min。用细胞刮刮取细胞,超声裂解,4 ℃离心机12 000 r/min离心10 min,吸取离心后的上清移至1.5 mL EP管得到细胞总蛋白。
总蛋白提取后用BCA试剂盒按说明书测蛋白浓度,加入SDS-PAGE蛋白上样缓冲液后100 ℃加热变性蛋白5 min。用SDS-PAGE凝胶配制试剂盒按说明书配制浓缩胶和分离胶进行SDS-PAGE电泳(每孔蛋白上样量为40 μg),冰上250 mA转膜,配制脱脂奶粉(5%浓度)封闭1 h,TBST清洗PVDF膜3×10 min后孵育一抗(稀释比例1 ∶1 000),4 ℃摇床过夜。次日同样步骤清洗PVDF膜3×10 min,孵育二抗2 h(稀释比例1 ∶3 000), 再次清洗PVDF膜后用ECL试剂盒进行曝光显影并保存结果。
1.2.5 ELISA检测细胞上清液中HIF-1α和VEGF的浓度收集不同剂量照射后的SW1463细胞培养基,离心后收集上清液,使用ELISA试剂盒检测VEGF在各组细胞上清液中的浓度水平。
1.2.6 CCK-8检测细胞增殖将培养的SW1463细胞和HUVEC细胞以2 000/孔接种于96孔板中。待细胞贴壁后分成4组,分别给予0、4、12、24 Gy单次放射线辐照。照射后更换新鲜培养基,并于照射后的0、24、48、72 h加入10 μL/孔的CCK-8试剂。用酶标仪在避光孵育2 h后检测波长为450 nm时的光密度值[D(450)]。
将培养的HUVEC细胞以2 000/孔接种于96孔板中,并分成4组,分别加入收集的SW1463细胞不同剂量(0、4、12、24 Gy)照射后条件培养基100 μL/孔。于接种后的0、24、48、72 h加入10 μL/孔的CCK-8试剂。用酶标仪在避光孵育2 h后检测波长为450 nm时的光密度值[D(450)]。
1.2.7 克隆形成实验将HUVEC细胞以500/孔接种于6孔板中,加入收集的SW1463细胞照射后条件培养基,于37 ℃、5% CO2孵箱中培养7 d。当肉眼可观察到细胞集落形成后终止培养,弃掉培养液,PBS清洗后加入4%多聚甲醛(1 mL/孔)固定30 min。结晶紫(1 mL/孔)染色15 min,PBS清洗、干燥后拍照,并计算克隆数。
1.3 统计学分析采用SPSS 21.0统计软件进行分析。计数资料采用χ2检验;计量资料以x±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,并采用LSD或Tamhane’s T2法进行两两比较。检验水准为0.05。
2 结果 2.1 肿瘤退缩评级情况常规分割放疗组42例患者术后病理标本中TRG0共8例,TRG1共7例,TRG2共11例,TRG3共16例;大分割放疗组14例患者术后病理标本中TRG0共1例,TRG1共2例,TRG2共8例,TRG3共3例。经χ2检验,两组放疗方案效果差异无统计学意义(表 1)。
| 组别 | n | 病理TRG评级 | |||
| TRG0 | TRG1 | TRG2 | TRG3 | ||
| 常规分割放疗组 | 42 | 8 | 7 | 11 | 16 |
| 大分割放疗组 | 14 | 1 | 2 | 8 | 3 |
| 合计 | 56 | 9 | 9 | 19 | 19 |
2.2 免疫组化检测直肠癌样本内CD34阳性表达并进行MVD计数
为了比较常规分割、大分割放射治疗后直肠癌患者癌组织内血管密度情况,采用DAB染色,血管内皮细胞用CD34标记,血管内皮细胞胞浆或胞膜呈现棕色或棕黄色染色颗粒为阳性表现。结果显示,大分割放疗组CD34阳性染色情况及MVD计数显著高于常规分割放疗组(P < 0.05,图 1)。
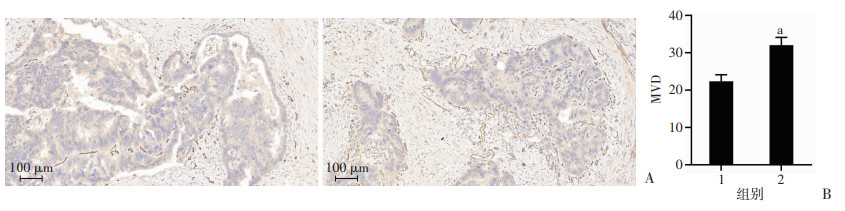
|
| A:免疫组化检测常规分割放疗组(左)、大分割放疗组(右)术后直肠腺癌组织标本CD34阳性表达;B:两组患者直肠癌组织MVD计数(n=5) 1:常规分割放疗组;2:大分割放疗组;a:P < 0.05,与常规分割放疗组比较 图 1 血管内皮细胞在肿瘤组织中CD34染色情况及MVD计数(S-P) |
2.3 Western blot检测直肠癌组织中VEGF和HIF-1α蛋白的表达
为了检测不同放射治疗模式下直肠癌组织中促血管生成因子的表达情况,采用Western blot检测直肠癌样本中促血管生成相关蛋白VEGF和HIF-1α的表达,并用Image J软件定量分析各蛋白条带的灰度值(蛋白相对表达量=目的/内参蛋白灰度值)。结果显示,大分割放疗组直肠癌组织中VEGF和HIF-1α蛋白表达水平显著高于常规分割放疗组(P < 0.01,图 2)。
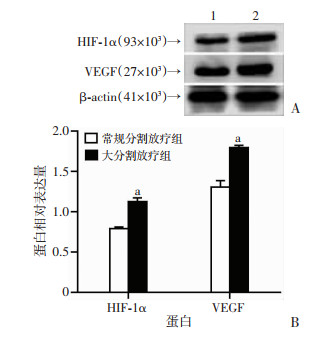
|
| A:Western blot检测结果 1:常规分割放疗组;2:大分割放疗组;B:蛋白相对表达量 a:P < 0.01,与常规分割放疗组比较 图 2 Western blot检测各组直肠癌组织中HIF-1α和VEGF蛋白的表达 |
2.4 CCK-8检测直肠癌细胞和血管内皮细胞的增殖情况
采用细胞实验来模拟人体放疗情况,并使用CCK-8检测两种细胞受不同剂量辐照后的增殖情况。结果显示,72 h后SW1453细胞(P < 0.05)和HUVEC细胞(P < 0.05)的增殖能力均随所受照射剂量的加大而降低,且4、12、24 Gy组均显著低于0 Gy组(P < 0.05,图 3)。
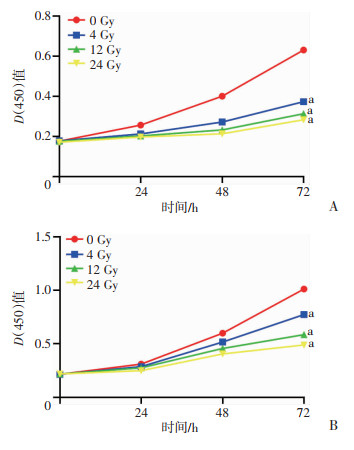
|
| A:SW1453细胞;B:HUVEC细胞;a:P < 0.05,与0 Gy比较 图 3 CCK-8检测不同剂量照射后SW1463细胞和HUVEC细胞增殖情况 |
2.5 Western blot检测直肠癌细胞中VEGF和HIF-1α表达
采用Western blot检测放疗后SW1463细胞中促血管生成因子的蛋白表达水平。结果显示,未经放射处理的SW1463细胞中VEGF和HIF-1α的蛋白表达水平较低,随着所受放射剂量的加大,SW1463细胞中VEGF(P < 0.01)和HIF-1α(P < 0.01)蛋白的表达水平均逐渐提高,且4、12、24 Gy均显著高于0 Gy(P < 0.01,图 4)。
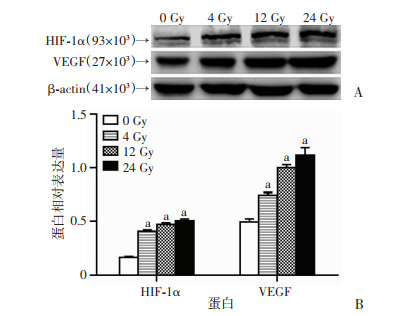
|
| A:Western blot检测结果;B:蛋白相对表达量 a:P < 0.01,与0 Gy比较 图 4 Western blot检测SW1463细胞中HIF-1α和VEGF蛋白的表达水平 |
2.6 ELISA检测直肠癌细胞上清液中VEGF的浓度
为了检测不同剂量射线照射后SW1463细胞促血管生成因子VEGF的分泌情况,收集SW1463细胞上清并采用ELISA检测其中VEGF的蛋白浓度水平。结果显示,SW1463细胞上清中VEGF含量与所受放射的剂量大小呈正相关,未经放射处理的SW1463细胞上清中的VEGF含量较低,随着放射剂量的增加,细胞上清中VEGF的含量逐渐升高,且4、12、24 Gy均显著高于0 Gy(P < 0.01,图 5)。
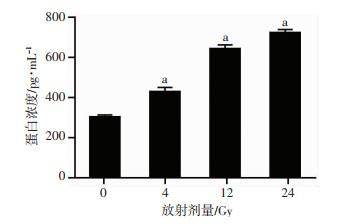
|
| a:P < 0.01,与0 Gy比较 图 5 ELISA法测定VEGF蛋白在SW1463细胞上清液中的含量 |
2.7 CCK-8检测血管内皮细胞在条件培养基影响下的增殖情况
通过CCK-8实验检测HUVEC细胞在不同剂量辐照条件培养基干预下的增殖情况。结果显示,与未放射条件培养基组相比,大剂量放射处理的直肠癌细胞培养基干预显著提高了HUVEC细胞的增殖能力(P < 0.01),且4、12、24 Gy均显著高于0 Gy(P < 0.01);随条件培养基所受放射剂量的加大,其干预提高HUVEC细胞增殖能力的作用越明显(P < 0.01,图 6)。
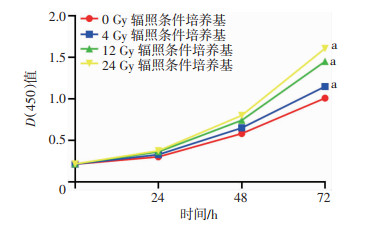
|
| a:P < 0.01,与0 Gy辐照条件培养基比较 图 6 CCK-8检测HUVEC细胞在不同剂量辐照后条件培养基中的增殖 |
2.8 克隆形成实验检测细胞条件培养基对血管内皮细胞增殖的影响
为了进一步验证血管内皮细胞在SW1463细胞辐照后条件培养基干预下的增殖情况,采用克隆形成实验并计数了各组条件培养基干预培养后HUVEC细胞形成克隆的情况。结果表明,大剂量辐照处理的直肠癌细胞培养基相比于未经辐照的条件培养基,能显著提高人脐静脉内皮细胞HUVEC的增殖能力(P < 0.01),且4、12、24 Gy均显著高于0 Gy(P < 0.01,图 7)。
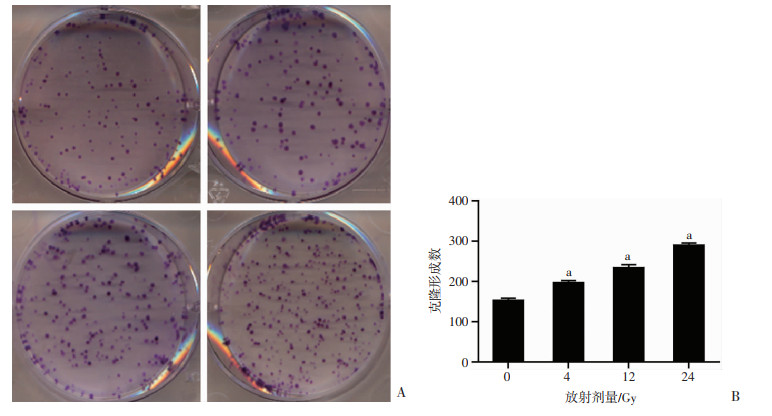
|
| A:分别为0、4、12、24 Gy条件培养基;B:克隆形成数计数 a:P < 0.01,与0 Gy条件培养基比较 图 7 克隆形成实验检测HUVEC细胞在不同剂量辐照条件培养基中的增殖 |
3 讨论
随着人们生活水平的提升,随之而来的是生活习惯和饮食结构的改变,我国结直肠癌的发病率呈现上升态势[14]。放射治疗作为直肠癌治疗的重要组成方式之一,其时机和剂量的把控显得尤为关键。长久以来,临床上采用先手术再放疗来降低肿瘤复发率,延长患者生存期。但近年来研究表明,术前放疗不仅具有传统术后放疗模式的优点,还具有缩小瘤体体积、降低肿瘤分期、增加部分患者进行根治性切除手术的机会和提高保肛率等多种优势[15-16]。因此,直肠癌的术前放疗得到了临床医师的广泛认可和运用。
过去,研究者对直肠癌的术前放疗模式进行了多种剂量组合的探索,包括长程的常规分割放疗模式:每次剂量1.8~2.0 Gy,进行25~28次;短程的大分割放疗模式:每次剂量5 Gy,进行5次;综合的新型放疗模式:每次剂量3 Gy,进行10次。遗憾的是,在局部复发、远处转移和总生存率方面各放疗模式并未发现显著差异。但在患者依从性和医疗资源占用方面,长程常规分割放疗存在一定的劣势,且一般认为长程常规分割放疗后患者更易发生辐射毒副反应[5, 17-18]。本研究通过术后病理TRG分级对常规分割放疗模式和大分割放疗模式进行比较,结果显示两种放疗分割模式在术后病理的TRG分级上无显著差异。但是本研究在不同剂量分割方式放疗后的直肠癌患者术后样本中发现,大分割放疗组直肠癌组织内CD34阳性染色和MVD计数均高于常规分割放疗组,推测可能与短程放疗采用的单次大剂量分割方式促进直肠癌组织内肿瘤血管的生成有关。为此,本研究检测了各组样本中HIF-1α和VEGF的蛋白表达水平,发现大分割放疗组直肠癌样本中HIF-1α和VEGF蛋白的表达水平显著高于常规分割放疗组。于是在体外细胞实验中,本研究使用不同放射剂量处理直肠癌细胞及血管内皮细胞以模拟体内情况。结果显示,虽然大剂量的辐照直接降低了血管内皮细胞和直肠癌细胞的增殖能力,但是通过检测直肠癌细胞内HIF-1α、VEGF的水平及上清液中VEGF的蛋白浓度,证明了射线辐照的确能促进这些因子在肿瘤细胞中的高表达。VEGF可直接作用于血管内皮细胞,诱导其增殖并促进血管的构建,还能通过旁分泌途径间接促进肿瘤的进展,是目前已发现的促肿瘤血管生成因子中作用效果最强的刺激因子[19-20]。而HIF-1α是VEGF表达的主要调控因子,能增强VEGF的转录活性和增加VEGF mRNA稳定性。在缺氧或受辐照的条件下,肿瘤细胞通过增强HIF-1α转录活性,上调VEGF表达来促进肿瘤新生血管形成[11, 21-22]。
为了证实VEGF对血管内皮细胞的影响,实验收集了照射后癌细胞的培养基以干预血管内皮细胞,发现这些条件培养基的确能呈放射剂量依赖性地促进血管内皮细胞的增殖。推测直肠细胞受到大剂量辐照后,细胞内HIF-1α、VEGF的表达增加,释放到胞外的VEGF蛋白也随之增多,VEGF作为强力的促血管生成因子,可直接作用于血管内皮细胞,促进血管内皮细胞的增殖。
另外,在实验中观察到随着放射剂量的增大,直肠癌细胞和血管内皮细胞的增殖能力虽然逐渐下降,但下降率明显放缓。推测这与细胞受到放射后DNA的损伤再修复有关,即小剂量照射后,细胞中亚致死性损伤的细胞占比例大。发生亚致死性损伤的细胞其DNA可在辐照停止后完成一定自我修复,从而逐渐恢复增殖能力。当辐照达到一定剂量时,大多数细胞将发生不可修复的致死性损伤。综上,研究者推测大剂量的照射虽然直接降低了直肠癌细胞和血管内皮细胞的增殖能力,但同时也促进了促血管生成因子HIF-1α、VEGF的表达升高,由于受到放射损伤的细胞存在再修复的机制,使得血管内皮细胞在肿瘤中增殖的总体水平呈上升表现。
如今,放疗技术水平的提升使大剂量照射得到进一步运用。由于增加了照射时的生物等效剂量,大剂量分割放疗在多种肿瘤的治疗中取得了良好的临床效果[23]。研究表明,相比于常规分割照射,大剂量分割照射在联合免疫治疗方面有明显的理论优势:大剂量分割照射后能产生更多的肿瘤抗原,且可诱导免疫细胞及时浸润[24]。此外,大剂量分割照射还能通过促进树突状细胞成熟、细胞因子分泌及激活T细胞特异性杀伤能力来加强免疫应答反应[25]。然而,肿瘤新生血管的增加会形成物理屏障,使免疫细胞到达肿瘤部位变得困难,限制免疫治疗的有效性[10]。异常管脉系统还会形成缺氧和酸性微环境,使T淋巴细胞和自然杀伤细胞等抗肿瘤免疫细胞变成无反应状态,随后发生凋亡,加剧免疫抑制[26]。另一方面,VEGF除了刺激肿瘤血管生成,还作为趋化因子对免疫细胞产生不同程度影响[27-28],如使树突状细胞和淋巴细胞等抗肿瘤免疫细胞相对缺乏,髓源性抑制细胞和肿瘤相关巨噬细胞等免疫抑制细胞积累,诱导免疫失衡。因此,如何优化组合使大分割放疗与免疫联合达到最优协同作用是值得进一步探索的问题。现在在肝癌、非小细胞肺癌、黑色素瘤领域运用抗血管生成靶向药物联合免疫药物的治疗模式有了非常好的疗效。在晚期结直肠癌领域,REGONIVO研究也证实了抗血管生成靶向药物联合免疫检查点抑制剂的抗肿瘤效应[29]。在大剂量放疗的同时应用抗血管生成的靶向药物,而后与免疫治疗联合可能是本研究下一步的研究方向。
本研究仍存在局限,本研究虽然探讨了不同剂量分割放射治疗对直肠癌细胞增殖及血管生成的影响,但未进一步探讨放射次数带来的影响。此外,细胞实验难以完全模拟临床放疗,研究者正在进行动物实验进一步验证研究结果。
综上所述,本研究证实了单次大剂量的放射促进直肠癌细胞中HIF-1α和VEGF的表达,促进血管内皮细胞的增殖,进而促进了肿瘤血管的生成,为探索肿瘤大剂量放疗联合免疫治疗的优化提供了一定参考。
| [1] |
苏文雨, 房静远. 2020年结直肠癌的研究新进展[J]. 中华医学信息导报, 2021, 36(3): 12-13. SU W Y, FANG J Y. New progress in colorectal cancer research in 2020[J]. Chin Med Information Guide, 2021, 36(3): 12-13. |
| [2] |
WU S G, ZHANG W W, SUN J Y, et al. Preoperative radiotherapy improves survival in rectal signet-ring cell carcinoma-a population-based study[J]. Radiat Oncol, 2017, 12(1): 141. |
| [3] |
GOLLINS S, WEST N, SEBAG-MONTEFIORE D, et al. Preoperative chemoradiation with capecitabine, irinotecan and cetuximab in rectal cancer: significance of pre-treatment and post-resection RAS mutations[J]. Br J Cancer, 2017, 117(9): 1286-1294. |
| [4] |
彭俊杰, 朱骥, 刘方奇, 等. 中国局部进展期直肠癌诊疗专家共识[J]. 中国癌症杂志, 2017, 27(1): 41-80. PENG J J, ZHU J, LIU F Q, et al. Expert consensus on diagnosis and treatment of locally advanced rectal cancer in China[J]. China Oncol, 2017, 27(1): 41-80. |
| [5] |
ERLANDSSON J, HOLM T, PETTERSSON D, et al. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (Stockholm Ⅲ): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial[J]. Lancet Oncol, 2017, 18(3): 336-346. |
| [6] |
ZHANG Y Y, CHEN B, DING Y Q. Metastasis-associated factors facilitating the progression of colorectal cancer[J]. Asian Pac J Cancer Prev, 2012, 13(6): 2437-2444. |
| [7] |
SUN W, WANG X J, LI J L, et al. microRNA-181a promotes angiogenesis in colorectal cancer by targeting SRCIN1 to promote the SRC/VEGF signaling pathway[J]. Cell Death Dis, 2018, 9(4): 438. |
| [8] |
KIM S, LEE M, CHOI Y K. The role of a neurovascular signaling pathway involving hypoxia-inducible factor and Notch in the function of the central nervous system[J]. Biomol Ther (Seoul), 2020, 28(1): 45-57. |
| [9] |
TIRPE A A, GULEI D A, CIORTEA S M, et al. Hypoxia: overview on hypoxia-mediated mechanisms with a focus on the role of HIF genes[J]. Int J Mol Sci, 2019, 20(24): 6140. |
| [10] |
VIALLARD C, LARRIVÉE B. Tumor angiogenesis and vascular normalization: alternative therapeutic targets[J]. Angiogenesis, 2017, 20(4): 409-426. |
| [11] |
ZHU H J, ZHANG S L. Hypoxia inducible factor-1α/vascular endothelial growth factor signaling activation correlates with response to radiotherapy and its inhibition reduces hypoxia-induced angiogenesis in lung cancer[J]. J Cell Biochem, 2018, 119(9): 7707-7718. |
| [12] |
CHABOWSKI M, NOWAK A, GRZEGRZOLKA J, et al. Comparison of microvessel density using nestin and CD34 in colorectal cancer[J]. Anticancer Res, 2018, 38(7): 3889-3895. |
| [13] |
MAEDA A, CHEN Y H, BU J C, et al. In vivo imaging reveals significant tumor vascular dysfunction and increased tumor hypoxia-inducible factor-1α expression induced by high single-dose irradiation in a pancreatic tumor model[J]. Int J Radiat Oncol, 2017, 97(1): 184-194. |
| [14] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [15] |
常娜, 钱立庭, 赵于飞, 等. 放疗技术在直肠癌术前治疗中的应用与研究进展[J]. 中国肿瘤, 2019, 28(11): 861-868. CHANG N, QIAN L T, ZHAO Y F, et al. Application of radiotherapy in preoperative treatment of rectal cancer[J]. China Cancer, 2019, 28(11): 861-868. |
| [16] |
万觉锋, 章真. 直肠癌术前放疗进展[J]. 中华结直肠疾病电子杂志, 2016, 5(2): 127-132. WAN J F, ZHANG Z. Advances in preoperative radiation of locally advanced rectal cancer[J]. Chin J Colorectal Dis Electron Ed, 2016, 5(2): 127-132. |
| [17] |
ANSARI N, SOLOMON M J, FISHER R J, et al. Acute adverse events and postoperative complications in a randomized trial of preoperative short-course radiotherapy versus long-course chemoradiotherapy for T3 adenocarcinoma of the rectum: trans-Tasman radiation oncology group trial (TROG 01.04)[J]. Ann Surg, 2017, 265(5): 882-888. |
| [18] |
ZHAN T C, GU J, LI M, et al. Intermediate-fraction neoadjuvant radiotherapy for rectal cancer[J]. Dis Colon Rectum, 2013, 56(4): 422-432. |
| [19] |
TSAI H C, TZENG H E, HUANG C Y, et al. WISP-1 positively regulates angiogenesis by controlling VEGF-A expression in human osteosarcoma[J]. Cell Death Dis, 2017, 8(4): e2750. |
| [20] |
YANG J G, WANG L L, MA D C. Effects of vascular endothelial growth factors and their receptors on megakaryocytes and platelets and related diseases[J]. Br J Haematol, 2018, 180(3): 321-334. |
| [21] |
LUDWIG N, WHITESIDE T L. Potential roles of tumor-derived exosomes in angiogenesis[J]. Expert Opin Ther Targets, 2018, 22(5): 409-417. |
| [22] |
郭靖, 尚杨杨, 汪荣泉. 结直肠癌及缺氧的结直肠癌细胞中HIF-1α与miRNA-200b表达的相关性[J]. 第三军医大学学报, 2016, 38(6): 545-549. GUO J, SHANG Y Y, WANG R Q. Correlation of HIF-1α and miRNA-200b expression in human colorectal cancer tissues and hypoxia-induced colorectal cancer cells[J]. J Third Mil Med Univ, 2016, 38(6): 545-549. |
| [23] |
胥芸芸, 洪梅, 李桂香. 放疗对机体抗肿瘤免疫效应机制的影响[J]. 现代肿瘤医学, 2016, 24(24): 4023-4025. XU Y Y, HONG M, LI G X. New progress on the effect of radiotherapy on the anti-tumor immune response[J]. J Mod Oncol, 2016, 24(24): 4023-4025. |
| [24] |
FREY B, RVCKERT M, WEBER J, et al. Hypofrac-tionated irradiation has immune stimulatory potential and induces a timely restricted infiltration of immune cells in colon cancer tumors[J]. Front Immunol, 2017, 8: 231. |
| [25] |
郑声琴, 范璟, 郑勤, 等. 单次大分割放疗在体外对树突状细胞激活T细胞的影响[J]. 东南大学学报(医学版), 2021, 40(1): 46-52. ZHENG S Q, FAN J, ZHENG Q, et al. Effects of single fractionation radiotherapy on dendritic cells activation to T cell in vitro[J]. J Southeast Univ Med Sci Ed, 2021, 40(1): 46-52. |
| [26] |
PILON-THOMAS S, KODUMUDI K N, EL-KENAWI A E, et al. Neutralization of tumor acidity improves antitumor responses to immunotherapy[J]. Cancer Res, 2016, 76(6): 1381-1390. |
| [27] |
SIA D, ALSINET C, NEWELL P, et al. VEGF signaling in cancer treatment[J]. Curr Pharm Des, 2014, 20(17): 2834-2842. |
| [28] |
FERRARA N, ADAMIS A P. Ten years of anti-vascular endothelial growth factor therapy[J]. Nat Rev Drug Discov, 2016, 15(6): 385-403. |
| [29] |
FUKUOKA S, HARA H, TAKAHASHI N, et al. Regorafenib plus nivolumab in patients with advanced gastric or colorectal cancer: an open-label, dose-escalation, and dose-expansion phase Ib trial (REGONIVO, EPOC1603)[J]. J Clin Oncol, 2020, 38(18): 2053-2061. |




