非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是由甘油三酯合成和分泌不平衡造成的代谢性疾病。糖尿病是其主要危险因素,目前有55%的2型糖尿病(type 2 diabetes, T2DM)患者存在NAFLD[1]。随着代谢性疾病(肥胖、T2DM和NAFLD)患病率持续上升,预计至2045年全球糖尿病患病人数将达到7亿,可以预计届时NAFLD患病人数将达到近4亿[2]。NAFLD引起的胰岛素抵抗等并发症同时是T2DM发展的主要危险因素,NAFLD患者患T2DM的风险显著增高,相比于其他代谢性疾病,T2DM与NAFLD具有更显著的相关性[3-4]。
雌马酚[7-羟基-3-(49-羟基苯基)-苯并二氢吡喃,Equol]是大豆异黄酮的肠道代谢产物[5]。多项研究表明,膳食来源的大豆异黄酮、大豆苷元可以抑制高糖环境下的胰岛细胞凋亡,改善胰岛功能,调节血糖[6]。外消旋雌马酚(S-Equol)是Equol的一种对映体,可以选择性激活雌激素受体β(ERβ),且S-Equol雌激素活性和抗氧化活性优于其他异黄酮[7-8]。
研究表明大豆异黄酮可以缓解肝脏纤维化进程,大豆苷元能够显著改善超重肥胖人群血管疾病危险因素的相关指标水平,而相比于可以代谢产生Equol的大鼠,不能代谢产生Equol的大鼠肝脏纤维化和气球样变更严重,大豆异黄酮和大豆苷元需要肠道代谢产生Equol来发挥生物学效应[9-11]。本研究旨在探讨S-Equol对T2DM合并NAFLD大鼠模型在糖脂代谢、胰岛素功能、肝功能及代谢相关蛋白表达方面的影响,为选择S-Equol改善NAFLD及其并发症造成的器官损伤和代谢紊乱提供实验依据。
1 材料与方法 1.1 实验动物本研究采用50只6周龄SPF级雄性SD大鼠,体质量(200±20) g,由北京华阜康生物科技股份有限公司提供[SCXK(京)2019-008]。饲养环境为陆军军医大学动物实验中心SPF级动物房,环境温度和湿度为中央空调统一控制[室温(22±2)℃,湿度60%~70%,12小时昼夜交替照明],每笼5只,自由摄食饮水。高脂高糖饲料的成分为10%猪油,20%蔗糖,2%胆固醇,0.5%胆酸钠,67.5%普通饲料(北京科奥协力饲料有限公司),普通饲料(北京华阜康生物科技股份有限公司)由陆军军医大学动物实验中心提供。
1.2 主要试剂与仪器本研究主要采用的试剂与仪器有:链尿佐菌素(streptozocin, STZ)(≥98%,碧云天生物技术有限公司);二甲亚砜[DMSO,生工生物工程(上海)股份有限公司]戊巴比妥钠(美国Sigma公司,由陆军军医大学第二附属医院实验动物中心提供);S-Equol(大赛璐药物手性技术有限公司,光学纯度≥99%);柠檬酸/柠檬酸钠(碧云天生物技术有限公司);超敏ECL化学发光试剂盒、RIPA裂解液(碧云天生物技术有限公司);血糖仪及血糖试纸(美国稳捷OneTouch公司);谷丙转氨酶、谷草转氨酶ELISA(南京建成生物工程研究所有限公司);胰岛素、肝脏白介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)ELISA试剂盒(慧佳科技有限公司);万分之一电子天平(常州奥斯豪仪器);全波长多功能酶标仪(美国THERMO公司);电泳槽,转膜槽(美国Bio-rad公司);化学发光成像仪(美国acuronBio公司);PCR仪(荧光定量CFX connect,美国Bio-rad公司);RT-PCR采用SYBR Green染料法PCR试剂盒(德国QIAGENG公司);Western-blot采用过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor gamma,PPARγ)抗体和乙酰辅酶a羧化酶(acetyl-CoA carboxylase,ACC)抗体(武汉三鹰生物技术有限公司)。
1.3 T2DM大鼠模型构建所有大鼠适应性喂养1周后,依据随机数字表法分为对照组(n=10),建模组(n=40)。对照组大鼠给予普通饲料喂养,建模组大鼠给予高脂高糖饲料喂养。4周后,所有大鼠禁食12 h,建模组大鼠腹腔注射链尿佐菌素(25 mg/kg,STZ溶于0.1 mol/L柠檬酸/柠檬酸钠缓冲液, pH=4.5),对照组大鼠腹腔注射与建模组等体积的柠檬酸/柠檬酸钠缓冲液,连续2次,间隔1周进行STZ注射造模,T2DM大鼠建模成功标准为建模完成1周后,6 h空腹血糖(fasting blood-glucose, FBG)>11.1 mmol/L。
1.4 动物分组和给药采用随机数字表法,将T2DM模型大鼠分为模型组(n=9)及S-Equol低剂量组(20 mg·kg-1·d-1, n=9)、中剂量组(40 mg·kg-1·d-1, n=8)和高剂量组(80 mg·kg-1·d-1, n=8)。S-Equol溶解于DMSO,悬浮于玉米油,各给药组于造模成功次日起灌胃给药,每日一次。糖尿病模型组和正常对照组灌胃给予等量DMSO+玉米油溶液。所有大鼠在12周干预期间自由摄食饮水,每周检测FBG和体质量。
1.5 样本采集和处理 1.5.1 样本采集准备所有大鼠在最后一次灌胃干预后禁食不禁水12 h,称量并记录,分批次麻醉取材。
1.5.2 血液样本采集将大鼠按5%(体积分数)异戊巴比妥钠腹腔注射麻醉后,取大鼠股动脉血,血液静置分层后,4℃离心(4 500 r/min,10 min)后获得血清,置于-80 ℃超低温冰箱备用。
1.5.3 肝脏样本采集采集血液后,4 ℃ 0.01 mol/L PBS反复灌注大鼠血管,至肝脏颜色苍白,摘取肝脏,滤纸吸干多余水分称量后,将肝脏分为3份,1份置入4%多聚甲醛用于病理学检测, 1份置入RNA保存液中用于RNA检测,1份置入-80 ℃超低温冰箱用于蛋白表达的检测。
1.6 检测指标和方法 1.6.1 大鼠血清和肝功能生物标志物检测大鼠血清总胆固醇(TC)、甘油三酯(TG)、血糖(FBG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆红素(TBIL)、直接胆红素(DBIL)、总蛋白(TP)、白蛋白(Alb)、球蛋白(Glb)、白球比(A/G)由新桥医院检验科检测;采用ELISA试剂盒检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)浓度;IL-1β、IL-6和TNF-α检测方法:称取肝组织100 mg,用RIPA裂解液提取总蛋白,BCA法检测蛋白浓度后,按照ELISA试剂盒说明书规程,全波长多功能酶标仪测定光密度值[D(450)],最后进行蛋白浓度校正。
1.6.2 油红O染色将由4%多聚甲醛溶液固定处理的肝脏进行脱水、包埋、冰冻切(3~5 μm)。4%多聚甲醛固定10 min后,放入60%异丙醇中洗涤2 min,滴加0.3%油红O染液,室温放置15 min后,依次用60%异丙醇和0.9% NaCl漂洗至显微镜下背景干净,苏木精复染7 min,1% HCl-酒精分化1 s,自来水返蓝10 min,干燥后封片。光镜下观察(×10),每组随机选取10个视野,拍照后,使用Image J软件进行O油红着色面积计算。
1.6.3 HE染色取各组大鼠肝脏石蜡包埋切片,采用HE染液,石蜡切片脱蜡后蒸馏水湿润,核染液染色5 min,蒸馏水洗5 s,浆染液染色30 s,蒸馏水洗,滤纸吸干后无水乙醇脱水2次后封片,光镜下观察,并拍照记录。
1.6.4 Western blot法检测肝脏组织中PPARγ和ACC蛋白表达称取100 mg大鼠肝脏组织,用RIPA裂解液+蛋白酶抑制剂(phenylmethanesulfonyl fluoride, PMSF)提取总蛋白后,使用BCA法测定蛋白质浓度,取70 μg蛋白质进行SDS-PAGE凝胶电泳后湿转法转至PVDF膜,5%脱脂奶粉封闭2 h后一抗4 ℃摇床过夜,次日洗膜缓冲液(tris buffered saline tween, TBST)洗涤3次后加入二抗孵育1 h,TBST洗涤3次后加入发光液曝光。以所测蛋白的灰度值/GAPDH的灰度值作为所测蛋白的相对表达。
1.6.5 RT-qPCR检测肝组织中PPARγ、ACC、固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1, SREBP-1)和脂肪酸合成酶(fatty acid synthetase, Fasn) mRNA表达水平取RNA固定液固定组织30 mg,采用一站式DNA、RNA、蛋白提取试剂盒试剂提取、纯化肝组织总mRNA,并测定总mRNA浓度,采用cDNA反转录试剂盒进行反转录得到cDNA,采用荧光定量CFX connect测定肝脏组织中PPARγ、SREBP、ACC和Fasn的mRNA相对表达量。RT-qPCR反应体系:引物1 μL,cDNA 2 μL,ddH2O 2 μL,Master Mix 5 μL,总体积10 μL。反应条件预变性:95 ℃ 5 min,共45个循环:95 ℃ 5 s,59 ℃ 15 s,72 ℃ 20 s,65~95 ℃,得到各组样品扩增反应的Ct值,以GAPDH作为内参基因,采用2-Ct法计算目的基因的相对表达量。引物序列:GAPDH:正向GCCAGCCTCGTCT CAGACA,反向AGAGAAGGCAGCCCTGGAAC;PPARγ:正向CCACCAACTTCGGAATCAGC,反向CCATTGGGTCAGCTCTTGTG;SREBP-1:正向CAGGAGC CACAATGAAGACC,反向AACGGTAGCGCTTCTCAATG;Fasn:正向TGGAAGACACTGGCTCGA AG,反向AGGGGAGATGAGAGGAGTCC;ACC:正向CAGGACCGATGTGATGTTGC,反向CAGGACCGATGTGATGTTGC。
1.7 统计学分析采用R软件(4.2.0)进行统计学分析,计量资料用x±s表示,采用shapiro.test函数做正态检验,采用levene Test函数做方差齐性检验,采用ggstatsplot (0.9.1)包的ggbetweenstats函数进行单因素anova分析,组间比较采用LSD-t检验。设定检验标准,P < 0.05为差异有统计学意义。
2 结果 2.1 建模情况及S-Equol对糖尿病大鼠代谢指标的影响通过4周高脂高糖饮食诱导联合STZ腹腔注射后,成功建模T2DM大鼠34只。与对照组比较,模型组体质量下降,反应迟钝,毛发枯燥、黄染,小便量增多,多稀便。与对照组比较,模型组大鼠FBG、TC水平显著升高(表 1,P < 0.05);与模型组比较,S-Equol干预后,大鼠体质量有增加,但并没有显著差异,低、高剂量组FBG以及低、中剂量组TC明显降低(P < 0.05);5组大鼠TG水平未见明显差异。
| 组别 | n | 体质量/g | 空腹血糖/mmol·L-1 | 甘油三酯/mmol·L-1 | 总胆固醇/mmol·L-1 |
| 对照组 | 10 | 568.63±32.80 | 7.68±1.36 | 0.33±0.11 | 1.48±0.60 |
| 模型组 | 8 | 392.90±40.83 | 29.95±4.28a | 0.61±0.33 | 2.62±0.46a |
| 低剂量组 | 9 | 447.50±78.47a | 14.01±7.16ab | 0.63±0.32 | 1.87±0.51b |
| 中剂量组 | 7 | 431.34±56.92a | 23.05±8.52a | 0.49±0.18 | 1.93±0.34b |
| 高剂量组 | 5 | 415.42±12.61a | 18.71±5.96ab | 0.51±0.15 | 1.91±0.61 |
| a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 | |||||
2.2 S-Equol对糖尿病大鼠肝功能指标的影响
与对照组比较,模型组肝脏重量、肝指数显著升高(图 1,P < 0.05),血清ALT、HDL、LDL、TBIL、DBIL、IBIL水平显著升高(表 2,P < 0.05),A/G显著降低(P < 0.05);与模型组比较,低剂量组肝脏重量以及肝指数显著降低(P < 0.05),中剂量组ALT以及DBIL明显降低(P < 0.05),低剂量组LDL显著降低,A/G比值显著升高(P < 0.05)。所有组间大鼠AST、TP、ALB、GLB未见显著差异。
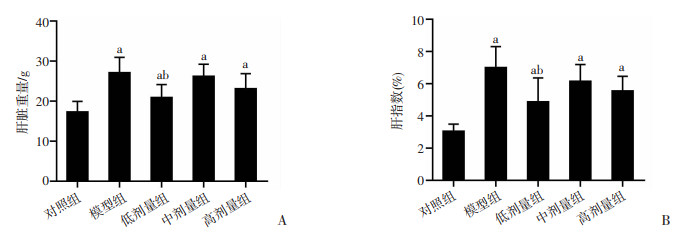
|
| a: P < 0.05, 与对照组比较,b: P < 0.05, 与模型组比较 图 1 S-Equol干预后各组肝脏重量(A)和肝指数(B)比较 (x±s,n=5) |
| 组别 | n | HDL/mmol·L-1 | LDL /mmol·L-1 | TBIL /mmol·L-1 | DBIL /mmol·L-1 | IBIL /mmol·L-1 | TP /g·L-1 |
| 对照组 | 10 | 0.33±0.09b | 0.28±0.09b | 1.04±0.59b | 0.32±0.17b | 0.71±0.49b | 55.17±20.67 |
| 模型组 | 8 | 0.70±0.29a | 0.57±0.17a | 2.19±0.83a | 0.60±0.24a | 1.93±0.25a | 61.06±12.93 |
| 低剂量组 | 9 | 0.54±0.18a | 0.34±0.11b | 2.52±0.75a | 0.56±0.22a | 1.97±0.58a | 53.22±10.35 |
| 中剂量组 | 7 | 0.51±0.14a | 0.41±0.11a | 2.16±0.54a | 0.27±0.20b | 1.89±0.38a | 51.99±8.44 |
| 高剂量组 | 5 | 0.64±0.12a | 0.42±0.06a | 2.24±0.86a | 0.52±0.29 | 1.72±0.61a | 54.66±10.94 |
| 组别 | ALB /g·L-1 | GLB /g·L-1 | A/G | ALT /U·L-1 | AST /U·L-1 | ||
| 对照组 | 27.13±3.21 | 28.04±4.80 | 0.98±0.08b | 25.75±13.07 | 44.12±15.25 | ||
| 模型组 | 25.73±4.41 | 35.34±8.56 | 0.74±0.06a | 81.56±34.35a | 66.67±23.42 | ||
| 低剂量组 | 24.86±4.61 | 28.37±6.03 | 0.89±0.10ab | 52.41±26.74a | 48.05±17.95 | ||
| 中剂量组 | 22.41±4.11 | 29.57±4.42 | 0.76±0.04a | 48.39±15.81ab | 48.19±14.01 | ||
| 高剂量组 | 23.32±5.22 | 31.34±5.84 | 0.74±0.06a | 64.74±33.84 | 50.61±18.73 | ||
| a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 | |||||||
2.3 肝脏组织的病理学结果
HE染色结果显示,对照组中央静脉完整,肝细胞和血窦正常,在血窦内可见少量kufffer细胞,模型组肝细胞紊乱,未见明显纤维化、坏死,可见大量脂肪堆积,肝窦无辐射,肝窦内及细胞间存在较多kufffer细胞,各S-Equol干预组肝小叶的整体形态逐渐接近正常,但可见中、低剂量组仍有明显有脂肪变,高剂量组肝细胞内及肝细胞间脂肪含量减少(图 2);各干预组异常血窦内仍可见kufffer细胞。通过油红O染色的方法来验证糖尿病大鼠模型肝脏脂肪沉积情况(图 3),验证S-Equol对糖尿病导致的NAFLD的改善作用。与对照组相比,模型组表现为脂质沉积增加,T2DM大鼠肝脏脂肪变性面积显著高于空白组(图 4,P < 0.05),NAFLD模型建立成功;不同浓度的S-Equol灌胃干预可以显著减少T2DM模型大鼠肝脏中脂滴的面积(P < 0.05)。
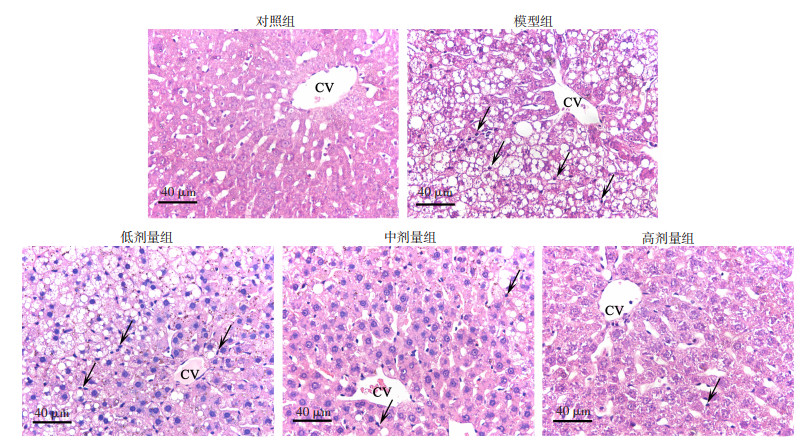
|
| CV:示中央静脉;箭头:示kuffer细胞 图 2 S-Equol干预对T2DM合并NAFLD大鼠肝脏组织形态学的影响 |

|
| 图 3 S-Equol干预对T2DM合并NAFLD大鼠肝脏组织脂质沉积影响(油红O染色) |
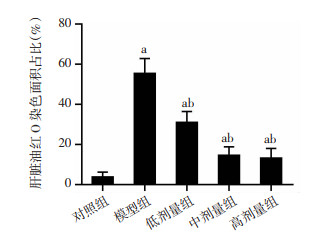
|
| a: P < 0.05, 与对照组比较; b: P < 0.05, 与模型组比较 图 4 各组大鼠肝脏组织油红染色面积定量分析 (n=10,x±s) |
2.4 S-Equol对糖尿病大鼠胰岛素分泌及胰岛素抵抗(HOMA-IR)的影响
与对照组比较,模型组HOMA-IR水平显著升高(图 5,P < 0.05);与模型组比较,高剂量组胰岛素浓度显著升高(P < 0.05),且呈现出胰岛素分泌由S-Equol干预低剂量向高剂量递增的梯度趋势,低剂量组HOMA-IR水平降低明显(P < 0.05)。

|
| a: P < 0.05, 与对照组比较,b: P < 0.05, 与模型组比较 图 5 S-Equol干预后各组胰岛素浓度(A)和HOMA-IR(B)比较 (n=5,x±s) |
2.5 S-Equol对肝组织IL-1β,IL-6,TNF-α表达影响
每组取5只大鼠的肝组织,采用ELISA试剂盒检测肝组织炎症因子表达(表 3),与对照相比,模型组大鼠肝脏IL-1β、IL-6和TNF-α表达升高(P < 0.05);与模型组相比,中、高剂量S-Equol干预显著降低肝组织IL-1β和IL-6表达,各干预组肝组织TNF-α表达显著降低(P < 0.05)。
| 分组 | IL-6 | IL-1β | TNF-α |
| 对照组 | 18.7 ±1.21b | 5.61 ±0.28b | 40.1 ±1.55b |
| 模型组 | 30.3 ±2.00a | 10.6 ±0.86a | 86.7 ±5.19a |
| 低剂量组 | 26.6 ±1.21a | 9.27 ±0.41a | 73.4 ±2.14ab |
| 中剂量组 | 23.8 ±1.18ab | 8.89 ±0.61ab | 55.9 ±3.10ab |
| 高剂量组 | 24.1 ±1.26ab | 8.14 ±0.44ab | 52.1 ±3.79ab |
| a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 | |||
2.6 Western blot结果
与对照组相比,模型组大鼠肝脏组织中ACC、PPARγ的蛋白表达显著升高(图 6,P < 0.05)。相比于模型组,S-Equol显著降低T2DM合并NAFLD模型大鼠肝脏组织中PPARγ蛋白的表达,中、高剂量S-Equol显著降低肝组织ACC的表达(P < 0.05)。
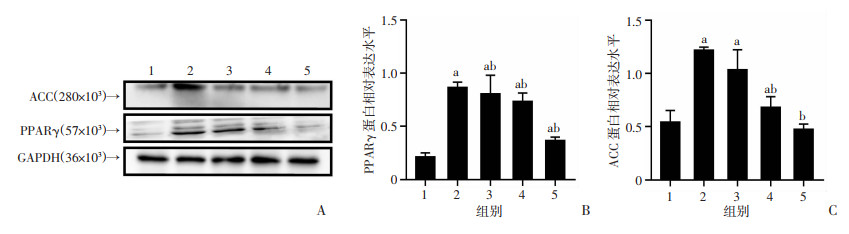
|
| A:Western blot检测各组大鼠ACC、PPARγ蛋白表达;B:各组大鼠PPARγ相对表达水平分析;C:各组大鼠ACC相对表达水平分析 1: 对照组;2:模型组;3:低剂量组;4:中剂量组;5:高剂量组 a: P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 6 S-Equol对大鼠肝脏ACC、PPARγ蛋白表达的影响 (x±s,n=5) |
2.7 RT-qPCR结果
与对照组相比,模型组大鼠肝脏组织中SREBP-1、Fasn、ACC、PPARγ的mRNA表达显著升高(图 7,P < 0.05)。相比模型组,不同剂量的S-Equol可显著降低大鼠肝脏组织中SREBP-1、PPARγ的mRNA表达,中、高剂量S-Equol显著降低ACC mRNA表达,高剂量S-Equol显著降低Fasn mRNA表达(P < 0.05)。

|
| A:ACC mRNA相对表达量;B:SREBP-1 mRNA相对表达量;C:PPARγ mRNA相对表达量;D:Fasn mRNA相对表达量 a: P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 7 S-Equol干预对大鼠肝脏SREBP-1、Fasn、ACC、PPARγ表达的影响 (x±s,n=5) |
3 讨论
S-Equol具有改善女性更年期症状,延缓心血管疾病、神经退行性疾病以及部分癌症进展的作用,作为植物类雌激素的肠道代谢产物,S-Equol相比于其他异黄酮类化合物,具有结构稳定、易于吸收、清除率低的优势,且具有更强的抗氧化和类雌激素效应[12-13]。但非所有个体都可以通过肠道菌群代谢大豆异黄酮产生S-Equol。既往研究主要集中于探讨大豆异黄酮的生物学效应,对S-Equol的作用效应和机制探究较少。而S-Equol是否可以作为非雌马酚生产者的补充制剂,也亟待进一步的实验证据。本研究通过探究S-Equol对T2DM合并NAFLD大鼠的作用,发现S-Equol可以调节SREBP通路分子和PPARγ,改善T2DM合并NAFLD大鼠的脂代谢水平并降低肝组织炎症水平,在一定程度上调节血糖水平和降低胰岛素抵抗状态,这表明S-Equol作为异黄酮的肠道代谢产物,可以有效延缓NAFLD的发展。
3.1 T2DM合并NAFLD大鼠模型的构建本实验建立的T2DM合并NAFLD大鼠模型通过两次小剂量STZ损伤胰岛β细胞配合高糖高脂饮食加重机体胰岛素抵抗状态,从而诱导肝脏的脂肪变性,继而加重胰岛素抵抗状态。T2DM合并NAFLD状态下,肝脏对游离脂肪酸(free fatty acid, FFA)的摄取和合成增加。SREBP-1和PPARγ被认为是推动肝脏脂肪变性过程中,促进脂质积累的关键分子,SREBP-1激活下游多种参与FFA和TG合成的酶过度表达,例如硬脂酰CoA去饱和酶(stearyl CoA desaturase, SCD)、Fasn和ACC等,导致肝内TG从头合成增加,造成肝脏脂质蓄积[14]。在正常大鼠中,SREBP-1和PPARγ都具有较低的表达水平,而在NAFLD模型中,两种分子有较大幅度的上调。另有研究表明,PPARγ可协同提高SREBP-1的表达[15]。经过12周T2DM合并NAFLD的病变发展后,模型组大鼠肝脏HE染色及油红O染色切片显示,肝脏组织具有大量的脂质沉积以及更多的炎症细胞。肝组织的Western blot和RT-qPCR结果显示,PPARγ、SREBP-1以及ACC表达显著升高。
3.2 S-Equol通过抑制SREBP通路分子和PPARγ的表达延缓NAFLD的进展通过12周的S-Equol干预,各个干预组大鼠的糖脂代谢水平,肝脏中脂质累积、炎症水平都有不同程度的改善。结果表明,S-Equol可以改善大鼠胰岛素的分泌状态和胰岛素抵抗水平,但是对空腹血糖的降低有限,同时降低血清甘油三酯和胆固醇水平的能力不显著,这说明S-Equol对T2DM并发的NAFLD的进程干预并不是直接通过降低血糖和胰岛素分泌来实现的。在观察到各干预组大鼠肝脏的HE染色和油红O染色的病理表现均显著改善后,推测S-Equol是通过改善肝脏脂代谢中脂质积累的环节,来抑制肝脏脂肪变性。通过Western blot和RT-qPCR对目标分子相对表达量的检测,中高剂量S-Equol显著抑制SREBP-1、ACC、Fasn以及PPARγ的转录与表达。这表明S-Equol是通过抑制SREBP通路的分子以及PPARγ的转录与表达,来抑制肝脏的脂质积累,改善肝脏的脂质蓄积,进而延缓NAFLD的进程。
3.3 S-Equol降低T2DM合并NAFLD大鼠肝组织炎症水平NASH是NAFLD的进一步的病变,其特征是脂肪变性、肝细胞气球样变性和炎症变化,NASH会进展为肝纤维化,严重的纤维化可进展为肝细胞癌,控制NAFLD向NASH的进展,也是调控NAFLD肝脏炎症水平,延缓疾病进程的关键环节。基于既往研究中S-Equol具有拮抗神经系统炎症以及通过改善肠道菌群抑制炎症发展的作用[16-18]。在本实验中,S-Equol显著降低了肝组织中的IL-1β、IL-6以及TNF-α表达水平(P < 0.05),这与HE染色结果中炎症细胞的减少现象相印证,但S-Equol的干预并不能使炎症水平恢复到对照组水平,可能存在原因有:第一,S-Equol可以显著的降低肝脏的脂质积累,但是降低T2DM合并NAFLD大鼠肝脏炎症水平能力较弱;第二,S-Equol是通过降低脂质积累水平,间接降低炎症水平,所以经过中低剂量S-Equol的干预后,大鼠肝脏组织仍有较高水平的脂质累积,炎症状态仍然持续存在。而S-Equol是通过改善脂质积累还是通过其他分子通路改善炎症水平,其中机制有待下一步的研究。
综上所述,本研究发现了大豆异黄酮的肠道代谢产物S-Equol对T2DM合并NAFLD大鼠模型的肝脏保护效应,且SREBP通路的以及PPARγ分子可能在S-Equol改善肝脏脂质累积和降低肝脏炎症水平效应中发挥作用,这对于S-Equol在肝脏代谢性疾病的应用及T2DM人群的膳食指导具有重要意义。
本研究还存在一定的局限性:第一,S-Equol发挥肝功能保护效应并不显著,尤其是不同剂量S-Equol干预组间肝脏保护作用发挥并无剂量依赖的规律可循,S-Equol的最适宜用量仍需探究;第二,仍需通过体外实验详细论证S-Equol对肝脏脂质代谢和炎症水平的调控效应机制,尤其是S-Equol是否需要通过雌激素受体介导,这些需要在后续研究中进一步深入探索。
本研究聚焦于S-Equol对T2DM合并NAFLD这一常见代谢性疾病模型的病理改变、肝组织炎症水平和脂质积累相关分子表达的调节作用,为该疾病的治疗和延缓疾病进程提供了新的思路,为植物性雌激素在该疾病的应用提供实验依据。
| [1] |
YOUNOSSI Z M, GOLABI P, DE AVILA L, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: a systematic review and meta-analysis[J]. J Hepatol, 2019, 71(4): 793-801. |
| [2] |
WILLIAMS R, KARURANGA S, MALANDA B, et al. Global and regional estimates and projections of diabetes-related health expenditure: results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Res Clin Pract, 2020, 162: 108072. |
| [3] |
MANTOVANI A, PETRACCA G, BEATRICE G, et al. Non-alcoholic fatty liver disease and risk of incident diabetes mellitus: an updated meta-analysis of 501 022 adult individuals[J]. Gut, 2021, 70(5): 962-969. |
| [4] |
TARGHER G, COREY K E, BYRNE C D, et al. The complex link between NAFLD and type 2 diabetes mellitus-mechanisms and treatments[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(9): 599-612. |
| [5] |
SCHWEN R J, NGUYEN L, JACKSON R L. Elucidation of the metabolic pathway of S-equol in rat, monkey and man[J]. Food Chem Toxicol, 2012, 50(6): 2074-2083. |
| [6] |
DONG H L, TANG X Y, DENG Y Y, et al. Urinary equol, but not daidzein and genistein, was inversely associated with the risk of type 2 diabetes in Chinese adults[J]. Eur J Nutr, 2020, 59(2): 719-728. |
| [7] |
WANG J, XU J, WANG B, et al. Equol promotes rat osteoblast proliferation and differentiation through activating estrogen receptor[J]. Genet Mol Res, 2014, 13(3): 5055-5063. |
| [8] |
王丽, 陈卡, 刘凯, 等. S-雌马酚改善高糖培养条件下INS-1细胞胰岛素分泌功能的研究[J]. 第三军医大学学报, 2015, 37(5): 386-391. WANG L, CHEN K, LIU K, et al. S-equol ameliorates insulin secretion of INS-1 cells cultured in high glucose[J]. J Third Mil Med Univ, 2015, 37(5): 386-391. |
| [9] |
AKAHANE T, KAYA D, NOGUCHI R, et al. Association between equol production status and nonalcoholic steatohepatitis[J]. Int J Mol Sci, 2021, 22(21): 11904. |
| [10] |
舒芙蓉, 秦玉, 曾媛, 等. 大豆甙元对超重并肥胖人群的干预效应[J]. 重庆医学, 2014, 43(17): 2116-2118. SHU F R, QIN Y, ZENG Y, et al. Intervention effects of daidzein on overweight and obesity population[J]. Chongqing Med, 2014, 43(17): 2116-2118. |
| [11] |
AKAHANE T, KAYA D, NOGUCHI R, et al. Association between equol production status and nonalcoholic steatohepatitis[J]. Int J Mol Sci, 2021, 22(21): 11904. |
| [12] |
SETCHELL K D, CLERICI C, LEPHART E D, et al. S-equol, a potent ligand for estrogen receptor beta, is the exclusive enantiomeric form of the soy isoflavone metabolite produced by human intestinal bacterial flora[J]. Am J Clin Nutr, 2005, 81(5): 1072-1079. |
| [13] |
SETCHELL K D R, FAUGHNAN M S, AVADES T, et al. Comparing the pharmacokinetics of daidzein and genistein with the use of 13C-labeled tracers in premenopausal women[J]. Am J Clin Nutr, 2003, 77(2): 411-419. |
| [14] |
INOUE M, OHTAKE T, MOTOMURA W, et al. Increased expression of PPAR gamma in high fat diet-induced liver steatosis in mice[J]. Biochem Biophys Res Commun, 2005, 336(1): 215-222. |
| [15] |
PETTINELLI P, VIDELA L A. Up-regulation of PPAR-gamma mRNA expression in the liver of obese patients: an additional reinforcing lipogenic mechanism to SREBP-1c induction[J]. J Clin Endocrinol Metab, 2011, 96(5): 1424-1430. |
| [16] |
DI CAGNO R, MAZZACANE F, RIZZELLO C G, et al. Synthesis of isoflavone aglycones and equol in soy milks fermented by food-related lactic acid bacteria and their effect on human intestinal Caco-2 cells[J]. J Agric Food Chem, 2010, 58(19): 10338-10346. |
| [17] |
LU C, GAO R J, ZHANG Y Y, et al. S-equol, a metabolite of dietary soy isoflavones, alleviates lipopolysaccharide-induced depressive-like behavior in mice by inhibiting neuroinflammation and enhancing synaptic plasticity[J]. Food Funct, 2021, 12(13): 5770-5778. |
| [18] |
SONG B C, LI P, YAN S J, et al. Effects of dietary astragalus polysaccharide supplementation on the Th17/treg balance and the gut microbiota of broiler chickens challenged with necrotic enteritis[J]. Front Immunol, 2022, 13: 781934. |




