腹膜透析(peritoneal dialysis,PD)是终末期肾脏病(end-stage renal disease,ESRD)患者主要的肾脏替代治疗方式之一[1]。腹膜透析相关性腹膜炎(peritoneal dialysis associated peritonitis, PDAP)是PD患者常见的严重并发症。单次发作的重症PDAP或多次发作的PDAP常导致腹膜超滤能力及毒素清除能力下降,是腹膜透析技术失败的最常见原因[2-3],是接近15% 的PD患者死亡的直接或主要原因[3]。PDAP经验性抗感染治疗必须涵盖革兰氏阳性菌和革兰氏阴性菌,2016年国际腹膜透析协会建议每个腹膜透析中心经验性治疗方案应当根据当地致病菌谱及抗菌药物敏感性资料来综合制定[4]。国外已有研究报道,PDAP致病菌谱和抗生素药物敏感性也随着时代的不同在不断发生变化[5]。因此,本研究拟分析陆军特色医学中心肾内科近14年不同时间段的PD患者发生PDAP致病菌谱变化趋势及初始治疗耐药情况的变化趋势,为后续临床PDAP患者制定经验性抗生素治疗方案提供可靠的理论依据。
1 资料与方法 1.1 伦理资料本研究为回顾性队列分析,得到了陆军特色医学中心伦理委员会批准,伦理号为医研伦理(2021)第321号。
1.2 一般资料本研究回顾性分析了近14年(2007年1月1日至2020年12月31日)在陆军特色医学中心肾内科进行PD治疗的873位患者的临床资料,所有腹膜透析导管采用标准双cuff卷曲型Tenckhoff管。所有患者术前应用第一代头孢菌素作为预防用药,没有例行筛查金黄色葡萄球菌的鼻腔定植。在放置Tenckhoff导管后立即开始培训。手术创面护理由患者或护理人员用碘伏和生理盐水定期消毒、清洁换药、敷料覆盖。伤口护理没有常规外用莫匹罗星或庆大霉素乳膏或软膏。当患者告知有腹膜炎相关症状时,如透析液混浊、腹痛或发热,则收集患者腹膜透析液,立即完善腹水常规检查、腹水细菌涂片及腹水培养检查。
1.3 方法本研究分析了873位PD患者的临床资料,其中352位患者发生过PDAP。根据腹膜炎发生时间分为时间段1(period 1,P1):2007年1月1日至2012年12月31日、时间段2(period 2,P2):2013年1月1日至2016年12月31日、时间段3(period 2,P3):2017年1月1日至2020年12月31日,然后比较不同时间段致病菌的变化趋势以及对初始治疗耐药的情况。
PDAP的诊断需要以下符合以下三点的任意一项:(1)与腹膜炎一致的临床特征,即腹痛或透析液混浊,伴或不伴发热;(2) 透析流出液白细胞计数>100×106/L(腹透液存腹时间至少2 h),中性粒细胞比例>50%;(3)透析液培养有病原微生物生长[4]。
PDAP的治疗:根据2016年国际腹膜透析协会指南建议,经验性抗生素治疗方案常选择一代头孢(头孢唑啉)1 g/d和三代头孢(头孢他啶等)1 g/d,覆盖了革兰氏阳性和革兰氏阴性菌。间断腹腔内加药(每天夜间留腹一次),待有培养和药敏结果后,立即根据药敏调整抗生素治疗方案。
1.4 统计学分析采用SPSS 26.0软件进行统计学分析。计量资料以x±s表示,组间比较用单因素方差分析;计数资料以率(%)表示,组间比较采用卡方检验。P < 0.05提示差异有统计学意义。
2 结果 2.1 所有患者的一般基线资料本研究回顾性分析了近14年(2007年1月1日至2020年12月31日)在陆军特色医学中心肾内科进行PD治疗的873位患者的临床资料,其中352位患者累次发生PDAP 637次。发生PDAP患者男性219例(62.2%),女性113例(37.8%),平均年龄47.9±14.9岁,中位透析龄24个月,总体腹膜炎发生率为0.28次/年,显著低于2016年国际腹膜透析协会指南规定的0.5次/年[4]。原发病包括:慢性肾小球肾炎204例(58%),糖尿病肾病52例(14.8%),高血压肾损害13例(3.7%),其他原因不明83例(23.6%)。文化程度包括:小学及以下85例(24.1%),初中132例(37.5%),高中68例(19.3%),大专40例(11.4%),本科及以上27例(7.7%)。PDAP总治愈率74.6%, 拔管率24.2%, 其中PDAP导致的死亡患者有8例,占1.3%。
2.2 导致腹膜炎的致病菌分布情况及变化趋势由图 1可看出,P1阶段: 50位患者,发生腹膜炎76例次,腹膜炎发生率为0.51次/年,P2阶段:150位患者,发生腹膜炎246例次,腹膜炎发生率为0.38次/年,P3阶段: 200位患者,发生腹膜炎315例次,腹膜炎发生率为0.22次/年,随着时间推移,腹膜炎发生率呈下降趋势,且下降幅度较大,显著低于2016年国际腹膜透析协会规定的0.5次/年[4]。P1阶段革兰染色阳性菌与阴性细菌导致的腹膜炎发生率大致相当,但到P2和P3阶段,导致PDAP的致病菌逐渐演变为以革兰染色阳性细菌为主。P1、P2、P3三个阶段腹水培养阴性的比率分别为23.7%、26.8%、23.8%,无显著统计学差异。从P1到P3阶段,金黄色葡萄球菌出现频率逐渐增加,P3阶段构成比例显著高于P1阶段(P < 0.05);溶血葡萄球菌、缓症链球菌、唾液链球菌各个时间段出现的构成比虽无统计学差异,但有增加趋势。而革兰氏染色阴性菌中,大肠埃希氏菌出现频率逐渐减少,P3阶段构成比显著低于P1阶段(P < 0.05);木糖产气碱杆菌从P2阶段开始出现,P3阶段又呈减少趋势,P3阶段其构成比显著低于P2阶段(P < 0.05);嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia,SM)从P2阶段开始出现,呈增多趋势,P3阶段构成比显著高于P1和P2阶段(P < 0.05);随着时间推移,真菌构成比也呈减少趋势,P2、P3阶段显著低于P1阶段(P < 0.05), 但P2和P3阶段无统计学差异(表 1)。
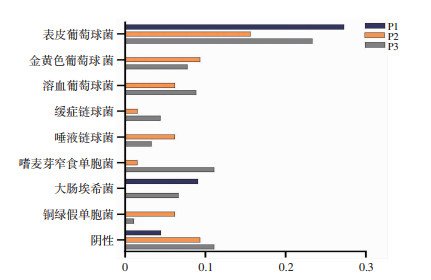
|
| 图 1 不同时间段对初始治疗耐药的细菌分布情况 |
| 细菌分布 | P1 | P2 | P3 |
| G+菌 | 25(33.0) | 91(34.0) | 137(43.5) |
| 表皮葡萄球菌 | 12(15.8) | 38(15.4) | 44(14) |
| 金黄色葡萄球菌 | 1(1.3) | 9(3.7) | 21(6.7)b |
| 溶血葡萄球菌 | 3(3.9) | 7(2.8) | 17(5.4) |
| 头状葡萄球菌 | 0 | 6(2.4) | 2(0.6) |
| 沃式葡萄球菌 | 0 | 7(2.8) | 3(0.9) |
| 唾液链球菌 | 0 | 5(2.0) | 7(2.2) |
| 缓症链球菌 | 0 | 2(0.8) | 7(2.2) |
| 其他 | 9(11.8) | 17(6.9) | 31(9.8) |
| G-菌 | 23(30.3) | 70(28.5) | 65(20.6) |
| 大肠埃希氏菌 | 10(13.2) | 26(10.6) | 18(5.7)b |
| 铜绿假单胞菌 | 3(3.9) | 5(2.0) | 5(1.6) |
| 阴沟肠杆菌 | 2(2.6) | 5(2.0) | 5(1.6) |
| 肺炎克雷伯菌 | 0 | 4(1.6) | 5(1.6) |
| 鲍曼不动杆菌 | 0 | 3(1.2) | 0 |
| 木糖产气碱杆菌 | 0 | 7(2.8) | 1(0.3)a |
| 鲍曼不动杆菌 | 0 | 3(1.2) | 0 |
| 嗜麦芽窄食单胞菌 | 0 | 1(0.4) | 10(3.2)ab |
| 其他 | 8(10.5) | 17(6.9) | 21(6.7) |
| 真菌 | 8(10.5) | 7(2.8)c | 11(3.5)b |
| 近平滑念珠菌 | 2(2.6) | 0 | 4(1.2) |
| 酵母样真菌 | 2(2.6) | 1(0.4) | 1(0.3) |
| 光滑念珠菌 | 2(2.6) | 0 | 0 |
| 黑曲霉菌 | 1(1.3) | 1(0.4) | 3(0.9) |
| 其他 | 1(1.3) | 8(3.2) | 3(0.9) |
| 混合 | 2(2.6) | 12(4.9) | 27(8.6) |
| 阴性 | 18(23.7) | 66(26.8) | 74(23.5) |
| 分枝杆菌 | 0 | 0 | 1(0.3) |
| 合计 | 76 | 246 | 315 |
| 所有变量均以百分数表示(%);a:P < 0.05,与P2比较; b: P < 0.05,与P1比较; c: P < 0.05,与P1比较 | |||
2.3 对初始治疗耐药的菌株分布情况
由图 1可看出,各个时间段内,表皮葡萄球菌对初始治疗耐药比例最大。P2、P3阶段金黄色葡萄球菌、溶血葡萄球菌耐药比例高于P1阶段。SM是在P2、P3阶段新出现的细菌,对初始治疗均耐药,出现比例逐渐增加。在P1到P3阶段,对于腹水培养为阴性的患者,初始治疗方案耐药比例也逐渐增加。
2.4 不同时间段腹膜炎治疗的转归情况由表 2可看出,从P1到P3阶段,各时间段腹膜炎对初始治疗耐药的比例无显著统计学差异。但各时间段耐药组拔管率明显高于不耐药组(P < 0.05)。从P1到P3阶段,不耐药组拔管率也成逐渐增加,P1和P2阶段无统计学差异,P1和P3阶段相比具有统计学差异(P < 0.05)。P1和P2阶段存在因腹膜炎导致死亡的病例,但P3阶段无一例患者因腹膜炎死亡。各时间段腹膜炎治愈率无统计学差异。
| 阶段 | P1 | P2 | P3 | |||||
| 不耐药 | 耐药 | 不耐药 | 耐药 | 不耐药 | 耐药 | |||
| 转归情况 | 54(71.0) | 22(29) | 182(73.9) | 64(26.1) | 225(71.4) | 90(28.6) | ||
| 拔管 | 4(7.4) | 7(31.8)a | 31(17.0) | 23(35.9)a | 47(20.8)b | 41(45.5)a | ||
| 死亡 | 2(3.7) | 1(4.5) | 3(1.6) | 2(3.1) | 0 | 0 | ||
| 治愈 | 48(88.9) | 14(63.7) | 148(81.4) | 39(61) | 178(81.2) | 49(54.5) | ||
| a: P < 0.05,与不耐药组相比; b: P < 0.05,与P1阶段不耐药组相比 | ||||||||
3 讨论
本研究主要回顾了近14年在陆军特色医学中心肾内科行PD治疗、发生过PDAP患者的临床资料,分析了所有PDAP致病菌谱的变化趋势以及初始治疗耐药情况,发现随着时代的变化,经过临床医护患的共同努力,总体PDAP的发生率明显下降,且显著低于国际腹膜透析协会指南规定的0.5次/年[4]。同时导致PDAP的致病菌谱、对初始治疗耐药情况,包括PDAP的治疗转归情况也在不断发生变化。
3.1 导致腹膜炎的致病菌变化趋势及耐药情况本研究发现,在不同时间段,PD患者发生PDAP的致病菌仍以革兰氏染色阳性细菌为主,其中表皮葡萄球菌占比最高,而且表皮葡萄球菌在各个阶段的耐药占比也是最高。另外一种革兰氏染色阳性细菌: 金黄色葡萄球菌导致的PDAP也呈增加趋势,该细菌通常源于出口感染或隧道感染,接触污染也很常见。而PD换液等操作不规范是这部分PD患者感染的主要途径。有学者发现在启动PD治疗6个月后,绝大部分患者开始出现洗手不规范、忘带口罩等[6]。2016年国际腹膜透析协会指南也明确指出,无论是新导入还是已经长期透析的PD患者,PD换液等操作不规范是导致PDAP的独立危险因素[4]。因此对这一部分PD患者,PD再培训就显得尤其重要。RUSSO等[7]指出,对于年轻(小于55岁)、受教育程度较低以及处于PD治疗早期或晚期(小于18个月或超过36个月)的患者,进行PD操作再培训,对降低腹膜炎的发生率具有重要意义。因此,PD专职护士在给患者制定PD培训计划时,就应强调“再培训”对腹膜炎的预防的重要临床意义,而有文献指出,确定哪些患者需要再培训的最可靠方法可能是PD护士的家访[7]。定期检查患者的换液操作是否规范,提高PD换液者的操作水平,对减少因操作污染导致的PDAP具有重要的预防意义。
近14年陆军特色医学中心肾内科因革兰氏染色阴性菌导致的PDAP发生率呈下降趋势,与Zeng等[8]的结论刚好相反。但大肠埃希氏菌导致的PDAP占比最高,与既往文献报道相符[8-9]。不同地区金黄色葡萄球菌导致PDAP的变化趋势各不相同[10-12]。因此,在不同国家和地区PDAP致病菌谱变化趋势不同,不同腹膜透析中心应当根据当地致病菌普特征综合制定相应的治疗方案的理念。
随着时代的变化,嗜麦芽窄食单胞菌(SM)从P2阶段开始出现,呈明显增多趋势。SM是一种非发酵需氧的革兰氏染色阴性杆菌,由于其毒力低,很少感染健康人,对多种抗生素天然耐药的特性使得治疗变得十分困难。最早1997年,SZETO等[13]首次报道6例SM导致PDAP,发现所有患者药物治疗效果不佳,最终都需要拔除腹膜透析导管。但也有个案报道指出,经过积极有效治疗,SM导致的PDAP可以治愈[14]。SM最常见的诱发因素包括糖尿病、肿瘤、贫血、营养不良、中性粒细胞减少症、接受免疫抑制治疗或先前使用广谱抗生素治疗等[14-16]。其中糖尿病与SM导致的PDAP的相关性得到极大重视。来自韩国的一个病例系列报道发现,所有因SM导致的PDAP患者均合并有糖尿病[16],国外已有文献指出由糖尿病肾病导致的ESRD患者比例最高可达66%[17]。因此不难想象,因糖尿病肾病导致的ESRD最终接受PD治疗的患者比例会越来越高,当该部分患者反复发生PDAP,且治疗效果差的情况下,我们需高度警惕SM感染。SM对多种抗生素天然耐药,SM相关的PDAP预后通常很差,具有较高的死亡率和技术失败率,治疗极具挑战。对于接受PD治疗的患者,一旦考虑诊断SM感染,应立即调整抗生素治疗方案。
3.2 不同时间段腹膜炎治疗的转归通过分析各时间段PDAP治疗转归情况我们发现,初始治疗耐药的腹膜炎组拔管率明显高于不耐药组患者,这提示我们在临床诊疗过程中,一旦患者初始治疗耐药,应立即根据药敏更换抗生素,同时需警惕这类患者拔管风险更高,提前做好医患沟通。在P3阶段,无一例患者因腹膜炎死亡,主要是随着临床经验及知识的不断更新,一旦出现难治性腹膜炎、真菌性腹膜炎以及已知预后极差的致病菌导致的PDAP患者等立即拔管,这在极大程度上避免了因腹膜炎导致的死亡,也提示及时拔除腹透管对这部分患者预后的重要影响。
总之,PDAP是PD患者的严重并发症之一,与PD患者死亡率相关[18]。陆军特色医学中心肾内科近14年PDAP总体发生率呈逐渐下降趋势,显著低于国际指南要求的0.5次/年的标准。不同国家和地区,导致PDAP的致病菌谱以及对初始治疗耐药情况均有自己的变化规律,因此在制定PDAP初始治疗方案时,应主张“中心个体化”原则选择适当的抗生素治疗方案。
| [1] |
TEITELBAUM I. Peritoneal dialysis[J]. N Engl J Med, 2021, 385(19): 1786-1795. |
| [2] |
HTAY H, CHO Y, PASCOE E M, et al. Multicenter registry analysis of center characteristics associated with technique failure in patients on incident peritoneal dialysis[J]. Clin J Am Soc Nephrol, 2017, 12(7): 1090-1099. |
| [3] |
SZETO C C, LI P K. Peritoneal dialysis-associated peritonitis[J]. Clin J Am Soc Nephrol, 2019, 14(7): 1100-1105. |
| [4] |
LI P K, SZETO C C, PIRAINO B, et al. ISPD peritonitis recommendations: 2016 update on prevention and treatment[J]. Perit Dial Int, 2016, 36(5): 481-508. |
| [5] |
KITTERER D, LATUS J, PÖHLMANN C, et al. Microbiological surveillance of peritoneal dialysis associated peritonitis: antimicrobial susceptibility profiles of a referral center in GERMANY over 32 years[J]. PLoS One, 2015, 10(9): e0135969. |
| [6] |
DONG J, CHEN Y. Impact of the bag exchange procedure on risk of peritonitis[J]. Perit Dial Int, 2010, 30(4): 440-447. |
| [7] |
RUSSO R, MANILI L, TIRABOSCHI G, et al. Patient re-training in peritoneal dialysis: why and when it is needed[J]. Kidney Int Suppl, 2006(103): S127-S132. |
| [8] |
ZENG Y, JIANG L S, LU Y, et al. Peritoneal dialysis-related peritonitis caused by gram-negative organisms: ten-years experience in a single center[J]. Ren Fail, 2021, 43(1): 993-1003. |
| [9] |
FENG X R, YANG X, YI C Y, et al. Escherichia coli Peritonitis in peritoneal dialysis: the prevalence, antibiotic resistance and clinical outcomes in a South China dialysis center[J]. Perit Dial Int, 2014, 34(3): 308-316. |
| [10] |
佟怡婧, 严豪, 李振元, 等. 711例次腹膜透析相关性腹膜炎的致病菌谱变化及药物敏感分析[J]. 中华肾脏病杂志, 2017, 33(8): 601-608. TONG Y J, YAN H, LI Z Y, et al. Analysis of microbiological trends and antibiotic susceptibility in 711 episodes of peritoneal dialysis-related peritonitis[J]. Chin J Nephrology, 2017, 33(8): 601-608. |
| [11] |
KIM D K, YOO T H, RYU D R, et al. Changes in causative organisms and their antimicrobial susceptibilities in CAPD peritonitis: a single center' s experience over one decade[J]. Perit Dial Int, 2004, 24(5): 424-432. |
| [12] |
KAVANAGH D, PRESCOTT G J, MACTIER R A. Peritoneal dialysis-associated peritonitis in Scotland (1999-2002)[J]. Nephrol Dial Transplant, 2004, 19(10): 2584-2591. |
| [13] |
SZETO C C, LI P K, LEUNG C B, et al. Xanthomonas maltophilia peritonitis in uremic patients receiving continuous ambulatory peritoneal dialysis[J]. Am J Kidney Dis, 1997, 29(1): 91-95. |
| [14] |
AZAK A, KOCAK G, HUDDAM B, et al. An unusual cause of continuous ambulatory peritoneal dialysis-associated outpatient peritonitis: Stenotrophomonas maltophilia[J]. Am J Infect Control, 2011, 39(7): 618. |
| [15] |
DENTON M, KERR K G. Microbiological and clinical aspects of infection associated with Stenotrophomonas maltophilia[J]. Clin Microbiol Rev, 1998, 11(1): 57-80. |
| [16] |
BAEK J E, JUNG E Y, KIM H J, et al. Stenotrophomonas maltophilia infection in patients receiving continuous ambulatory peritoneal dialysis[J]. Korean J Intern Med, 2004, 19(2): 104-108. |
| [17] |
LI P K, CHOW K M, VAN DE LUIJTGAARDEN M W, et al. Changes in the worldwide epidemiology of peritoneal dialysis[J]. Nat Rev Nephrol, 2017, 13(2): 90-103. |
| [18] |
BOUDVILLE N, KEMP A, CLAYTON P, et al. Recent peritonitis associates with mortality among patients treated with peritoneal dialysis[J]. J Am Soc Nephrol, 2012, 23(8): 1398-1405. |




