2. 400030 重庆, 重庆大学附属肿瘤医院健康体检与肿瘤筛查中心
2. Health Examination and Oncology Screening Center, Chongqing University Cancer Hospital, Chongqing, 400030, China
肺癌患者易发生静脉血栓事件(venous thromboembolism event,VTE)[1],化疗、抗血管生成药物等治疗因素会增加VTE的发生[2-3]。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是治疗肺癌的新选择,它们通过靶向程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)或其配体(programmed cell death protein ligand 1,PD-L1)来削弱肿瘤免疫逃逸,显著改善肺癌患者的预后。目前,关于ICIs治疗是否增加VTE尚有争议。在ICIs获批的临床试验中,血栓形成并不是常见的不良事件,发生率≤5%[4]。在一项荟萃分析中,接受ICIs治疗的癌症患者的VTE发生率为2.7%,与单纯化疗相比,ICIs治疗并未增加VTE[5]。在另一项评估ICIs治疗的黑色素瘤和非小细胞肺癌患者VTE发生率的荟萃分析中显示,ICIs治疗相关的VTE不可忽视[6]。在一项纳入1 686例因各种恶性肿瘤接受免疫治疗的回顾性队列研究中,有404例(24%)患者在免疫治疗期间发生VTE,且VTE与总生存期降低相关(HR=1.22,95%CI: 1.06~1.41, P<0.008)[7]。总结多项回顾性研究数据表明,ICIs治疗相关的VTE发生率在2.6%~30.3%[8]。
ICIs联合化疗是晚期小细胞肺癌和驱动基因阴性的晚期非小细胞肺癌的一线治疗选择,ICIs治疗晚期肺癌后发生VTE的危险因素及其对患者预后的影响尚不清楚。因此,本研究旨在分析接受ICIs治疗的晚期肺癌患者发生VTE的频率、危险因素及VTE对预后的影响。
1 资料与方法 1.1 研究对象筛选2018年6月至2021年10月在重庆大学附属肿瘤医院肿瘤内科接受ICIs治疗的晚期肺癌患者403例。纳入标准:①病理诊断为肺癌且有1个以上器官转移;②接受过1次以上的ICIs治疗。排除标准:①开始使用ICIs时或之前即存在深静脉血栓(deep vein thrombosis,DVT)或肺动脉栓塞(pulmonary embolism,PE);②无评估深静脉血栓的影像学检查记录。
1.2 研究方法ICIs治疗相关VTE的定义:自第1剂ICIs治疗后,截至观察时间,由彩超或CT检查诊断的DVT或PE。将纳入的病例分为VTE组(n=31)和非VTE组(n=289)。收集患者以下信息:①基线资料:年龄、性别、病理类型、合并症、吸烟史,第1剂ICIs治疗入院时的BMI、东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、Caprini评分、Khorana评分;②治疗情况:免疫检查点抑制剂、免疫治疗线数、抗血管生成药物治疗史、免疫联合化疗、无进展生存时间(progression-free survival time,PFS)、免疫相关不良事件(immune-related adverse events,irAE)等;③实验室指标:第1剂ICIs治疗前的最后一次血常规、D-二聚体、炎症因子等。
PFS是指在免疫治疗的第1个周期之前,从最近的CT或PET-CT扫描到肿瘤进展、死亡或最后随访的时间。在整个研究过程中观察器官特异性免疫相关不良事件(皮肤: 皮疹和瘙痒, 心脏: 心肌炎, 内分泌: 垂体和甲状腺炎, 呼吸道: 肺炎),直到最后一个周期结束后至少1个月,按照美国国立癌症研究所不良事件通用术语标准第4版进行评估。本研究获得重庆大学附属肿瘤医院伦理委员会批准(CZLS2022125-A)。
1.3 统计学分析采用GraphPad Prism 7.0和SPSS 20.0统计学软件进行分析,对两组数据进行单因素组间差异比较,符合正态分布的计量资料以x±s表示,组间比较采用成组t检验,非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料以频数和百分率表示,采用χ2检验或Fisher精确概率法。采用二元Logistic回归分析独立预测因素。采用Kaplan-Meier法绘制PFS曲线,并采用Wilcoxon检验进行组间比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 基线资料共入选320例患者,年龄(58.89±8.72)岁,其中男性260例,女性60例。共发生VTE 31例,VTE发生率为9.69%,其中下肢深静脉血栓22例,颈内静脉血栓5例,肺动脉栓塞8例(4例合并下肢深静脉血栓、1例合并颈内静脉血栓),左上肢深静脉血栓2例(1例合并下肢深静脉血栓)。15例在免疫治疗开始后的3个月内发生,6例在3~6个月发生,5例在>6~12个月发生,5例在12个月以后发生。
2.2 单因素分析单因素分析发现VTE组与非VTE组的年龄、糖尿病、Caprini评分≥5分占比、D-二聚体≥0.5 mg/L占比、IL-8、IL-6、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)水平差异均具有统计学意义(P < 0.05)。两组的性别、BMI、吸烟史、ECOG评分、Khorana评分、查尔森共病评分、肺癌病理类型、免疫治疗线数、免疫检查点抑制剂、抗血管生成药物治疗史、免疫联合化疗占比、白细胞计数、血红蛋白、血小板计数、淋巴细胞与中性粒细胞比值、白介素2受体、免疫相关不良反应发生率及免疫相关不良反应的器官分布均无统计学差异。见表 1。
| 指标 | VTE组(n=31) | 非VTE组(n=289) | t/χ2 | P |
| 男性 | 27(87.1) | 233(80.6) | - | 0.474 |
| 年龄/岁 | 61.84±9.36 | 58.57±8.61 | -1.991 | 0.047 |
| BMI/kg·m-2 | 22.98±2.44 | 23.05±3.09 | 0.126 | 0.900 |
| ECOG评分 | - | 0.264 | ||
| 0~1分 | 30(96.8) | 287(99.3) | ||
| ≥2分 | 1(3.2) | 2(0.7) | ||
| 免疫治疗线数 | 0.610 | 0.435 | ||
| 1线 | 21(67.7) | 175(60.6) | ||
| ≥2线 | 10(32.3) | 114(39.4) | ||
| 肺癌分型 | 3.609 | 0.429 | ||
| 腺癌 | 18(58.0) | 157(54.4) | ||
| 鳞癌 | 10(32.3) | 100(34.6) | ||
| 小细胞癌 | 2(6.5) | 27(9.3) | ||
| 淋巴上皮瘤样癌 | 1(3.2) | 1(0.3) | ||
| 大细胞癌 | 0 | 4(1.4) | ||
| 免疫检查点抑制剂 | 12.026 | 0.081 | ||
| 卡瑞利珠单抗 | 20(64.5) | 194(68.1) | ||
| 帕博利珠单抗 | 6(19.4) | 30(10.3) | ||
| 信迪利单抗 | 0 | 27(9.3) | ||
| 度伐利尤单抗 | 3(9.7) | 6(2.1) | ||
| 替雷利珠单抗 | 2(6.4) | 18(6.1) | ||
| 阿替利珠单抗 | 0 | 12(4.2) | ||
| 特瑞普利单抗 | 0 | 1(0.3) | ||
| 纳武利尤单抗 | 0 | 1(0.3) | ||
| 抗血管生成药物治疗史(贝伐珠单抗/安罗替尼/阿帕替尼/恩度) | 7(22.6) | 57(19.7) | 0.143 | 0.705 |
| 免疫联合化疗 | 29(93.5) | 261(90.3) | 0.345 | 0.557 |
| 查尔森共病评分a≥1分 | 13(41.9) | 81(28.4) | 2.467 | 0.116 |
| 吸烟 | 19(61.3) | 170(58.8) | 0.070 | 0.791 |
| Khorana评分≥3分 | 1(3.2) | 22(7.6) | - | 0.711 |
| Caprini评分≥5分 | 14(45.2) | 52(18.0) | 12.623 | < 0.001 |
| 糖尿病 | 8(25.8) | 31(10.7) | 5.949 | 0.022 |
| 白细胞/109 ·L-1 | 7.31±3.24 | 7.12±3.17 | -0.319 | 0.750 |
| 淋巴细胞/中性粒细胞 | 0.36±0.29 | 0.34±0.21 | -0.399 | 0.690 |
| 血小板/109·L-1 | 229.65±83.97 | 250.15±107.22 | 1.031 | 0.303 |
| 血红蛋白/ g·L-1 | 126.23±19.30 | 125.07±18.24 | -0.335 | 0.738 |
| D-二聚体≥0.5 mg/L | 21(67.7) | 135(46.7) | 4.955 | 0.020 |
| 同型半胱氨酸/μmol·L-1 | 17.20±5.52 | 14.46±6.71 | -2.192 | 0.029 |
| IL-6/ pg·mL-1 | 12.10(9.55,12.80) | 6.14(5.37,7.79) | -4.295 | < 0.001 |
| IL-8/pg·mL-1 | 94.00(29.00,189.00) | 21.40(15.30,38.80) | -4.461 | < 0.001 |
| TNF-α/ pg·mL-1 | 16.01±6.61 | 11.37±5.53 | 4.353 | < 0.001 |
| IL-2受体/ U·mL-1 | 743.87±387.22 | 616.27±339.72 | 1.960 | 0.051 |
| 免疫相关不良反应 | 3.502 | 0.161 | ||
| 无 | 24(77.4) | 234(81.0) | ||
| 1级不良反应 | 2(6.5) | 35(12.1) | ||
| ≥2级不良反应 | 5(16.1) | 20(6.9) | ||
| 免疫相关不良反应 | 9.418 | 0.075 | ||
| 无 | 24(77.4) | 234(81.0) | ||
| 肺炎 | 6(19.4) | 14(4.8) | ||
| 甲状腺炎 | 1(3.2) | 30(10.4) | ||
| 皮炎 | 0 | 7(2.4) | ||
| 垂体炎 | 0 | 3(1.0) | ||
| 心肌炎 | 0 | 1(0.4) | ||
| a:查尔森共病评分标准为心肌梗死1分,心力衰竭1分,周围血管病1分,脑血管病1分,痴呆1分,慢性肺部疾病1分,结缔组织病1分,溃疡病1分,轻度肝脏疾病1分,糖尿病1分,有并发症的糖尿病2分,偏瘫2分,慢性肾病2分,白血病2分,恶性淋巴瘤2分,恶性肿瘤未转移2分,中至重度肝脏疾病3分,恶性肿瘤并转移6分,获得性免疫缺陷综合征6分 | ||||
2.3 二元Logistic回归分析
将既往报道与VTE相关,并且在单因素分析中差异有统计学意义的变量作为二元Logistic回归分析的协变量,包括年龄、糖尿病、Caprini评分≥5分、D-二聚体≥0.5 mg/L、TNF-α,分析得到VTE的独立危险因素:Caprini评分≥5分、糖尿病和TNF-α。将TNF-α转化为分类变量以适用于临床应用,采用ROC曲线得到TNF-α的最佳截断值为12.8 pg/mL(AUC:0.766,灵敏度:0.806,1-特异度:0.211)。将TNF-α >12.8 pg/mL也作为二元Logistic回归分析的协变量,最终得到VTE的独立危险因素:Caprini评分≥5分(OR=4.236,95%CI: 1.754~10.231,P=0.001)、糖尿病(OR=2.801,95%CI: 1.008~7.784,P=0.048)、TNF-α >12.8 pg/mL(OR=14.178,95%CI: 5.588~35.973,P < 0.001)。见表 2。
| 变量 | B | OR | 95%CI | P |
| Caprini评分≥5分 | 1.444 | 4.236 | 1.754~10.231 | 0.001 |
| 糖尿病 | 1.030 | 2.801 | 1.008~7.784 | 0.048 |
| TNF-α >12.8 pg/mL | 2.652 | 14.178 | 5.588~35.973 | < 0.001 |
| 常数 | -4.161 | 0.016 |
2.4 预后分析
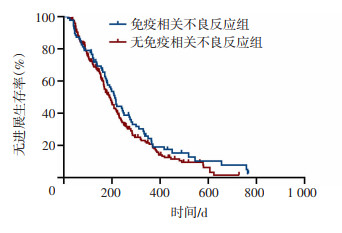
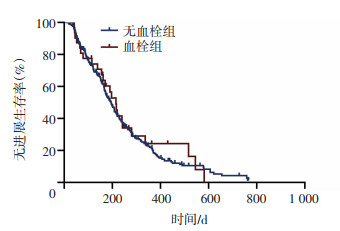
Kaplan-Meier分析结果显示,AE组中位PFS为212.0(95%CI: 166.3~257.7) d,与非AE组[190.0(95%CI: 167.7~212.3) d]比较差异无统计学意义(P=0.420,图 1)。单独分析VTE对预后的影响,发现VTE组的中位PFS为215.0(95%CI: 177.3~252.8)d,与非VTE组[195.0(95%CI: 175.4~214.6) d]比较差异无统计学意义(P=0.726,图 2)。
|
| 图 1 Kaplan-Meier分析免疫相关不良反应组与无免疫相关不良反应组的无进展生存时间 |
|
| 图 2 Kaplan-Meier分析血栓组与无血栓组的无进展生存时间 |
3 讨论
ICIs自应用于临床以来,已显著改善了晚期肺癌患者的预后,但其不良反应不容忽视。VTE是一种既往未被充分认识且重要的irAE[7]。既往研究显示,irAE与ICIs治疗的疗效提高相关[9]。本研究发现,晚期肺癌患者经ICIs治疗后的VTE发生率为9.69%,与既往研究相似[8]。有48.4%的VTE发生在ICIs开始治疗后的3个月内,且67.7%的VTE患者接受ICIs作为一线治疗,因此推测,在存在血栓形成风险的患者中,ICIs可能直接增加VTE的发生风险。在31例VTE患者中,有8例(25.8%)发生肺动脉栓塞,应充分重视ICIs相关的VTE风险。
3.1 TNF-α升高增加VTE的发生ICIs影响血栓形成的机制目前尚不清楚。一种可能的机制是活化的T细胞诱导组织因子(tissue factor,TF)产生增加以刺激促凝血活性[10]。TF主要来源于单核细胞,是一种跨膜细胞表面糖蛋白,可触发外源性凝血级联反应[11],T细胞活化会诱导PD-L1阳性单核细胞中TF的表达,因此,ICIs激活的T细胞可能会在单核细胞中诱导大量TF产生导致凝血功能紊乱[10]。此外,阻断免疫检查点与炎症细胞因子水平升高有关,推测这种炎症激活状态可能是引发高凝状态的机制之一[12]。既往研究显示阻断PD-L1可促进TNF-α的表达[13]。本研究显示,TNF-α >12.8 pg/mL是VTE的独立危险因素。也有研究报道TNF-α促进VTE发生,其机制主要是通过抑制蛋白C系统[14],以及通过NF-kB通路增加组织因子的产生[15]。
3.2 Caprini评分≥5分与的VTE发生率高Caprini评分是预测静脉血栓的常用风险评估模型之一,包含39个风险变量,Caprini评分≥5分与为VTE高风险,本研究以此为截断值,发现Caprini评分≥5分是VTE的独立危险因素。本研究中VTE组的Caprini评分更高,可能与VTE组的高同型半胱氨酸血症患者占比更多有关。同型半胱氨酸是Caprini评分风险变量之一,是一种来源于蛋氨酸的中间体含巯基氨基酸,可以调节血凝块收缩,其水平升高与血栓风险增加有关[16]。Khorana评分是针对门诊癌症患者开发的VTE风险评估模型,仅包括5个风险变量,如治疗前血液学结果、BMI和癌症部位等,可简便快捷的应用。Khorana评分≥3分为VTE高风险,本研究以此为临界值,发现VTE组Khorana评分≥3分的占比与非VTE组差异无统计学意义,分析其中的原因可能是本研究对象均为肺癌,且大部分为一线治疗,收集的数据也是在第1剂ICIs治疗前,而血液学指标异常多在数次化疗之后,此外,由于亚洲患者的BMI通常低于35 kg/m2,因而两组Khorana评分差异不显著。因此,虽然Khorana评分更简单,指标更客观,但其可能不适合亚洲人群。此外,在识别住院癌症患者的VTE风险方面,Caprini评分优于Khorana评分[17]。
3.3 糖尿病增加VTE风险本研究发现VTE组中合并糖尿病的患者显著多于非VTE组,进一步应用二元Logistic回归分析显示糖尿病是发生VTE的独立危险因素。糖尿病为公认的动脉血栓栓塞的危险因素,但其是否增加VTE的发生尚存在争议[18-19]。既往研究显示,血糖升高可增加氧化应激,进而增加凝血因子的基因转录;同时降解内皮壁的糖萼层,释放凝血因子,刺激凝血级联反应;增加参与凝血和纤维蛋白溶解的蛋白质的糖基化,将它们的活性转变为促凝血状态[20]。一项近期的荟萃分析显示ICIs引起高血糖发生率为0.2%~4.9%[21],其机制是胰腺β细胞的自身免疫性破坏和内源性胰岛素释放的丧失[22]。鉴于ICIs对炎症激活以及对血糖波动的影响,推测这种叠加效应促进了糖尿病患者的VTE发生。因此,预防性的抗凝治疗和严格的血糖控制对这类患者可能是必要的。
3.4 VTE与PFS的关系关于ICIs相关性血栓对患者生存的影响,有研究显示血栓形成与生存恶化相关[7],但也有研究得出不同结论[23]。本研究采用PFS评估VTE对预后的影响,发现VTE组的中位PFS与非VTE组差异无统计学意义,说明发生VTE不影响患者的生活质量,至于是否影响总生存时间,需对后续的随访数据做进一步分析才能明确。研究报道,VTE与ICIs治疗的非小细胞肺癌的PFS及总生存时间无关[24]。研究显示irAE与ICIs治疗的疗效提高相关[9],新的研究证据表明VTE也是一种irAE[7]。本研究将VTE与其他器官发生的AE共同作为irAE,结果发现irAE组与非irAE组的中位PFS差异无统计学意义。尽管多项研究显示irAE与ICIs治疗的有效率及生存时间增加相关[9, 25],但这种关联并不紧密,仍存在一定争议[26],总生存时间和PFS仍取决于癌症类型、分期和患者特征等因素。
本研究也存在局限性。首先,这是一项单中心的回顾性研究。其次,样本量相对较小,主要是因为近3年来我国才广泛开展免疫治疗。第三,本研究的中期随访时间较短,大部分参与者没有达到终点,导致信息偏差。第四,没有分析动脉栓塞事件,可能低估了整体血栓发生率。第五,为了证明ICIs和VTE之间的直接相关性,设置具有相似临床特征但未接受免疫治疗的患者作为对照组是最佳的,但是由于癌症治疗的发展,真实世界中无法获得非免疫疗法治疗的对照组。
综上所述,本研究显示晚期肺癌患者经ICIs治疗后的VTE发生率为9.69%,应充分重视ICIs相关的VTE风险,ICIs引起VTE的机制目前尚不清楚,值得深入研究。Caprini评分≥5分、糖尿病和TNF-α>12.8 pg/mL是VTE发生的独立危险因素,对该类患者预防性抗凝治疗或许是有益的。本研究具有一定的局限性,未来需更大样本量和前瞻性研究进行验证。
| [1] |
COHEN A T, KATHOLING A, RIETBROCK S, et al. Epidemi- ology of first and recurrent venous thromboembolism in patients with active cancer. A population-based cohort study[J]. Thromb Haemost, 2017, 117(1): 57-65. |
| [2] |
PRANDONI P, CAMPELLO E. Venous thromboembolism in cancer patients undergoing chemotherapy: risk factors and prevention[J]. Semin Thromb Hemostasis, 2021, 47(8): 914-919. |
| [3] |
TOTZECK M, MINCU R I, RASSAF T. Cardiovascular adverse events in patients with cancer treated with bevacizumab: a meta-analysis of more than 20 000 patients[J]. J Am Heart Assoc, 2017, 6(8): e006278. |
| [4] |
NICHETTI F, LIGORIO F, ZATTARIN E, et al. Is there an interplay between immune checkpoint inhibitors, thromboprophylactic treatments and thromboembolic events? mechanisms and impact in non-small cell lung cancer patients[J]. Cancers, 2019, 12(1): 67. |
| [5] |
SOLINAS C, SABA L C, SGANZERLA P, et al. Venous and arterial thromboembolic events with immune checkpoint inhibitors: a systematic review[J]. Thromb Res, 2020, 196: 444-453. |
| [6] |
GIUSTOZZI M, BECATTINI C, ROILA F, et al. Vascular events with immune checkpoint inhibitors in melanoma or non-small cell lung cancer: a systematic review and meta-analysis[J]. Cancer Treat Rev, 2021, 100: 102280. |
| [7] |
ROOPKUMAR J, SWAIDANI S, KIM A S, et al. Increased incidence of venous thromboembolism with cancer immunotherapy[J]. Med (N Y), 2021, 2(4): 423-434. |
| [8] |
ZOU X L, CHEN W Y, ZHANG G Y, et al. Risk factors, incidence, and prognosis of thromboembolism in cancer patients treated with immune checkpoint inhibitors[J]. Front Pharmacol, 2021, 12: 747075. |
| [9] |
SHANKAR B, ZHANG J J, NAQASH A R, et al. Multi-system immune-related adverse events associated with immune checkpoint inhibitors for treatment of non-small cell lung cancer[J]. JAMA Oncol, 2020, 6(12): 1952-1956. |
| [10] |
SATO R, IMAMURA K, SAKATA S, et al. Disorder of coagulation-fibrinolysis system: an emerging toxicity of anti-PD-1/PD-L1 monoclonal antibodies[J]. J Clin Med, 2019, 8(6): 762. |
| [11] |
KASTHURI R S, TAUBMAN M B, MACKMAN N. Role of tissue factor in cancer[J]. J Clin Oncol, 2009, 27(29): 4834-4838. |
| [12] |
URWYLER P, EARNSHAW I, BERMUDEZ M, et al. Mechanisms of checkpoint inhibition-induced adverse events[J]. Clin Exp Immunol, 2020, 200(2): 141-154. |
| [13] |
LIU S H, MI J Q, LIU W G, et al. Blocking of checkpoint receptor PD-L1 aggravates osteoarthritis in macrophage-dependent manner in the mice model[J]. Int J Immunopathol Pharmacol, 2019, 33: 2058738418820760. |
| [14] |
FERRONI P, RIONDINO S, PORTARENA I, et al. Associa tion between increased tumor necrosis factor alpha levels and acquired activated protein C resistance in patients with metastatic colorectal cancer[J]. Int J Colorectal Dis, 2012, 27(12): 1561-1567. |
| [15] |
DE FONSEKA A M, TUSKEY A, CONAWAY M R, et al. Antitumor necrosis factor-α therapy is associated with reduced risk of thromboembolic events in hospitalized patients with inflammatory bowel disease[J]. J Clin Gastroenterol, 2016, 50(7): 578-583. |
| [16] |
LITVINOV R I, PESHKOVA A D, LE MINH G, et al. Effects of hyperhomocysteinemia on the platelet-driven contraction of blood clots[J]. Metabolites, 2021, 11(6): 354. |
| [17] |
HU Y H, LI X Q, ZHOU H X, et al. Comparison between the khorana prediction score and caprini risk assessment models for assessing the risk of venous thromboembolism in hospitalized patients with cancer: a retrospective case control study[J]. Interact Cardiovasc Thorac Surg, 2020, 31(4): 454-460. |
| [18] |
HEIT J A. Epidemiology of venous thromboembolism[J]. Nat Rev Cardiol, 2015, 12(8): 464-474. |
| [19] |
GARIANI K, MAVRAKANAS T, COMBESCURE C, et al. Is diabetes mellitus a risk factor for venous thromboembolism? A systematic review and meta-analysis of case-control and cohort studies[J]. Eur J Intern Med, 2016, 28: 52-58. |
| [20] |
LEMKES B A, HERMANIDES J, DEVRIES J H, et al. Hyperglycemia: a prothrombotic factor?[J]. J Thromb Haemost, 2010, 8(8): 1663-1669. |
| [21] |
STELMACHOWSKA-BANAS' M, CZAJKA-ORANIEC I. Management of endocrine immune-related adverse events of immune checkpoint inhibitors: an updated review[J]. Endocr Connect, 2020, 9(10): R207-R228. |
| [22] |
YIM C, MANSELL K, HUSSEIN N, et al. Current cancer therapies and their influence on glucose control[J]. World J Diabetes, 2021, 12(7): 1010-1025. |
| [23] |
GUTIERREZ-SAINZ L, MARTINEZ-MARIN V, VIÑAL D, et al. Incidence of venous thromboembolic events in cancer patients receiving immunotherapy: a single-institution experience[J]. Clin Transl Oncol, 2021, 23(6): 1245-1252. |
| [24] |
DESCHÊNES-SIMARD X, RICHARD C, GALLAND L, et al. Venous thrombotic events in patients treated with immune checkpoint inhibitors for non-small cell lung cancer: a retrospective multicentric cohort study[J]. Thromb Res, 2021, 205: 29-39. |
| [25] |
MAILLET D, CORBAUX P, STELMES J J, et al. Association between immune-related adverse events and long-term survival outcomes in patients treated with immune checkpoint inhibitors[J]. Eur J Cancer, 2020, 132: 61-70. |
| [26] |
ABDIHAMID O, OMAR A, RUGAMBWA T. Defining the correlation between immune-checkpoint inhibitors-related adverse events and clinical outcomes: a narrative review[J]. Ecancermedicalscience, 2021, 15: 1314. |




