术后认知功能障碍(post operative cognitive dysfunction, POCD)是一种以术后神经认知缺陷为特征的疾病,会导致较差预后和转归,包括延长住院时间和提高死亡率[1-3]。有研究表明脑氧供需平衡失调和自动调节功能受损是POCD诱因[4-5],用近红外光谱技术测量出的局部脑氧饱和度(regional cerebral oxygen saturation,rSO2)和脑组织总血红蛋白浓度指数(cerebral tissue hemoglobin index,THI)指标,能有效评价脑氧供需平衡状态[6-7]。局部脑氧饱和度(rSO2)较基线值显著降低的心脏手术患者已被证明与术后认知能力下降、精神错乱、较长重症监护病房和住院时间有关[8-9]。有研究表明在先天性心脏病婴儿手术中,THI与总血红蛋白水平成正相关[10]。对rSO2和THI的研究大多集中在吸入麻醉下行成人或婴儿心脏手术的患者,本研究想在排除低体温、体外循环及吸入麻醉的影响后,对丙泊酚麻醉前后rSO2和THI的变化进行研究。丙泊酚是一种静脉注射短效麻醉剂,有动物和人体研究显示,丙泊酚可降低脑血流量(cerebral blood flow,CBF)、脑氧代谢率(cerebral metabolic rate of oxygen,CMRO2)和葡萄糖的局部代谢率(regional metabolic rate of glucose)[11-12],并增加血液中一氧化氮(NO)的生成[13]。丙泊酚具有血管活性特性,是否会在麻醉后干扰大脑脑氧供需平衡是值得研究的问题。本研究的主要研究目标是通过测量rSO2和THI定量评估丙泊酚对大脑脑氧供需平衡的影响,分析丙泊酚麻醉后是否会对脑氧供需产生影响,以便及时采取相应脑保护措施从而减少术后并发症,为术中管理提供一定参考。
脑内自动调节(cerebral autoregulation, CA)是指在灌注压发生变化时大脑保持稳定血流的能力,从而保护脑组织免受低灌注和高灌注[14]。持续监测CA可能有助于引导动脉血压(arterial blood pressure, ABP)和脑灌注压目标达到“最佳”水平,从而减少术后神经系统并发症[15-16]。七氟烷会损害自动调节[17-18],大幅度缩短自动调节平台范围,从而掩盖年龄的差异,使麻醉状态下不同年龄组差别较小[19-20]。但是静脉麻醉对于大脑调节功能的影响却报道得较少,是否与吸入麻醉一样,对于大脑自动调节的平台有显著影响,也是值得研究的问题。还有研究表明手术时长会影响脑氧饱和度[5],肝门阻断技术有助于减少术中出血[21],肝脏对低血压和缺氧耐受性差,肝门阻断期间易引起全身血流动力学紊乱。探寻不同年龄段、手术时长和是否进行肝门阻断患者的脑氧和自动调节功能是否存在差异是本研究的次要目标。
1 资料与方法 1.1 研究对象该研究为前瞻性观察性研究,通过陆军军医大学第一附属医院伦理委员会批准(批准号为KY2020005)。所有受试者提供了书面的知情同意书。选取从2020年6-10月于我院因胰腺和肝胆方面疾病在丙泊酚麻醉下行择期开放腹腔手术患者,共53例。记录如手术时长,是否阻断肝门等术中信息以及高血压、糖尿病病史、体质量指数(body mass index,BMI)、身高、性别、年龄、体质量等人口统计信息。
纳入标准:①ASA分级Ⅰ~Ⅲ级;②年龄18~80岁;③在丙泊酚静脉麻醉下行择期开腹肝胆外科手术;④患者自愿填写书面知情同意书并加入研究。排除标准:①颈动脉狭窄病史;②颅脑手术史或中枢神经系统疾病;③心脏瓣膜疾病、心肌梗死、房颤、室早或射血分数<50%;④精神原因不能参与研究者,如诊断为精神性疾病、逻辑记忆及沟通能力障碍的患者;⑤研究人员认为有其他的原因导致无法纳入该受试者。
样本量计算:本研究以主要指标脑氧饱和度rSO2在丙泊酚麻醉前后的差异作为计算样本量的依据,通过预实验发现,左侧rSO2在麻醉前后的差异为-1.8±4.2,而右侧rSO2在麻醉前后的差异为-1.9±3.7,取α=0.05,β=0.2,保证左右侧rSO2在麻醉前后具有差异性的最小样本量分别为45和32例。取两者较大值45例,同时考虑到临床试验中病例脱落和剔除的风险,增加约15%的样本,即为53例。
1.2 术中管理患者术前禁食、禁饮6~8 h。在利多卡因局麻后行桡动脉穿刺置管,用于测量血气分析和监测微创下动脉血流动力学。在麻醉诱导前以100% 纯氧为患者进行面罩通气3 min。麻醉诱导静脉给予依托咪酯(0.25 mg/kg)、舒芬太尼(0.4 μg/kg)、阿曲库铵(0.3 mg/kg)诱导后行气管插管,在效应室靶控输注模式下行丙泊酚2.5~4 μg/mL、瑞芬太尼2~4 ng/mL靶控输注,同时以0.2 mg/(kg·h)静脉泵注顺式阿曲库铵,0.5 μg/(kg·h)静脉泵注右美托咪定。
1.3 监测设备及相关指标的计算方法心指数(cardiac index,CI)和有创MAP使用心输出量测量仪(Pulsion公司,德国)通过桡动脉进行监测,从患者入手术室至手术结束期间每12秒自动保存测量数据。动脉血气分析指标如PaO2、PaCO2、pH等在麻醉实施前20 min、手术实施前10 min、手术实施后每小时和手术结束前10 min测量1次。脑氧供需平衡监测通过使用近红外光谱组织血氧参数监测仪(苏州爱琴生物电子医疗有限公司,中国),用酒精拭子清洗皮肤后,将监测2个探头放置在患者左右眉弓上方1 cm处,以医用弹性绷带固定探头。从患者入手术室后开始监测,每2秒自动测量并保存患者左右脑rSO2和左右脑THI直至手术结束。脑氧供需平衡的监测结果取左右脑rSO2的平均值和左右脑THI的平均值。计算左右脑rSO2平均值和MAP之间以及左右脑THI平均值和MAP之间的连续性线性皮尔逊相关系数,分别得到变量COx (脑血氧测定指数)和THx (总血红蛋白反应指数)。以上述结果描绘出MAP-COx柱状图和MAP-THx柱状图。当COx的值接近0时,表示rSO2与MAP的变化不相关,处于此时MAP该患者的CA调节能力正常。当COx的值接近1时,表示rSO2与MAP变化相关,CA调节能力受损,此时MAP低于CA调节范围下限或高于CA调节范围上限。当THx的值接近0时,表示THI与MAP的变化不相关,处于此时MAP该患者的CA调节能力正常。当THx的值接近1时,表示THI与MAP的变化相关,此时MAP低于CA调节范围下限或高于CA调节范围上限。参考既往研究[22],当COx恰好≥0.4或THx恰好≥0.4时,表明此时的MAP超出大脑自动调节范围。在COx-MAP曲线图上取COx=0.4的横线,若能恰好在横线上得到两个MAP值,则将相对小的MAP值作为由COx界定的CA范围下限,将相对大的MAP值作为由COx界定的CA范围上限。若COx-MAP曲线图上无法恰好在横线上得到两个MAP值,则取COx>0.4时最小的COx所对应的两个MAP值,其中较小值和较大值分别作为COx界定的CA范围下限和上限。测定方法示例见图 1。同理,在THx-MAP曲线图上取THx=0.4的横线,若能恰好在横线上得到两个MAP值,则将相对小的MAP值作为由THx界定的CA范围下限,将相对大的MAP值作为由THx界定的CA范围上限。若THx-MAP曲线图上无法恰好在横线上得到两个MAP值,则取THx>0.4时最小的THx所对应的两个MAP值,其中较小值和较大值分别作为THx界定的CA范围下限和上限。测定方法示例见图 1。
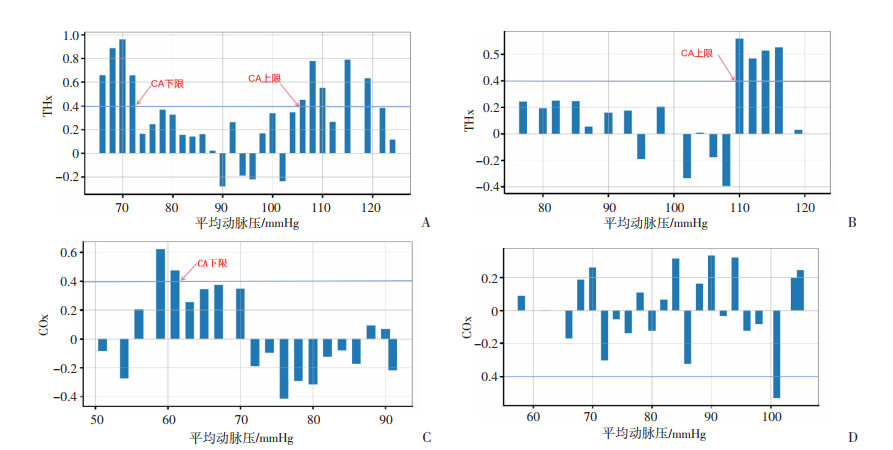
|
| A:脑血流自动调节范围:上限下限都有;B:脑血流自动调节范围:只有上限;C:脑血流自动调节范围:只有下限;D:脑血流自动调节范围:维持在调节范围内 图 1 脑血流自动调节曲线的分类 |
1.4 统计学分析
所有统计分析均使用IBMSPSS 23.0。符合正态分布的计量资料以x±s来描述。左右脑rSO2和THI在麻醉前和麻醉后比较采用配对t检验,左右脑rSO2和THI根据年龄、是否阻断肝门和手术时长进行分组,采用双侧t检验比较。由COx和THx界定的CA上限、下限和调节范围同样根据年龄、是否阻断肝门和手术时长分组,采用双侧t检验比较。检验水准α=0.05,左右脑rSO2和THI随年龄的线性相关性图使用GraphPadPrism 5软件。
2 结果 2.1 人口统计学和术中数据共纳入53例患者,其中男性28例,女性25例;高血压患者5例,糖尿病患者5例。患者年龄为22~75(51.67±12.74)岁,BMI为16.65~28.32(22.43±2.67)kg/m2,肝门未阻断有26例,手术时长为156~577(340.64±108.79)min,心率为47.69~93.00(70.83±10.24)次/min, 术中MAP为71.21~113.79(89.21±9.12)mmHg。pH值为7.35~7.47(7.40±0.03),PaO2为63.00~424.06(210.30±67.60)mmHg, ETCO2为30.3~46.39(36.75±3.55)mmHg。
2.2 左右侧脑rSO2和THI根据麻醉前和麻醉后分组比较左右侧脑rSO2在麻醉前和麻醉后进行配对样本t检验,左侧rSO2 t=5.479, P<0.001;右侧rSO2 t=5.078, P<0.001, 说明左右侧脑rSO2在麻醉前和麻醉后差异有统计学意义(表 1)。左右侧脑THI在麻醉前和麻醉后进行配对样本t检验,左侧THI t=4.301, P<0.001;右侧THI t=4.123, P<0.001, 说明左右侧THI在麻醉前和麻醉后差异有统计学意义(表 1)。
| 组别 | rSO2(%)均值 | THI均值 | |||
| 左侧 | 右侧 | 左侧 | 右侧 | ||
| 麻醉前 | 63.17±3.55 | 63.43±3.74 | 0.95±0.36 | 1.00±0.39 | |
| 麻醉后 | 61.04±3.24 | 61.29±3.53 | 0.86±0.32 | 0.91±0.38 | |
| t | 5.479 | 5.078 | 4.301 | 4.123 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | |
2.3 左右侧脑rSO2和THI分别根据年龄、是否阻断肝门和手术时长分组比较
左右脑rSO2和THI根据年龄分组比较差异无统计学意义(表 2)。线性相关性图中THI有随着年龄增长而下降的趋势,左脑THI随年龄变化趋势r=-0.261 8,P=0.058 3(图 2B),右脑THI随年龄变化趋势r=-0.283 6,P=0.039 6(图 2D)。左右侧脑rSO2和THI根据是否阻断肝门分组和手术时长分组后比较发现差异都无统计学意义(表 3、4)。线性相关性图显示左右脑rSO2与手术时间的线性相关性不强(图 3A、C),THI与手术时长的线性相关性不强(图 3B、D)。
| 组别 | n | rSO2(%)均值 | THI均值 | |||
| 左侧 | 右侧 | 左侧 | 右侧 | |||
| ≤50岁 | 22 | 61.20±2.92 | 61.33±4.03 | 0.91±0.34 | 1.01±0.34 | |
| >50岁 | 31 | 61.37±3.38 | 61.67±3.06 | 0.84±0.31 | 0.86±0.40 | |
| 合计 | 61.30±3.17 | 61.53±3.46 | 0.87±0.32 | 0.92±0.38 | ||
| t | -0.190 | -0.350 | 0.739 | 1.420 | ||
| P | 0.850 | 0.728 | 0.464 | 0.162 | ||
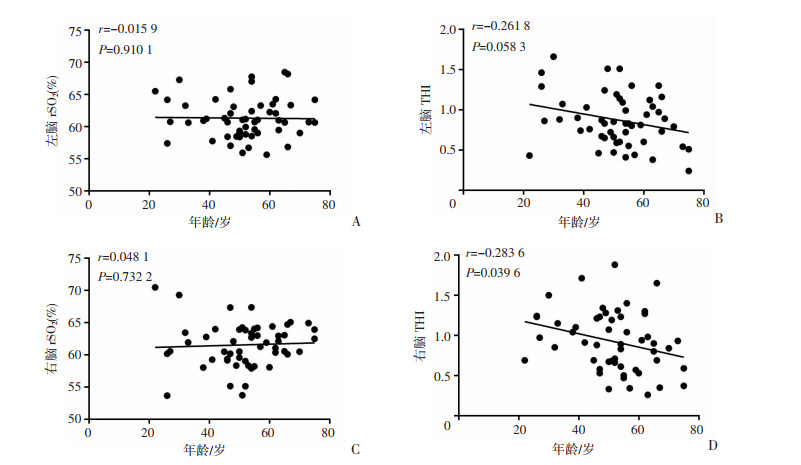
|
| A:左脑rSO2随年龄的变化趋势;B:左脑THI随年龄的变化趋势;C:右脑rSO2随年龄的变化趋势;D:右脑THI随年龄的变化趋势 图 2 左右侧脑rSO2和THI与年龄比较的线性回归分析 |
| 组别 | n | rSO2(%)均值 | THI均值 | |||
| 左侧 | 右侧 | 左侧 | 右侧 | |||
| 肝门未阻断 | 26 | 60.81±2.76 | 60.66±3.55 | 0.92±0.33 | 0.88±0.39 | |
| 肝门阻断 | 27 | 61.77±3.50 | 62.37±3.22 | 0.82±0.31 | 0.97±0.36 | |
| 合计 | 61.30±3.17 | 61.53±3.46 | 0.87±0.32 | 0.92±0.38 | ||
| t | -1.107 | -1.830 | 1.072 | -0.907 | ||
| P | 0.274 | 0.073 | 0.289 | 0.369 | ||
| 组别 | n | rSO2(%)均值 | THI均值 | |||
| 左侧 | 右侧 | 左侧 | 右侧 | |||
| 手术时长<360 min | 30 | 61.64±3.29 | 61.86±3.42 | 0.87±0.31 | 0.90±0.36 | |
| 手术时长≥360 min | 23 | 60.86±3.01 | 61.10±3.54 | 0.87±0.35 | 0.95±0.40 | |
| 合计 | 61.30±3.17 | 61.53±3.46 | 0.87±0.32 | 0.92±0.38 | ||
| t | 0.891 | 0.791 | -0.049 | -0.405 | ||
| P | 0.377 | 0.433 | 0.961 | 0.687 | ||
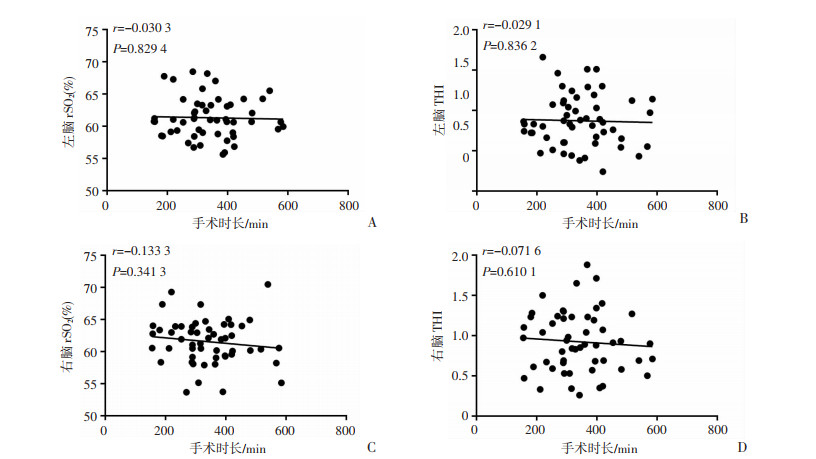
|
| A:左脑rSO2随手术时长的变化趋势;B:左脑THI随手术时长的变化趋势;C:右脑rSO2随手术时长的变化趋势;D:右脑THI随手术时长的变化趋势 图 3 左右侧rSO2和THI与手术时长比较的线性回归分析 |
2.4 脑血流自动调节的限制性和范围
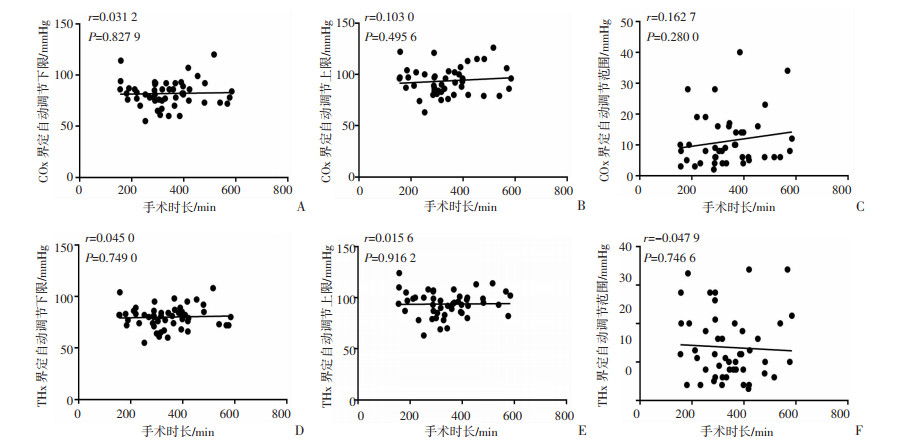
脑血流自动调节范围只有上限(图 1B)、只有下限(图 1C)和一直维持在调节范围内(图 1D)的未纳入统计分析。脑血流自动调节由COx和THx分别界定的CA上限、下限和调节范围长度根据年龄分组发现差异无统计学意义(表 5)。COx和THx分别界定的CA上限、下限和调节范围长度随年龄变化的线性相关性不强(图 4)。由COx和THx分别界定的CA上限、下限和调节范围长度根据肝门阻断分组发现差异无统计学意义(表 6)。由COx和THx分别界定的CA上限、下限和调节范围长度根据手术时长分组发现差异无统计学意义(表 7)。由COx和THx分别界定的CA上限、下限和调节范围长度随手术时长变化的线性相关性不强(图 5)。
| 组别 | COx界定自动调节 | THx界定自动调节 | |||||
| 下限 | 上限 | 范围 | 下限 | 上限 | 范围 | ||
| ≦50岁 | 79.77±10.54 (n=22) |
91.47±13.22 (n=19) |
10.47±6.96 (n=19) |
78.55±8.96 (n=22) |
93.68±11.88 (n=19) |
14.42±9.29 (n=19) |
|
| >50岁 | 83.66±13.95 (n=29) |
95.22±14.05 (n=27) |
11.74±9.34 (n=27) |
80.97±11.67 (n=31) |
93.83±12.83 (n=29) |
13.38±8.32 (n=29) |
|
| 合计 | 81.98±12.63 (n=51) |
93.67±13.69 (n=46) |
11.22±8.38 (n=46) |
79.96±10.61 (n=53) |
93.77±12.34 (n=48) |
13.79±8.63 (n=48) |
|
| t | -1.090 | -0.913 | -0.501 | -0.817 | -0.039 | 0.405 | |
| P | 0.281 | 0.366 | 0.619 | 0.418 | 0.969 | 0.687 | |
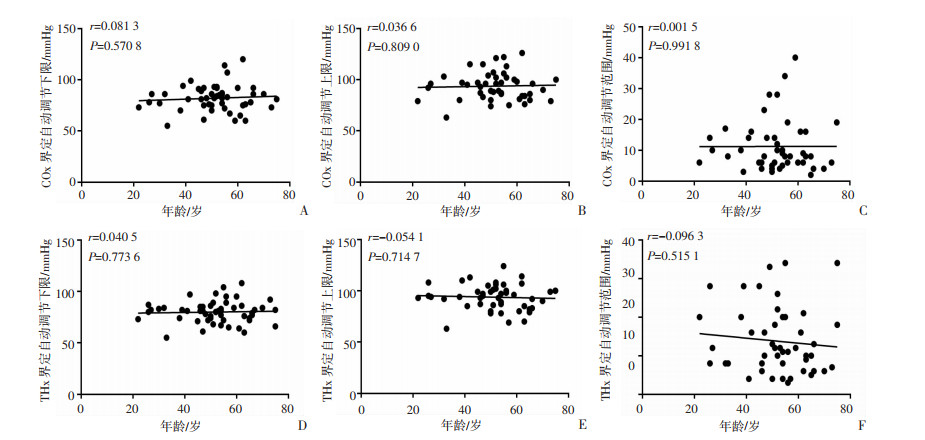
|
| A:COx界定自动调节下限随年龄的变化趋势;B:COx界定自动调节上限随年龄的变化趋势;C:COx界定自动调节范围随年龄的变化趋势;D:THx界定自动调节下限随年龄的变化趋势;E:THx界定自动调节上限随年龄的变化趋势;F:THx界定自动调节范围随年龄的变化趋势 图 4 脑血流自动调节的限制性和范围根据年龄分组比较的线性回归分析 |
| 组别 | COx界定自动调节 | THx界定自动调节 | |||||
| 下限 | 上限 | 范围 | 下限 | 上限 | 范围 | ||
| 肝门未阻断 | 84.88±14.14 (n=24) |
96.62±13.17 (n=21) |
10.33±6.82 (n=21) |
80.42±11.97 (n=26) |
96.13±12.82 (n=23) |
14.83±9.26 (n=23) |
|
| 肝门阻断 | 79.41±10.73 (n=27) |
91.20±13.89 (n=25) |
11.96±9.57 (n=25) |
79.52±9.31 (n=27) |
91.60±11.71 (n=25) |
12.84±8.09 (n=25) |
|
| 合计 | 81.98±12.63 (n=51) |
93.67±13.69 (n=46) |
11.22±8.38 (n=46) |
79.96±10.61 (n=53) |
93.77±12.34 (n=48) |
13.79±8.63 (n=48) |
|
| t | 1.566 | 1.349 | -0.652 | 0.308 | 1.280 | 0.793 | |
| P | 0.124 | 0.184 | 0.518 | 0.760 | 0.207 | 0.432 | |
| 组别 | COx界定自动调节 | THx界定自动调节 | |||||
| 下限 | 上限 | 范围 | 下限 | 上限 | 范围 | ||
| 手术时长<360 min | 80.30±11.96 (n=30) |
91.15±13.28 (n=27) |
9.93±7.16 (n=27) |
77.87±10.45 (n=30) |
91.85±14.17 (n=27) |
14.19±8.66 (n=27) |
|
| 手术时长≥360min | 84.38±13.44 (n=21) |
97.26±13.81 (n=19) |
13.05±9.77 (n=19) |
82.70±10.39 (n=23) |
96.24±9.24 (n=21) |
13.29±8.79 (n=21) |
|
| 合计 | 81.98±12.63 (n=51) |
93.67±13.69 (n=46) |
11.22±8.38 (n=46) |
79.96±10.61 (n=53) |
93.77±12.34 (n=48) |
13.79±8.63 (n=48) |
|
| t | -1.139 | -1.513 | -1.254 | -1.671 | -1.229 | 0.355 | |
| P | 0.260 | 0.138 | 0.216 | 0.101 | 0.225 | 0.724 | |
|
| A:COx界定自动调节下限随手术时长的变化趋势;B:COx界定自动调节上限随手术时长的变化趋势;C:COx界定自动调节范围随手术时长的变化趋势;D:THx界定自动调节下限随手术时长的变化趋势;E:THx界定自动调节上限随手术时长的变化趋势;F:THx界定自动调节范围随手术时长的变化趋势 图 5 脑血流自动调节的限制性和范围根据手术时长分组比较的线性回归分析 |
3 讨论
在非心脏手术患者中,POCD发生率因手术种类不同可达4%~54%[23-24]。近红外光谱法(Near-Infrared Spectroscopy)可对心脏手术成年患者进行连续监测,通过测量局部脑氧饱和度(rSO2)和脑组织血红蛋白浓度指数(THI)反映脑氧供需功能[7],监测rSO2和THI能为术中管理提供参考,以便及时采取措施预防术后神经系统并发症[8-9]并维持总血红蛋白浓度稳定[10]。计算大脑中动脉血流速度与平均动脉血压之间的移动线性相关系数能间接反映脑血流量(cerebral blood flow,CBF)功能,监测脑自动调节可能在预防体外循环(cardiopulmonary bypass, CPB)期间的损伤性低血压方面有作用[7, 22],将MAP控制在脑血流自动调节(cerebral autoregulation, CA)范围内可以起到保护脑灌注及减少POCD的作用。
3.1 rSO2和THI在丙泊酚麻醉前后分组比较在丙泊酚麻醉后,我们结果显示左右脑rSO2在与麻醉前相比有下降,差异有统计学意义(表 1),这和既往研究结果相一致[25]。既往研究报道rSO2在七氟烷麻醉后相比最大值有下降[26],我们的结果显示丙泊酚麻醉和七氟烷麻醉一样会使rSO2下降。该研究还报道rSO2在七氟烷麻醉后的下降程度小于丙泊酚麻醉后的下降程度[26],未来可进一步开展更大病例样本的研究来探讨及验证。本研究还显示左右脑THI在与麻醉前相比有下降,差异有统计学意义(表 1)。有研究报道在正常ETCO2时行七氟烷麻醉后THI会下降[27],本研究显示丙泊酚麻醉后和七氟烷麻醉一样会使THI下降。我们严格遵循麻醉常规管理方案,术中动脉血气分析显示气体交换平衡,排除了高碳酸血症的影响。研究表明丙泊酚会使所有脑区域的脑血流(CBF)和脑葡萄糖代谢率降低[11-12],丙泊酚与人脑微血管内皮细胞炎症和血脑屏障的破坏也有密切关系[28-30]。脑血流为大脑提供灌注和氧气,葡萄糖是脑细胞唯一的能量来源,人脑微血管内皮细胞和血脑屏障保护脑组织不受血液中有害物质损害。丙泊酚麻醉后rSO2和THI降低可能与脑血流量与脑葡萄糖代谢率降低,人脑微血管内皮细胞和血脑屏障受损之间存在一定联系,需要更大样本的研究来证明。临床麻醉管理中常以rSO2值从基线下降≥20%或绝对值rSO2≤50%作为实施改善脑氧合的触发点[31],可通过及时采取冰帽、提高吸氧浓度、调整呼吸机参数, 维持CO2在正常范围内(35-45mmHg)、把血压调整在基线值20%以内、输血维持血红蛋白在100 g/L[32]等脑保护措施来维持脑灌注和氧合。还有研究表明苯溴马隆通过抑制人脑血管内皮细胞中的Egr-1来防止丙泊酚引起的炎症和损伤[33],未来可进一步开展大样本临床研究来探讨和证实。
3.2 rSO2和THI根据年龄、是否阻断肝门和手术时长分组比较本研究得出的主要结果显示左右脑rSO2和THI根据年龄分组比较,年龄≤50岁vs.年龄>50岁差异无统计学意义(表 2)。但是线性相关曲线显示左右脑THI随着年龄的增长有逐渐下降的趋势(图 2B、图 2D),这可能是麻醉后老年人MAP更低造成的,在麻醉诱导后1、3和5 min测量MAP,MAP表现出随年龄增长显著下降的趋势[34]。结合本研究结果,应当加强对老年患者THI的监测。虽然目前在临床麻醉管理中对THI变化幅度的具体危险值还未达成共识,但是THI与脑总血红蛋白浓度正相关,THI降低表明脑总血红蛋白浓度降低,脑总血红蛋白是影响脑供氧的因素之一。可结合患者血气分析结果及时采取输血等措施来维持血红蛋白浓度,从而维持患者脑供氧给平衡。本研究得出的结果还显示左右脑rSO2和THI分别根据是否阻断肝门分组比较和手术时长是否大于360 min分组比较,差异都无统计学意义(表 3、表 4)。这可能是由于我们严格遵循肝胆胰腺手术麻醉管理原则,对术中失血和输血进行充分估计和准备,采用低中心静脉压技术减少出血,根据血气分析调整呼吸参数并适时使用了血管活性药。
3.3 脑血流自动调节的限制性和范围早期对脑血流动力学的研究提出,在MAP为50~150 mmHg[35]间CBF自动调节系统保持稳定。本研究次要结果显示:由COx和THx界定的患者CA范围与之前对清醒受试者的研究相比,丙泊酚麻醉通常会导致CA范围缩短(表 5)。吸入麻醉下年轻患者和老年患者的平均CA范围分别仅为(13.8±9.8)mmHg和(10.8±8.6)mmHg[20]。本研究结果显示丙泊酚麻醉和吸入麻醉一样会使CA范围缩短(表 5)。这可能与丙泊酚降低脑血流量[11-12]及导致脑微血管细胞受损[29-30]存在一定联系。研究表明维持MAP在65mmHg上可减少非心脏手术术后器官损伤[36],可通过输注血红蛋白及应用血管活性药物等方法维持MAP在CA调节范围内。在心脏手术中个体化监测CA并管理MAP比常规方案更能降低术后谵妄发生率[15],在丙泊酚麻醉非心脏手术下对患者进行个体化监测CA并随访术后并发症值得更大规模地研究。有研究报道吸入麻醉下[20]患者CA下限分别为(66±12, 73±14)mmHg。本研究显示年轻和老年患者的上下限在丙泊酚麻醉下相比吸入麻醉下更高(表 5),这可能与研究选取的测量仪器和入组病人情况不同有关。
本研究次要结果还显示年轻和老年患者中自动调节上限、下限和平台长度差异无统计学意义(表 5)。这与国外在七氟烷麻醉下得到的结果相一致[20],这可能说明年龄的增长似乎不会削弱人体大脑血流自动调节能力,人体大脑血流自动调节能力具有有较强的稳定性。其他因素也会影响到围术期中枢神经系统并发症,脑灌注只是其中一个因素。本研究结果显示由COx和THx分别界定的CA上限、下限和调节范围长度根据是否阻断肝门(表 6)和手术时长(表 7)进行分组比较,差异无统计学意义。可能是由于我们在相对长时间的手术中定时测血气分析并调整用药维持电解质平衡,及时输注红细胞和使用冰袋缩短了脑缺血缺氧时间。
3.4 影响脑血流的其他因素及本研究局限性影响CBF因素有很多,如挥发性麻醉剂、动脉氧(PaO2)和二氧化碳分压(PaCO2)、脑代谢率、血管活性剂、血液黏度和神经源性途径等[37]。此外有研究报道高血压病史患者大脑自动调节范围下限比普通患者更高,这表明相比普通患者高血压患者对低MAP的耐受性更差[38]。影响CBF的其他因素未来值得进一步研究。
本研究也存在着一定的局限性,比如我们的研究中没有使用BIS监测,由于前额上的空间有限,不可能正确放置NIRS和BIS监测的传感器。如果我们使用BIS监测,许多患者可能会接受较低剂量的丙泊酚。然而,目前还不清楚这是否会影响我们的研究结果。由于患者术前认知功能的评估和术后并发症的随访不是本研究主要目标,所以上述结果暂未纳入统计。目前的样本量只能满足主要研究目标(即左右脑rSO2和THI在丙泊酚麻醉前后有无差异),可纳入更多的病例进行前瞻性研究分析,来进一步探讨次要研究目标并研究术中脑氧供需平衡和脑自动调节功能同术后并发症的关联。
综上,在丙泊酚麻醉下行开腹肝胆外科手术患者中,左右脑rSO2和THI相比麻醉前降低,左右脑THI有随年龄下降的趋势;丙泊酚麻醉通常会导致自动调节平台的缩短,调节范围和吸入麻醉下调节范围相近。在和研究报道的吸入麻醉下相比,丙泊酚麻醉下患者CA的上限、下限相对更高。年龄是否大于50岁、是否阻断肝门和手术时长是否大于360 min对自动调节平台无影响。应该加强术中对rSO2THI和的监测,及时采取脑保护措施实现围术期脑自动调节功能平衡。
| [1] |
MOSKOWITZ E E, OVERBEY D M, JONES T S, et al. Post-operative delirium is associated with increased 5-year mortality[J]. Am J Surg, 2017, 214(6): 1036-1038. |
| [2] |
RADTKE F M, FRANCK M, HERBIG T S, et al. Incidence and risk factors for cognitive dysfunction in patients with severe systemic disease[J]. J Int Med Res, 2012, 40(2): 612-620. |
| [3] |
ROBINSON T N, RAEBURN C D, TRAN Z V, et al. Post-operative delirium in the elderly: risk factors and outcomes[J]. Ann Surg, 2009, 249(1): 173-178. |
| [4] |
BELROSE J C, NOPPENS R R. Anesthesiology and cognitive impairment: a narrative review of current clinicalliterature[J]. BMC Anesthesiol, 2019, 19(1): 241. |
| [5] |
辜梦月. 开腹手术患者术中脑氧供需平衡与脑血流自动调节范围的影响因素研究[D]. 重庆: 陆军军医大学, 2021. GU M Y. A study on effect factors of cerebral oxygen supply-consumption balance and cerebral autoregulation in patients during open abdominal surgery[D]. Chongqing: Army Medical University, 2021. |
| [6] |
HORI D, HOGUE C W Jr, SHAH A, et al. Cerebral autoregulation monitoring with ultrasound-tagged near-infrared spectroscopy in cardiac surgery patients[J]. Anesth Analg, 2015, 121(5): 1187-1193. |
| [7] |
HIGHTON D, GHOSH A, TACHTSIDIS I, et al. Monitoring cerebral autoregulation after brain injury: multimodal assessment of cerebral slow-wave oscillations using near-infrared spectroscopy[J]. Anesth Analg, 2015, 121(1): 198-205. |
| [8] |
DE TOURNAY-JETTÉ E, DUPUIS G, BHERER L, et al. The relationship between cerebral oxygen saturation changes and postoperative cognitive dysfunction in elderly patients after coronary artery bypass graft surgery[J]. J Cardiothorac Vasc Anesth, 2011, 25(1): 95-104. |
| [9] |
SCHOEN J, MEYERROSE J, PAARMANN H, et al. Preoperative regional cerebral oxygen saturation is a predictor of postoperative delirium in on-pump cardiac surgery patients: a prospective observational trial[J]. Crit Care, 2011, 15(5): R218. |
| [10] |
SHEN J, WANG W, ZHANG W, et al. A high-efficiency MUF method benefits postoperative hemodynamic stability and oxygen delivery in neonates with transposition of great arteries[J]. J Card Surg, 2019, 34(6): 468-473. |
| [11] |
OSHIMA T, KARASAWA F, SATOH T. Effects of propofol on cerebral blood flow and the metabolic rate of oxygen in humans[J]. Acta Anaesthesiol Scand, 2002, 46(7): 831-835. |
| [12] |
SCHLVNZEN L, JUUL N, HANSEN K V, et al. Regional cerebral blood flow and glucose metabolism during propofol anaesthesia in healthy subjects studied with positron emission tomography[J]. Acta Anaesthesiol Scand, 2012, 56(2): 248-255. |
| [13] |
GONZÁLEZ-CORREA J A, CRUZ-ANDREOTTI E, ARREBOLA M M, et al. Effects of propofol on the leukocyte nitric oxide pathway: in vitro and ex vivo studies in surgical patients[J]. Naunyn Schmiedebergs Arch Pharmacol, 2008, 376(5): 331-339. |
| [14] |
CALDAS J R, HAUNTON V J, PANERAI R B, et al. Cerebral autoregulation in cardiopulmonary bypass surgery: a systematic review[J]. Interact Cardiovasc Thorac Surg, 2018, 26(3): 494-503. |
| [15] |
BROWN CH 4th, NEUFELD K J, TIAN J, et al. Effect of targeting mean arterial pressure during cardiopulmonary bypass by monitoring cerebral autoregulation on postsurgical delirium among older patients: a nested randomized clinical trial[J]. JAMA Surg, 2019, 154(9): 819-826. |
| [16] |
HORI D, BROWN C, ONO M, et al. Arterial pressure above the upper cerebral autoregulation limit during cardiopulmonary bypass is associated with postoperative delirium[J]. Br J Anaesth, 2014, 113(6): 1009-1017. |
| [17] |
CONTI A, IACOPINO D G, FODALE V, et al. Cerebral haemodynamic changes during propofol-remifentanil or sevoflurane anaesthesia: transcranial Doppler study under bispectral index monitoring[J]. Br J Anaesth, 2006, 97(3): 333-339. |
| [18] |
OGAWA Y, IWASAKI K, SHIBATA S, et al. The effect of sevoflurane on dynamic cerebral blood flow autoregulation assessed by spectral and transfer function analysis[J]. Anesth Analg, 2006, 102(2): 552-559. |
| [19] |
BURKHART C S, ROSSI A, DELL-KUSTER S, et al. Effect of age on intraoperative cerebrovascular autoregulation and near-infrared spectroscopy-derived cerebral oxygenation[J]. Br J Anaesth, 2011, 107(5): 742-748. |
| [20] |
GOETTEL N, PATET C, ROSSI A, et al. Monitoring of cerebral blood flow autoregulation in adults undergoing sevoflurane anesthesia: a prospective cohort study of two age groups[J]. J Clin Monit Comput, 2016, 30(3): 255-264. |
| [21] |
王存川, 黄璟, 胡友主, 等. 肝门阻断技术在腹腔镜肝部分切除术中的应用[J]. 中华外科杂志, 2009, 47(11): 874-875. WANG C C, HUANG J, HU Y Z, et al. Application of hepatic hilum blocking technique in laparoscopic partial hepatectomy[J]. Chin J Surg, 2009, 47(11): 874-875. |
| [22] |
BRADY K, JOSHI B, ZWEIFEL C, et al. Real-time continuous monitoring of cerebral blood flow autoregulation using near-infrared spectroscopy in patients undergoing cardiopulmonary bypass[J]. Stroke, 2010, 41(9): 1951-1956. |
| [23] |
MAHANNA-GABRIELLI E, SCHENNING K J, ERIKSSON L I, et al. State of the clinical science of perioperative brain health: report from the American Society of Anesthesiologists Brain Health Initiative Summit 2018[J]. Br J Anaesth, 2019, 123(4): 464-478. |
| [24] |
RUDOLPH J L, MARCANTONIO E R. Review articles: postoperative delirium: acute change with long-term implications[J]. Anesth Analg, 2011, 112(5): 1202-1211. |
| [25] |
LI Q, ZHU M E, ZHANG Y R, et al. Influential factors of cerebral oxygen saturation in?pediatric cardiovascular surgery[J]. J Central South Univ Med Sci, 2018, 43(3): 287-292. |
| [26] |
VALENCIA L, RODRÍGUEZ-PÉREZ A, KVHLMORGEN B, et al. Does sevoflurane preserve regional cerebral oxygen saturation measured by near-infrared spectroscopy better than propofol?[J]. Ann Fr Anesth Reanim, 2014, 33(4): e59-e65. |
| [27] |
SCHOPFER L, HABRE W, PICHON I, et al. Effect of permissive mild hypercapnia on cerebral vasoreactivity in infants: a randomized controlled crossover trial[J]. Anesth Analg, 2021, 133(4): 976-983. |
| [28] |
SHARMA H S, PONTÉN E, GORDH T, et al. Propofol promotes blood-brain barrier breakdown and heat shock protein (HSP 72 kd) activation in the developing mouse brain[J]. CNS Neurol Disord Drug Targets, 2014, 13(9): 1595-1603. |
| [29] |
SWEENEY M D, ZHAO Z, MONTAGNE A, et al. Blood-brain barrier: from physiology to disease and back[J]. Physiol Rev, 2019, 99(1): 21-78. |
| [30] |
LIN M C, CHEN C L, YANG T T, et al. Anesthetic propofol overdose causes endothelial cytotoxicity in vitro and endothelial barrier dysfunction in vivo[J]. Toxicol Appl Pharmacol, 2012, 265(2): 253-262. |
| [31] |
刘强, 韩如泉. 脑氧饱和度监测方法及其应用进展[J]. 国际麻醉学与复苏杂志, 2018, 39(3): 234-238. LIU Q, HAN R Q. Advances in cerebral oxygen saturation monitoring and its application[J]. Int J Anesthesiol Resusc, 2018, 39(3): 234-238. |
| [32] |
OKONKWO D O, SHUTTER L A, MOORE C, et al. Brain oxygen optimization in severe traumatic brain injury phase-Ⅱ: a phase Ⅱ randomized trial[J]. Crit Care Med, 2017, 45(11): 1907-1914. |
| [33] |
HUANG Z H, HUANG B, WEI Q S, et al. The protective effects of benzbromarone against propofol-induced inflammation and injury in human brain microvascular endothelial cells (HBMVECs)[J]. Neurotox Res, 2021, 39(5): 1449-1458. |
| [34] |
LIU Y L, CHEN F, ZHAO W B, et al. Pulmonary artery pressure and variations in arterial blood pressure during the induction period of general anesthesia in elderly patients[J]. J Coll Physicians Surg Pak, 2021, 31(1): 8-13. |
| [35] |
LASSEN N A. Cerebral blood flow and oxygen consumption inman[J]. Physiol Rev, 1959, 39(2): 183-238. |
| [36] |
WESSELINK E M, KAPPEN T H, TORN H M, et al. Intraoperative hypotension and the risk of postoperative adverse outcomes: a systematic review[J]. Br J Anaesth, 2018, 121(4): 706-721. |
| [37] |
RICKARDS C A. Cerebral blood-flow regulation during hemorrhage[J]. Compr Physiol, 2015, 5(4): 1585-1621. |
| [38] |
JONES-MUHAMMAD M, WARRINGTON J P. Cerebralblood flow regulation in pregnancy, hypertension, and hypertensive disorders of pregnancy[J]. Brain Sci, 2019, 9(9): E224. |




