2. 410008 长沙,中南大学湘雅医院妇科
2. Department of Obstetrics and Gynecology, Xiangya Hospital, Central South University, Changsha, Hunan Province, 410008, China
卵巢癌是女性生殖系统常见的恶性肿瘤,其病死率位居妇科恶性肿瘤之首。2020年全球新发病例超过30万,20万患者病死[1]。卵巢癌被称为“沉默杀手”,主要因为卵巢深居盆腔,早期卵巢癌症状隐匿,约70%的患者确诊时已为晚期。晚期卵巢癌患者预后差,5年生存率<40%[2]。肿瘤细胞减灭术和以紫杉醇、卡铂为主的化疗是卵巢癌的传统治疗方法,但是>75%的患者会发生耐药[3]。尽管靶向和免疫治疗已经兴起,然而近年卵巢癌患者5年生存率并无明显改善(仍在35%~40%之间);无进展生存期(progression-free-survival,PFS) 仅12~18个月[4-5]。居高不下的病死率促使研究人员不断探寻有效的卵巢癌治疗靶点。
WNK2是近20年才被发现的一个具有双螺旋、PXXP、SH3结构域的细胞质蛋白[6]。人WNK2主要在心脏、大脑和结肠中表达。其异常可能涉及多种疾病的发生发展,如戈登综合征、颅内出血及肿瘤等疾病[7-9]。近年来,WNK2被发现在多种肿瘤进展中起着重要调控作用。如启动子异常高甲基化导致人脑胶质瘤、脑膜瘤、胃癌和结肠癌中的WNK2水平显著降低,进而促进了肿瘤的增殖以及细胞的迁移和运动。研究进一步证明WNK2通过调控MEK1/ERK1/2,Rac1通路抑制胶质瘤细胞生长[10-12]。在宫颈癌中,WNK2通过调控ERK通路抑制了肿瘤细胞的增殖和侵袭[13]。然而不同于报道的其他肿瘤,我们前期研究证明WNK2在卵巢癌中高表达,并能促进卵巢癌细胞增殖、侵袭等恶性生物学行为。磷酸化质谱测序进一步发现WNK2调控卵巢癌细胞骨架形成等生物学过程。因此WNK2在卵巢癌发展中很可能扮演重要促癌角色[14-15]。
RNA-Seq作为新兴测序技术,较其他测序技术具有明显的优势。其能检测所有的转录本,包括编码RNA (mRNA)和非编码RNA (ncRNA),如microRNA、长链非编码RNA (lncRNA)、核糖体RNA (rRNA) 和转移RNA (tRNA)[16]。转录组测序不仅能发现新的基因,其生成的数据加速了对可变剪接基因、融合基因、突变/SNP、等位基因特异性表达和生物标志物的了解,并且在研究导致卵巢癌耐药的新机制上发挥了充分的作用[17]。
为了更全面地探究WNK2在卵巢癌中调控的分子机制。本研究通过RNA-Seq测序获取WNK2在体外培养卵巢癌细胞中调控的转录本信息,并通过DisGeNET、DO、GO、KEGG富集分析WNK2参与的生物和代谢等过程,为WNK2在卵巢癌中扮演的角色提供了更有力的证据。
1 材料与方法 1.1 实验试剂和实验仪器人卵巢癌细胞株SKOV3、CAOV3购于ATCC官网;细胞培养试剂购于衍庆生物技术有限公司;RNA提取试剂TRIzol、RT-PCR试剂盒购于TaKaRa公司;ROS检测试剂盒购于索莱宝公司。研究中的转染试剂是赛默飞品牌的lipo3000。BX53荧光显微镜购自日本奥林巴斯公司;Bio-Rad PCR仪CFX96购自美国伯乐公司。si-WNK2由广州锐博生物公司设计,序列为:CAAGGACAATGGAGCCATA。WNK2过表达质粒由上海吉凯生物技术有限公司构建。
1.2 实验方法 1.2.1 细胞株及细胞培养人卵巢癌细胞SKOV3和CAOV3培养于湿润、37 ℃、5% CO2的细胞培养箱中,培养基用DMEM(Gibico,美国)和10%的胎牛血清配制。
1.2.2 si-RNA将SKOV3和CAOV3细胞铺板于6孔板中,24 h后细胞密度保持70%左右进行转染。两个EP管中分别加入500 μL optimem和20 μmol/L siRNA (5 μL si-WNK2或si-NC)或5 μL的lipo3000。轻轻摇晃混匀后,静置5 min。将EP管中的si-RNA和转染试剂混合,常温下静置20 min后加入细胞培养孔中。3个培养孔作为实验组转染si-WNK2,另外3个孔作为对照组转染si-NC。
1.2.3 质粒转染将SKOV3和CAOV3细胞铺板于6孔板中,24 h后细胞密度大约保持70%左右进行质粒转染。转染前将培养基换成无血清培养基。两个EP管中分别加入500 μL optimem和3 μg质粒或5 μL lipo 3 000,轻轻摇晃混匀后,静置5 min。将EP管中的质粒和转染试剂混合,常温下静置20 min后加入细胞培养孔中,转染6 h后细胞换液。
1.2.4 RT-qPCR细胞转染48 h后,6孔板中的细胞用PBS清洗2次,按照试剂使用说明书提取RNA。吸取部分WNK2敲降实验组和NC对照组的RNA进行RT-qPCR。取1 μg的RNA进行反转录,合成cDNA后,用无酶水稀释5倍。取4 μL cDNA,5 μL SYBG和1 μL引物进行RNA检测,验证WNK2的敲降效果以及差异基因的转录水平变化。本研究中的所有引物由擎科生物公司合成,引物序列如表 1所示。
| 基因名称 | 引物名称 | 序列(5'-3') | 产物长度/bp |
| VAV1 | VAV1-正义 | TCTGCCCAAGATGGAGGTGTTTCA | 108 |
| VAV1-反义 | TTCGTGAGCTCCACAATGTCTCCA; | ||
| DDIT4 | DDIT4-正义 | AGGGGTTTGACCGCTCCA | 99 |
| DDIT4-反义 | CCAGGTAAGCCGTGTCTTCC | ||
| SESN2 | SESN2-正义 | AAGACCCTACTTTCGGA | 159 |
| SESN2-反义 | CTGCCTGGAACTTCTCAT | ||
| CYR61 | CYR61-正义 | CTCCCTGTTTTTGGAATGGA | 241 |
| CYR61-反义 | TGGTCTTGCTGCATTTCTTG | ||
| GADD45A | GADD45A-正义 | TTTGCAATATGACTTTGGAGGA | 72 |
| GADD45A-反义 | CATCCCCCACCTTATCCAT | ||
| KLF4 | KLF4-正义 | ACCTACACAAAGAGTTCCCATC | 136 |
| KLF4-反义 | TGTGTTTACGGTAGTGCCTG | ||
| CDKN1 | CDKN1-正义 | GCAGACCAGCATGACAGATTT | 70 |
| CDKN1-反义 | GGATTAGGGCTTCCTCTTGGA | ||
| DDAH2 | DDAH2-正义 | GGTCGATGGAGTCCGCAAAG | 100 |
| DDAH2-反义 | GGTGAAGAGAACGTCAGTGC | ||
| PDGFB | CDKN1-正义 | AATTCAAGCACACGCATGAC | 87 |
| CDKN1-反义 | ATAACCCTGCCCACACACTC | ||
| Romo1 | CDKN1-正义 | CTGTCTCAGGATCGGAATGCG | 114 |
| CDKN1-反义 | CATCGGATGCCCATCCCAATG |
1.2.5 RNA-seq测序
前期研究发现WNK2在卵巢癌细胞SKOV3中表达最高,因此SKOV3细胞中的WNK2被成功敲降后,将实验组和对照组的RNA送至诺和致源生物科技有限公司进行RNA-seq测序分析。公司在测序之前,通过琼脂糖凝胶电泳,D(260)/D(280)及D(260)/D(230)的比值等检测,确保RNA样品符合质检。通过文库构建和上机测序,对基因表达进行定量分析,再用DESeq2筛选WNK2干扰前后表达水平显著差异的基因。差异基因筛选标准是|log2(Fold Change)|>0且padj < 0.05。
1.2.6 富集分析及验证为了得到WNK2在卵巢癌中调控的代谢过程,cluster Profiler软件对差异基因集进行DO通路富集分析和GO功能富集分析。根据富集分析结果进行验证。
1.2.7 ROS检测WNK2敲降或过表达48 h后,检测卵巢癌细胞中的ROS水平。使用无血清培养基将荧光探针稀释1 000倍,再将孔板中的培养基换成荧光探针稀释液,37 ℃孵育30 min。使用无血清培养基充分清洗未进入细胞的荧光探针,荧光显微镜下拍照。
1.3 统计学方法本研究的统计学分析借助于软件SPSS 22.0完成,t检验用于检测两组样品均值,P<0.05为差异有统计学意义。
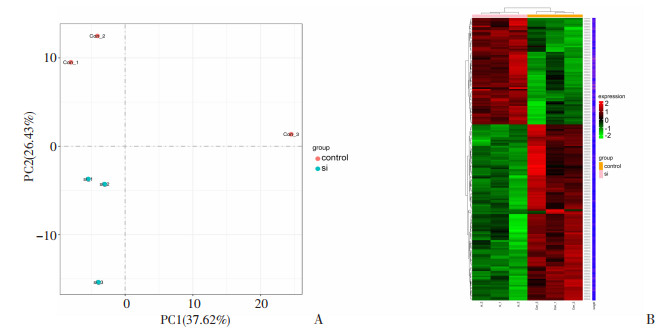
2 结果 2.1 主成分分析及聚类热图为了评估样本组间差异及组内重复情况,本研究对所有样本的基因表达值(fragments per kilobase of exon model per million mapped fragments,FPKM)进行主成分分析(principal component analysis,PCA)。结果所示,组间样本分散,组内样本聚在一起(图 1A)。所有进行聚类分析的基因阈值为padj<0.05。图 1B为差异表达基因聚类热图,图中横坐标为样品名,纵坐标为差异基因FPKM归一化后的数值,颜色越红,表达量越高;越绿,表达量越低。结果显示组内样品聚在一起,样品重复性较好。
|
| A: 主成分分析;B: 差异表达基因聚类热图 图 1 主成分分析及聚类热图 |
2.2 富集分析 2.2.1 DisGeNET及DO富集分析
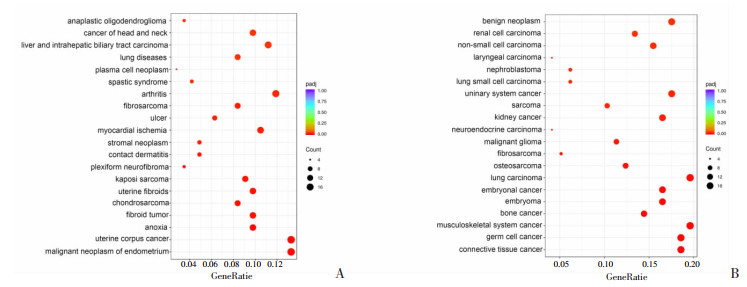
为了探究WNK2调控的基因与哪些疾病关系密切,本研究进行了DisGeNET和DO富集分析。DisGeNET富集分析表明WNK2影响的差异基因与子宫内膜癌、宫体癌、头颈癌、肝癌、胆道癌等恶性肿瘤相关(图 2A),DO富集分析显示差异基因与结缔组织、生殖细胞、泌尿系统、肌肉骨骼系统等恶性肿瘤相关(图 2B)。
|
| A:DisGeNET富集分析;B: Do富集分析 图 2 差异基因疾病富集分析 |
2.2.2 GO功能富集
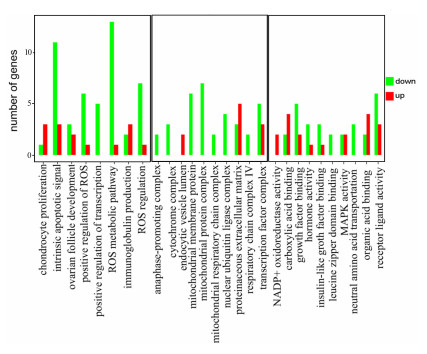
本研究进一步将差异基因进行GO功能富集分析,结果显示WNK2的敲降引起多个代谢过程相关基因表达下降,其中ROS代谢、线粒体蛋白复合物、凋亡等过程是差异基因富集最明显的GO功能,并且ROS代谢是差异基因富集最为显著的过程(图 3)。表 2是ROS代谢相关过程中的差异基因信息。
|
| 图 3 差异基因GO富集分析 |
| GO ID号 | 代谢过程 | 校正P值 | 差异基因数 | 下调基因 | 上调基因 |
| 0072593 | 活性氧代谢过程 | 0.000162941 | 14 | SESN2/CYR61/GADD45A/KLF4/CDKN1/VAV1/PDGFB/ROMO1/DDAH2/DDIT4/ATP5IF1/CTGF/NOXA1 | HSP90AA1 |
| 2000379 | 活性氧代谢正向调控 | 0.004782767 | 7 | GADD45A/KLF4/CDKN1/PDGFB/ROMO1/DDAH2 | 0 |
| 2000377 | 活性氧代谢调控 | 0.033299698 | 8 | GADD45A/KLF4/CDKN1/PDGFB/ROMO1/DDAH2/NOXA1 | HSP90AA1 |
2.2.3 GO功能富集
WNK2正调控的差异基因富集于ROS代谢过程、凋亡信号通路、内质网应激中RNA聚合酶Ⅱ的转录调控、细胞黏附调控等生物过程。细胞组成上参与泛素连接酶复合物、线粒体膜蛋白复合物、细胞色素复合物等的形成。并参与生长因子结合、转录激活因子活性、中性氨基酸跨膜转运蛋白活性等分子功能(图 4)。

|
| A: GO富集分析柱状图; B: GO富集分析气泡图 图 4 WNK2正调控的差异基因GO富集分析 |
2.2.4 差异基因的PPI网络图
String数据库构建差异蛋白互作网络图,如图 5所示,差异基因间有着丰富的相互作用,其中与ROS相关的CDKN1、GADD45A、KLF4、CYR61、ROMO1蛋白位于蛋白网络中心位置。

|
| 图 5 差异基因的PPI网络图 |
2.2.5 RT-qPCR验证转录组测序结果
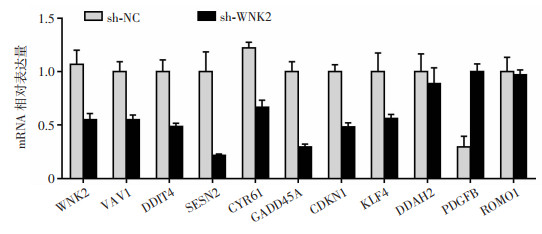
GO功能分析表明差异基因富集最明显的是ROS代谢过程,并且PPI网络图显示ROS相关蛋白均位于核心位置。本研究组用RT-qPCR验证ROS代谢过程的基因SESN2、CYR61、GADD45A、KLF4、CDKN1、VAV1、PDGFB、ROMO1、DDAH2、DDIT4是否被WNK2调控,结果显示(图 6),WNK2敲降引起大部分ROS代谢过程的基因如SESN2、CYR61、GADD45A、KLF4、CDKN1、VAV1、DDIT4的下调,推测WNK2极可能影响卵巢癌细胞的ROS代谢过程。
|
| 图 6 RT-qPCR检测WNK2敲降后SKOV3细胞ROS代谢差异基因的变化 |
2.2.6 WNK2对卵巢癌细胞ROS代谢的影响
为了检测WNK2是否影响卵巢癌细胞的ROS生成,本研究组在卵巢癌细胞系CAOV3和SKOV3中过表达和敲降WNK2后检测ROS的变化(图 7、8)。结果显示WNK2过表达后,卵巢癌细胞SKOV3、CAOV3中的ROS生成增多;WNK2敲降后,卵巢癌细胞SKOV3、CAOV3中的ROS生成减少。
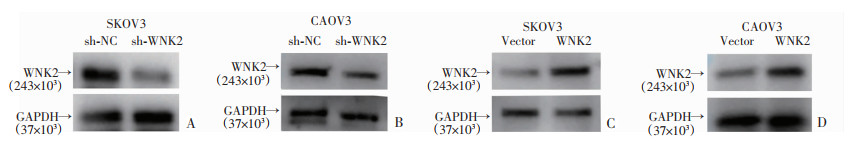
|
| A: SKOV3细胞中WNK2的敲降效果;B: CAOV3细胞中WNK2的敲降效果;C: SKOV3细胞中WNK2的过表达效果;D: CAOV3细胞中WNK2的过表达效果 图 7 Western blot检测CAOV3、SKOV3中WNK2被成功敲降和过表达 |
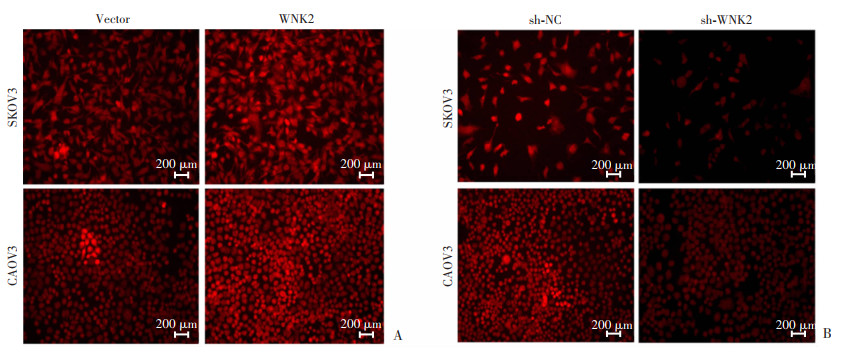
|
| A: WNK2过表达后卵巢癌细胞ROS的变化; B: WNK2敲降后卵巢癌细胞ROS的变化 图 8 免疫荧光检测WNK2对卵巢癌细胞中ROS形成的影响 |
3 讨论
卵巢癌是病死率最高的妇科恶性肿瘤,目前治疗方法难以提高其5年生存率,寻找有效诊治卵巢癌的分子靶点是迫在眉睫的任务。作为近20余年新发现的蛋白,WNK2能调控多种肿瘤的恶性进展。本课题组前期证明WNK2促进卵巢癌细胞的恶性行为[14-15],为进一步挖掘该激酶在卵巢癌中扮演的角色,本研究利用转录组测序探究WNK2在卵巢癌中调控的生物和代谢过程。
转录组测序检测包括编码RNA (mRNA)和非编码RNA (ncRNA)在内的所有转录本信息,能更全面地了解WNK2在卵巢癌中调控的生物和代谢过程。鉴于SKOV3细胞中WNK2表达最高[14],因此用si-RNA将卵巢癌细胞系SKOV3中的WNK2敲降后,提取总的RNA进行转录组测序,并分析WNK2在卵巢癌细胞中调控的所有转录信息。通过对差异基因进行DisGeNET、DO和GO富集,获取WNK2在卵巢癌细胞中调控的生物功能和代谢过程。分析表明差异基因与子宫内膜癌、宫体癌、头颈癌、肝癌、胆道癌以及结缔组织、生殖细胞、泌尿系统、肌肉骨骼系统等恶性肿瘤密切相关。GO功能富集分析表明差异蛋白富集于ROS代谢过程、凋亡信号通路和细胞黏附等生物过程。细胞组成上WNK2调控的蛋白参与泛素连接酶复合物、线粒体膜蛋白复合物以及细胞色素复合物等的形成。众所周知,ROS代谢过程是促发肿瘤,引起肿瘤进展的一个重要因素[18]。凋亡和细胞黏附也与肿瘤细胞生长和侵袭两大恶性行为密不可分。泛素连接酶影响各种蛋白酶解,在细胞各种生命活动中起着至关重要的调控作用[19]。线粒体作为供能细胞器,影响细胞分化、生长、凋亡、信号传递等过程[20]。线粒体膜蛋白复合物作为线粒体的重要组成成分,细胞色素复合物作为呼吸链的一部分,均调控包括细胞凋亡,细胞周期和细胞增殖在内的多种生物学过程[21]。
ROS代谢是差异基因富集最为显著的过程,ROS相关蛋白均位于PPI蛋白网络中心位置。WNK2敲降后,该生物过程绝大部分差异基因转录水平下降,RNA-seq测序结果可信。其中PDGFB和ROMO1转录水平未下降。我们推测可能是因为检测方法不同造成的差异。RNA-seq测序是通过检测基因全长定量,而qPCR检测则是通过引物扩增基因特定区域,因此定量基因表达时,难以避免产生差异。此外,两株经典的卵巢癌细胞系SKOV3和CAOV3验证实验表明WNK2促进卵巢癌细胞ROS产生。ROS通过激活癌基因影响肿瘤发生发展中几乎所有过程,它通过损伤DNA,促使肿瘤发生,还通过影响血管生成、上皮间充质转变、细胞黏附等过程,促进肿瘤细胞的增殖、侵袭[22]。卵巢癌是由输卵管上皮细胞长期暴露于ROS演变而来的,高水平的ROS是导致卵巢癌恶性进程的重要原因[23-24]。CYR61、VAV1、PDGFB、DDIT4促进ROS的产生和积聚,SESN2则抑制ROS的产生。KLF4在不同情况下既可促进也可抑制ROS的产生[25-32],这代表WNK2促进卵巢癌细胞ROS是多种因素共同促进ROS产生和积聚增加的结果。研究发现,ROS能促进GADD45A、CDKN1的表达[33-34],那么GADD45A、CDKN1的变化是由WNK2还是由ROS的改变引起的呢?后续需设计实验研究具体原因。
综上所述,本研究通过RNA-seq测序和活性氧检测证明了WNK2促进卵巢癌细胞SKOV3和CAOV3中ROS形成,为WNK2在卵巢癌中扮演的重要角色提供了更多的证据,也为下一步WNK2发展为卵巢癌新的治疗靶点提供了思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
KUROKI L, GUNTUPALLI S R. Treatment of epithelial ovarian cancer[J]. BMJ, 2020, 371: m3773. |
| [3] |
GADDUCCI A, GUARNERI V, PECCATORI F A, et al. Current strategies for the targeted treatment of high-grade serous epithelial ovarian cancer and relevance of BRCA mutational status[J]. J Ovarian Res, 2019, 12(1): 9. |
| [4] |
MCGEE J, PEART T M, FOLEY N, et al. Direct genetics referral pathway for high-grade serous ovarian cancer patients: the "opout" process[J]. J Oncol, 2019, 2019: 6029097. |
| [5] |
LHEUREUX S, BRAUNSTEIN M, OZA A M. Epithelial ovarian cancer: evolution of management in the era of precision medicine[J]. CA Cancer J Clin, 2019, 69(4): 280-304. |
| [6] |
XU B, ENGLISH J M, WILSBACHER J L, et al. WNK1, a novel mammalian serine/threonine protein kinase lacking the catalytic lysine in subdomain Ⅱ[J]. J Biol Chem, 2000, 275(22): 16795-16801. |
| [7] |
ANGLANI F, SALVIATI L, CASSINA M, et al. Genotype-phenotype correlation in Gordon's syndrome: report of two cases carrying novel heterozygous mutations[J]. J Nephrol, 2022, 35(3): 859-862. |
| [8] |
YOSHIDA T, KATO K, YOKOI K, et al. Association of genetic variants with hemorrhagic stroke in Japanese individuals[J]. Int J Mol Med, 2010, 25(4): 649-656. |
| [9] |
HE S H, PHAM M H, PEASE M, et al. A review of epi-genetic and gene expression alterations associated with intracranial meningiomas[J]. Neurosurg Focus, 2013, 35(6): E5. |
| [10] |
MONIZ S, MATOS P, JORDAN P. WNK2 modulates MEK1 activity through the Rho GTPase pathway[J]. Cell Signal, 2008, 20(10): 1762-1768. |
| [11] |
DU J, LIANG Y, LI J, et al. Correction to: LINC00858 knockdown inhibits gastric cancer cell growth and induces apoptosis through reducing WNK2 promoter methylation[J]. Cell Oncol (Dordr), 2021, 44(1): 235. |
| [12] |
WU J B, MENG X M, GAO R, et al. Long non-coding RNA LINC00858 inhibits colon cancer cell apoptosis, autophagy, and senescence by activating WNK2 promoter methylation[J]. Exp Cell Res, 2020, 396(1): 112214. |
| [13] |
MONIZ S, VERÍSSIMO F, MATOS P, et al. Protein kinase WNK2 inhibits cell proliferation by negatively modulating the activation of MEK1/ERK1/2[J]. Oncogene, 2007, 26(41): 6071-6081. |
| [14] |
LI F J, LIANG Z, JIA Y Q, et al. microRNA-324-3p suppresses the aggressive ovarian cancer by targeting WNK2/RAS pathway[J]. Bioengineered, 2022, 13(5): 12030-12044. |
| [15] |
李凤杰, 贾永琴, 梁振, 等. 基于磷酸化修饰组学分析WNK2调控卵巢癌细胞骨架形成[J]. 陆军军医大学学报, 2022, 44(6): 513-521. LI F J, JIA Y Q, LIANG Z, et al. Analysis of WNK2 regulating cytoskeleton formation in ovarian cancer cells based on phosphorylation modification sequencing[J]. J Army Med Univ, 2022, 44(6): 513-521. |
| [16] |
WANG Z, GERSTEIN M, SNYDER M. RNA-Seq: a revolutionary tool for transcriptomics[J]. Nat Rev Genet, 2009, 10(1): 57-63. |
| [17] |
WANG J L, DEAN D C, HORNICEK F J, et al. RNA sequencing (RNA-Seq) and its application in ovarian cancer[J]. Gynecol Oncol, 2019, 152(1): 194-201. |
| [18] |
CHIO I I C, TUVESON D A. ROS in cancer: the burning question[J]. Trends Mol Med, 2017, 23(5): 411-429. |
| [19] |
ZHENG N, SHABEK N. Ubiquitin ligases: structure, function, and regulation[J]. Annu Rev Biochem, 2017, 86: 129-157. |
| [20] |
PUROHIT P K, SAINI N. Mitochondrial microRNA (MitomiRs) in cancer and complex mitochondrial diseases: current status and future perspectives[J]. Cell Mol Life Sci, 2021, 78(4): 1405-1421. |
| [21] |
WITUS S R, STEWART M D, KLEVIT R E. The BRCA1/BARD1 ubiquitin ligase and its substrates[J]. Biochem J, 2021, 478(18): 3467-3483. |
| [22] |
SAED G M, DIAMOND M P, FLETCHER N M. Updates of the role of oxidative stress in the pathogenesis of ovarian cancer[J]. Gynecol Oncol, 2017, 145(3): 595-602. |
| [23] |
KOBAYASHI H, IMANAKA S, SHIGETOMI H. Revisiting therapeutic strategies for ovarian cancer by focusing on redox homeostasis[J]. Oncol Lett, 2022, 23(3): 80. |
| [24] |
马骏, 王育. 活性氧与上皮性卵巢癌转移的相关性研究进展[J]. 中国实用妇科与产科杂志, 2011, 27(11): 862-865. MA J, WANG Y. The relationship between reactive oxygen species and metastasis of epithelial ovarian cancer[J]. Chin J Pract Gynecol Obstet, 2011, 27(11): 862-865. |
| [25] |
BORKHAM-KAMPHORST E, SCHAFFRATH C, VAN DE LEUR E, et al. The anti-fibrotic effects of CCN1/CYR61 in primary portal myofibroblasts are mediated through induction of reactive oxygen species resulting in cellular senescence, apoptosis and attenuated TGF-β signaling[J]. Biochim Biophys Acta, 2014, 1843(5): 902-914. |
| [26] |
CHEN C C, KIM K H, LAU L F. The matricellular protein CCN1 suppresses hepatocarcinogenesis by inhibiting compensatory proliferation[J]. Oncogene, 2016, 35(10): 1314-1323. |
| [27] |
ZHAO T M, BENARD V, BOHL B P, et al. The molecular basis for adhesion-mediated suppression of reactive oxygen species generation by human neutrophils[J]. J Clin Invest, 2003, 112(11): 1732-1740. |
| [28] |
LU Q B, WAN M Y, WANG P Y, et al. Chicoric acid prevents PDGF-BB-induced VSMC dedifferentiation, proliferation and migration by suppressing ROS/NFκB/mTOR/P70S6K signaling cascade[J]. Redox Biol, 2018, 14: 656-668. |
| [29] |
LI Z L, ZHAO Q W, LU Y J, et al. DDIT4 S-nitrosylation aids p38-MAPK signaling complex assembly to promote hepatic reactive oxygen species production[J]. Adv Sci (Weinh), 2021, 8(18): e2101957. |
| [30] |
SHIN J, BAE J, PARK S, et al. mTOR-dependent role of Sestrin2 in regulating tumor progression of human endometrial cancer[J]. Cancers, 2020, 12(9): 2515. |
| [31] |
BORKHAM-KAMPHORST E, SCHAFFRATH C, VAN DE LEUR E, et al. The anti-fibrotic effects of CCN1/CYR61 in primary portal myofibroblasts are mediated through induction of reactive oxygen species resulting in cellular senescence, apoptosis and attenuated TGF-β signaling[J]. Biochim Biophys Acta, 2014, 1843(5): 902-914. |
| [32] |
BLUM A, MOSTOW K, JACKETT K, et al. KLF4 regulates metabolic homeostasis in response to stress[J]. Cells, 2021, 10(4): 830. |
| [33] |
QI L, WANG Y Y, SU S Q, et al. Sodium selenite inhibits cervical cancer growth via ROS mediated AMPK/FOXO3a/GADD45a axis[J]. Chem Biol Interact, 2022, 367: 110171. |
| [34] |
ZHOU X Y, ZHANG J, LI Y, et al. Advanced oxidation protein products induce G1/G0-phase arrest in ovarian granulosa cells via the ROS-JNK/p38 MAPK-p21 pathway in premature ovarian insufficiency[J]. Oxid Med Cell Longev, 2021, 2021: 6634718. |




