脓毒症是一种全身性炎症反应综合征,可发展为脓毒症休克及多器官功能障碍综合征[1-2]。脓毒症病程中出现的心功能障碍称为脓毒症心肌病[3]。临床研究显示,罹患心功能障碍的脓毒症患者死亡率为70%~90%,显著高于无心功能不全的脓毒症患者[4-5]。目前对脓毒症诱导的心功能障碍仍缺乏有效的治疗手段。
心脏是人体中的高耗能器官,无时无刻不在消耗氧气生成ATP为细胞收缩提供能量,满足全身血液供应。心肌细胞对内环境变化敏感,易遭受氧自由基攻击而影响正常收缩[6]。越来越多的证据表明,氧化应激损伤是脓毒症心肌病的重要发病机制,减轻脓毒症病程中心脏的氧化应激对维持心功能是有利的[6-7]。
核转录因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是体内调节机体氧化还原平衡的重要转录因子,广泛表达于心脏[8]。富马酸二甲酯(dimethyl fumarate,DMF)是一种富马酸衍生物,在临床上多用来治疗多发性硬化症,近来发现它在肝、肾、脑等器官中均表现出抗氧化特性[9]。但其在脓毒症心肌病中的作用尚不明确。本研究通过构建相关模型,探讨DMF在脓毒症心肌病中的作用及潜在机制,以期为临床治疗提供参考。
1 材料与方法 1.1 主要试剂和仪器DMF和脂多糖(lipopolysaccharide, LPS)购自美国Sigma-Aldrich公司;BCA蛋白浓度测定试剂盒、丙二醛(alondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒、还原型谷胱甘肽(glutathione, GSH)和氧化型谷胱甘肽(oxidized glutathione, GSSG)检测试剂盒购自中国碧云天公司;PVDF转印膜、ECL发光液购自美国Millipore公司;Nrf2抗体、HO-1抗体、SOD2抗体、GAPDH抗体购自中国Proteintech公司;山羊抗兔二抗购自美国Abcam公司;生化分析仪购自中国迈瑞公司;VevoⒸ2100超声成像平台购自日本FUJIFILM公司。
1.2 动物模型建立与分组本实验将30只8~10周龄,体质量22~24 g的C57/BL6J雄性小鼠(合格证号:0237502,北京维通利华实验动物技术有限公司)饲养于标准清洁级环境,自由饮食饮水,随机等分为空白组、模型组和治疗组。治疗组小鼠灌胃溶解于生理盐水的富马酸二甲酯(25 mg/kg),空白组和模型组小鼠灌胃生理盐水,每天一次,持续7天[10-11]。第七天灌胃结束后1 h,模型组和治疗组各取一半小鼠腹腔注射大剂量LPS(30 mg/kg),空白组给予生理盐水,观察72 h内的生存情况[12-13]。在剩余模型组和治疗组小鼠的腹腔注射LPS(15 mg/kg)诱导脓毒症,空白组给予生理盐水。采用经胸心脏超声评估24 h心功能,左心室射血分数(left ventricular ejection fraction, LVEF)低于50%则认为脓毒症心肌病小鼠模型构建成功。24 h后处死模型组、治疗组和空白组剩余的小鼠,留取心脏和血浆。
1.3 经胸心脏超声小鼠经1%~2%(体积分数)的异氟醚麻醉诱导后,仰卧位固定于恒温板上,胸前区脱毛,稳定小鼠心率在400~500次/min,设置超声探头的探测深度为15 mm。找到胸骨旁左心室短轴切面,记录并分析小鼠左室射血分数和左室短轴缩短率(left ventricular fractional shortening,LVFS)。
1.4 肌酸激酶同工酶(creatine kinase isoenzymes, CK-MB)和乳酸脱氢酶(lactate dehydrogenase, LDH)水平测定小鼠血液样本2 500 r/min于4 ℃离心10 min,收集上清置于全自动生化仪进行检测。
1.5 心脏组织HE染色取各组小鼠新鲜心脏左室组织块,置入4%多聚甲醛固定24 h,乙醇梯度脱水,石蜡包埋,切成5 μm切片,烘干脱蜡后,HE染色后在显微镜下观察小鼠心脏组织形态学变化。
1.6 MDA、SOD、GSH及GSSG检测各组小鼠分别取20 mg心肌组织,加入裂解液匀浆,10 000×g离心10 min取上清。分别按照MDA检测试剂盒、SOD检测试剂盒、GSH检测试剂盒和GSSG检测试剂盒说明进行操作。所有操作均在4℃条件下进行,上清液蛋白浓度使用BCA法定量校正后得到MDA、GSH和GSSG含量及SOD活性。
1.7 蛋白免疫印迹制备小鼠心肌组织匀浆,对裂解后的蛋白上清进行定量,取20 μg样品行SDS-PAGE凝胶电泳蛋白分离,将PVDF膜用5%白蛋白在室温下封闭1 h。分别加入Nrf2、HO-1和SOD2一抗溶液,在4℃摇床孵育过夜。次日,TBST洗膜3次,加入二抗溶液室温摇床孵育,TBST洗膜3次后使用ECL法显影。用Image J(NIH)软件计算各目的蛋白表达量,使用内参蛋白GAPDH表达进行上样量校正,得到各目的蛋白的相对表达量。
1.8 统计学分析采用GraphPad Prism7.0进行数据分析。所有数据以x±s呈现,使用非配对双尾Student't检验对两组之间计量资料进行分析,使用重复测量单因素方差分析多组数据进行分析,P < 0.05表明差异有统计学意义。
2 结果 2.1 富马酸二甲酯对LPS诱导的生存率及心脏的影响给予大剂量LPS时,模型组小鼠存活率仅20%,治疗组的小鼠存活率为80%,说明DMF改善了LPS引起的脓毒症致死(图 1)。给予LPS(15 mg/kg)24 h后,模型组小鼠出现明显的心功能障碍,左室射血分数和短轴缩短率均明显下降(P < 0.01,图 2A、C、D),心肌组织破坏明显,表现为肌纤维排列紊乱,间质水肿及炎症细胞浸润(图 2B),心肌损伤标志物CK-MB和LDH水平大幅上升(P < 0.01,图 2E、F)。而治疗组小鼠心脏收缩功能有一定恢复(P < 0.01,图 2A、C、D),心肌形态结构相对较好(图 2B),CK-MB和LDH水平有一定回落(P < 0.01,图 2E、F)。
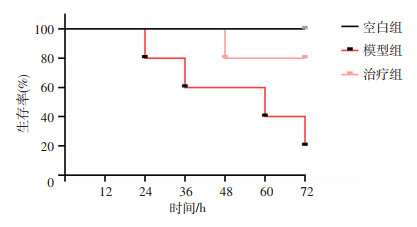
|
| 图 1 小鼠72 h生存率 (x±s, n=5) |
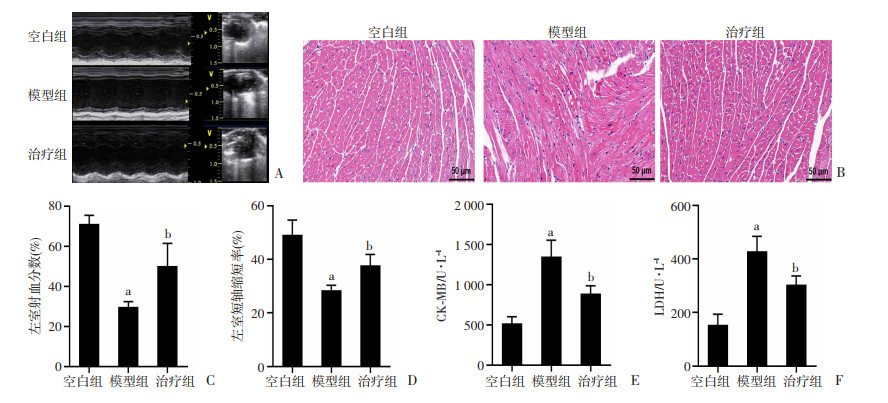
|
| A:小鼠心脏超声;B:小鼠左室切片HE染色;C:左室射血分数;D:左室短轴缩短率;E:血浆CK-MB水平;F:血浆LDH水平 a: P < 0.01,与空白组比较;b: P < 0.01,与模型组比较 图 2 小鼠24 h心功能、心肌组织结构及心肌损伤标志物对比 (x±s, n=5) |
2.2 富马酸二甲酯减轻脓毒症心肌氧化应激
对比空白组,模型组小鼠脂质过氧化终产物MDA含量明显上升,抗氧化酶SOD活性明显下降,抗氧化物GSH含量下降明显,但氧化型GSSG含量上升(P < 0.01,图 3)。而富马酸二甲酯处理的小鼠心脏相比模型组MDA和GSSG含量减少(P < 0.01,图 3A、D),SOD活性较高(P < 0.01,图 3B),且GSH含量上升(P < 0.01,图 3C)。
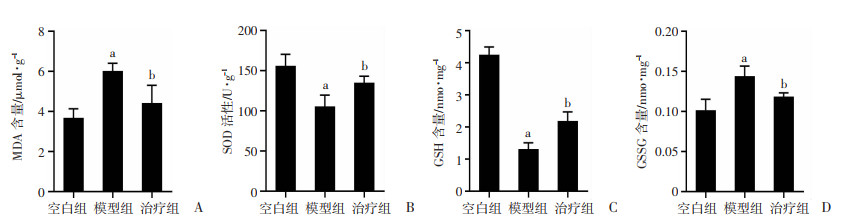
|
| A: 心肌丙二醛水平;B: 心肌超氧化物歧化酶活性;C: 心肌还原性谷胱甘肽含量;D: 心肌氧化型谷胱甘肽含量 a: P < 0.01,与空白组比较;b: P < 0.01,与模型组比较 图 3 各组小鼠氧化应激指标对比 (x±s, n=5) |
2.3 富马酸二甲酯激动脓毒症心脏中Nrf2及下游靶蛋白表达
Western blot结果显示,模型组小鼠心脏Nrf2、HO-1和SOD2蛋白表达均低于空白组(P < 0.01)。而治疗组上述蛋白表达明显高于模型组(P < 0.01,图 4)。

|
| A: 代表性的心肌蛋白免疫印迹图;B: Nrf2蛋白相对表达水平;C: HO-1蛋白相对表达水平;D: SOD2蛋白相对表达水平 a: P < 0.01,与空白组比较;b: P < 0.01,与模型组比较 图 4 各组小鼠心脏Nrf2、HO-1及SOD2蛋白表达对比 (x±s, n=5) |
3 讨论 3.1 DMF改善LPS诱导的脓毒症心肌损伤和心功能破坏
脓毒症作为一种全身的应激反应,常伴有心肌损伤的发生,严重时可引起心律失常、心功能不全和心源性休克[5-6]。脓毒症合并心肌损伤的患者预后较差且死亡率较高[2]。本研究中,使用腹腔注射细菌内毒素LPS模拟脓毒症病理过程,观察到给予大剂量LPS时,小鼠72 h死亡率较高;给予较低剂量的LPS时,小鼠心脏收缩功能受损伴有心肌结构破坏和心损伤标志物水平增加,认为小鼠脓毒症心肌病模型诱导成功,与文献报道的一致[12]。对于治疗组小鼠,连续7 d使用临床实验中已被证明安全浓度的富马酸二甲酯,显著改善了LPS诱导的小鼠心功能障碍和心肌损伤,提示富马酸二甲酯是脓毒症心肌病有效的保护制剂。
3.2 DMF减轻脓毒症心肌氧化应激DMF最开始是一种经FDA批准的用于多发性硬化症的药物,作为一种有效的免疫调节制剂引起了广泛关注[16]。DMF介导细胞内防御机制的多个过程,包括Nrf2/ARE抗氧化途径、NF-κB炎症途径以及铁死亡途径[10]。既往研究显示,DMF通过抗炎抗氧化发挥神经保护作用,促进脑缺血再灌注损伤大鼠认知功能的恢复[17]。也有研究称DMF显著减少了缺血再灌注心脏的梗死面积,维持心肌线粒体呼吸[14]。DMF还可通过激活SOCS3/JAK1/STAT3信号通路,抑制肝癌的进展[18]。DMF在不同组织和器官中的抗氧化特性使本研究组考虑其对于脓毒症心肌也有一定的保护作用。
LPS刺激诱发的全身炎症反应会导致活性氧爆发最终损伤细胞功能[12, 19]。与文献报道的一致,本研究观察到脓毒症小鼠心脏中产生大量脂质过氧化和蛋白氧化损伤的生物标志物MDA,同时, 细胞内重要的抗氧化物质SOD活性和GSH水平同时受到抑制[12-13]。而在DMF处理的小鼠中,心脏组织的SOD活性及GSH的含量上升,且MDA的含量下降。以上结果都提示DMF能够有效抑制脓毒症过程中的心肌氧化应激。
3.3 DMF激活Nrf2抗氧化通路为进一步探索DMF发挥抗氧化应激效应的机制,注意到DMF是有效的Nrf2激动剂。既往研究发现,DMF可激活Nrf2,抑制铁死亡从而改善急性肾损伤[10]。Nrf2作为一种抗氧化基因表达的核转录因子,在心脏中高表达。生理条件下,Nrf2与Keap1结合,以无活性复合物的形式存在于细胞质中。在低氧或缺血等应激情况下,Nrf2入核与基因启动子区域的抗氧化反应元件(antioxidant response element,ARE)结合,促进靶基因的表达,如超氧化物歧化酶和血红素加氧酶-1等[6, 19], 已被证实在心肌缺血再灌注损伤、心肌肥大等疾病模型中发挥强大的保护作用[8]。本研究组考虑DMF对脓毒症心脏的保护作用是否与激动Nrf2调节氧化还原平衡有关,发现LPS诱导的小鼠心脏Nrf2、HO-1及SOD2均低于正常空白组[14, 20],但对接受DMF处理的小鼠,上述抗氧化蛋白表达降低的趋势明显被抑制,提示DMF激活Nrf2上调了上述靶基因的表达。
综上所述,本研究通过构建动物模型并将DMF运用于小鼠脓毒症心肌病中,运用多种生物学手段发现DMF激活Nrf2,促进下游抗氧化基因蛋白表达,减轻脓毒症小鼠的心肌氧化应激损伤,改善心脏功能,这对于临床中脓毒症心肌病患者的防治是有意义的。
| [1] |
BEESLEY S J, WEBER G, SARGE T, et al. Septic cardiomyopathy[J]. Crit Care Med, 2018, 46(4): 625-634. |
| [2] |
HOLLENBERG S M, SINGER M. Pathophysiology of sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. |
| [3] |
SWEENEY T E, KHATRI P. Septic cardiomyopathy: getting to the heart of the matter[J]. Crit Care Med, 2017, 45(3): 556-557. |
| [4] |
MARTIN L, DERWALL M, AL ZOUBI S, et al. The septic heart: current understanding of molecular mechanisms and clinical implications[J]. Chest, 2019, 155(2): 427-437. |
| [5] |
EHRMAN RR, SULLIVAN A N, FAVOT M J, et al. Pathophysiology, echocardiographic evaluation, biomarker findings, and prognostic implications of septic cardiomyopathy: a review of the literature[J]. Crit Care, 2018, 22(1): 112. |
| [6] |
DURAND A, DUBURCQ T, DEKEYSER T, et al. Involvement of mitochondrial disorders in septic cardiomyopathy[J]. Oxid Med Cell Longev, 2017, 2017: 4076348. |
| [7] |
WANG R Z, XU Y R, FANG Y X, et al. Pathogenetic mechanisms of septic cardiomyopathy[J]. J Cell Physiol, 2022, 237(1): 49-58. |
| [8] |
TONELLI C, CHIO Ⅱ C, TUVESON D A. Transcriptional regulation by Nrf2[J]. Antioxid Redox Signal, 2018, 29(17): 1727-1745. |
| [9] |
SAIDU N E B, KAVIAN N, LEROY K, et al. Dimethylfumarate, a two-edged drug: current status and future directions[J]. Med Res Rev, 2019, 39(5): 1923-1952. |
| [10] |
YANG Y W, CAI FF, ZHOU N, et al. Dimethyl fumarate prevents ferroptosis to attenuate acute kidney injury by acting on NRF2[J]. Clin Transl Med, 2021, 11(4): e382. |
| [11] |
徐桂萍, 朱倩倩, 杨振宇. 富马酸二甲酯减轻糖尿病大鼠心肌缺血再灌注损伤及其相关机制研究[J]. 中华危重症医学杂志(电子版), 2021, 14(2): 100-106. XU G P, ZHU Q Q, YANG Z Y. Protective effect of dimethyl fumarate on myocardial ischemia/reperfusion injury in diabetic rats and its mechanism[J]. Chin J Crit Care Med Electron Ed, 2021, 14(2): 100-106. |
| [12] |
LI Y, FENG Y F, LIU X T, et al. Songorine promotes cardiac mitochondrial biogenesis via Nrf2 induction during sepsis[J]. Redox Biol, 2021, 38: 101771. |
| [13] |
TAN Y, WAN HH, SUN M M, et al. Cardamonin protects against lipopolysaccharide-induced myocardial contractile dysfunction in mice through Nrf2-regulated mechanism[J]. Acta Pharmacol Sin, 2021, 42(3): 404-413. |
| [14] |
ASHRAFIAN H, CZIBIK G, BELLAHCENE M, et al. Fumarate is cardioprotective via activation of the Nrf2 antioxidant pathway[J]. Cell Metab, 2012, 15(3): 361-371. |
| [15] |
LIEBMANN M, KORN L, JANOSCHKA C, et al. Dimethyl fumarate treatment restrains the antioxidative capacity of T cells to control autoimmunity[J]. Brain, 2021, 144(10): 3126-3141. |
| [16] |
于庆, 王星童, 罗鹏飞, 等. 富马酸二甲酯在人体自身免疫疾病中的临床应用进展[J]. 中国免疫学杂志, 2017, 33(11): 1718-1722. YU Q, WANG X T, LUO P F, et al. Clinical application of dimethyl fumarate in human autoimmune diseases[J]. Cell Mol Immunol, 2017, 33(11): 1718-1722. |
| [17] |
查宗怡, 楚兰, 李媛, 等. 富马酸二甲酯对大鼠脑缺血再灌注损伤的影响[J]. 中华老年心脑血管病杂志, 2022, 24(2): 201-205. ZHA Z Y, CHU L, LI Y, et al. Effects of dimethyl fumarate on cerebral I/R injury in rats[J]. Chin J Geriatr Heart Brain Vessel Dis, 2022, 24(2): 201-205. |
| [18] |
LIU H, FENG X D, YANG B, et al. Dimethyl fumarate suppresses hepatocellular carcinoma progression via activating SOCS3/JAK1/STAT3 signaling pathway[J]. Am J Transl Res, 2019, 11(8): 4713-4725. |
| [19] |
PIZZINO G, IRRERA N, CUCINOTTA M, et al. Oxidative stress: harms and benefits for human health[J]. Oxid Med Cell Longev, 2017, 2017: 8416763. |
| [20] |
FORMAN H J, ZHANG H Q. Targeting oxidative stress in disease: promise and limitations of antioxidant therapy[J]. Nat Rev Drug Discov, 2021, 20(9): 689-709. |




