2. 400042 重庆,陆军特色医学中心病理科
2. Department of Pathology, Army Medical Center of PLA, Chongqing, 400042, China
肾癌(renal cell carcinoma, RCC)是泌尿系统主要的恶性肿瘤之一。在美国,每年约有65 000例新诊断RCC和约15 000例RCC相关的死亡[1];在中国,RCC是排名第二位的泌尿生殖系统恶性肿瘤,2015年新增66 800例,死亡则达到23 400例[2]。肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是RCC最常见的亚型(75%~80%),具有较高的侵袭性和转移性。手术是局限性或局部进展性ccRCC的一线治疗方法,术后5年生存率约为70%,其中约30%病例会在3~5年内发生转移,转移性ccRCC的5年生存率不到20%。目前,病理分级、TNM分期和体能评分是ccRCC临床上最常用的预后预测指标。但基于这些指标的预后结果往往并不一致,部分原因是肿瘤的高度异质性[3]。
据报道,近90% ccRCC携带VHL(von hippel-lindau tumor suppressor)基因突变,由此导致缺氧诱导因子(hypoxia inducible factors,HIFs)降解减少并形成假性缺氧微环境,最终发生广泛的代谢重编程[4]。脂质代谢重编程是ccRCC细胞的代谢特点之一,包括了脂质摄入、运输、从头脂肪合成、脂滴积累和脂肪酸氧化等方面的广泛变化[5]。肉碱穿梭系统是脂肪酸氧化过程的重要组成部分,在正常细胞和癌细胞脂肪酸代谢的精细调节中均起着重要作用[6]。肉碱棕榈酰转移酶IA(carnitine palmitoyltransferase 1A, CPT1A)和肉碱棕榈酰转移酶Ⅱ(carnitine palmitoyltransferase 2, CPT2)分别位于线粒体外膜和内膜上,是长链脂肪酸转运至线粒体进行β氧化的限速酶[7]。最近研究表明,脂肪酸氧化除了有助于癌细胞增殖外,还在抗血管生成药物的耐药方面发挥着重要作用[8],但脂肪酸降解在ccRCC脂质沉积中的作用、CPT1A和CPT2表达水平及其意义尚不完全清楚。
本研究旨在探索脂肪酸降解相关基因及代谢产物在正常肾组织及不同分期ccRCC的变化,通过生物信息学分析寻找ccRCC脂质沉积的关键分子,采用免疫组化染色、Western blot实验等验证脂肪酸降解关键分子的表达情况,分析其与患者预后的关系,为ccRCC寻找新的预后标志物及治疗靶点。
1 资料与方法 1.1 生物信息学分析本研究使用TCGA中ccRCC转录组学数据和MSKCC中ccRCC代谢组学数据,通过Metabologram[9]分析脂肪酸降解相关基因在正常肾组织、ccRCC组织以及较早(Ⅰ/Ⅱ)、较晚(Ⅲ/Ⅳ) 分期ccRCC中基因表达、代谢物丰度的差异。通过R2: Genomics Analysis and Visualization Platform (http://r2.amc.nl)及UALCAN(http://ualcan.path.uab.edu/index.html)等网页工具分析脂肪酸降解通路(参考KEGG)和肉碱穿梭系统中基因(CPT1A, CPT2)在正常肾组织及不同病理、临床分期ccRCC的表达[10]。使用Reactome数据库(https://reactome.org)分析棕榈酰肉碱相关的代谢酶(CPT1A、CPT2、CACT、CrAT)。脂肪酸氧化相关19个基因(ACAA1 CPT1A, ACADM, GCDH, ACADS, ACAT2, ECI2, ACAT1, ACADSB, CYP4A11, ACADVL, ADH1A, CPT2, HADHB, ADH1B, ALDH9A1, ACSL5, ADH4, ADLH3A2)参考AIDERUS等[11]定义的基因标签。
1.2 临床资料本研究队列纳入本院2007-2016年肾癌患者,共154例,患者基本临床信息见表 1。肿瘤病理分级采用2016 WHO/ISUP病理分级系统,临床分期则采用了第8版TNM分期系统。石蜡包埋癌组织样本来自病理科,并成功构建了组织芯片[12]。154例样本中,26例因石蜡样本不合格而被排除,22例因芯片打孔取材较少,难以染色和评分而被排除。患者在手术前均未接受任何治疗,3名患者在术后因接受舒尼替尼治疗而被排除,最终103名患者的临床资料被纳入分析。患者年龄范围21~79岁,平均55.6岁,随访时间范围为2~114个月,中位随访时间为52个月(Q1=26,Q3=70)。至随访结束时,33例患者出现局部复发(2例)或远处转移(31例),死亡31例(26例肾癌相关死亡)。本研究经陆军特色医学中心伦理委员会批准[医研伦审(2018)第26号]。
| 临床指标 | 例数(%) | CPT1A | P | CPT2 | P | ||
| 低表达 | 高表达 | 低表达 | 高表达 | ||||
| 性别 | |||||||
| 男 | 59(57.28) | 40 | 19 | 25 | 24 | ||
| 女 | 44(42.72) | 23 | 21 | 0.082 | 20 | 24 | 0.371 |
| 年龄/岁 | |||||||
| < 55 | 62(60.19) | 39 | 23 | 33 | 29 | ||
| ≥55 | 41(39.81) | 29 | 12 | 0.372 | 22 | 19 | 0.481 |
| 病理分级 | |||||||
| Ⅰ | 15(14.71) | 6 | 9 | 5 | 10 | ||
| Ⅱ | 43(41.18) | 23 | 20 | 17 | 26 | ||
| Ⅲ | 32(31.37) | 27 | 5 | 23 | 9 | ||
| Ⅳ | 13(12.75) | 9 | 4 | 0.009 | 10 | 3 | 0.004 |
| T分期 | |||||||
| pT1 | 63(61.1) | 33 | 30 | 30 | 33 | ||
| pT2 | 16(15.5) | 11 | 5 | 9 | 7 | ||
| pT3 | 16(15.5) | 11 | 5 | 12 | 4 | ||
| pT4 | 2(1.9) | 2 | 0 | 0.224 | 1 | 1 | 0.137 |
| N分期 | |||||||
| pN0 | 94(91.26) | 58 | 36 | 50 | 44 | ||
| pN1 | 9(8.74) | 5 | 4 | 0.688 | 5 | 4 | 0.892 |
| M分期 | |||||||
| M0 | 84(81.37) | 46 | 38 | 37 | 47 | ||
| M1 | 19(18.63) | 16 | 3 | 0.015 | 18 | 1 | < 0.001 |
| TNM分期 | |||||||
| Ⅰ | 53(51.46) | 27 | 26 | 21 | 32 | ||
| Ⅱ | 17(16.50) | 11 | 6 | 7 | 10 | ||
| Ⅲ | 11(10.68) | 5 | 6 | 6 | 5 | ||
| Ⅳ | 22(21.36) | 19 | 3 | 0.025 | 21 | 1 | < 0.001 |
1.3 材料与试剂
正常肾组织及ccRCC组织来源于2019年6-9月收集的临床样本(经病理证实为正常肾组织及ccRCC)。临床样本离体后立即置入液氮冷冻后转入-80 ℃冰箱保存备用。鼠抗人单抗CPT1A(ab128568) 和兔抗人单抗CPT2 (ab181114)均购自英国Abcam公司,鼠和兔IgG二抗均购自Proteintech公司。RIPA裂解液购自Thermo Fisher公司,SDS-PAGE胶试剂盒购自北京鼎国昌盛生物公司,ECL发光液购自美国Advansta公司,PVDF膜购自美国Bio-Rad公司。
1.4 Western blot实验10对新鲜冰冻的ccRCC及正常肾组织, 在含蛋白酶抑制剂的RIPA裂解缓冲液中匀浆。组织裂解物在10%聚丙烯酰胺凝胶上分离,凝胶中的蛋白质转移到PVDF膜上。CPT1A(1 ∶3 000稀释)和CPT2(1 ∶3 000稀释)的一抗以及抗小鼠或抗兔IgG二抗用于蛋白检测。
1.5 免疫组化染色及评分CPT1A(1 ∶1 000)和CPT2(1 ∶200)一抗在4 ℃的加湿室中孵育过夜。然后在37 ℃下应用生物素化的抗小鼠IgG/抗兔IgG二抗孵育30 min。二氨基联苯胺分别显色5 s和10 s,最后苏木精复染。2名病理专家独立对组织芯片免疫组化染色进行评分。评分公式如下:染色强度×阳性细胞率。染色强度从0~3分(0,无染色;1,轻微染色;2,中等染色;3,强染色)。阳性细胞率标准如下:①染色细胞数 < 1/3为1分;②1/3≤染色细胞数 < 2/3为2分;③染色细胞数≥2/3为3分。CPT1A和CPT2的评分中位数均等于2,因此将得分2用作高低表达分界值,≤2被认为是低表达,>2被认为是高表达。
1.6 统计学分析免疫组化评分分析中采用Pearson卡方检验和Spearman相关性检验分析蛋白表达差异及与临床资料之间的关系。生存分析通过R软件“survival”包完成。采用Cox风险回归模型进行单因素和多因素分析,并通过受试者工作曲线(ROC)分析预测5年无疾病生存率的敏感性和特异性,曲线下面积(AUC)用于衡量预测准确性。R软件“pROC”用于绘制ROC曲线。P < 0.05表示差异具有统计学意义。
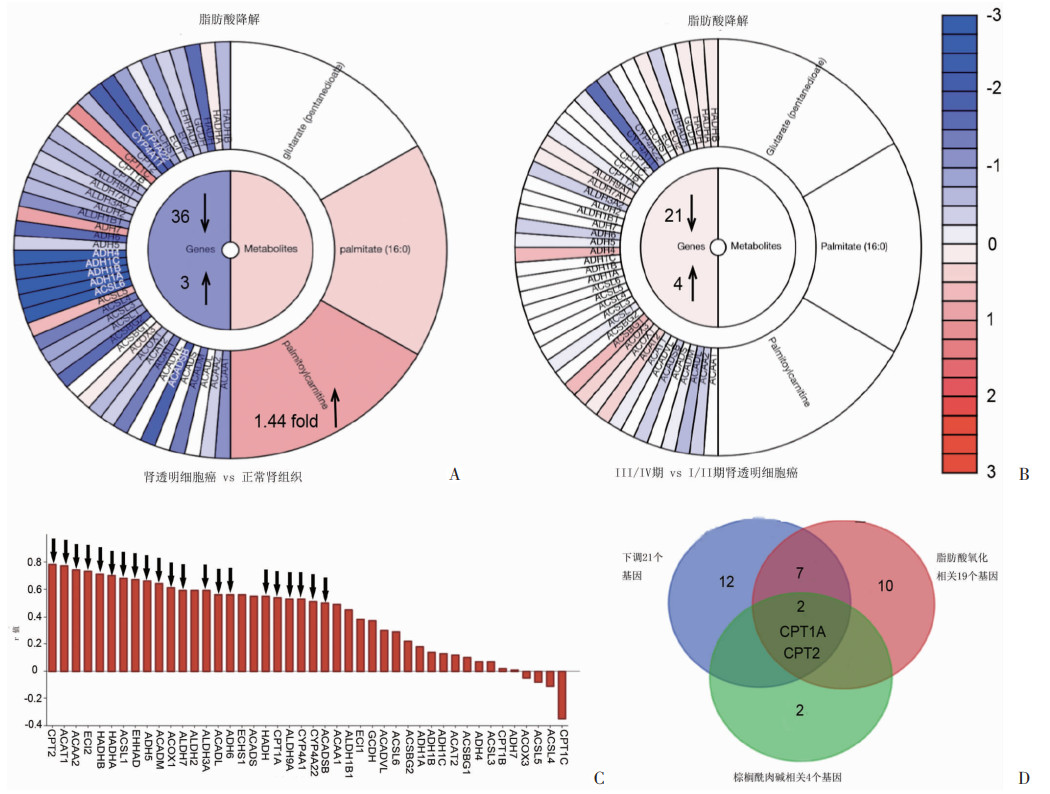
2 结果 2.1 ccRCC中的脂质沉积是肉碱棕榈酰转移酶介导的脂肪酸氧化减少的结果代谢图(Metabologram)中显示,与癌旁正常组织相比,44个脂肪酸降解相关基因中有36个基因表达下调,3个基因表达上调,其余5个基因在ccRCC组织中变化不明显,脂肪酸降解基因在ccRCC低表达;代谢物棕榈酰肉碱丰度升高(图 1A)。因此,下调的脂肪酸降解通路可能在ccRCC中发挥重要作用。比较临床早期(Ⅰ/Ⅱ期)和晚期(Ⅲ/Ⅳ期)ccRCC中44个脂肪酸降解相关基因的变化,发现大约一半(21/44)基因在晚期ccRCC表达下调,4个基因上调,19个基因表达几乎没有变化(图 1B、C)。这些结果表明脂肪酸降解减少可能是ccRCC进展过程中细胞中脂肪过度沉积的原因,并且与肿瘤更高的临床分期相关。进一步分析发现,CPT1A和CPT2是脂肪酸氧化、棕榈酰肉碱代谢及ccRCC临床进展的关键基因(图 1D)。
|
| A: 脂肪酸降解相关基因及代谢物在ccRCC的变化情况;B: 脂肪酸降解相关基因及代谢物在临床Ⅲ/Ⅳ期ccRCC的变化情况;C: 表达下调的脂肪酸降解基因及其通路贡献指数;D: CPT1A、CPT2是ccRCC脂肪酸降解关键基因 图 1 肾透明细胞癌中脂肪酸降解减少 |
2.2 ccRCC中CPT1A、CPT2表达水平与临床分期、病理分级呈负相关
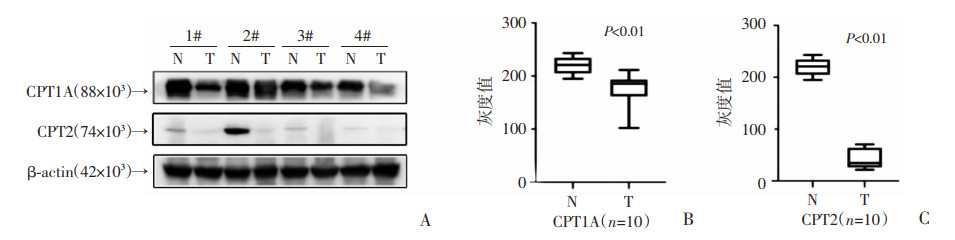
为进一步验证CPT1A、CPT2在ccRCC的表达情况,我们使用ccRCC组织芯片对CPT1A和CPT2进行免疫组化染色和评分,结果表明CPT1A和CPT2在ccRCC组织中表达下调(P < 0.05, 图 2)。Western blot实验结果同样显示与正常肾组织相比,CPT1A、CPT2在ccRCC肿瘤组织中表达下调(P < 0.01, 图 3)。进一步分析发现,CPT1A和CPT2的表达水平与病理分级(r=-0.243,P=0.013;r=-0.391,P < 0.01)和TNM分期(r=-0.363,P < 0.01;r=-0.430,P < 0.01)呈负相关(表 1)。分析TCGA转录组学数据还发现,CPT1A、CPT2在ccRCC中表达下调,其表达水平与病理分级、TNM分期、局部淋巴结和远处转移相关。这些数据共同表明,ccRCC中CPT1A、CPT2的表达水平与TNM分期和恶性程度呈负相关。

|
| A: CPT1A在正常肾组织及不同病理分级ccRCC中的表达情况;B: 不同病理分级样本中CPT1A表达高/低的比例;C: CPT2在正常肾组织及不同病理分级ccRCC中的表达情况;D: 不同病理分级样本中CPT2表达高/低的比例 图 2 CPT1A、CPT2在肾透明细胞癌的表达及与病理分级的关系 |
|
| A: CPT1A、CPT2蛋白免疫印迹;B:CPT1A灰度分析;C:CPT2灰度分析 图 3 CPT1A、CPT2在肾透明细胞癌表达下调 |
2.3 CPT1A、CPT2表达降低与肾透明细胞癌不良预后相关
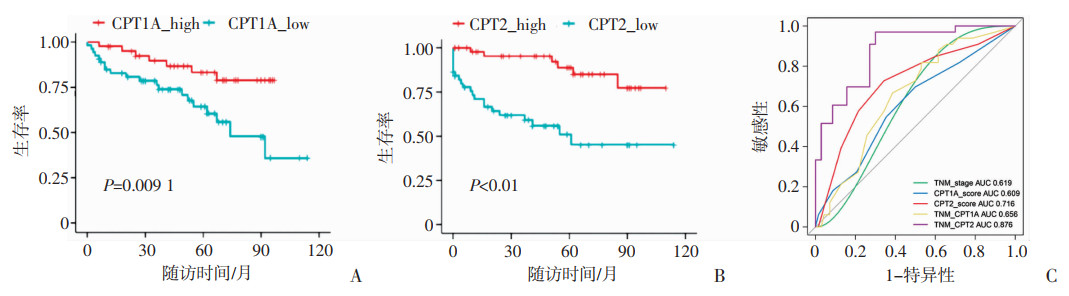
为进一步分析CPT1A、CPT2表达在ccRCC的意义,进行生存分析,结果表明CPT1A和CPT2低表达患者无疾病生存率较高表达患者明显更低(图 4A、B)。为了研究CPT1A、CPT2表达水平是否可以作为无疾病生存率的独立预后预测因素,进行Cox回归分析。单因素Cox回归分析显示,CPT1A、CPT2表达水平降低与较低的无疾病生存率显著相关(P < 0.05, P < 0.01)。对性别、年龄、病理分级、CPT1A和CPT2的表达水平、TNM分期进行多因素Cox回归分析, 结果显示CTP2是ccRCC无疾病生存率独立预后预测因素(表 2)。
|
| A: CPT1A生存分析;B: CPT2生存分析;C: 各独立预后因素及评分模型的ROC分析 图 4 CPT1A、CPT2与肾透明细胞癌预后的关系 |
| 因素 | 单因素分析 | 多因素分析 | |||||
| HR | 95%CI | P | HR | 95%CI | P | ||
| 性别 | |||||||
| (女性vs男性) | 0.930 | 0.442~1.958 | 0.848 | ||||
| 年龄/岁 | |||||||
| (>55 vs ≤55) | 1.788 | 0.850~3.761 | 0.126 | ||||
| 手术方式 | 1.320 | 0.585~2.710 | 0.104 | ||||
| (腹腔镜vs开放) | |||||||
| 坏死 | 1.540 | 1.084~2.971 | 0.047 | 1.365 | 0.873~2.162 | 0.076 | |
| (有vs无) | |||||||
| 病理分级 | |||||||
| (G3~G4 vs G1~G2) | 2.074 | 1.310~3.285 | 0.002 | 1.267 | 0.758~2.120 | 0.404 | |
| TNM分期 | |||||||
| (S3~S4 vs S1~S2) | 2.37 | 1.726~3.255 | < 0.001 | 2.625 | 1.630~4.228 | 0.009 | |
| CPT1A表达 | |||||||
| (高vs低) | 0.789 | 0.635~0.981 | 0.033 | 1.086 | 0.814~1.450 | 0.576 | |
| CPT2表达 | |||||||
| (高vs低) | 0.650 | 0.518~0.816 | < 0.001 | 0.681 | 0.496~0.936 | < 0.001 | |
2.4 CPT1A、CPT2与TNM分期联合预后预测模型的建立
单因素Cox回归分析显示,病理分级、坏死、TNM分期、CPT1A、CPT2表达水平均与无疾病生存率相关;多因素Cox回归分析显示TNM分期、CPT2表达与ccRCC预后相关,是独立的预后预测因子(表 2)。基于此,构建预后风险函数H=αX1+βX2 (X1=TNM分期; X2=CPT1A评分or CPT2评分)。TNM-CPT1A模型=2.220X1+0.884X2;TNM-CPT2模型=2.110X1+0.697X2;模型评分越高,ccRCC预后越差。以各独立因素为协变量,以本研究队列中非转移样本(n=84)随访结果为因变量,做ROC曲线分析,采用曲线下面积评估模型优劣。分析结果显示,与单独的TNM分期(AUC 0.619, 95%CI=0.467~0.811)相比,TNM-CPT1A模型(AUC 0.656, 95%CI=0.547~0.764, P=0.207)和TNM-CPT2模型(AUC 0.876, 95%CI= 0.808~0.944, P < 0.01)显著提高了预测准确性(图 4C)。
3 讨论长期以来,肾透明细胞癌缺乏良好的预后标志物。本研究从TCGA的ccRCC转录组学数据和MSKCC的代谢组学数据的生物信息学分析入手,发现脂肪酸降解减少可能是ccRCC脂质沉积重要原因。其中,CPT1A和CPT2是ccRCC脂肪酸降解关键基因。本研究结果表明,与癌旁正常组织相比,CPT1A、CPT2在ccRCC组织mRNA和蛋白水平均表达下调,其表达水平与病理分级和TNM分期呈负相关。而且CPT1A、CPT2表达水平越低,患者无疾病生存率越低。本研究发现,CPT1A、CPT2表达水平与TNM分期联合构建的预后预测模型TNM-CPT1A、TNM-CPT2可以显著提高TNM分期对预后预测的准确性,尤其是TNM-CPT2能更准确预测ccRCC患者预后。
本研究结果表明棕榈酰肉碱在ccRCC的代谢丰度高于正常肾组织。既往WETTERSTEN和GANTI等[13-14]也发现ccRCC患者尿液中酰基肉碱和肉碱水平升高,而且二者升高水平与病理分级相关,这都提示肉碱穿梭系统在ccRCC发生和进展中发挥重要作用,但肉碱棕榈酰转移酶(CPT1A、CPT2)的表达情况并不完全清楚。CPT1A在前列腺癌、肺癌、胃癌和乳腺癌等多种癌症中表达上调[6];与此相反,DU等[15]发现,与正常肾组织相比,CPT1A在ccRCC中表达下调,CPT1A是缺氧诱导因子1α(hypoxia inducible factor 1 alpha,HIF1A)和缺氧诱导因子2α(hypoxia inducible factor 2 alpha,HIF2A)转录抑制的直接靶点。CPT1A低表达是在VHL缺失的ccRCC细胞中观察到的,而再表达VHL可导致HIFs的降解、CPT1A信号及蛋白水平升高,并能抑制脂滴形成和肿瘤生长,这表明CPT1A是以VHL缺失依赖的方式被抑制[15-16]。另一项研究发现,CPT1A表达下调可促进ccRCC中脂质积聚和肿瘤进展,而过表达CPT1A可通过PPARα-CD36信号减少脂质积聚并抑制肿瘤细胞增殖[17]。尽管如此, ccRCC中CPT1A蛋白表达与病理分级、临床分期关系并不清楚。本研究结果证实CPT1A蛋白在ccRCC低表达;其表达水平与病理分级、临床分期呈负相关;分期分级越高,CPT1A表达越低。此外,值得注意的是,CPT1A也是琥珀酰化修饰的调节酶,可调节烯醇酶1(enolase 1)的琥珀酰化而促进乳腺癌增殖,以及调节S100A10的琥珀酰化而促进胃癌转移[18]。因此,CPT1A在ccRCC进展中的作用有待于进一步研究。
研究表明,CPT2在各癌种的表达情况并不一致,在前列腺癌和复发性乳腺癌中高表达,而在结直肠癌、肝癌、卵巢癌中低表达。目前CPT2在ccRCC的表达及临床意义并不清楚。本研究结果证实CPT2在ccRCC中表达降低;其表达水平与病理分级、临床分期呈负相关;分期分级越高,CPT2表达越低。近期多个研究表明下调CPT2可以抑制肉碱穿梭系统,影响β氧化和酮体的利用[19],与肿瘤治疗反应、化疗耐药、肿瘤细胞干性、增殖及转移能力有关。例如,CPT2下调可通过p53通路促进结直肠癌增殖并抑制凋亡[20],也可通过激活ROS/Wnt/β-catenin诱导的糖酵解以触发结直肠癌细胞干性和对奥沙利铂耐药[21]。另外,CPT2下调使肝癌细胞适应富脂微环境,促进肿瘤发生并增加对顺铂的耐药性[22-23];也可通过诱导ROS/NF-κB信号促进卵巢癌生长和转移[24]。因此,CPT2表达下调在ccRCC脂质沉积和肿瘤进展中的作用及重要性可能不亚于CPT1A,其机制值得深入研究。
脂质沉积是ccRCC最重要的病理学特征,是脂质摄入、合成及氧化等过程的结果,与肿瘤侵袭性、抗血管生成药物耐药及较差预后相关[8, 13, 15]。既往研究发现,HIF1A的激活增加了脂质受体基因(CD36, ACVRL1) 和脂质储存基因(HILPDA,FABP7)的转录,增加了脂质的摄入[25]。而ccRCC中ACLY、ACC、FASN及SCD1等脂肪酸从头合成关键酶的过表达则增加了脂肪酸的合成。本研究则发现CPT1A、CTP2表达下调是ccRCC脂肪酸降解减少的重要原因之一。以上脂代谢重编程过程最终导致了ccRCC细胞中脂质过度沉积,形成脂滴,构成病理染色上的“透明”表型。
TNM分期是目前肿瘤诊疗中应用最广泛的预后评价系统,最新版(第8版)肾癌TNM分期对ccRCC预后预测具有重要指导意义,但同一分期患者的临床结局常存在明显差异[26]。SSIGN评分和Leibovich(2018)评分是目前用于ccRCC预后风险评估的良好模型,二者分别在TNM分期之外添加了更多的临床指标,二者对ccRCC预后预测有重要意义,但存在指标更复杂、临床操作不便的问题[27-28]。本研究发现CPT1A、CPT2表达水平与ccRCC预后明显正相关,CPT1A、CPT2可作为ccRCC预后的预测指标。基于此,我们构建了结合TNM分期与CPT1A、CPT2表达的预后预测模型。结果显示,TNM-CPT1A、TNM-CPT2模型均可提高TNM分期对ccRCC预后预测的准确性,其中TNM-CPT2模型优于TNM-CPT1A模型。因此,CPT2可能是ccRCC中比CPT1A更优越的预后标志物。
本研究也存在一些不足。首先,本研究是一个单中心的回顾性队列研究,虽然有公共数据库TCGA-ccRCC队列mRNA水平的数据佐证,但结论仍需要进一步的外部验证。其次,血液相关指标,如血红蛋白、血钙、乳酸脱氢酶、中心粒细胞和血小板计数的纳入可能增加我们结果的可信度。
总之,本研究结果表明,与高表达患者相比,CPT1A、CPT2低表达预示ccRCC患者预后不良,二者可能是ccRCC预后标志物和潜在的治疗靶点。
| [1] |
BARATA P C, RINI B I. Treatment of renal cell carcinoma: current status and future directions[J]. CA Cancer J Clin, 2017, 67(6): 507-524. |
| [2] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA A Cancer J Clin, 2016, 66(2): 115-132. |
| [3] |
LJUNGBERG B, ALBIGES L, ABU-GHANEM Y, et al. European Association of Urology guidelines on renal cell carcinoma: the 2019 update[J]. Eur Urol, 2019, 75(5): 799-810. |
| [4] |
HSIEH J J, LE V H, OYAMA T, et al. Chromosome 3p loss-orchestrated VHL, HIF, and epigenetic deregulation in clear cell renal cell carcinoma[J]. J Clin Oncol, 2018, 36(36): JCO2018792549. |
| [5] |
KOUNDOUROS N, POULOGIANNIS G. Reprogramming of fatty acid metabolism in cancer[J]. Br J Cancer, 2020, 122(1): 4-22. |
| [6] |
MELONE M A B, VALENTINO A, MARGARUCCI S, et al. The carnitine system and cancer metabolic plasticity[J]. Cell Death Dis, 2018, 9(2): 228. |
| [7] |
BONNEFONT J P, DJOUADI F, PRIP-BUUS C, et al. Carnitine palmitoyltransferases 1 and 2: biochemical, molecular and medical aspects[J]. Mol Aspects Med, 2004, 25(5/6): 495-520. |
| [8] |
IWAMOTO H, ABE M, YANG Y L, et al. Cancer lipid metabolism confers antiangiogenic drug resistance[J]. Cell Metab, 2018, 28(1): 104-117. |
| [9] |
HAKIMI A A, REZNIK E, LEE C H, et al. An integrated metabolic atlas of clear cell renal cell carcinoma[J]. Cancer Cell, 2016, 29(1): 104-116. |
| [10] |
CHANDRASHEKAR D S, BASHEL B, BALASUBRA-MANYA S A H, et al. UALCAN: a portal for facilitating tumor subgroup gene expression and survival analyses[J]. Neoplasia, 2017, 19(8): 649-658. |
| [11] |
AIDERUS A, BLACK M A, DUNBIER A K. Fatty acid oxidation is associated with proliferation and prognosis in breast and other cancers[J]. BMC Cancer, 2018, 18(1): 805. |
| [12] |
KALLIONIEMI O P, WAGNER U, KONONEN J, et al. Tissue microarray technology for high-throughput molecular profiling of cancer[J]. Hum Mol Genet, 2001, 10(7): 657-662. |
| [13] |
WETTERSTEN H I, HAKIMI A A, MORIN D, et al. Grade-dependent metabolic reprogramming in kidney cancer revealed by combined proteomics and metabolomics analysis[J]. Cancer Res, 2015, 75(12): 2541-2552. |
| [14] |
GANTI S L, TAYLOR S L, KIM K, et al. Urinary acylcarnitines are altered in human kidney cancer[J]. Int J Cancer, 2012, 130(12): 2791-2800. |
| [15] |
DU W N, ZHANG L C, BRETT-MORRIS A, et al. HIF drives lipid deposition and cancer in ccRCC via repression of fatty acid metabolism[J]. Nat Commun, 2017, 8(1): 1769. |
| [16] |
HERAVI G, YAZDANPANAH O, PODGORSKI I, et al. Lipid metabolism reprogramming in renal cell carcinoma[J]. Cancer Metastasis Rev, 2022, 41(1): 17-31. |
| [17] |
YANG H, ZHAO H, REN Z, et al. Overexpression CPT1A reduces lipid accumulation via PPARα/CD36 axis to suppress the cell proliferation in ccRCC[J]. Acta Biochim Biophys Sin (Shanghai), 2022, 54(2): 220-231. |
| [18] |
LU W Q, CHE X F, QU X J, et al. Succinylation regulators promote clear cell renal cell carcinoma by immune regulation and RNA N6-methyladenosine methylation[J]. Front Cell Dev Biol, 2021, 9: 622198. |
| [19] |
LU X, ZHANG X H, ZHANG Y J, et al. Metabolic profiling analysis upon acylcarnitines in tissues of hepatocellular carcinoma revealed the inhibited carnitine shuttle system caused by the downregulated carnitine palmitoyltransferase 2[J]. Mol Carcinog, 2019, 58(5): 749-759. |
| [20] |
LIU F Q, LI X Q, YAN H, et al. Downregulation of CPT2 promotes proliferation and inhibits apoptosis through p53 pathway in colorectal cancer[J]. Cell Signal, 2022, 92: 110267. |
| [21] |
LI H, CHEN J H, LIU J, et al. CPT2 downregulation triggers stemness and oxaliplatin resistance in colorectal cancer via activating the ROS/Wnt/β-catenin-induced glycolytic metabolism[J]. Exp Cell Res, 2021, 409(1): 112892. |
| [22] |
FUJIWARA N, NAKAGAWA H, ENOOKU K, et al. CPT2 downregulation adapts HCC to lipid-rich environment and promotes carcinogenesis via acylcarnitine accumulation in obesity[J]. Gut, 2018, 67(8): 1493-1504. |
| [23] |
LIN M H, LV D, ZHENG Y L, et al. Downregulation of CPT2 promotes tumorigenesis and chemoresistance to cisplatin in hepatocellular carcinoma[J]. OncoTargets Ther, 2018, 11: 3101-3110. |
| [24] |
ZHANG X H, ZHANG Z, LIU S J, et al. CPT2 down-regulation promotes tumor growth and metastasis through inducing ROS/NFκB pathway in ovarian cancer[J]. Transl Oncol, 2021, 14(4): 101023. |
| [25] |
VAN DER MIJN J C, FU L P, KHANI F, et al. Combined metabolomics and genome-wide transcriptomics analyses show multiple HIF1α-induced changes in lipid metabolism in early stage clear cell renal cell carcinoma[J]. Transl Oncol, 2020, 13(2): 177-185. |
| [26] |
TAMAYO P, CHO Y J, TSHERNIAK A, et al. Predicting relapse in patients with medulloblastoma by integrating evidence from clinical and genomic features[J]. J Clin Oncol, 2011, 29(11): 1415-1423. |
| [27] |
PARKER W P, CHEVILLE J C, FRANK I, et al. Application of the stage, size, grade, and necrosis (SSIGN) score for clear cell renal cell carcinoma in contemporary patients[J]. Eur Urol, 2017, 71(4): 665-673. |
| [28] |
BLACKMUR J P, GABA F, FERNANDO D, et al. Leibovich score is the optimal clinico-pathological system associated with recurrence of non-metastatic clear cell renal cell carcinoma[J]. Urol Oncol, 2021, 39(7): 438. |




