2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:检验科
2. Department of Clinical Laboratory, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
婴儿喂养首选母乳,当亲母母乳不能成为新生儿喂养的第一选择时,世界卫生组织(WHO)推荐选择来自健康的产妇或人乳库(human milk bank)的捐赠人乳(donor human milk, DHM)[1]。人乳库是收集DHM,并负责人乳消毒、加工、检测、储存、分配使用等的专业机构。建立人乳库是收集DHM的重要方式,可使母乳缺失或母乳不足的新生儿能获得母乳喂养。自1909年奥地利建立首家人乳库以来,全球已建立600余家人乳库[2],截止2019年我国大陆地区共建立19家人乳库[3]。
人乳是一种生物产品,从采集、储存、加工到食用的过程中出现污染很常见,DHM的分享存在病毒或病原体传播的风险。中国大陆地区人乳库运行质量与安全管理专家的建议中提出巴氏消毒是DHM质量的关键风险控制点[4]。微生物学检测可对DHM巴氏消毒效果进行验证及筛选,人乳库环境感染控制可保障DHM灭菌条件[5]。2020年7月中国营养学会发布了医疗机构人乳库建立与管理规范团体标准[6],但目前各地人乳库DHM微生物学检测方法及环境感控效果检测尚无统一规范,DHM病原学谱分析及人乳库环境卫生相关研究较为缺乏。因此,本研究回顾性分析我院人乳库DHM的微生物学检测结果及环境卫生学监测结果,探讨采用液体增菌培养方法对DHM进行微生物学检测,并对人乳库进行环境感控监测,以期有效预防、消除DHM的潜在风险,为人乳库运行质量安全管理、风险控制措施提供参考。
1 资料与方法 1.1 一般资料选择2015年12月至2021年12月在陆军军医大学第一附属医院人乳库捐赠的1 601例DHM,均为本院住院分娩的健康产妇无偿捐赠,并签署捐乳知情同意书。纳入标准:①捐赠资格符合《2013年北美母乳库建立和运行管理指南》及T/CNSS 2020-003《医疗机构人乳库建立与管理规范》中捐赠筛查要求;②冷冻储存不超过3个月,冷藏储存不超过24 h; ③捐赠乳储存环境符合要求:独立区域放置且冷藏储存温度为4 ℃,冷冻储存温度为-20 ℃。排除标准:①储奶容器有破损或可疑污染;②外观可见异物或性状异常。本研究已获得陆军军医大学第一附属医院伦理委员会的批准[(B)KY202239]。
1.2 方法 1.2.1 微生物学检测方法采用液体增菌培养法进行DHM微生物学检测,培养皿使用血培养瓶。随机抽取同一捐赠者的同一批次DHM,全部混装后用无菌注射器抽吸乳汁样本,分别注入厌氧培养瓶及需氧培养瓶各8~10 mL进行孵育。培养基采用Thermo Scientific液体微生物培养基,35~37 ℃孵育120 h,检测仪器使用Thermo ScientificTM、VersaTREKTM 528、VITEK 2 COMPACT全自动微生物鉴定系统及VITEKMS质谱鉴定系统对标本进行菌种鉴定。参照全国临床微生物检验操作标准流程进行采样及细菌的分离培养,药敏标准参照美国抗微生物药物敏感性试验操作方法和判断标准(CISIM-100)。
1.2.2 环境卫生学检测方法医院感控专职人员每月对人乳库进行环境卫生学检测,检测项目包括室内空气、物体表面、人乳库工作人员手、咽拭子共4项。①空气采样:消毒或规定通风换气后且无人走动的情况下静止10 min采样,采样高度距离地面0.8~1.5 m,放在采样位置暴露5 min,采样完成后标记培养区域及时送检;②物体表面:用5 cm×5 cm灭菌规格板放在被检物体表面,用浸有无菌0.03 mol/L磷酸盐缓冲液棉拭子在规格板内横竖往返各涂5次,连续采样1~4个规格板面积,将棉拭子放入装有10 mL无菌检验用洗脱液的试管内送检;③工作人员手:人乳库工作人员进行卫生手消毒后,用浸有无菌0.03 mol/L磷酸盐缓冲液棉拭子在手指曲面从指根到指端来回涂擦各2次,一只手涂擦面积约30 cm2,将棉拭子放入10 mL采样液试管内及时送检;④咽拭子:选择人乳库工作人员,使其暴露喉咙,无菌拭子轻柔迅速擦拭双侧咽扁桃体和咽后壁3次,将拭子垂直放入试管内,避免擦拭瓶口,及时送检。
1.3 统计学方法所有原始数据采用IBM SPSS 23.0进行数据整理与分析,描述性统计方法,分类数据采用例数和百分率n(%),两组间分类资料比较采用卡方检验,不同年份间分类资料间分布采用卡方趋势检验,α=0.05。
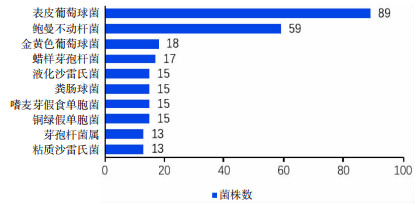
2 结果 2.1 DHM微生物学检测结果 2.1.1 消毒前DHM病原体分布情况共送检1 601例DHM样本,巴氏消毒前组共866例。消毒前DHM样本共培养出病原体644株,占比74.36%,无病原体生长222例,占比25.64%。检出革兰阳性菌334株,占比51.86%, 革兰阴性菌235株,占比36.49%,疑似污染73例,占比11.34%,真菌2株,占比0.31%。共检出两种厌氧菌:产气荚膜梭菌(3株)、第三梭菌(1株),菌种分布见表 1。消毒前DHM样本病原体检出株数最多的前10位中,前3位分别是表皮葡萄球菌(89株)、鲍曼不动杆菌(59株)、金黄色葡萄球菌(18株),病原体检出株数前10位统计情况见图 1。
| 菌种 | 检出(株) | 构成比(%) |
| 革兰阴性菌 | 235 | 36.49 |
| 鲍曼不动杆菌 | 59 | 9.16 |
| 液化沙雷氏菌 | 15 | 2.33 |
| 嗜麦芽假食单胞菌 | 15 | 2.33 |
| 铜绿假单胞菌 | 15 | 2.33 |
| 粘质沙雷氏菌 | 13 | 2.01 |
| 乌尔新不动杆菌 | 9 | 1.40 |
| 琼氏不动杆菌 | 8 | 1.24 |
| 产酸克雷伯菌 | 8 | 1.24 |
| 阴沟肠杆菌 | 7 | 1.09 |
| 肺炎克雷伯菌 | 7 | 1.09 |
| 洛菲不动杆菌 | 6 | 0.93 |
| 霍氏肠杆菌 | 4 | 0.62 |
| 荧光假单胞菌 | 4 | 0.62 |
| 放射根瘤菌 | 4 | 0.62 |
| 少动鞘氨醇单胞菌 | 3 | 0.47 |
| 奥斯陆摩拉菌 | 3 | 0.47 |
| 其他 | 55 | 8.54 |
| 革兰阳性菌 | 334 | 51.86 |
| 表皮葡萄球菌 | 89 | 13.82 |
| 金黄色葡萄球菌 | 18 | 2.79 |
| 蜡样芽孢杆菌 | 17 | 2.64 |
| 粪肠球菌 | 15 | 2.33 |
| 芽孢杆菌属 | 13 | 2.01 |
| 葡萄球菌属 | 11 | 1.71 |
| 枯草芽孢杆菌 | 7 | 1.09 |
| 唾液链球菌 | 7 | 1.09 |
| 棒状杆菌属 | 4 | 0.62 |
| 溶血葡萄球菌 | 4 | 0.62 |
| 产气荚膜梭菌 | 3 | 0.47 |
| 第三梭菌 | 1 | 0.16 |
| 其他 | 145 | 22.51 |
| 真菌 | 2 | 0.31 |
| 近平滑念珠菌 | 1 | 0.155 |
| 黄曲霉菌 | 1 | 0.155 |
| ≥3种菌生长,疑似污染 | 73 | 11.34 |
|
| 图 1 消毒前DHM病原体检出株数前10位统计情况 |
2.1.2 消毒后DHM病原体分布情况
巴氏消毒后组共735例DHM样本,培养出病原体92株,占比12.52%,无病原体生长643例,占比87.48%。检出病原体中革兰阳性菌59株,占比64.13%, 革兰阴性菌33株,占比35.87%。消毒后DHM样本检出两种厌氧菌:产气荚膜梭菌(1株)、第三梭菌(1株),菌种分布见表 2。病原体检出株数最多的前10位中,前3位分别是蜡样芽孢杆菌(23株)、芽孢杆菌属(12株)、表皮葡萄球菌(7株),检出病原体株数前10位统计情况见图 2。
| 菌种 | 检出(株) | 构成比(%) |
| 革兰阴性菌 | 33 | 35.87 |
| 奥斯陆摩拉菌 | 5 | 5.44 |
| 少动鞘氨醇单胞菌 | 5 | 5.44 |
| 乌尔新不动杆菌 | 2 | 2.17 |
| 液化沙雷氏菌 | 2 | 2.17 |
| 阴沟肠杆菌 | 2 | 2.17 |
| 琼氏不动杆菌 | 2 | 2.17 |
| 鲍曼不动杆菌 | 1 | 1.09 |
| 其他 | 14 | 15.22 |
| 革兰阳性菌 | 59 | 64.13 |
| 蜡样芽孢杆菌 | 23 | 25.00 |
| 表皮葡萄球菌 | 12 | 13.04 |
| 枯草芽孢杆菌 | 7 | 7.61 |
| 芽孢杆菌属 | 4 | 4.35 |
| 粪肠球菌 | 3 | 3.26 |
| 沃氏葡萄球菌 | 2 | 2.17 |
| 产气荚膜梭菌 | 1 | 1.09 |
| 第三梭菌 | 1 | 1.09 |
| 其他 | 6 | 6.52 |

|
| 图 2 消毒后DHM病原体检出株数前10位统计情况 |
2.1.3 DHM消毒前后微生物学检测结果对比
巴氏消毒后的病原体检出率明显低于巴氏消毒前,差异具有统计学意义(χ2=612.283,P < 0.01)。消毒后致病菌检出率降低,差异有统计学意义(χ2=418.154,P < 0.01),见表 3。
| 组别 | n | 检出病原体 | 检出致病菌 | 未检出病原体 |
| 巴氏消毒前 | 866 | 644(74.4) | 488(75.8) | 222(25.6) |
| 巴氏消毒后 | 735 | 92(12.5) | 57(61.9) | 643(87.5) |
| χ2 | 418.154 | 612.283 | ||
| P | < 0.01 | < 0.01 |
2.2 环境卫生学检测结果
2015-2021年人乳库空气、物体表面、工作人员手、咽拭子进行Ⅱ类环境监测,检测结果经过卡方趋势检验,人乳库空气合格率显著提升,差异有统计学意义(P < 0.05),物体表面、工作人员手检测、工作人员咽拭子检测合格率逐年递增,差异有统计学意义(P < 0.05),见表 4。
| 年份 | 空气 | 物体表面 | 工作人员手 | 工作人员咽拭子 | |||||||||||
| 检测数 | 合格数 | 合格率(%) | 检测数 | 合格数 | 合格率(%) | 检测数 | 合格数 | 合格率(%) | 检测数 | 合格数 | 合格率(%) | ||||
| 2015 | 12 | 7 | 58.3 | 24 | 18 | 75.0 | 12 | 8 | 66.7 | 16 | 10 | 62.5 | |||
| 2016 | 12 | 8 | 66.7 | 22 | 20 | 90.9 | 12 | 9 | 75.0 | 15 | 12 | 80.0 | |||
| 2017 | 13 | 11 | 84.6 | 23 | 20 | 87.0 | 12 | 10 | 83.0 | 17 | 15 | 88.2 | |||
| 2018 | 12 | 11 | 91.6 | 24 | 22 | 91.7 | 12 | 11 | 91.7 | 16 | 15 | 93.8 | |||
| 2019 | 12 | 12 | 100.0 | 25 | 23 | 92.0 | 13 | 12 | 92.3 | 16 | 15 | 93.8 | |||
| 2020 | 12 | 12 | 100.0 | 34 | 33 | 97.1 | 16 | 16 | 100.0 | 12 | 12 | 100.0 | |||
| 2021 | 12 | 12 | 100.0 | 31 | 31 | 100.0 | 16 | 16 | 100.0 | 12 | 12 | 100.0 | |||
| 合计 | 85 | 73 | 85.9 | 183 | 167 | 91.3 | 93 | 82 | 88.2 | 104 | 91 | 87.5 | |||
| χ2 | 14.180 | 11.436 | 10.826 | 11.019 | |||||||||||
| P | 0.005 | 0.036 | 0.032 | 0.036 | |||||||||||
3 讨论 3.1 巴氏消毒是保证DHM质量安全的关键环节
母乳并非无菌,研究表明采集人乳中,>75%的人乳样本有细菌生长[7]。本次调查结果显示,74.36%的DHM在巴氏消毒前存在病原体。检出的病原体中75.8%为致病菌,检出菌株数的前三位中包括鲍曼不动杆菌、金黄色葡萄球菌两种致病菌。鲍曼不动杆菌是临床最重要的致病菌之一,可引起医院获得性肺炎、血流感染、腹腔感染、中枢神经系统感染、泌尿系统感染、皮肤软组织感染等[8]。若喂养污染的DHM可能导致新生儿败血症、坏死性小肠结肠炎等不良后果,尤其对早产儿及低体重出生儿危害更大。疑因喂养污染采集母乳引起的新生儿败血症及坏死性小肠结肠炎的病例报道并非少见[9-10]。本次调查结果显示,经巴氏消毒后DHM病原体检出率明显降低,且消毒后检出的病原体中,致病菌检出率降低。因此,对DHM进行巴氏消毒,有效消灭人乳中本身存在或加工处理过程中可能污染的细菌,是保证DHM质量安全的关键环节。
3.2 采用严格的微生物学检测方法,提高DHM病原体检出率是关键控制点采用液体增菌培养法对DHM进行严格的微生物学检测筛选,可提高病原体检出率,有利于监控巴氏消毒效果,筛选出不合格DHM进行丢弃销毁。本次调查中12.5%的DHM因消毒后仍存在细菌而被丢弃。澳大利亚Perron Rotary Express人乳库4年间数据显示,有26%的巴氏消毒人乳因严格微生物学检测筛选被丢弃[11]。本次调查中发现DHM中检出了金黄色葡萄球菌及坂崎肠杆菌,食品安全国家标准微生物检验技术[12-14]中对于该类细菌均推荐进行增菌培养。同时,延长细菌培养时间,可降低假阴性风险。本次调查检出细菌中包括苛养菌诺卡菌属,此类细菌生长速度缓慢,一般5~7 d可见菌落,所需培养时间较长[15]。并且对DHM样本同时进行需氧和厌氧培养,可以提高厌氧菌检出率。本次调查中DHM检出产气荚膜梭菌和第三梭菌两种厌氧菌,其中产气荚膜梭菌是人类气性坏疽的主要细菌,所致疾病包括气性坏疽、食物中毒,引起坏死性结肠炎等严重后果。该菌需在厌氧环境进行培养,可形成芽孢,能耐受100 ℃、30 min的加热[16],无法通过巴氏消毒完全杀灭。本次调查结果显示,产气荚膜梭菌生长的DHM样本消毒前后的微生物检测结果中,需氧培养基结果均为阴性,而厌氧培养基结果为阳性,我院检验科立即报危急值,人乳库启动追溯及召回程序,对DHM紧急溯源、召回,人乳库封库采样后终末消毒,未造成不良后果。因此,对DHM进行严格的微生物学检测,使用液体增菌培养,延长培养时间,需氧和厌氧培养同时进行,严格病原体筛选,是控制DHM质量的最后环节,可预防及消除DHM安全危害,是保证DHM质量安全的关键控制点。
3.3 加强环境清洁消毒,提高人乳库环境卫生检测合格率,是确保人乳库运行安全的关键风险控制点对DHM的处理区域进行清洁和消毒的过程及评价应依照医疗机构环境表面清洁与消毒管理规范和医院感染预防与评价规范执行[6]。2019年我院人乳库改为使用医用等离子体空气消毒器每日进行2次空气循环消毒,环境卫生学检测结果显示自2019年起人乳库空气培养合格率显著提高。2020年我院人乳库参照我国最新颁布的人乳库团体标准对操作区域物体表面、超净台、冰箱、巴氏消毒水浴箱等仪器设备校准和消毒方式以及人乳库操作人员工作规范进行了调整和细化,环境卫生学检测结果显示,2020年起,我院人乳库物体表面和操作人员手卫生及咽拭子检测合格率均逐年上升。规范人乳库环境清洁与消毒,按照Ⅱ类环境进行环境卫生学监测,是保障DHM在加工、消毒、储存和分装等环节的质量安全的关键控制点。
3.4 研究局限及结论本研究的不足之处在于,只对DHM微生物检测实验方法进行了探讨,未观测DHM微生物检测时机及采样方式是否对检测结果及DHM质量造成影响。例如DHM微生物检测是采用随机抽样混装后采样,还是全批次混装后采样进行检测,仍需进一步探索。
综上所述,本研究表明:对DHM进行严格的微生物学检测,加强人乳库环境卫生学监测可以提高DHM质量,有效预防、消除DHM安全危害。我国人乳库发展建设正处于起步阶段,也是快速发展阶段,对潜在危害因素进行风险评估,确定控制措施,才能切实保障人乳库运行质量,保证提供更安全优质的DHM,推动人乳库可持续发展,使新生儿受益。
| [1] |
SAADEHM R. A new global strategy for infant and young child feeding[J]. Forum Nutr, 2003, 56: 236-238. |
| [2] |
韩树萍, 余章斌, 陈小慧. 2013年北美母乳库的建立和运行管理指南[J]. 中华实用儿科临床杂志, 2014, 29(23): 1838-1840. HAN S P, YU Z B, CHEN X H. Guidelines for the establishment and operation of adonorhumanmilkbanking in 2013[J]. Chin J Appl Clin Pediatr, 2014, 29(23): 1838-1840. |
| [3] |
寸待丽. 全球母乳库运行管理模式探讨[J]. 国际儿科学杂志, 2019, 46(2): 123-126. CUN D L. Human milk bank operation and management mode[J]. Int J Pediatr, 2019, 46(2): 123-126. |
| [4] |
中国医师协会儿童健康专业委员会母乳库学组, 中华医学会儿科学分会儿童保健学组, 《中华儿科杂志》编辑委员会. 中国大陆地区人乳库运行质量与安全管理专家建议[J]. 中华儿科杂志, 2017, 55(8): 577-579. Breast Milk Bank Group of Child Health Professional Committee of Chinese Medical Doctor Association, Child Health Care Group of Scientific Branch of Chinese Medical Doctor Association, Editorial Committee of Chinese Journal of Pediatrics. Recommendations of experts on the operation and management of human milk banks in Chinese Mainland[J]. Chin J Pediatr, 2017, 55(8): 577-579. |
| [5] |
中国医师协会儿童健康专业委员会母乳库学组, 中华医学会儿科学分会儿童保健学组, 《中华儿科杂志》编辑委员会. 中国大陆地区人乳库运行质量与安全管理专家建议[J]. 中华儿科杂志, 2017, 55(8): 577-579. Breast Milk Bank Group of Child Health Professional Committee of Chinese Medical Doctor Association, Child Health Care Group of Scientific Branch of Chinese Medical Association, Editorial Committee of Chinese Journal of Pediatrics. Expert suggestions on the operation quality and safety management of human milk banks in Chinese Mainland[J]. Chin J Pediatr, 2017, 55(8): 577-579. |
| [6] |
中国营养学会. 医疗机构人乳库建立与管理规范: T/CNSS 2020-003[S/OL]. (2020-07-31)[2022-04-27]. https://www.cnsoc.org/notice/files/@CmsXh_1646ee69-066d-4f76-be2b-3e1dbb8cb3de.pdf. Chinese Nutrition Society. Establishment and operation standard of human milk bank in medical institutions: T/CNSS 2020-003[S/OL]. (2020-07-31)[2022-04-27]. https://www.cnsoc.org/notice/files/@CmsXh_1646ee69-066d-4f76-be2b-3e1dbb8cb3de.pdf. |
| [7] |
COSSEY V, JEURISSEN A, THELISSEN M J, et al. Expressed breast milk on a neonatal unit: a hazard analysis and critical control points approach[J]. Am J Infect Control, 2011, 39(10): 832-838. |
| [8] |
陈佰义, 何礼贤, 胡必杰, 等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中国医药科学, 2012, 2(8): 3-8. CHEN B Y, HE L X, HU B J, et al. Consensus of Chinese experts on diagnosis, treatment and prevention of Acinetobacter baumannii infection[J]. China Med Pharm, 2012, 2(8): 3-8. |
| [9] |
BHATIA J. Human milk and the premature infant[J]. Ann Nutr Metab, 2013, 62(Suppl 3): 8-14. |
| [10] |
MURGUIA-PENICHE T, KIRSTEN G F. Meeting the challenge of providing neonatal nutritional care to very or extremely low birth weight infants in low-resource settings[J]. World Rev Nutr Diet, 2014, 110: 278-296. |
| [11] |
SIMMER K, HARTMANN B. The knowns and unknowns of human milk banking[J]. Early Hum Dev, 2009, 85(11): 701-704. |
| [12] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准, 食品微生物学检验, 金黄色葡萄球菌检验: GB 4789.10-2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission, State Food and Drug Administration. National standard for food safety, microbiological examination of food, Examination of Staphylococcus aureus: GB 4789.10-2016[S]. Beijing: Standards Press of China, 2017. |
| [13] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准, 食品微生物学检验, 单核细胞增生李斯特氏菌检验: GB 4789.30-2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission, State Food and Drug Administration. National standard for food safety, microbiological examination of food, Examination of Listeria monocytogenes: GB 4789.30-2016[S]. Beijing: Standards Press of China, 2017. |
| [14] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准, 食品微生物学检验, 克罗诺杆菌属: GB 4789.40-2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission, State Food and Drug Administration. National standard for food safety, microbiological examination of food, Examination of Cronobacteria: GB 4789.40-2016[S]. Beijing: Standards Press of China, 2017. |
| [15] |
王桂琴, 强华. 医学微生物学[M]. 北京: 中国医药科技出版社, 2016: 154-155. WANG G Q, QIANG H. Medical microbiology[M]. Beijing: China Medical Science and Technology Press, 2016: 154-155. |
| [16] |
JUNEJA V K, NOVAK J S, HUANG L H, et al. Increased thermotolerance of Clostridium perfringens spores following sublethal heat shock[J]. Food Control, 2003, 14(3): 163-168. |




