肝硬化(liver cirrhosis, LC)是由一种或多种致病因素长期或反复作用导致的弥漫性肝损害。组织学上表现为肝脏假结节再生、纤维间隔形成、肝结构塌陷及肝血管扭曲[1],进而引起肝脏功能受损及门静脉高压。门脉高压症(portal hypertension, PH)是肝硬化的一种严重的且几乎不可避免的并发症,也是其病程和预后的重要决定因素[2-4]。门脉高压性胃病(portal hypertensive gastropathy, PHG)是门脉高压在胃镜下的特征性表现,发生率为20%~75%[5],也是引起肝硬化患者消化道出血的常见原因之一[6-7]。目前,PHG具体发病机制尚未完全阐明,可能与门脉高压引起胃黏膜微循环血流动力学改变,黏膜防御屏障受损等相关[8]。
因存在高酸性环境,胃既往被认为不适宜微生物生长,但随着高通量测序技术在菌群研究中的广泛应用,研究发现胃中存在丰富的微生物群落[9]。生理状态下,胃酸是抑制微生物过度生长的一种有效的胃杀菌屏障[10],而肠-唾液硝酸盐循环和胃移行性复合运动能够增强胃液的杀菌作用[11-12],以上机制有利于维持胃菌群的动态平衡。病理状态下,如萎缩性胃炎、门静脉高压等可引起胃酸分泌减弱[13],胃液pH升高,胃杀菌屏障功能损害,从而造成胃菌群生态失调。既往研究发现胃菌群失调与胃炎、胃溃疡、胃癌等多种胃疾病进展相关[14]。然而,目前关于肝硬化门静脉高压症患者胃菌群结构特征以及胃菌群与PHG发生发展的相关性尚不清楚。
本研究选择拟行经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)治疗的肝硬化门脉高压症患者为研究对象,胃镜下收集患者胃黏膜和胃液标本,应用16s rRNA高通量测序技术,探讨肝硬化门脉高压症患者胃菌群结构特征,分析胃菌群结构变化的影响因素以及菌群与临床参数之间的相关性,为临床提供思考。
1 资料与方法 1.1 一般资料选取2020年11月至2021年11月因肝硬化于陆军特色医学中心消化内科拟接受TIPS治疗的23例患者。肝硬化及门脉高压症诊断依据病史、临床表现及CT或B超等辅助检查确诊。排除标准:①不愿接受胃镜检查或存在胃镜检查禁忌;②住院前1个月内服用PPI、抗生素、益生菌及益生元等;③既往接受门体分流或断流术;④严重心、肺等大器官功能衰竭、严重感染及非肝脏恶性肿瘤;⑤主观不愿意继续完成临床研究;⑥研究者认为不适于参与的任何医学或非医学状况。本研究方案经陆军特色医学中心医学伦理委员会批准[医研伦审(2020)第135号],患者均签署临床研究知情同意书。
1.2 样本采集及处理于TIPS术前1周采集患者胃液与胃黏膜标本。采集流程为:胃镜操作者严格按照胃镜操作规范穿戴手术衣帽、戴无菌手套,顺利进镜后,抽取无菌生理盐水50 mL经胃镜活检通道注入,分别从胃底、胃体、胃窦三部位反复回抽冲洗3次,再留取10 mL作为模拟胃液样本送检,分别从胃窦、大弯中下段胃体钳取黏膜标本各1块。所有标本按照采集要求于15 min内经液氮速冻5 min后,放置-80 ℃冰箱保存备检。
1.3 DNA提取及Illumina测序使用E.Z.N.A.® Stool DNA Kit试剂盒(Omega Bio-Tek, America)根据说明操作从组织样本中提取细菌DNA。采用细菌特异性引物对16S rDNA V3-V4高变区进行PCR扩增,上游引物341F:5′-CCTAYGGG-RBGCASCAG-3′;下游引物806R:5′-GGACTACNN-GGGTATCTAAT-3′。PCR反应体系为:5×FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、上游引物(5 μmol/L) 0.8 μL、下游引物(5 μmol/L) 0.8 μL、FastPfu聚合酶0.4 μL、BSA 0.2 μL、DNA模板10 ng、补ddH2O至20 μL;反应参数设置:95 ℃ 5 min;27个循环(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s);72 ℃ 10 min,10 ℃至停止。使用2%琼脂糖凝胶电泳检测PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen, America)进行纯化。利用Illumina公司的NovaSeq PE250平台进行测序,根据97%[15-16]的相似度对序列进行OTU聚类。以上操作均依托上海凌恩生物科技有限公司完成。
1.4 门静脉压力梯度测量局麻下穿刺右侧颈内静脉成功后, 置入RUPS-100肝穿刺装置(美国Cook公司),沿鞘送入导管至肝静脉出口下腔静脉作造影,并测量下腔静脉压(重复3次取均值),DSA导引下穿刺肝内门静脉,当证实穿入门静脉后,测门静脉压力(方法同上),门静脉压力与下腔静脉压力差即为门静脉压力梯度(portal pressure gradient,PPG)[17]。以上操作均在TIPS手术过程中完成。
1.5 PHG诊断标准依据McCormack分级标准[18],采用胃镜检查评估PHG的严重程度。轻度:黏膜表面呈现细小粉红色斑点或猩红热样疹,条纹状胃黏膜皱襞上出现表浅红斑,红色或粉红色水肿多边形区域被白色网格状结构间隔,即蛇皮征或马赛克征;重度:弥漫性樱桃红斑和(或)弥漫性出血性胃炎。
1.6 统计学分析采用SPSS 26.0软件进行一般资料统计分析,符合正态分布的计量资料以x±s表示,采用独立样本t检验;不符合正态分布的计量资料用M(P25,P75)表示,采用非参数独立样本Mann-Whitney秩和检验。生物信息学采用R 4.1.2软件进行分析。绘制Shannon- Wiener曲线反映测序数据的合理性和间接反映样品中物种丰度;物种累积曲线(species accumulation curves)判断测序样本量的充分性和预测样品中物种丰度。采用Kruskal-Wallis检验比较组间菌属相对丰度的差异。计算α多样性反映样本内观察到的物种丰度及多样性,采用Mann-Whitney秩和检验比较α多样性指数的差异。β多样性采用主坐标分析(principal co-ordinates analysis, PCoA),通过Adonis检验比较样本间组成的相似性或差异性。利用LEfSe(LDA Effect Size)工具比较组间差异菌群。通过冗余分析(redundancy analysis, RDA)探索在样本整体菌群结构变化过程中发挥主要作用的环境因子;将不同菌属的丰度与环境因子进行Spearman相关性分析,从而获得与环境因子相关的物种信息。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料共收集29例肝硬化患者临床资料及生物样本,其中6例患者胃黏膜标本因PCR扩增结果不符合测序分析要求被剔除,最终纳入23例患者(男性12例,女性11例),年龄(54.4±10.8)岁,16例为病毒性肝硬化,7例为非病毒性肝硬化。PHG与non-PHG患者间白细胞(white blood cells, WBC)、红细胞(redblood cell, RBC)、血红蛋白(hemoglobin, Hb)、血小板(platelet, PLT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、白蛋白(albumin, Alb)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)、总胆红素(total bilirubin, TBil)、凝血酶原时间(prothrombin time, PT)、国际标准化比值(international normalized ratio, INR)、血肌酐(serum creatinine, Scr)以及PPG等临床参数差异无统计学意义(P均>0.05),见表 1。
| 参数 | 总计(n=23) | PHG(n=14) | non-PHG(n=9) | P值 |
| 年龄/岁 | 54.4±10.8 | 53.1±13.0 | 56.2±6.4 | 0.516 |
| 性别 | 0.680 | |||
| 男 | 12(52.2) | 8(57.1) | 4(44.4) | |
| 女 | 11(47.8) | 6(42.9) | 5(55.6) | |
| BMI/kg·m-2 | 22.2±2.6 | 21.6±2.6 | 23.2±2.5 | 0.179 |
| 病因 | 0.999 | |||
| 病毒 | 16(69.6) | 10(71.4) | 6(66.7) | |
| 非病毒 | 7(30.4) | 4(28.6) | 3(33.3) | |
| WBC/109·L-1 | 3.24(2.15,3.88) | 3.30(2.16,3.69) | 3.01(2.01,4.08) | 0.926 |
| RBC/1012·L-1 | 2.73(2.34,3.32) | 2.74(2.22,3.19) | 2.67(2.44,3.68) | 0.403 |
| Hb/g·L-1 | 67(74,82) | 71(63,76) | 68(82,104) | 0.083 |
| PLT/109·L-1 | 68(45,81) | 70(40,88) | 67(48,71) | 0.688 |
| AST/U·L-1 | 31.8(25.6,60.2) | 28.3(24.1,56.8) | 40.3(26.5,76.5) | 0.277 |
| ALT/U·L-1 | 34.5(25.4,42.1) | 34.0(26.2,38.3) | 42.2(22.5,55.1) | 0.250 |
| Alb/g·L-1 | 34.2±6.4 | 33.0±5.3 | 36.1±7.7 | 0.263 |
| ALP/U·L-1 | 79.7(64.2,116.0) | 74.6(50.3,119.8) | 87.2(76.1,101.8) | 0.439 |
| GGT/U·L-1 | 34.2(17.4,58.9) | 49.8(15.8,60.5) | 28.1(17.7,50.8) | 0.999 |
| TBil/μmol·L-1 | 22.8(15.9,31.9) | 25.3(18.8,55.0) | 20.4(13.7,24.0) | 0.124 |
| PT/s | 13.7(12.6,15.9) | 13.5(12.0,15.7) | 13.7(12.7,16.0) | 0.877 |
| INR | 1.20(1.11,1.39) | 1.19(1.05,1.37) | 1.20(1.12,1.40) | 0.829 |
| Scr/μmol·L-1 | 67.6±15.3 | 69.6±14.4 | 64.6±17.1 | 0.462 |
| PPG/mmHg | 20.2±5.4 | 20.2±4.9 | 20.1±6.4 | 0.966 |
2.2 测序质量评估
Shannon-Wiener曲线是利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线,以此反映各样本在不同测序数量时的微生物多样性。结果显示,在一定范围内,随着测序量增加,Shannon值急剧上升,而继续增加测序量时,曲线逐渐趋向平坦,说明本研究测序数据量足够大,可以反映样本中绝大多数的物种信息。同样地,物种聚类曲线随着样本量的加大,曲线逐渐趋于平坦,说明本研究样本量能够满足分析要求。此外,从Shannon-Wiener曲线可知胃黏膜物种丰度高于胃液(图 1)。
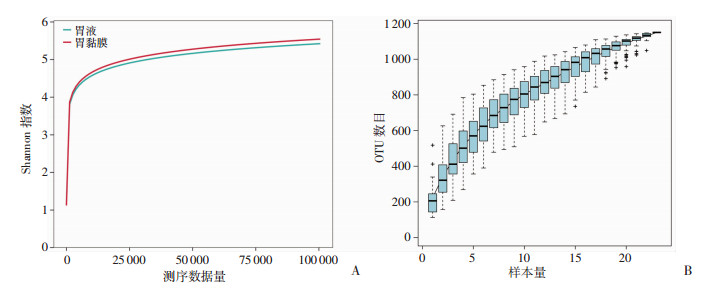
|
| A:菌群Shannon-Wiener曲线;B:胃菌群物种累积曲线 图 1 肝硬化患者胃菌群测序质量评估曲线 |
2.3 门脉高压症患者胃菌群特征 2.3.1 胃菌群组成分析
对肝硬化门脉高压症患者胃黏膜与胃液菌群相对丰度分析发现,胃黏膜主要菌群在门分类水平上分别为变形菌门(44.2%)、拟杆菌门(35.3%)、放线菌门(11.6%)、绿弯菌门(1.78%)、酸杆菌门(1.75%)等;胃液主要菌门分别为拟杆菌门(33.2%)、变形菌门(31.4%)、厚壁菌门(25.4%)、放线菌门(3.33%)、梭菌门(3.31%)。经Kruskal-Wallis检验结果发现,除拟杆菌门外,变形菌门、放线菌门、绿弯菌门、酸杆菌门、厚壁菌门、梭菌门在两者间相对丰度存在统计学差异(P<0.05)。在属分类水平上分析发现,胃黏膜主要菌属为Vibrionimonas属(26.8%)、慢生根瘤菌属(18.9%)、分枝杆菌属(10.3%)、Methylovirgula属(6.3%)等;胃液主要菌属为Vibrionimonas(13.7%)、链球菌属(13.0%)、慢生根瘤菌属(12.3%)、普氏-7菌属(5.2%),见图 2A、B。α多样性分析结果表明,胃黏膜Chao1指数显著高于胃液(2 662 vs 1 760,P<0.01,图 2C),而Shannon指数两组间差异无统计学意义(P>0.05),提示胃黏膜物种丰度显著高于胃液,而物种多样性胃黏膜与胃液无显著差异。基于Bray-Curtis距离对胃黏膜与胃液菌群β多样性分析,PCoA分析显示在PC1轴上两者菌群间能够相互区分,提示胃黏膜与胃液菌群结构不同,存在统计学差异(P<0.05,图 2E)。
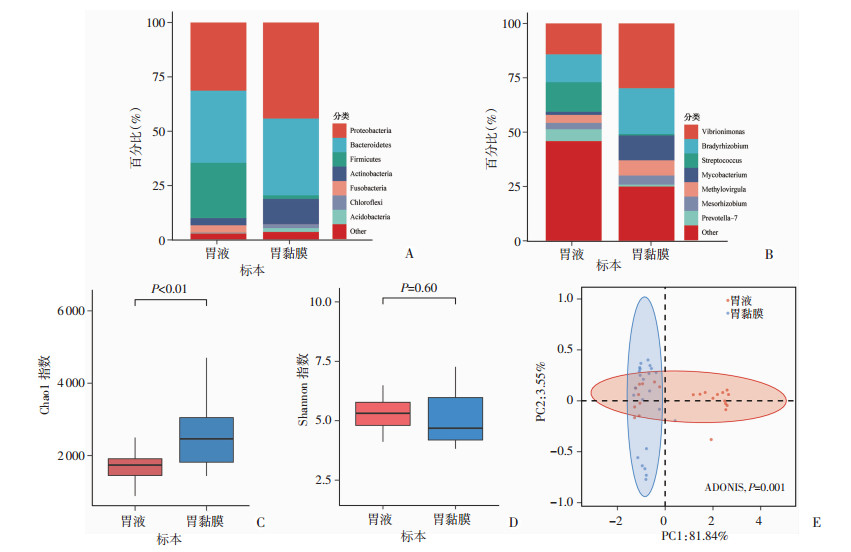
|
| A:门水平组成;B:属水平组成;C:Chao1指数比较;D:Shannon指数比较;E:PCoA分析图每个点代表一个不同的样本,PC1可能是影响群落组成的潜在主成分 图 2 肝硬化患者胃菌群组成 |
2.3.2 胃黏膜与胃液菌群差异分析
LEfSe分析是基于物种相对丰度表,通过非参数检验和线性判别分析的结合,用于群落丰度差异检验(本研究采用LDA>2, P<0.05为检验水准)。LEfSe分析显示,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)等菌群在胃黏膜中富集,而厚壁菌门(Firmicutes)、梭菌门(Fusobacteria)在胃液中富集(图 3)。
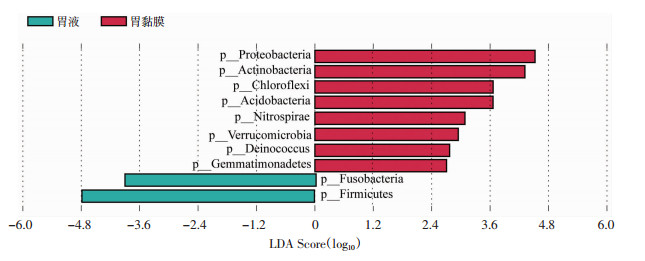
|
| 红色表示胃黏膜富集菌落;绿色表示胃液富集菌落 图 3 肝硬化患者胃黏膜与胃液菌群LEfSe分析 |
2.4 PHG患者胃菌群特征 2.4.1 PHG患者胃菌群组成特征
门水平上,PHG与non-PHG患者胃黏膜主要群落分别为变形菌门(43.4%, 45.4%)、拟杆菌门(36.7%, 33.1%)、放线菌门(11.8%, 11.3%)等。属水平上,PHG与non-PHG患者胃黏膜主要菌属分别为Vibrionimonas属(27.0%, 26.4%)、慢生根瘤菌属(20.0%, 17.3%)、分枝杆菌属(10.6%, 9.7%)等(图 4A、B)。α多样性分析表明,PHG与non-PHG患者胃黏膜Chao1指数(2 739 vs 2 543)、Shannon指数(5.21 vs 5.32)两组间差异均无统计学意义(P>0.05,图 4C、D)。β多样性显示,基于Bray-Curtis距离的PCoA分析表明,PHG与non-PHG患者胃黏膜菌群的相对丰度在整体上差异无统计学意义(P>0.05,图 4E)。
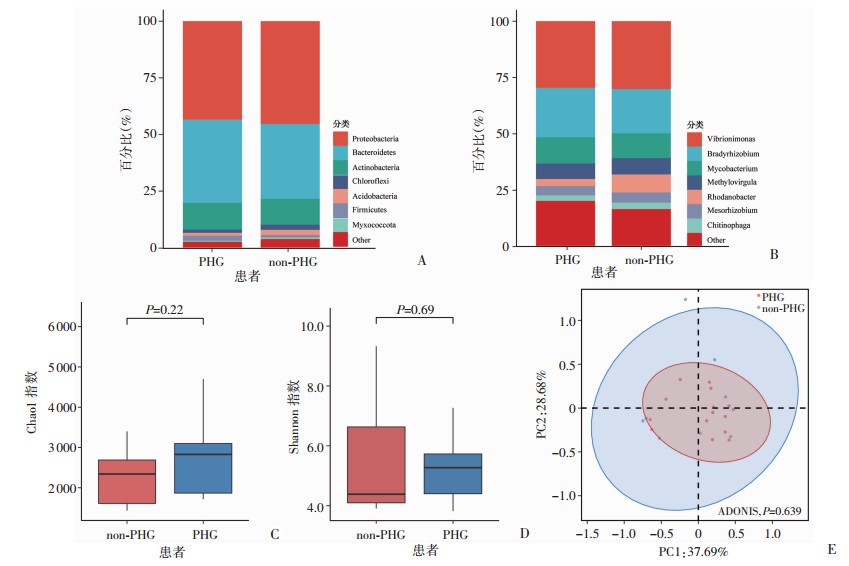
|
| A:门水平组成;B:属水平组成;C:Chao1指数比较;D:Shannon指数比较;E:PCoA可视化图 图 4 PHG与non-PHG患者胃黏膜菌群组成的比较 |
2.4.2 PHG患者胃黏膜差异菌群分析
PHG患者胃黏膜菌群组成与non-PHG患者不同。LEfSe分析显示,消化链球菌属(Peptostreptococcus)与二氧化碳噬纤维菌属(Capnocytophaga)在PHG患者胃黏膜中富集,而吞菌弧菌属(Peredibacter)在non-PHG患者胃黏膜中富集(图 5)。

|
| 红色表示non-PHG胃黏膜富集菌属;绿色表示PHG胃黏膜富集菌属 图 5 PHG患者胃黏膜菌群LEfSe分析 |
2.5 胃黏膜菌群与临床参数相关性分析 2.5.1 胃黏膜整体群落结构影响因素分析
为获得在胃黏膜整体群落结构变化过程中发挥主要作用的临床参数,采用RDA分析患者临床参数与胃黏膜群落的相关性,以相关系数的平方(r2)作为拟合优度的检验统计量,通过置换检验分析。结果表明,PPG与胃黏膜群落结构变化具有显著相关性(r2=0.683, P<0.001),而Hb、PLT、ALT、Alb与TBil与胃黏膜群落结构变化无明显相关性(P>0.05,表 2)。RDA分析可视化见图 6。
| 临床参数 | 胃黏膜 | |
| r2 | P值 | |
| Hb | 0.123 | 0.226 |
| PLT | 0.133 | 0.272 |
| ALT | 0.009 | 0.911 |
| Alb | 0.062 | 0.580 |
| TBil | 0.307 | 0.069 |
| PPG | 0.683 | <0.001 |
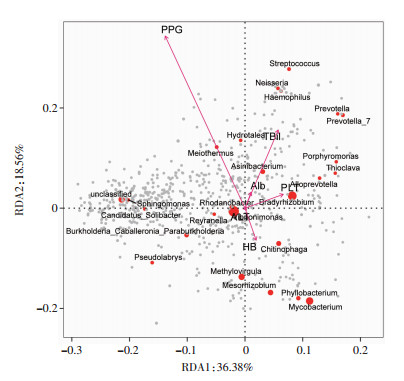
|
| 图 6 临床参数与胃黏膜群落结构变化RDA分析 |
2.5.2 菌群丰度与临床参数相关性分析
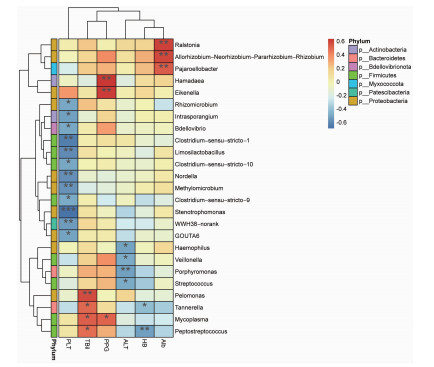
在属水平上采用Spearman等级相关分析寻找与患者临床参数相关的物种信息。结果表明,胃黏膜哈马达菌属(Hamadaea)、艾肯氏菌属(Eikenella)丰度与PPG呈正相关(r分别为0.633、0.618,P均<0.01);假单胞菌属(Pelomonas)丰度与TBil呈正相关(r=0.571,P<0.01);Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium属、Ralstonia属及Pajaroellobacter属丰度与Alb呈正相关(r分别为0.583、0.597、0.533,P<0.01);而寡养单胞菌属(Stenotrophomonas)丰度与PLT呈负相关(r=-0.698,P<0.001,图 7)。
|
| X轴上为临床参数,Y轴为菌属信息,Spearman等级相关系数R值在热图中以不同颜色展示:红色表示正相关,蓝色表示负相关。右侧图例是不同R值的颜色区间,左边的色条标注了物种所属门分类。*:P<0.05;* *:P<0.01;* * *:P<0.001 图 7 25种细菌与肝硬化患者临床参数相关性热图 |
3 讨论
门静脉高压是慢性肝病患者的重要临床特征之一,PHG是在门脉高压基础上形成的胃黏膜特征性改变,然而既往研究发现,门静脉压力与PHG的严重程度不具有显著相关性[19],提示在门静脉高压之外,可能存在其他因素参与PHG的发生发展。胃内因存在高酸性环境,曾被认为是无菌的,随着分子技术的发展与应用,目前发现胃内存在含量丰度高达102~104 CFU/mL的微生物群落[20]。胃肠道微生物群落对组织代谢、发育、炎症和免疫等均有影响[21]。胃微生物群落结构失调与胃溃疡、胃癌、胃MALT淋巴瘤等多种胃疾病发生发展密切相关[22],且在不同胃疾病中,胃菌群具有特征性改变[23]。然而肝硬化门脉高压症患者胃菌群特征及其影响因素尚未被重视,相关研究较少,对肝硬化PHG患者胃菌群特征更加缺乏认识。因此本研究利用16S rRNA技术对肝硬化门脉高压症患者胃菌群特征进行初步研究,进一步分析PHG胃黏膜菌群特征,并对影响门脉高压症患者胃菌群结构变化的相关因素进行探讨。
既往胃菌群研究主要基于胃液微生物培养,但胃液与胃黏膜上皮细胞间存在pH梯度[24],而pH是影响胃菌群特征的重要因素,因此有必要对胃黏膜与胃液菌群进行对比分析。本研究发现,肝硬化门脉高压症患者胃黏膜与胃液菌群在不同分类学水平上存在显著差异。门水平上,胃黏膜菌群主要由变形菌门、拟杆菌门、放线菌门、绿弯菌门、酸杆菌门组成;而胃液菌群则由拟杆菌门、变形菌门、厚壁菌门、放线菌门、梭菌门组成,与既往研究一致[25-26]。属水平上,胃黏膜菌群主要为弧菌属、慢生根瘤菌属、分枝杆菌属,而胃液主要菌属为弧菌属、链球菌属、慢生根瘤菌属。既往研究显示链球菌属、丙酸杆菌属和乳酸杆菌属在胃黏膜中富集,与本研究结果不同,提示门静脉高压可对胃菌群结构产生影响,引起胃黏膜菌群失调。α多样性分析表明,胃黏膜Chao1指数显著高于胃液,提示胃黏膜物种丰度显著高于胃液,与LI等[27]研究结果一致,但与其他一些研究结果不同。SUNG等[28]研究发现胃液菌群丰度显著高于胃黏膜,而SUN等[29]研究显示胃液中菌群多样性显著高于胃黏膜,但物种丰度上两者无显著差异。这可能与研究人群、疾病状态及其他因素(饮食、药物、生活习惯等)存在差异相关。β多样性分析显示,胃黏膜与胃液菌群结构不同,与SUN等[29]研究结果一致。LEfSe分析显示,变形菌门、放线菌门、酸杆菌门、绿弯菌门等在胃黏膜中相对丰度高于胃液,而厚壁菌门与梭菌门在胃黏膜中相对丰度低于胃液。这说明胃液中的菌群不等同于粘附在胃黏膜上的菌群。
PHG是引起肝硬化患者消化道出血的常见原因之一,也是肝硬化患者生存预后的独立危险因素。PHG的发生与门静脉高压、胃黏膜防御屏障破坏及细胞因子、炎性介质释放等有关,而胃肠道菌群失调与黏膜屏障功能受损及炎症介质释放密切相关。门静脉高压可对胃菌群结构产生影响,引起胃菌群失调,而胃菌群失调可能参与PHG的发生发展。本研究从胃菌群角度探索菌群与PHG发生的关系。结果显示PHG与non-PHG患者胃菌群整体结构在不同分类学水平上无显著差异;α多样性与β多样性两者间差异无统计学意义。这可能与纳入样本量较少有关,但也可能提示PHG并不是影响患者胃菌群结构变化的主要因素。LEfSe分析显示消化链球菌属(Peptostreptococcus)与二氧化碳噬纤维菌属(Capnocytophaga)在PHG患者胃黏膜中富集。消化链球菌属与二氧化碳噬纤维菌属均是人体口咽部的常驻菌,SUNG等[30]研究发现在根治幽门螺旋杆菌后的人群中,胃内消化链球菌属丰度较根治前显著增加。消化链球菌属与胃黏膜慢性炎症、萎缩及肠化密切相关[30-31],肝硬化患者肠道消化链球菌属丰度增加与慢加急性肝衰竭发生相关[32]。与non-PHG患者相比,PHG患者胃黏膜中消化链球菌属与二氧化碳噬纤维菌属相对丰度更高,提示胃菌群可能在PHG发生过程中发挥作用,为进一步探索PHG发病机制及防治策略提供有益参考。既往一项多中心随机对照试验表明,补充益生菌能够减少潜在病原微生物(potentially pathogenic microorganisms, PPMO) 在重症患者胃内定植[33]。那么能否通过补充益生菌抑制口咽等外源菌群在胃中定植,调节肝硬化患者胃菌群,从而有益于PHG的防治值得进一步探讨。
RDA分析显示,PPG是影响胃黏膜菌群群落结构变化的主要因素。PPG是反映门静脉高压的最直接的证据,可能通过以下途径影响胃菌群结构。一是门静脉高压引起胃黏膜微循环障碍,胃黏膜缺血、缺氧引起胃壁细胞数目减少和分泌功能障碍[13]。张民生等[34]曾报道,肝硬化患者胃液酸度随着门静脉压力升高而降低。细菌定植胃黏膜依赖于细菌的运动性及其对胃黏膜表面黏液降解能力。胃黏液层的黏度具有pH依赖性,随pH的增加而降低,因此当胃酸分泌降低时细菌更易在胃中定植[35-36]。二是门脉高压引起胃动力障碍[37-38],直接导致胃移行性复合运动增强及胃液杀菌的作用减弱,增加菌群在胃内定植风险。三是门脉高压引起小肠运动障碍及小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)[39],肠道菌群向胃内移位增多。Spearman等级相关分析表明,哈马达菌属(Hamadaea)与艾肯氏菌属(Eikenella)丰度与PPG呈正相关(P<0.001)。艾肯氏菌属是口腔及呼吸道正常菌群,提示随着PPG升高,随吞咽进入胃内的一些细菌可能更易在胃黏膜中定植。哈马达菌属是环境中的一种放线菌,但其在胃中定植尚未见报道。本研究还发现假单胞菌属(Pelomonas)丰度与TBil呈正相关(P<0.01)。SHAO等[40]曾报道Pelomonas在急性肝损伤模型小鼠肠道中丰度增加。SCHÄFFLER等[41]对克罗恩患者肠道菌群研究发现,Pelomonas丰度与疾病活动指数(Crohn’s disease activity index, CDAI)增加相关。由此推测,Pelomonas可能是一种促炎菌,能够促进肝脏炎症反应,加重肝损伤,从而显示与TBil相关性,但需进一步研究证实。
本研究是一项对肝硬化门脉高压症患者胃菌群特征的观察性研究,研究中也存在一些局限性。首先,纳入样本量偏少、人群地域局限。既往研究证实,胃内群落分布受环境、饮食、生活方式等因素影响,人群因素会导致研究存在人群选择偏倚。其次,研究中缺少健康人群以及肝硬化无门脉高压症人群作为对照,存在设计上的不足。
综上所述,本研究发现肝硬化门脉高压症患者胃黏膜与胃液菌群结构存在差异,但两者间物种多样性无显著差异。与肝硬化non-PHG患者相比,PHG患者胃黏膜菌群存在特征性改变,提示胃菌群可能参与PHG的发生。PPG是影响胃黏膜菌群结构变化的主要因素,胃黏膜哈马达菌属、艾肯氏菌属相对丰度升高可能与肝硬化门静脉高压相关。这为从胃菌群角度研究门静高脉症提供了重要参考价值。
| [1] |
SCHUPPAN D, AFDHAL N H. Liver cirrhosis[J]. Lancet, 2008, 371(9615): 838-851. |
| [2] |
BOSCH J, ABRALDES J G, BERZIGOTTI A, et al. The clinical use of HVPG measurements in chronic liver disease[J]. Nat Rev Gastroenterol Hepatol, 2009, 6(10): 573-582. |
| [3] |
GARCIA-TSAO G, ABRALDES J G, BERZIGOTTI A, et al. Portal hypertensive bleeding in cirrhosis: risk stratification, diagnosis, and management: 2016 practice guidance by the American association for the study of liver diseases[J]. Hepatology, 2017, 65(1): 310-335. |
| [4] |
D'AMICO G, GARCIA-TSAO G, PAGLIARO L. Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies[J]. J Hepatol, 2006, 44(1): 217-231. |
| [5] |
GJEORGJIEVSKI M, CAPPELL M S. Portal hypertensive gastropathy: a systematic review of the pathophysiology, clinical presentation, natural history and therapy[J]. World J Hepatol, 2016, 8(4): 231-262. |
| [6] |
MERLI M, NICOLINI G, ANGELONI S, et al. The natural history of portal hypertensive gastropathy in patients with liver cirrhosis and mild portal hypertension[J]. Am J Gastroenterol, 2004, 99(10): 1959-1965. |
| [7] |
PATWARDHAN V R, CARDENAS A. Review article: the management of portal hypertensive gastropathy and gastric antral vascular ectasia in cirrhosis[J]. Aliment Pharmacol Ther, 2014, 40(4): 354-362. |
| [8] |
YI Z Q, ZHANG M L, MA Z Y, et al. Role of the posterior mucosal defense barrier in portal hypertensive gastropathy[J]. Biomed Pharmacother, 2021, 144: 112258. |
| [9] |
RAJILIC-STOJANOVIC M, FIGUEIREDO C, SMET A, et al. Systematic review: gastric microbiota in health and disease[J]. Aliment Pharmacol Ther, 2020, 51(6): 582-602. |
| [10] |
GIANNELLA R A, BROITMAN S A, ZAMCHECK N. Gastric acid barrier to ingested microorganisms in man: studies in vivo and in vitro[J]. Gut, 1972, 13(4): 251-256. |
| [11] |
XU J, XU X, VERSTRAETE W. The bactericidal effect and chemical reactions of acidified nitrite under conditions simulating the stomach[J]. J Appl Microbiol, 2001, 90(4): 523-529. |
| [12] |
ZHANG S Y, SHI D, LI M R, et al. The relationship between gastric microbiota and gastric disease[J]. Scand J Gastroenterol, 2019, 54(4): 391-396. |
| [13] |
高萍, 张绍刚, 张美艳. 肝硬化患者胃内24 h pH监测结果分析[J]. 临床军医杂志, 2011, 39(6): 1267-1268. GAO P, ZHANG S G, ZHANG M Y. Analysis of 24h pH monitoring results in the stomach of patients with liver cirrhosis[J]. Clin J Med Off, 2011, 39(6): 1267-1268. |
| [14] |
SJÖVALL H. Meaningful or redundant complexity—mechanisms behind cyclic changes in gastroduodenal pH in the fasting state[J]. Acta Physiol (Oxf), 2011, 201(1): 127-131. |
| [15] |
EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nat Methods, 2013, 10(10): 996-998. |
| [16] |
STACKEBRANDT E, GOEBEL B M. Taxonomic note: a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. Int J Syst Evol Microbiol, 1994, 44(4): 846-849. |
| [17] |
RÖSSLE M. TIPS: 25 years later[J]. J Hepatol, 2013, 59(5): 1081-1093. |
| [18] |
MCCORMACK T T, SIMS J, EYRE-BROOK I, et al. Gastric lesions in portal hypertension: inflammatory gastritis or congestive gastropathy?[J]. Gut, 1985, 26(11): 1226-1232. |
| [19] |
PERINI R F, CAMARA P R S, FERRAZ J G P. Pathogenesis of portal hypertensive gastropathy: translating basic research into clinical practice[J]. Nat Clin Pract Gastroenterol Hepatol, 2009, 6(3): 150-158. |
| [20] |
DELGADO S, CABRERA-RUBIO R, MIRA A, et al. Microbiological survey of the human gastric ecosystem using culturing and pyrosequencing methods[J]. Microb Ecol, 2013, 65(3): 763-772. |
| [21] |
OHNO H, SATOH-TAKAYAMA N. Stomach microbiota, Helicobacter pylori, and group 2 innate lymphoid cells[J]. Exp Mol Med, 2020, 52(9): 1377-1382. |
| [22] |
LIU X S, SHAO L, LIU X, et al. Alterations of gastric mucosal microbiota across different stomach microhabitats in a cohort of 276 patients with gastric cancer[J]. EBioMedicine, 2019, 40: 336-348. |
| [23] |
ZHANG X M, LI C, CAO W J, et al. Alterations of gastric microbiota in gastric cancer and precancerous stages[J]. Front Cell Infect Microbiol, 2021, 11: 559148. |
| [24] |
HUNT R H, YAGHOOBI M. The esophageal and gastric microbiome in health and disease[J]. Gastroenterol Clin N Am, 2017, 46(1): 121-141. |
| [25] |
BASSIS C M, ERB-DOWNWARD J R, DICKSON R P, et al. Analysis of the upper respiratory tract microbiotas as the source of the lung and gastric microbiotas in healthy individuals[J]. mBio, 2015, 6(2): e00037. |
| [26] |
SCHULZ C, SCHVTTE K, KOCH N, et al. The active bacterial assemblages of the upper GI tract in individuals with and without Helicobacter infection[J]. Gut, 2018, 67(2): 216-225. |
| [27] |
LI M, SHAO D, ZHOU J, et al. Microbial diversity and composition in six different gastrointestinal sites among participants undergoing upper gastrointestinal endoscopy in Henan, China[J]. Microbiol Spectr, 2022, 10(3): e0064521. |
| [28] |
SUNG J, KIM N, KIM J, et al. Comparison of gastric microbiota between gastric juice and mucosa by next generation sequencing method[J]. J Cancer Prev, 2016, 21(1): 60-65. |
| [29] |
SUN Q H, ZHANG J, SHI Y Y, et al. Microbiome changes in the gastric mucosa and gastric juice in different histological stages of Helicobacter pylori-negative gastric cancers[J]. World J Gastroenterol, 2022, 28(3): 365-380. |
| [30] |
SUNG J, COKER O, CHU E, et al. Gastric microbes associated with gastric inflammation, atrophy and intestinal Metaplasia 1 year after Helicobacter pylori eradication[J]. Gut, 2020, 69(9): gutjnl-2019. |
| [31] |
WU F, YANG L Y, HAO Y H, et al. Oral and gastric microbiome in relation to gastric intestinal metaplasia[J]. Int J Cancer, 2022, 150(6): 928-940. |
| [32] |
SOLÉ C, GUILLY S, DA SILVA K, et al. Alterations in gut microbiome in cirrhosis as assessed by quantitative metagenomics: relationship with acute-on-chronic liver failure and prognosis[J]. Gastroenterology, 2021, 160(1): 206-218. |
| [33] |
ZENG J, WANG C T, ZHANG F S, et al. Effect of probiotics on the incidence of ventilator-associated pneumonia in critically ill patients: a randomized controlled multicenter trial[J]. Intensive Care Med, 2016, 42(6): 1018-1028. |
| [34] |
张民生, 冯燕, 江月萍, 等. 肝硬化非曲张静脉破裂出血与血清促胃液素、胃液酸度及门静脉内径关系探讨[J]. 青岛大学医学院学报, 2001, 37(4): 329-330. ZHANG M S, FENG Y, JIANG Y P, et al. A study on relationship of nonvaricos-rupture hemorrhage of cirrhosis with serum gastrin, acidity of gastric juice and the inner diameter of portal vein[J]. J Qingdao Univ Med Sci, 2001, 37(4): 329-330. |
| [35] |
SWIDSINSKI A, SYDORA B C, DOERFFEL Y, et al. Viscosity gradient within the mucus layer determines the mucosal barrier function and the spatial organization of the intestinal microbiota[J]. Inflamm Bowel Dis, 2007, 13(8): 963-970. |
| [36] |
GODDARD A F, SPILLER R C. The effect of omeprazole on gastric juice viscosity, pH and bacterial counts[J]. Aliment Pharmacol Ther, 1996, 10(1): 105-109. |
| [37] |
APRILE L R O, MENEGHELLI U G, MARTINELLI A L C, et al. Gastric motility in patients with presinusoidal portal hypertension[J]. Am J Gastroenterol, 2002, 97(12): 3038-3044. |
| [38] |
FAHMY M E, OSMAN M A, MAHMOUD R A, et al. Measuring of gastric emptying in Egyptian pediatric patients with portal hypertension by using real-time ultrasound[J]. Saudi J Gastroenterol, 2012, 18(1): 40-43. |
| [39] |
GUNNARSDOTTIR S A, SADIK R, SHEV S, et al. Small intestinal motility disturbances and bacterial overgrowth in patients with liver cirrhosis and portal hypertension[J]. Am J Gastroenterol, 2003, 98(6): 1362-1370. |
| [40] |
SHAO Y, JIANG Y C, LI H, et al. Characteristics of mouse intestinal microbiota during acute liver injury and repair following 50% partial hepatectomy[J]. Exp Ther Med, 2021, 22(3): 953. |
| [41] |
SCHÄFFLER H, HERLEMANN D P R, ALBERTS C, et al. Mucosa-attached bacterial community in Crohn's disease coheres with the clinical disease activity index[J]. Environ Microbiol Rep, 2016, 8(5): 614-621. |




