2. 710077 西安,西安医学院第一附属医院妇产科
2. Department of Obstetrics and Gynecology, First Affiliated Hospital of Xi'an Medical University, Xi'an, Shaanxi Province, 710077, China
胰腺癌(pancreatic cancer)发病率逐年增加,位列所有癌症致死原因第5位,是一种恶性程度极高的消化系统肿瘤。由于早期无明显症状、疾病进展快及化疗有效率低,患者预后极差,总体5年生存率仅有8%,又将其称为“癌中之王”[1]。胰腺癌治疗目前主要采取手术为主,并辅助放、化疗的综合治疗手段,但90%的胰腺癌患者经指南推荐的治疗后效果欠佳[2]。因此,深入阐明胰腺癌的发生机制结合分子靶向干预和放化疗,是提高胰腺癌疗效的重要手段[3]。Smad3是重要的细胞内分子,负责将细胞质膜受体信号传至细胞核[4-5]。Smad3作为重要的转录因子,是转移生长因子β(transforming growth factor β, TGF-β)下游的重要靶点。在细胞增殖[6]、损伤修复[7]、纤维化[8]、癌症发展等方面发挥着重要作用[9-10]。在肝癌后期Smad3通过诱导上皮-间质转化促进肿瘤转移[11],然而Smad3在胰腺癌发生、发展中的作用目前仍不清楚。
分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)可将细胞外信息传递至细胞核中,在生理及病理过程中发挥重要的作用。其中p38是重要的应激激酶,能对外界刺激迅速做出反应[12]。p38在体内有α、β、γ和δ 4种亚型,且胰腺癌细胞均表达p38的4种亚型。研究发现降低胰腺癌细胞中p38 α和p38 β的表达能够抑制胰腺癌细胞的体外生长,同时发现p38 α能促进胰腺癌的迁移,而p38 β对胰腺癌的迁移无明显调控作用,由此可见p38/MAPK在胰腺癌中发挥亚型特异性功能[13]。此外,胰腺癌细胞分泌外泌体被T淋巴细胞摄取后激活p38/MAPK信号通路,进而诱导内质网应激介导细胞凋亡,促进胰腺癌发生、发展[14]。
自噬在生物体高度保守是维持机体稳态的重要机制[15-16],依赖溶酶体对细胞组分的降解以维持逆境条件下机体的代谢平衡。自噬异常与胰腺癌等众多肿瘤的发生、发展密切相关[17]。早期研究表明,利用遗传和药理抑制自噬会导致活性氧(reactive oxygen species, ROS)产生,增加DNA损伤和代谢功能障碍,最终抑制胰腺癌的发展[18]。此外,自噬还可以通过降解MHC-I促进胰腺癌的免疫逃避,表明自噬增加有助于胰腺癌的进展[19]。
p38/MAPK信号通路不仅对自噬具有促进和抑制的双重性调控[20],而且也是细胞凋亡的主要调控通路之一。胰腺癌细胞对细胞凋亡有抵抗力,从而促进其侵袭性和对常规治疗方式的抵抗力[21]。因此,靶向细胞凋亡途径是胰腺癌治疗的新思路。在生物体内细胞自噬与凋亡过程存在十分复杂的相互作用关系,过度自噬会诱导细胞凋亡。本研究通过干预Smad3的表达初步探讨Smad3对胰腺癌细胞Panc-1、BxPC-3自噬和凋亡的影响机制,进而初步验证Smad3表达水平在人胰腺癌诊断和进展中的价值;同时探究Smad3对胰腺癌细胞自噬的调控能力,以期为胰腺癌的治疗提供新的靶点和理论依据。
1 材料与方法 1.1 细胞、标本及试剂人的胰腺癌细胞系Panc-1、AsPC-1、BxPC-3购自美国ATCC细胞库(American Type Culture Collection);胰腺正常导管上皮细胞HPDE购自武汉普诺赛公司。对照和胰腺癌患者组织标本来自2015-2020年西安医学院第一附属医院和咸阳人民医院。标本获取经捐赠者或亲属的书面知情同意,研究获得西安医学院第一附属医院伦理委员会的批准(XYL2022122)。主要试剂:胎牛血清、DMEM细胞培养基、胰蛋白酶购自HyClone公司;LipofectamineTM2000购自美国英杰生命技术有限公司;总蛋白提取试剂盒、PI-Annexin-V试剂盒购自碧云天生物技术有限公司;抗体Smad3、p-Smad3购自爱博泰克生物有限公司;GAPDH购自康成生物技术有限公司;p-p38、p38、LC3、p62购自美国Cell Signaling Technology公司;SB203580购自北京索莱宝科技有限公司;辣根过氧化物酶标记的山羊抗小鼠二抗购自美国Sigma公司;DAB检测试剂盒购自中杉金桥公司。对照组(Sh-Scramble)病毒及Smad3敲减序列(Sh-Smad3、CRISPR/Cas9-Smad3)由擎科生物公司合成,见表 1。
| 名称 | 序列(5′→3′) |
| ShScramble | 正义链:CCGGGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAACTCGAGTTCTTTTTG 反义链:AATTCAAAAAGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAACTCGAGTTC |
| shSmad3-1 | 正义链:CCGGGAGCCTGGTCAAGAAACTCAACTCGAGTTGAGTTTCTTGACCAGGCTCTTTTTG 反义链:AATTCAAAAAGAGCCTGGTCAAGAAACTCAACTCGAGTTGAGTTTCTTGACCAGGCTC |
| shSmad3-2 | 正义链:CCGGTGAGCAGAACAGGTAGTATTACTCGAGTAATACTACCTGTTCTGCTCATTTTTG 反义链:AATTCAAAAATGAGCAGAACAGGTAGTATTACTCGAGTAATACTACCTGTTCTGCTCA |
| gRNA-1 | 正义链:CACCGGCTGTAGTCGTCCAGTGGG 反义链:AAACCCCACTGGACGACTACAGCC |
| gRNA-2 | 正义链:CACCGCGCTCCGAATTGGAGGGGT 反义链:AAACACCCCTCCAATTCGGAGCGC |
1.2 生物信息学分析
利用GEPIA2数据库(http://gepia.cancer-pku.cn/) 对Smad3在胰腺正常组织(n=171)及癌组织(n=179) 中的表达差异和存活相关性进行统计学分析。
1.3 免疫组化将临床标本组织切片放置60 ℃烘箱烘片1 h,将切片放入环保透明剂中脱蜡2次,每次20 min。之后依次放入100%、95%、70%、50%乙醇中各水化5 min,去离子水中浸泡5~10 min后置于10 mmol/L pH 6.0柠檬酸- 柠檬酸钠缓冲溶液中抗原修复3.5 min,室温自然冷却。PBS中浸泡5~10 min,3% H2O2室温放置10 min,0.1% TX-100室温孵育10 min,PBS洗2~3次,每次5 min,3% BSA室温封闭1 h。一抗Smad3(1 ∶500)溶于1% BSA,4 ℃过夜。1×PBS洗4次,每次5 min,二抗室温孵育1 h。PBS洗4次,每次5 min,DAB显色后,苏木精复染3~5 min后自来水充分冲洗显色。1% HCl(75% 乙醇中)水化5 s,自来水冲洗3~5 min,95%、100%乙醇各脱水5 min,最后用中性树胶封片保存。
1.4 细胞培养及分组胰腺癌细胞株Panc-1、BxPC-3生长于37 ℃、5% CO2以及饱和湿度的恒温培养箱中。细胞培养使用含10% FBS、1%双抗(链霉素、青霉素)的完全培养基,2 d进行一次传代。敲减实验分为对照组(Scr)和Smad3敲减组(ShSmad3-1、ShSmad3-2组:细胞分别转染ShSmad3-1、ShSmad3-2慢病毒);敲除实验分为空白对照组(WT)和Smad3敲除组(Smad3 KO-1、Smad3 KO-2组:Panc-1细胞分别转入CRISPR/Cas9-Smad3质粒,经嘌呤霉素筛选后的单克隆细胞系1#、2#)。回复实验在敲减实验3组基础上再加入25、50 μmol/L羟氯喹(HCQ);过表达实验在敲减实验3组基础上再加入外源过表达Smad3(pLVX- Smad3);抑制实验在敲减实验3组基础上再加入p38抑制剂SB203580 20 μmol/L(SB203580)。处理细胞48 h后,收集各组细胞进行相关检测。
1.5 病毒包装当293T细胞生长至60%~70%时进行转染。将PMD2.G、PSPAX2、pLKO.1 sh-Smad3按1 ∶1 ∶1各8 μg及60 μL转染试剂PEI加入750 μL DMEM培养基(不含血清、双抗),混合均匀,室温放置20 min后加入293T细胞转染4~6 h,换新鲜完全培养基,继续培养48 h可收集培养基上清,1 500×g离心10 min,取上清,再用0.45 μm滤膜过滤,所得液体即为包装后病毒。
1.6 慢病毒感染BxPC-3细胞在6孔板中长到融合度为50%~60%时,按培养基与病毒液体积比1 ∶1进行加液,同时加入1 μL (2 000×) polybrene混匀。2 d后,加入1.5 μg/mL嘌呤霉素筛选2 d,收样进行检测。
1.7 CRISPR/Cas9、ShSmad3质粒构建及CRISPR/Cas9-Smad3敲除细胞的筛选将合成的gRNA及ShRNA正义链与反义链进行退火,退火产物与经过双酶切的pLKO.1 (EcoRⅠ、AgeⅠ)、PX459(BbsⅠ)载体进行连接,小提质粒,并经测序验证。
将构建好的针对Smad3基因的CRISPR/Cas9敲除质粒纯化后转入胰腺癌细胞(Panc-1)中。经过稳定筛选挑单克隆,并通过提取基因组DNA和Western blot确定其表达情况。经过鉴定筛选2个独立的细胞系用于后续实验。基因组PCR上游引物序列:5′-GCCTTC-AATATGAAGAAGGAC-3′,下游引物序列:5′-CATTCG-GGTCAACTGGTA-3′。
1.8 细胞计数将生长良好的105个细胞铺在6孔板上,分别在生长0、3、5 d用血球计数板进行细胞计数,并用结晶紫进行染色。
1.9 蛋白提取及Western blot检测收好的细胞加入含有蛋白酶抑制剂的裂解溶液Lysis Buffer (DTT、mG132、Cocktail、DTT、PhosSTOP)置于冰上,每隔5 min剧烈涡旋1次,共裂解20 min后,12 500×g、4 ℃离心5 min,取上清进行BCA蛋白定量,加入对应体积的蛋白上样缓冲液(5×Loading buffer),95 ℃加热5 min后进行蛋白电泳。10% SDS-PAGE电泳分离,转移至PVDF膜(使用前用甲醇浸泡激活30 s),用含5%脱脂奶粉的PBST摇床封闭1 h。加入一抗p-p38、p38、LC3、p62(1 ∶1 000)、Smad、p-Smad3(1 ∶1 000)、GAPDH(1 ∶10 000),4 ℃孵育过夜,PBST洗膜4次,每次5 min,室温孵育二抗1 h,PBST洗膜4次,每次5 min,用ECL法发光后胶片曝光。
1.10 PI-Annexin V染色BxPC3、Panc-1胰腺癌细胞用PBS洗涤2次,用不含EDTA的胰酶进行完全消化,1 000×g离心5 min,弃上清收集细胞,并用PBS轻轻重悬细胞计数,然后再1 000×g离心5 min,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC轻轻混匀,加入10 μL碘化丙啶染色液(PI),然后在室温下避光孵育15 min,最后通过流式细胞仪检测分析。
1.11 统计学分析数据以x±s表示,使用Microsoft Excel 2003(Microsoft Corp)与GraphPad Prism 5.0(GraphPad Software Inc.)软件进行数据采集、记录、运算与分析。两组间差异比较采用两独立样本t检验,多组间差异比较采用方差分析。P < 0.05表示差异有统计学意义。
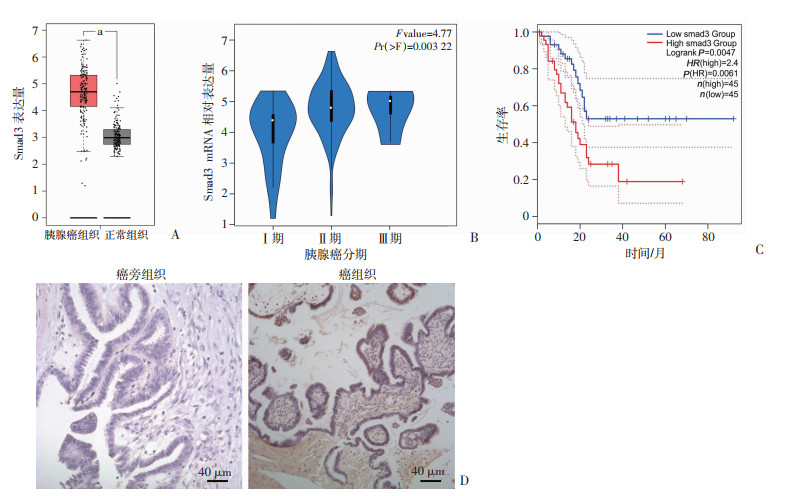
2 结果 2.1 Smad3蛋白表达与胰腺癌的关系GEPIA2数据库分析结果显示,与正常胰腺组织相比,Smad3在胰腺癌组织中高表达(P < 0.05,图 1A),同时在胰腺癌不同分期Smad3的表达差异有统计学意义(P=0.003 22,图 1B)。进一步将胰腺癌患者分为Smad3高表达组(n=45)和Smad3低表达组(n=45),通过生存分析发现Smad3的表达与胰腺癌患者的生存率呈负相关(P=0.006 1,图 1C)。利用临床病理标本进行免疫组化染色,发现Smad3在胰腺癌组织中高表达(图 1D)。
|
| A:GEPIA2数据库分析胰腺癌组织与正常组织中Smad3的表达 a:P < 0.05;B:GEPIA2数据库分析胰腺癌不同分期中Smad3的表达差异;C:Smad3表达与患者生存的相关性;D:免疫组化检测Smad3在胰腺病理切片中的表达 图 1 Smad3在正常组织及胰腺癌组织中的表达 |
2.2 胰腺癌细胞系中Smad3的表达
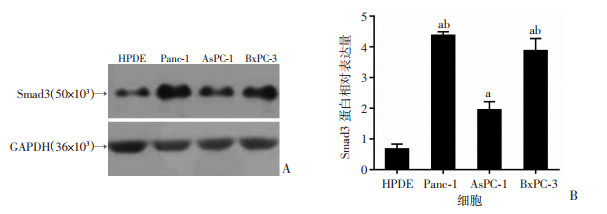
收集胰腺正常导管上皮细胞HPDE、胰腺癌细胞BxPC-3、AsPC-1、Panc-1。通过Western blot检测Smad3的表达情况。与胰腺正常导管上皮细胞相比,Smad3在胰腺癌细胞BxPC-3、Panc-1中表达较高(图 2)。因此,后续实验选择这2个细胞系进行。
|
| A:Western blot检测Smad3的表达;B:半定量分析 a:P < 0.05,与HPDE比较;b:P < 0.05,与AsPC-1比较 图 2 Smad3在胰腺正常导管上皮细胞、胰腺癌细胞中的表达 |
2.3 胰腺癌细胞系BxPC-3、Panc-1中敲除(敲减)Smad3
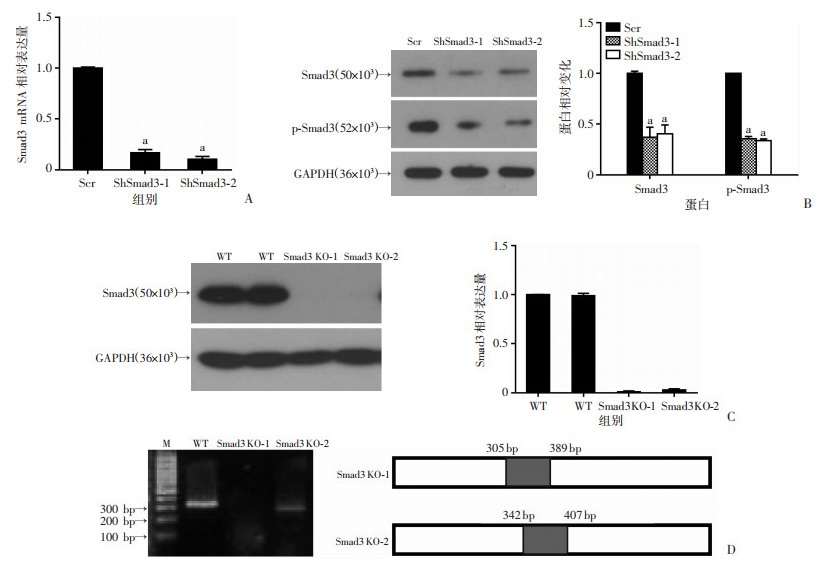
分别利用ShRNA以及CRISPR/Cas9两种不同的体系干预Smad3的表达。BxPC-3细胞中转入ShSmad3-1、ShSmad3-2慢病毒72 h后,qPCR检测结果显示Smad3 mRNA水平下调明显(P < 0.05,图 3A),同时利用Western blot从蛋白水平进行验证,发现2个ShRNA的敲减效果较好(图 3B)。进一步在Panc-1细胞中转入CRISPR/Cas9-Smad3质粒经嘌呤霉素筛选后挑取单克隆。利用Western blot和测序进行验证,发现单克隆细胞系1#、2#敲除较好(图 3C、D),可以用于后续实验。
|
|
Scr:对照组;ShSmad3-1、ShSmad3-2:Smad3敲减组;a:P < 0.05,与对照组(Scr)比较 A:qPCR检测转入ShSmad3后胰腺癌细胞Smad3 mRNA变化;B:Western blot检测Smad3的敲减效率 WT:空白对照组;Smad3-KO:Smad3敲除组;M:标准 C:Western blot检测Smad3敲除的单克隆细胞系;D:Smad3敲除单克隆细胞系基因组PCR产物 图 3 利用ShRNA、CRISPR/Cas9体系敲减及敲除Smad3的表达 |
2.4 在胰腺癌细胞中敲减Smad3影响细胞凋亡
利用构建好的Smad3敲减BxPC-3稳转细胞系铺板(105个细胞)绘制细胞的生长曲线(图 4A),并进行结晶紫染色(图 4B)。敲减Smad3后,胰腺癌细胞BxPC-3、Panc-1的数目均显著减少。同时利用Smad3敲减的Panc-1、BxPC-3细胞进行PI-Annexin V标记并进行流式分析,发现敲减Smad3后凋亡细胞显著增加(P < 0.05,图 4C),提示Smad3对胰腺癌的发生发展至关重要。

|
| A:敲减Smad3后各组胰腺癌细胞计数分析 a:P < 0.05,与对照组(Scr)比较;B:结晶紫染色观察敲减Smad3后各组胰腺癌细胞生长情况;C:流式细胞仪检测敲减Smad3后胰腺癌细胞的凋亡情况 图 4 敲减Smad3后诱导胰腺癌细胞凋亡增加 |
2.5 敲除(敲减)Smad3后自噬蛋白LC3、p62蛋白水平降低
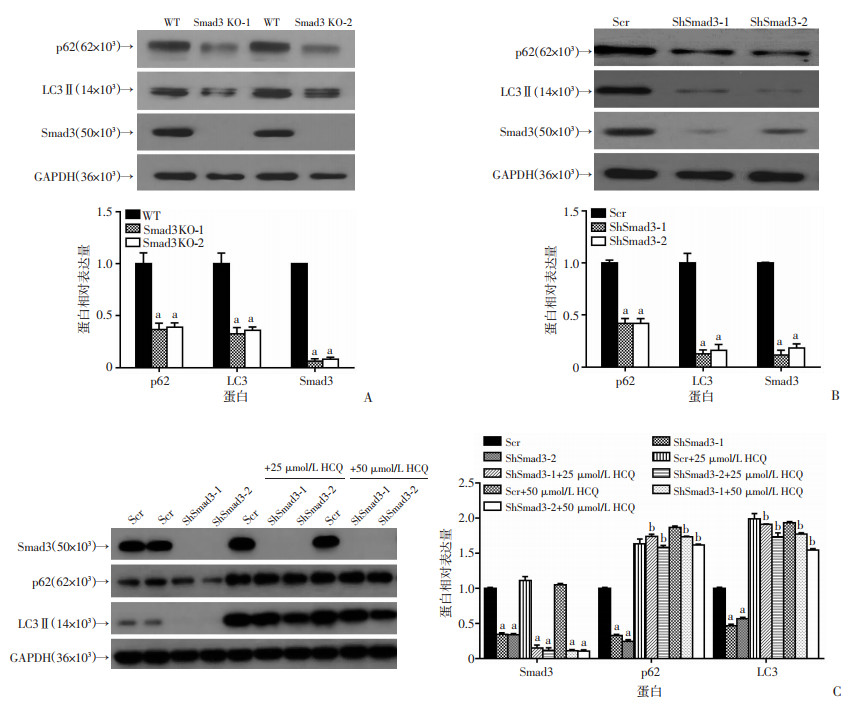
在敲除、敲减Smad3的Panc-1细胞中,LC3、p62均显著下调(图 5A、B)。同时在BxPC-3细胞中利用shRNA敲减Smad3后加入25、50 μmol/L羟氯喹(HCQ),利用Western blot检测发现LC3、p62蛋白水平能回复(图 5C)。进一步说明降低Smad3的表达影响胰腺癌细胞的自噬过程。
|
|
WT:空白对照组;Scr:对照组;Smad3 KO-1、Smad3 KO-2:Smad3敲除组;ShSmad3-1、ShSmad3-2:Smad3敲减组;a:P < 0.01,与对照组比较;b:P < 0.01,与Smad3敲减组比较 A:Western blot检测Smad3敲除胰腺癌细胞LC3、p62蛋白水平变化;B:Western blot检测Smad3敲减胰腺癌细胞LC3、p62蛋白水平变化;C:Western blot检测Smad3敲减胰腺癌细胞以及加HCQ后LC3、p62蛋白变化 图 5 干预Smad3表达后自噬蛋白LC3、p62蛋白水平降低 |
2.6 敲除(敲减)Smad3后通过p38/MAPK通路影响细胞凋亡
Western blot检测结果显示,与对照组相比,在敲减Smad3的BxPC-3细胞中p-p38显著上调(P < 0.05,图 6A),同时在敲除Smad3的胰腺癌细胞中p-p38蛋白水平也升高(P < 0.05,图 6B)。为了进一步证明Smad3通过p38通路调控自噬诱导细胞凋亡进行了回补实验。外源过表达Smad3后发现LC3、p62蛋白水平能够回复(P < 0.01,图 6C),同时利用p38抑制剂SB203580处理胰腺癌细胞同样发现LC3、p62蛋白水平增加(P < 0.01,图 6D)。提示下调Smad3后胰腺癌细胞生物学过程的改变,很有可能是通过p38/MAPK信号通路。

|
|
a:P < 0.05,与对照组(Scr)比较;b:P < 0.01,与Smad3敲减组比较 A:Western blot检测胰腺癌细胞敲减Smad3后p-p38、p38的蛋白变化;B:Western blot检测胰腺癌细胞敲除Smad3后p-p38、p38的蛋白变化;C:Western blot检测外源过表达Smad3后检测p-p38、LC3、p62的蛋白变化 a:P < 0.05,与对照组(Scr)比较;b:P < 0.01,与Smad3敲减组比较 D:流式细胞仪检测外源过表达Smad3后胰腺癌细胞凋亡情况变化;E:Western blot检测p38抑制剂SB203580及ShSmad3慢病毒同时处理胰腺癌细胞48 h后p-p38、LC3、p62的蛋白变化 图 6 Smad3通过MAPK-p38信号通路影响细胞凋亡与自噬 |
3 讨论
胰腺癌是一种恶性消化道肿瘤。由于早期没有特别有效的诊断标志物,一经发现就已进入中晚期,5年存活率极低。因此,相关的靶向治疗研究亟待开展[22-23]。本研究发现Smad3在胰腺癌中高表达且与患者的生存呈负相关,同时敲减Smad3后导致胰腺癌细胞凋亡增加。结果提示Smad3对胰腺癌发生、发展有重要的调控作用。研究表明植物类黄酮化合物影响TGF-β1/Smad3和TGF-β1/p38 MAPK信号通路调控自噬,可以减轻肝脏纤维化[24-25],同时发现Smad3能促进自噬失调调控细胞溶酶体缺失[26],然而Smad3在胰腺癌中调控自噬与凋亡的机制尚不明确。本研究发现干扰Smad3通过激活p38/MAPK信号通路诱导细胞过度自噬,从而导致其凋亡增加。
自噬是维持细胞稳态的关键机制,也是一种高度保守的生物学过程。通过对自身蛋白质和细胞器的降解使细胞能够在极端环境下存活[27]。因此,自噬调控受阻将会导致许多疾病的发生[28]。随着研究的深入,发现自噬蛋白Beclin 1基因在小鼠和人体中具有肿瘤抑制作用,进一步说明自噬具有肿瘤抑制功能[29]。由于自噬在肿瘤的形成过程中具有双重作用,因此抑制或诱导自噬途径对肿瘤的预防和治疗具有很大优势。本研究发现Smad3能够增加自噬相关蛋白LC3、p62的表达,具有自噬抑制作用,进而促进胰腺癌的发生、发展。因此,针对Smad3的靶向研究将为胰腺癌治疗提供新的思路。
细胞自噬与凋亡存在复杂的作用关系。自噬是细胞凋亡所需的过程,然而过度自噬能够诱导细胞凋亡[30]。p38/MAPK是调控细胞自噬及凋亡过程的重要信号通路。本研究发现干预Smad3的表达,p-p38蛋白水平显著增加,而自噬蛋白LC3、p62下调,同时胰腺癌细胞凋亡也显著增加。结果提示靶向干预Smad3后,导致胰腺癌细胞过度自噬,进而诱导胰腺癌细胞凋亡。用p38抑制剂SB203580处理Smad3敲减胰腺癌细胞相关蛋白的变化又能回复,进一步提示可能通过p38/MAPK信号通路进行调节。
综上所述,本研究探讨了Smad3表达水平与胰腺癌发生、发展以及患者生存的关系,结果表明Smad3高表达与胰腺癌的发生、发展正相关,与患者生存负相关。此外,Smad3在胰腺癌细胞系中高表达,敲减(敲除)Smad3可明显促进胰腺癌细胞凋亡,且能上调p-p38蛋白的表达,同时下调LC3、p62的表达。提示Smad3在胰腺癌发生、发展中发挥重要的促进作用,为临床治疗胰腺癌提供新的靶点。Smad3可作为胰腺癌一个潜在的临床诊疗的生物标记物。
| [1] |
MILLER K D, NOGUEIRA L, MARIOTTO A B, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. |
| [2] |
ZEESHAN M S, RAMZAN Z. Current controversies and advances in the management of pancreatic adenocarcinoma[J]. World J Gastrointest Oncol, 2021, 13(6): 472-494. |
| [3] |
YANG A N, HERTER-SPRIE G, ZHANG H K, et al. Autophagy sustains pancreatic cancer growth through both cell-autonomous and nonautonomous mechanisms[J]. Cancer Discov, 2018, 8(3): 276-287. |
| [4] |
PENG L, YANG C W, YIN J W, et al. TGF-β2 induces Gli1 in a Smad3-dependent manner against cerebral ischemia/reperfusion injury after isoflurane post-conditioning in rats[J]. Front Neurosci, 2019, 13(1): 636. |
| [5] |
ITOH Y, SAITOH M, MIYAZAWA K. Smad3-STAT3 crosstalk in pathophysiological contexts[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(1): 82-90. |
| [6] |
SHENG J Y, WANG L, TANG P M K, et al. Smad3 deficiency promotes beta cell proliferation and function in db/db mice via restoring Pax6 expression[J]. Theranostics, 2021, 11(6): 2845-2859. |
| [7] |
JIANG Z, GUO Y, MIAO L F, et al. SMAD3 silencing enhances DNA damage in radiation therapy by interacting with MRE11-RAD50-NBS1 complex in glioma[J]. J Biochem, 2019, 165(4): 317-322. |
| [8] |
SEO H Y, LEE S H, LEE J H, et al. Clusterin attenuates hepatic fibrosis by inhibiting hepatic stellate cell activation and downregulating the Smad3 signaling pathway[J]. Cells, 2019, 8(11): 1442. |
| [9] |
TANG P M K, ZHOU S, MENG X M, et al. Smad3 promotes cancer progression by inhibiting E4BP4-mediated NK cell development[J]. Nat Commun, 2017, 8(2): 14677. |
| [10] |
HUANG Y T, CHENG A C, TANG H C, et al. USP7 facilitates SMAD3 autoregulation to repress cancer progression in p53-deficient lung cancer[J]. Cell Death Dis, 2021, 12(10): 880. |
| [11] |
MUÑOZ M D, DE LA FUENTE N, SÁNCHEZ-CAPELO A. TGF-β/Smad3 signalling modulates GABA neurotransmission: implications in Parkinson's disease[J]. Int J Mol Sci, 2020, 21(2): 590. |
| [12] |
FALCICCHIA C, TOZZI F, ARANCIO O, et al. Involvement of p38 MAPK in synaptic function and dysfunction[J]. Int J Mol Sci, 2020, 21(16): 5624. |
| [13] |
TIAN X D, TRAUB B, XIE X H, et al. Opposing oncogenic functions of p38 mitogen-activated protein kinase alpha and beta in human pancreatic cancer cells[J]. Anticancer Res, 2020, 40(10): 5545-5556. |
| [14] |
SHEN T, HUANG Z H, SHI C F, et al. Pancreatic cancer-derived exosomes induce apoptosis of T lymphocytes through the p38 MAPK-mediated endoplasmic reticulum stress[J]. FASEB J, 2020, 34(6): 8442-8458. |
| [15] |
KLIONSKY D J, PETRONI G, AMARAVADI R K, et al. Autophagy in major human diseases[J]. EMBO J, 2021, 40(19): e108863. |
| [16] |
KOCATURK N M, AKKOC Y, KIG C, et al. Autophagy as a molecular target for cancer treatment[J]. Eur J Pharm Sci, 2019, 134(1): 116-137. |
| [17] |
ONORATI A V, DYCZYNSKI M, OJHA R, et al. Targeting autophagy in cancer[J]. Cancer, 2018, 124(16): 3307-3318. |
| [18] |
LI J B, CHEN X, KANG R, et al. Regulation and function of autophagy in pancreatic cancer[J]. Autophagy, 2021, 17(11): 3275-3296. |
| [19] |
YAMAMOTO K, VENIDA A, YANO J, et al. Autophagy promotes immune evasion of pancreatic cancer by degrading MHC-I[J]. Nature, 2020, 581(7806): 100-105. |
| [20] |
LI W M, ZHU J Q, DOU J, et al. Phosphorylation of LAMP2A by p38 MAPK couples ER stress to chaperone-mediated autophagy[J]. Nat Commun, 2017, 8(1): 1763. |
| [21] |
MODI S, KIR D, BANERJEE S, et al. Control of apoptosis in treatment and biology of pancreatic cancer[J]. J Cell Biochem, 2016, 117(2): 279-288. |
| [22] |
ANSARI D, TINGSTEDT B, ANDERSSON B, et al. Pancreatic cancer: yesterday, today and tomorrow[J]. Future Oncol, 2016, 12(16): 1929-1946. |
| [23] |
MCGUIGAN A, KELLY P, TURKINGTON R C, et al. Pancreatic cancer: a review of clinical diagnosis, epidemiology, treatment and outcomes[J]. World J Gastroenterol, 2018, 24(43): 4846-4861. |
| [24] |
LIU N, FENG J, LU X Y, et al. Isorhamnetin inhibits liver fibrosis by reducing autophagy and inhibiting extracellular matrix formation via the TGF-β1/Smad3 and TGF-β1/p38 MAPK pathways[J]. Mediators Inflamm, 2019, 2019: 1-14. |
| [25] |
JI J, YU Q, DAI W Q, et al. Apigenin alleviates liver fibrosis by inhibiting hepatic stellate cell activation and autophagy via TGF-β1/Smad3 and p38/PPARα pathways[J]. PPAR Res, 2021, 2021: 1-15. |
| [26] |
YANG C, CHEN X C, LI Z H, et al. SMAD3 promotes autophagy dysregulation by triggering lysosome depletion in tubular epithelial cells in diabetic nephropathy[J]. Autophagy, 2021, 17(9): 2325-2344. |
| [27] |
CAO Q Q, YOU X, XU L J, et al. PAQR3 suppresses the growth of non-small cell lung cancer cells via modulation of EGFR-mediated autophagy[J]. Autophagy, 2020, 16(7): 1236-1247. |
| [28] |
DENG S, SHANMUGAM M K, KUMAR A P, et al. Targeting autophagy using natural compounds for cancer prevention and therapy[J]. Cancer, 2019, 125(8): 1228-1246. |
| [29] |
WANG R C, WEI Y J, AN Z Y, et al. Akt-mediated regulation of autophagy and tumorigenesis through beclin 1 phosphorylation[J]. Science, 2012, 338(6109): 956-959. |
| [30] |
阚月一, 王娅杰, 李琦, 等. 肿瘤发展过程中自噬与凋亡的相互作用[J]. 中国比较医学杂志, 2018, 28(2): 106-112. KAN Y Y, WANG Y J, LI Q, et al. Interaction between autophagy and apoptosis during tumor development[J]. Chin J Comp Med, 2018, 28(2): 106-112. |




